玉米纹枯病生防菌DZSY21的抗病机制
2017-04-08江胡彪乔建礼武安宁
苏 博,江胡彪,乔建礼,潘 洁,许 伟,武安宁,丁 婷,*
(1.安徽省作物生物学重点实验室,安徽 合肥 230036; 2.安徽农业大学 植物保护学院,安徽 合肥 230036; 3.南阳市农业科学院 植保农化研究所,河南 南阳 473083)
玉米纹枯病生防菌DZSY21的抗病机制
苏 博1,江胡彪2,乔建礼3,潘 洁2,许 伟2,武安宁2,丁 婷2,*
(1.安徽省作物生物学重点实验室,安徽 合肥 230036; 2.安徽农业大学 植物保护学院,安徽 合肥 230036; 3.南阳市农业科学院 植保农化研究所,河南 南阳 473083)
为明确杜仲内生细菌DZSY21对玉米纹枯病的抗病机制,利用抗生素标记法分析了DZSY21菌体在玉米叶鞘组织中的定殖情况,通过小区接种试验,研究不同生育期玉米叶鞘引入DZSY21对玉米抗纹枯病的作用,并采用分光光度法和荧光定量PCR技术检测不同生育期玉米叶鞘组织中的多酚氧化酶(PPO)、过氧化物酶(POD)和苯丙氨酸解氨酶(PAL)的酶活性以及PR-1、PR-2a基因的表达水平变化。结果表明:菌株DZSY21引入玉米叶鞘后,可在其体内定殖,与玉米叶鞘组织形成和谐的共生关系,在一定程度上增强玉米对纹枯病的抗性;DZSY21在玉米叶鞘的定殖能提高玉米叶鞘组织防御酶PPO、POD和PAL的活性,同时诱导防卫基因表达。该研究结果为揭示生防细菌DZSY21的生防机理及应用提供了科学依据。
玉米纹枯病;多酚氧化酶;过氧化物酶;苯丙氨酸解氨酶;防卫反应基因;定殖
玉米纹枯病(maize sheath blight)是由立枯丝核菌(Rhizoctoniasolani)引起的土传性病害,在国内外玉米产区广泛发生且危害严重,严重制约玉米产量和品质性状的提高。目前,主要是利用化学药剂防治该病,然而化学农药在使用过程中容易造成环境污染、药害、农产品农药残留超标、农田生态平衡和生物多样性被破坏等问题[1-2]。植物内生细菌生长在植物体内,受寄主植物的保护,有较稳定的生存环境,不易受环境条件的影响,可以在植物体内独立地繁殖和传递,更易发挥其生物学功能[3-8]。有益的植物内生细菌有可能成为生物防治中有潜力的微生物农药、增产菌或生防载体菌。目前,有关植物内生细菌及其代谢产物控制植物病害的研究已成为热点。
本试验将从杜仲中分离的内生细菌DZSY21(BacillussubtilisDZSY21)引入玉米叶鞘组织,研究不同生育期DZSY21引入玉米叶鞘对玉米抗纹枯病的影响,分析其在玉米叶鞘的定殖情况,并检测了玉米叶鞘组织多酚氧化酶(polyphenol oxidase,PPO)、过氧化物酶(peroxidase,POD)和苯丙氨酸解氨酶(phenylalnine ammonialyase,PAL)活性以及胁迫响应基因(PR-1、PR-2a)的表达情况,初步明确了杜仲内生细菌DZSY21对玉米纹枯病的抗病机制。
1 材料与方法
1.1 菌种来源
杜仲内生细菌编号为DZSY21(BacillussubtilisDZSY21),NCBI登录号为KP777560,保藏于中国微生物菌种保藏管理委员会普通微生物中心(保藏编号:CGMCC NO. 11749)。玉米纹枯病菌YWSZ12(RhizoctoniasolaniYWHB12)由安徽农业大学植物保护学院植物病理学教研室提供,玉米纹枯病菌YWSZ12自安徽省宿州市感染玉米纹枯病的玉米植株上分离获得。
1.2 供试玉米品种
玉米自交系昌7-2。
1.3 供试培养基和化学药剂
马铃薯葡萄糖固体培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂15 g,水1 L。
牛肉膏蛋白胨固体培养基(NA固):牛肉膏3.0 g,NaCl 5.0 g,蛋白胨10.0 g,琼脂15~20 g,水1 L,pH 7.2~7.5。
肉汤固体培养基(LB固):胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,琼脂15~20 g,水1 L。
牛肉膏蛋白胨液体培养基(NA液):牛肉膏3.0 g,NaCl 5.0 g,蛋白胨10.0 g,水1 L,pH 7.2~7.5。
20%井冈霉素水溶性粉剂(浙江省桐庐汇丰生物化工有限公司):用无菌水配成50 μg·mL-1溶液,贮藏备用。
1.4 DZSY21菌悬液制备
菌株DZSY21接种于牛肉膏蛋白胨液体培养基中,摇床转速为160 rpm·min-1,于37 ℃培养8~10 h,调节发酵液中DZSY21的菌体浓度至1.0×106cfu·mL-1,获得DZSY21菌悬液。
1.5 菌株DZSY21在玉米叶鞘组织中的定殖
1.5.1 定性检测
玉米种植于安徽农业大学教学实习基地,种植方式为垄栽,垄面宽70 cm,垄距30 cm,株距30 cm,行距60 cm,每垄栽植20粒健康玉米种子(昌7-2),共栽植2垄。待玉米均长至大喇叭口期,每垄分别选取长势相当的多棵玉米植株进行处理。空白对照(CK):在玉米植株贴近地面的第1个叶鞘上喷洒5 mL无菌牛肉膏蛋白胨液体培养基。DZSY21菌悬液处理(S):将5 mL DZSY21菌悬液直接喷洒于健康玉米植株贴近地面的第1个叶鞘表面,保湿培养24 h。每个处理5株玉米,3个重复。接种DZSY21菌悬液24 h后,对上述2种处理的玉米叶鞘进行取样,样本送安徽农业大学生物技术中心进行处理以及透射电镜观察(HT-7700透射电镜,加速电压80 kV),记录DZSY21菌体在玉米叶鞘组织中的生长情况。
1.5.2 定量检测
菌株标记:采用卡那霉素法标记,将供试菌株DZSY21转入含2.5 μg·mL-1卡那霉素的LB平板培养基,逐步筛选出在200 μg·mL-1卡那霉素的LB培养基上稳定生长、对病原真菌有拮抗作用的DZSY21突变体菌株。
筛选方法:将100 μL DZSY21菌株培养液均匀涂于含2.5 μg·mL-1卡那霉素的LB培养基平板上,28 ℃培养24 h,选取生长良好的菌落,移至卡那霉素浓度相同的培养基上继代2次,以获得稳定的抗性,然后转入含高浓度卡那霉素的LB培养基,直至在200 μg·mL-1卡那霉素的LB培养基上获得稳定生长的突变体菌株。
抗性突变株拮抗作用测定:利用对峙生长法,测定抗性突变株对玉米纹枯病菌的拮抗作用,以原始菌株DZSY21为对照,最终获得稳定生长、对玉米纹枯病菌的拮抗活性无明显改变的DZSY21突变体菌株。
玉米纹枯病菌的制备:将玉米茎秆剪为长约5 cm、宽约2 cm的节段,在1%的蔗糖溶液中浸泡30 min,倒掉多余的溶液,把玉米茎秆分装在三角瓶中,12l ℃灭菌30 min后接种纹枯病菌,28 ℃,培养4 d备用。
DZSY21突变株在玉米体内定殖的定量检测:将DZSY21突变株在含200 μg·mL-1卡那霉素的LB培养基中,28 ℃、160 r·min-1振荡培养24 h,浓度约为6×105cfu·min-1。待玉米长至大喇叭口期,分别选取长势相当的多棵玉米植株进行以下2种处理:DZSY21突变株菌悬液处理组(S):将5 mL DZSY21突变株菌悬液直接喷洒于健康玉米植株贴近地面的第1个叶鞘表面,保湿培养12 h后,接种灭菌的玉米茎秆(不接种玉米纹枯病菌)于相同部位,保湿培养12 h。DZSY21突变株+玉米纹枯病菌的混合处理组(SB):将5 mL DZSY21突变株菌悬液直接喷洒于玉米叶鞘表面,保湿培养12 h后,接种带有玉米纹枯病菌的玉米茎秆于相同部位,保湿培养12 h。以上2种处理均于接种后1、3、5、7、10、15 d取样,分离玉米叶鞘组织中的DZSY21抗性突变株。定量称取玉米叶鞘样品0.5 g,在0.1% HgCl2溶液中浸泡5 min,无菌水洗涤干净,放入研钵内,加入4.5 mL无菌水充分研磨,得到0.1 g·mL-1的母液;用无菌水将母液依次稀释至0.01、0.001 g·mL-1,吸取100 μL 0.001 g·mL-1的稀释液涂布于含200 μg·mL-1卡那霉素的LB培养基,培养计数,重复3次。用最后1次洗涤的无菌水涂抹平板检测样品消毒是否彻底。
1.6 菌株DZSY21对玉米纹枯病的防效测定
1.6.1 玉米纹枯病菌的制备
玉米纹枯病菌的制备方法同1.5.2节。
1.6.2 防治效果测定
玉米种植方法同1.5.1节。共设5个处理,每种处理5株玉米,3次重复。在玉米大喇叭口期,将菌株DZSY21引入玉米叶鞘,并于接种玉米纹枯病菌后的第4、6、8、10、12天调查各组纹枯病的发病率,根据玉米纹枯病害分级标准[9],计算病情指数。
5个处理分别为:空白对照处理(CK),将5 mL无菌牛肉膏蛋白胨液体培养基直接喷洒于玉米植株贴近地面的第1个叶鞘(下同),12 h后,在玉米植株相同部位接种灭菌的玉米茎秆(将不接种玉米纹枯病菌的玉米茎秆放入玉米分蘖的叶鞘与茎之间),保湿培养12 h。玉米纹枯病菌处理(B),将5 mL牛肉膏蛋白胨液体培养基直接喷洒于玉米叶鞘表面12 h后,在相同部位接种玉米纹枯病菌(取1.6.1节培养好的带有玉米纹枯病菌的玉米茎秆放入玉米分蘖的叶鞘与茎之间。下同),保湿培养12 h。DZSY21菌悬液处理(S),将5 mL牛肉膏蛋白胨液体培养基直接喷洒于玉米叶鞘表面12 h后,在相同部位直接喷洒5 mL DZSY21菌悬液,保湿培养12 h。菌株DZSY21+玉米纹枯病菌的混合处理组(SB):将5 mL DZSY21菌悬液直接喷洒于玉米叶鞘表面,保湿培养12 h后,接种玉米纹枯病菌于相同部位,保湿培养12 h。井冈霉素+玉米纹枯病菌的混合处理组(Y):5 mL井冈霉素溶液喷在玉米叶鞘表面,保湿培养12 h后,接种玉米纹枯病菌于相同部位,保湿培养12 h。
1.7 酶活性及基因表达测定
共4个处理:空白对照(CK),玉米纹枯病菌处理(B),DZSY21菌悬液处理组(S),DZSY21菌株+玉米纹枯病菌混合处理(SB)。处理方法及采样时间同1.6.2节。
1.7.1 酶活性测定
称取500 mg玉米叶鞘组织混合样品在液氮中研磨后,加入5 mL 0.1 mol·L-1pH 7.0的磷酸盐缓冲液,4 ℃ 5 000g离心15 min。上清液即为粗酶液,测定PPO、POD和PAL的活性。酶活性测定参考文献[10-13],并进行相关诱导效应计算[14]。
诱导效应计算公式如下:
DZSY21在单菌体系中对玉米叶鞘3种酶活性的诱导效应(分别用APPO、APOD、APAL表示):A=(S处理组酶活性-CK处理组酶活性)/ CK处理组酶活性×100%;
DZSY21在双菌体系中对玉米叶鞘3种酶活性的诱导效应(分别用BPPO、BPOD、BPAL表示):B=(SB处理组酶活性-B处理组酶活性)/ B处理组酶活性×100%。
1.7.2 RT-PCR
以actin为内参基因,检测玉米直接防御蛋白调控基因PR-1、PR-2a的表达水平[15]。不同处理组不同生长期玉米样品的RNA提取和cDNA合成参照牛吉山等[16]的方法。引物信息见表1。
表1 RT-PCR引物信息
Table 1 The information of primers for RT-PCR
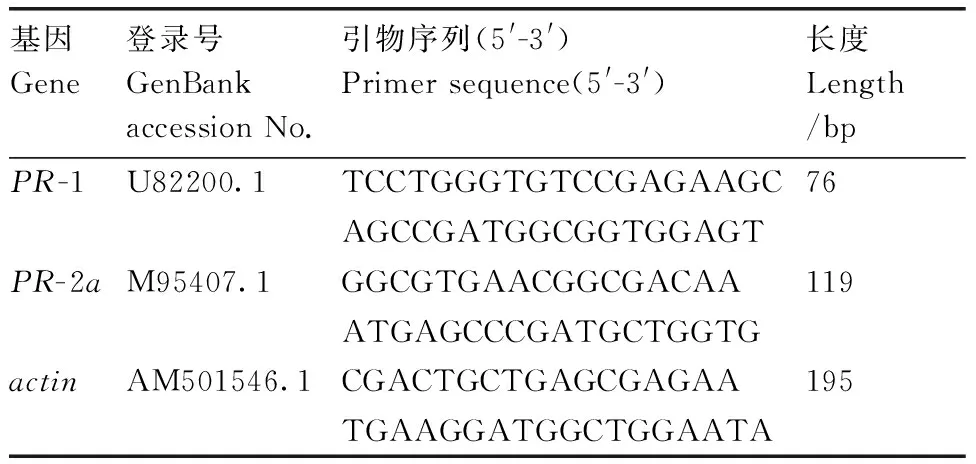
基因Gene登录号GenBankaccessionNo.引物序列(5'-3')Primersequence(5'-3')长度Length/bpPR-1U82200.1TCCTGGGTGTCCGAGAAGC76AGCCGATGGCGGTGGAGTPR-2aM95407.1GGCGTGAACGGCGACAA119ATGAGCCCGATGCTGGTGactinAM501546.1CGACTGCTGAGCGAGAA195TGAAGGATGGCTGGAATA
2 结果与分析
2.1 菌株DZSY21在玉米叶鞘组织中的定殖
2.1.1 定性检测
与空白对照组(图1-B)相比,接种DZSY21菌悬液24 h后,DZSY21菌悬液处理组中,DZSY21菌体能侵入玉米叶鞘组织内部,菌体形态如图1-C-7、图1-D-9所示,而空白对照组的叶鞘组织中未发现该菌存在(图1-B)。此外,菌株DZSY21在叶鞘中的生长对玉米组织和细胞结构无显著影响,叶绿体、淀粉粒均正常,说明菌株DZSY21可与玉米叶鞘组织形成和谐的共生关系。
2.1.2 定量检测
如图2所示,S处理组和SB处理组DZSY21抗性突变株数量均呈现先下降再上升的趋势,且不同生长时期S处理组分离的DZSY21抗性突变株均多于SB处理组,可能是由于将外源DZSY21抗性突变株引入玉米叶鞘,DZSY21抗性突变株需要通过与玉米叶鞘组织的内生微生物进行营养以及空间生态位等方面的竞争,维持自身生长繁殖,反映在数据上则是生长前期,抗性突变株数量呈现下降趋势,抗性突变株适应玉米叶鞘组织环境、占据了生态位定殖以后,抗性突变株在玉米叶鞘中的数量则呈上升趋势;SB处理组的DZSY21抗性突变株引入玉米叶鞘后,在定殖过程中,不仅要和内生微生物进行竞争,还要与玉米纹枯病菌进行竞争,因此,数量上要少于单独接种DZSY21抗性突变株的S处理组。
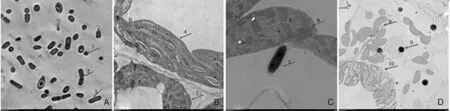
A,DZSY21菌体在透射电镜下的形态;B,空白对照处理(CK);C和D,DZSY21菌悬液处理组。其中,A-1、A-2、A-3、C-7、D-9为菌株DZSY21;B-5、C-6、D-8为叶绿体;B-4、D-10为淀粉粒;C-7为DZSY21菌体完整形态;D-9为DZSY21菌体的横切形态A, the shape of DZSY21 under the transmission electron microscopy; B, blank control (CK); C and D, maize leaf sheath inoculated by DZSY21 after 24 h. A-1, A-2, A-3, C-7, D-9 were DZSY21; B-5, C-6, D-8 were chloroplast; B-4, D-10 were starch granule; C-7 showed the complete form of DZSY21; D-9 showed the crosscutting form of DZSY21图1 菌株DZSY21与玉米叶鞘共生情况Fig.1 The symbiosis between DZSY21 and maize leaf sheath
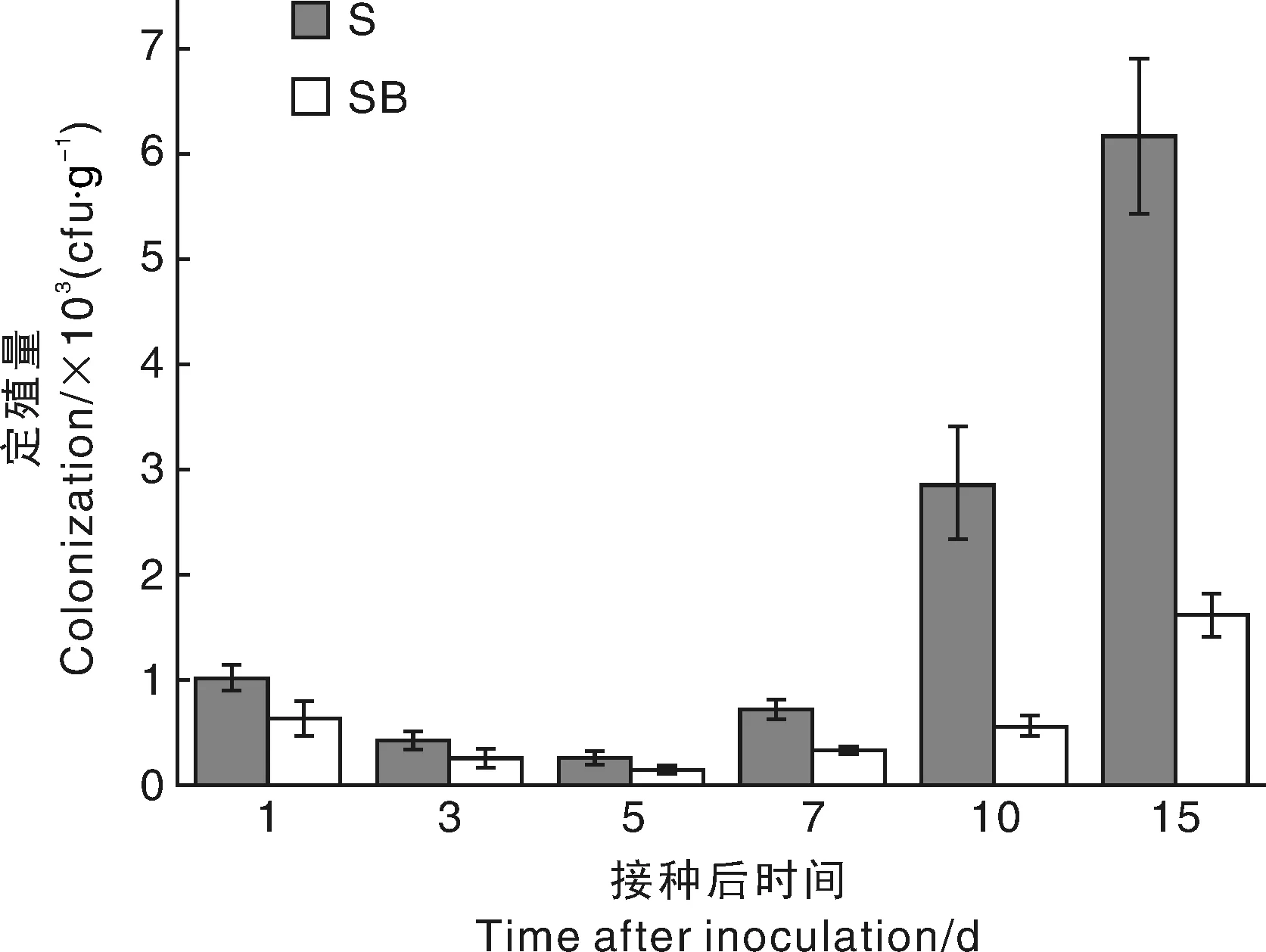
数据以鲜质量计。S,DZSY21菌悬液处理;SB,DZSY21+玉米纹枯病菌混合处理Data was detected based on fresh weight. S, treatment of strain DZSY21; SB, treatment of strain DZSY21+R. solani图2 DZSY21抗性突变株在玉米体内的定殖量Fig.2 Colonization of DZSY21 resistant mutant strains in corn
2.2 菌株DZSY21引入玉米叶鞘对玉米纹枯病的防治效果
DZSY21菌悬液喷洒玉米叶鞘表面,保湿培养12 h后,接种玉米纹枯病菌,于接种纹枯病菌后的第4、6、8、10、12天对不同处理组进行玉米纹枯病病害调查,计算病情指数。结果如表2所示,随生长期的延长,B、SB及Y处理组玉米纹枯病的病情指数均呈现缓慢增长并趋于平稳的趋势;截至第12天,B处理组(单独接种玉米纹枯病菌)病情指数达到75.41%,而同一生长期的SB
处理组(菌株DZSY21+玉米纹枯病菌)玉米患病较轻,其病情指数仅为33.26%,与Y处理组(井岗霉素+玉米纹枯病菌)玉米病情指数(31.65%)无显著差异。接种纹枯病菌后第12天,不同处理组玉米纹枯病的发病情况如图2所示。上述结果说明,在玉米叶鞘引入菌株DZSY21能够提高玉米植株对纹枯病的抗性,降低玉米纹枯病的病情指数,减轻纹枯病对玉米的危害。此外,试验中发现,经DZSY21菌悬液处理(S)的玉米植株,其生长发育和空白对照处理(CK)相同,均正常生长,没有病害发生,从一定程度上反映了DZSY21菌株在玉米叶鞘的介入对玉米没有致病作用(图2)。
2.3 菌株DZSY21引入玉米叶鞘对其防御酶活性的影响
2.3.1 PAL活性
接种DZSY21后不同时间玉米叶鞘的PAL活性如表3所示,S处理及SB处理均可诱导玉米叶鞘的PAL活性。其中,接种玉米纹枯病菌后第4、6、8天,S处理组的PAL活性增长率APAL小于SB处理组的PAL活性增长率BPAL;接种后第10、12天,S处理组PAL活性增长率APAL大于SB处理BPAL,说明此时B处理组对玉米叶鞘PAL活性的诱导效应好于SB处理组。
2.3.2 POD活性
表4为不同处理组的玉米植株在接种DZSY21后不同时间叶鞘的POD活性变化情况。S处理及SB处理均对玉米叶鞘POD活性有一定的诱导作用,且SB处理对POD的诱导效应大于S处理;接种玉米纹枯病菌后4、6、8、10、12 d,SB处理POD活性增长值BPOD分别是S处理酶活增长值APOD的1.5、2.1、2.8、3.8、2.7倍。此外,4种处理的玉米叶鞘POD活性在5个测定时间的变化趋势均为先上升后下降,均在接种玉米纹枯病后10 d达到最高值,随后逐渐下降。
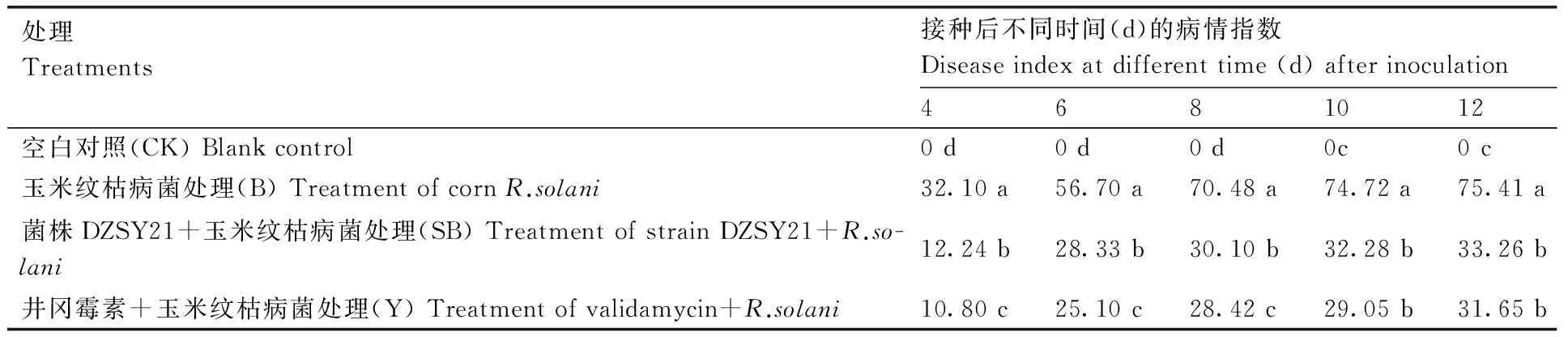
表2 接种纹枯病菌后不同时间玉米纹枯病的病情指数
表中所列数据是3组重复的平均值,同列数据后无相同小写字母表示差异显著(P<0.05)。表3-5同。
The data were averaged from three independent replicates. Data marked without the same lowercase letter in each column indicated significant differences atP<0.05. The same as tables 3-5.

CK,空白对照;B,玉米纹枯病菌处理;S,DZSY21菌悬液处理;SB,DZSY21+玉米纹枯病菌处理;Y,井冈霉素+玉米纹枯病菌处理CK, treatment of blank control; B, treatment with R. solani; S, treatment with strain DZSY21; SB, treatment with strain DZSY21+R. solani; Y, treatment with Validamycin+R. solani图3 接种纹枯病菌12 d后不同处理组玉米纹枯病发病情况Fig.3 The effects of different treatments on morbidity of maize sheath blight
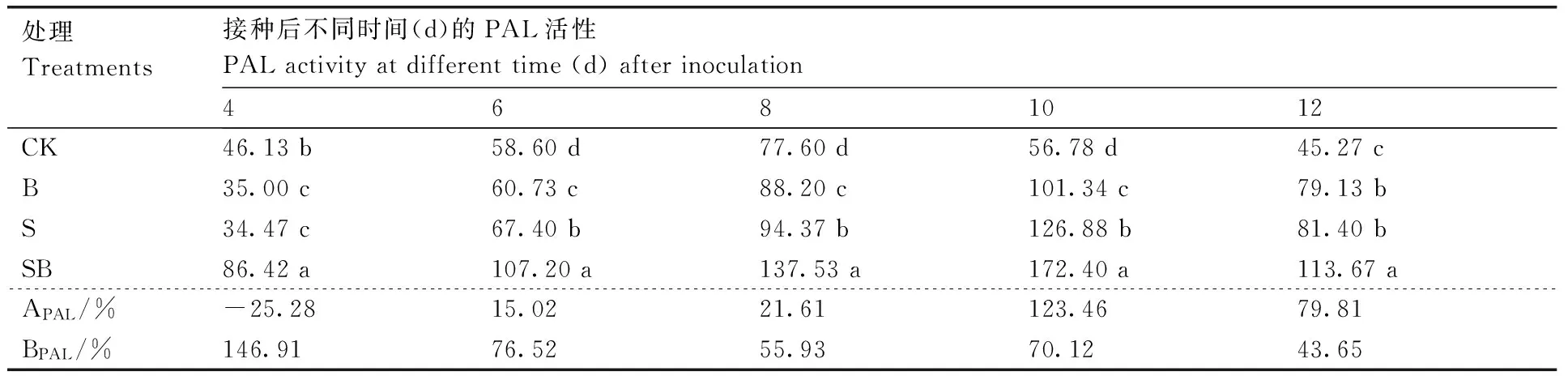
表3 不同处理组的玉米叶鞘PAL活性
APAL,S处理组的PAL活性增长率;BPAL,SB处理组的PAL活性增长率。
APAL, the growth rate of PAL activity of S treatment; BPAL, the growth rate of PAL activity of SB treatment.
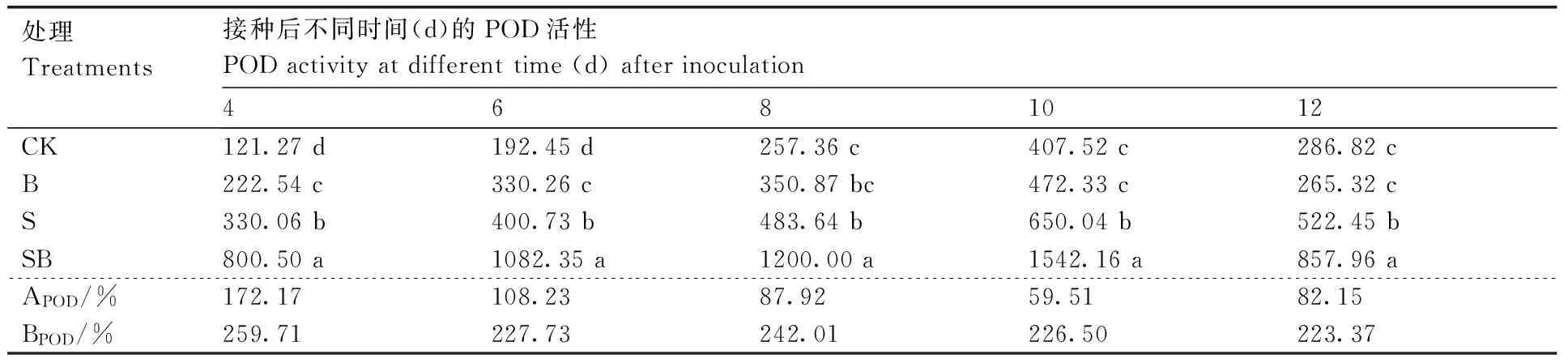
表4 不同处理组的玉米叶鞘POD活性
APOD,S处理组的POD活性增长率;BPOD,SB处理组的POD活性增长率。
APOD, the growth rate of POD activity of S treatment; BPAL, the growth rate of POD activity of SB treatment.
2.3.3 PPO活性
表5为不同处理组的玉米植株在接种DZSY21后不同时间叶鞘的PPO活性的变化情况。S处理及SB处理均可显著提高玉米植株叶鞘PPO活性,且SB处理对PPO的诱导效应大于S处理;接种玉米纹枯病菌后4、6、8、10、12 d,SB处理PPO活性增长值BPPO分别是S处理PPO活性增长值APPO的5.3、2.2、1.3、1.3、1.6倍。此外,SB处理组的玉米植株叶鞘PPO活性在接种玉米纹枯病后10 d达到最大,而S处理组叶鞘PPO活性则在接种玉米纹枯病后8 d达到最大。
2.4 菌株DZSY21引入玉米叶鞘对其PR-1、PR-2a基因表达的影响
如图4所示,S处理组和SB处理组中,PR-1、PR-2a基因的表达水平均随着玉米植株的生长逐渐增强,其中,S处理组中PR-1、PR-2a基因的表达水平分别在第6和8天达到峰值;而SB处理组中PR-1、PR-2a基因的表达水平均在第8天达到峰值,其峰值增强幅度分别约是B处理组的1.8倍和1.1倍。此后,随着玉米植株的生长,S处理组和SB处理组的PR-1、PR-2a基因的表达量均呈下降趋势。截至第12天,不同处理组的PR-1基因表达量为SB处理>CK处理>B处理>S处理,PR-2a基因表达量则为SB处理>B处理>S处理>CK处理。
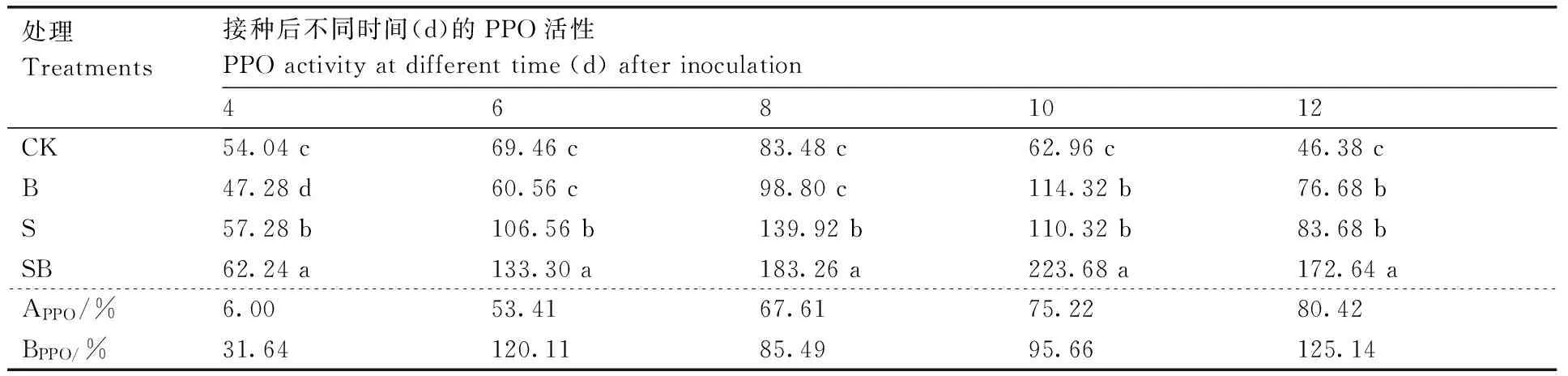
表5 不同试验处理组的玉米叶部PPO活性
APPO,S处理组的PPO活性增长率;BPPO,SB处理组的PPO活性增长率。
APOD, the growth rate of PPO activity of S treatment; BPAL, the growth rate of PPO activity of SB treatment.
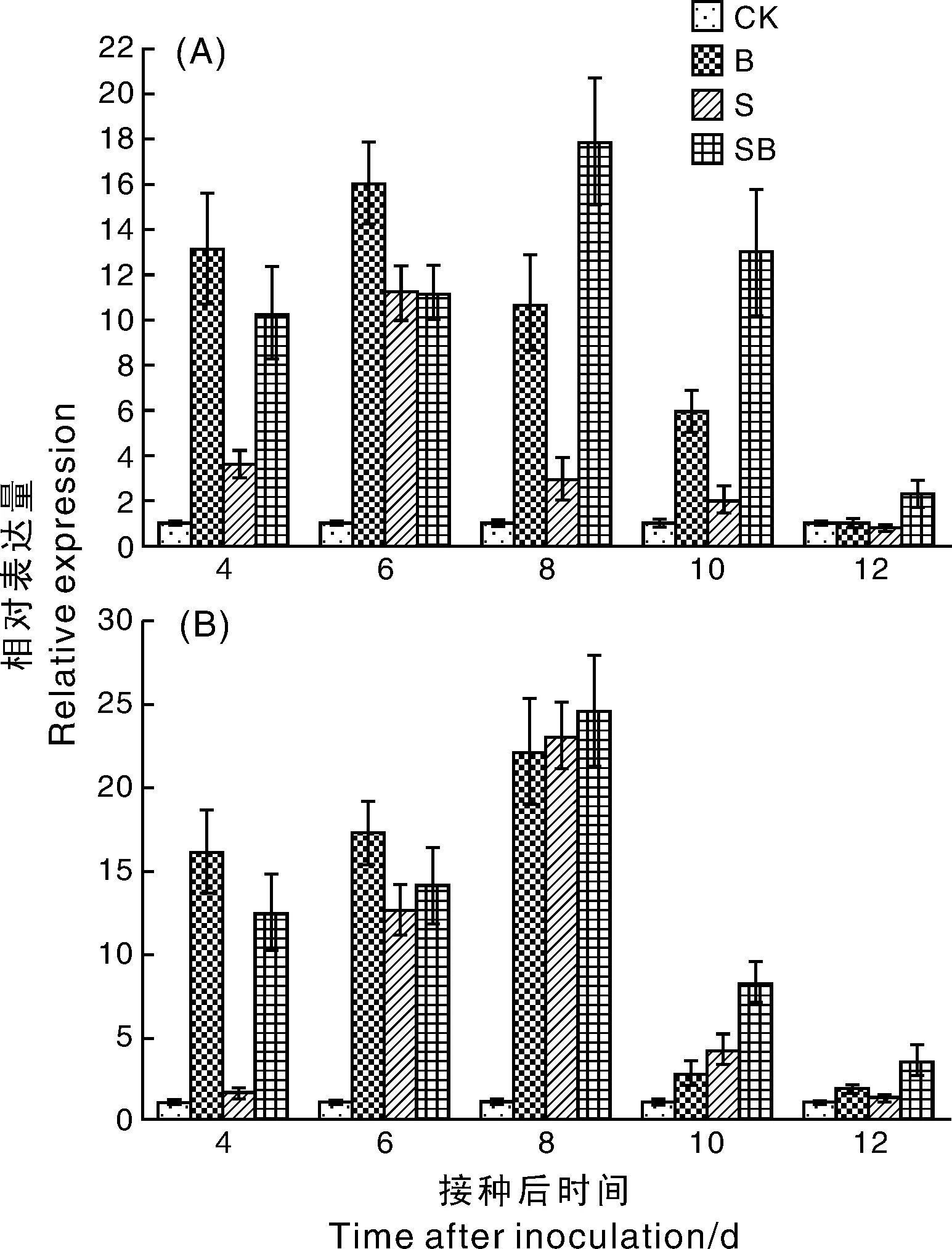
图4 DZSY21对玉米叶鞘PR-1(A)和PR-2a(B)基因表达的影响Fig.4 Effects of DZSY21 on the expression of PR-1 (A) and PR-2a (B) genes in maize leaf sheath
3 讨论
目前报道的生物防治玉米纹枯病所用菌株多为玉米根际或内生微生物。如邱小燕等[17]发现,玉米根际土壤分离得到的根际细菌515-126对田间玉米纹枯病有一定防治效果,相对防效达到49.37%;毛腾霄[18]将从玉米茎基部叶鞘分离得到的芽孢杆菌BS-8D接入玉米植株茎基部,能延缓病菌对植株的侵染。本研究中,将从杜仲体内获得的1株离体条件下对玉米纹枯病菌具有较强拮抗作用的内生细菌DZSY21引入玉米植株,能在较大程度上降低玉米纹枯病的病情指数,可诱导玉米植株对纹枯病产生抗性。生防微生物能否侵入植物并在植株内生存和定殖是其与植物互作并发挥生防作用的先决条件[19-20]。利用透射电镜以及抗生素标记法发现,喷洒于玉米叶鞘表面的DZSY21菌体,能够侵入叶鞘内部,且对玉米组织和细胞结构无显著影响,可与玉米叶鞘组织形成和谐的共生关系,在其体内稳定定殖,该试验结果在一定程度上为菌株DZSY21增强玉米对纹枯病的抗性机制研究提供了理论基础。此外,在对玉米植株抗纹枯病防效试验中,本文只针对选用的玉米自交系昌7-2展开了调查,由于不同品种间的抗、耐病性存在着明显差异,后期该课题组又选用了玉米品种C8605-2进行纹枯病抗病试验,试验结果和玉米自交系昌7-2一致,表明菌株DZSY21引入不同品种玉米叶鞘,均能明显降低玉米纹枯病的病情指数。
经菌株DZSY21处理后的玉米叶鞘,再接种玉米纹枯病菌,接种后不同时间玉米叶鞘PPO、POD、PAL活性以及PR-1、PR-2a基因表达水平较单独接种玉米纹枯病原菌、单独引入DZSY21菌悬液等处理均明显增强。外部症状上,经菌株DZSY21处理的玉米叶鞘,再接种玉米纹枯病菌后,纹枯病的病情指数随着玉米生长时间的延长,增加缓慢,截至第12天,SB处理组(菌株DZSY21+玉米纹枯病菌)的病情指数为33.26%,而相同生长时期的B处理组(玉米纹枯病菌)的病情指数则为75.61%。由此可知,菌株DZSY21引入玉米叶鞘后,随着玉米体内防御酶活性的升高以及PR基因表达的增强,玉米植株的抗病水平也随之提高。
植物诱导系统抗性(induced systemic resistance,ISR)是指植物在诱导子的激活作用下,自身防御基因被激活,植物体内发生生理生化变化,产生抗性的过程,是内生细菌防治植物病害的重要作用机制[21-22]。在诱导子的激活作用下,不仅植物细胞壁的结构发生改变,而且植物体内一些生理生化反应也产生了变化,如POD、PPO、SOD和PAL等多种植物防御相关酶基因的表达[23]。因而,PAL、POD和PPO通常作为衡量植物体内防卫反应的重要酶活性指标[24-25]。本研究中,分别于接种后第4、6、8、10、12天进行PPO、POD和PAL活性的测定。结果表明,经拮抗菌株DZSY21处理的玉米叶鞘,再接种玉米纹枯病菌后,5个测定时间的3种酶活性基本上均高于空白对照组以及玉米纹枯病菌处理组、单独引入DZSY21菌悬液处理组。由此可初步推测,拮抗菌株DZSY21引入玉米植株能够提高玉米叶鞘组织的PPO、POD和PAL活性,从而间接提高玉米植株对纹枯病的抗病性。而DZSY21引入玉米植株会不会对玉米的其他各项生长指标(如根系、株高、鲜质量)产生影响,则有待进一步研究。
与仅接种DZSY21相比较,菌株DZSY21+玉米纹枯病菌处理组的玉米植株PR-1、PR-2a基因表达水平逐渐增强,在一定程度上提高了玉米植株对纹枯病的抗病水平。究其原因,可能是生防菌引入植物体内,可作为植物防卫基因表达的激发子[26-27],当玉米植株先接种DZSY21菌株,再接种玉米纹枯病菌后,植株体内防卫基因PR-1、PR-2a的表达量也随之增强。此外,本研究仅分析了菌株DZSY21引入玉米叶鞘对PR-1、PR-2a表达的影响,而玉米体内的主要防御基因除了直接防御蛋白调控基因之外,还包括丁布合成调控基因(Bx1、Bx6和Bx9)、PAL基因以及间接防御物质挥发物调控基因(FPS和TPS)等,这些防御基因的表达在一定程度上均可提高玉米对病虫害的抵抗能力[27-28]。后续试验将从基因表达水平,验证菌株DZSY21引入玉米叶鞘对间接防御物质、直接防御物质合成相关基因表达以及玉米抗纹枯病的影响。
[1] 罗茂, 彭华, 高健, 等.玉米纹枯病抗性相关miRNA的鉴定与功能分析[J]. 中国生物化学与分子生物学报, 2012, 28(12): 1122-1132. LUO M, PENG H, GAO J, et al. Identification and functional analysis of miRNAs in response to banded leaf and sheath blight inZeamays[J].ChineseJournalofBiochemistryandMolecularBiology, 2012, 28(12): 1122-1132.(in Chinese with English abstract)
[2] 姚金保, 马鸿翔, 张平平,等. 小麦优良亲本宁麦9号的研究与利用[J]. 核农学报, 2012, 26(1): 17-21. YAO J B, MA H X, ZHANG P P, et al. Research of wheat elite parent Ningmai 9 and its utilization[J].JournalofNuclearAgriculturalSciences, 2012, 26(1): 17-21.(in Chinese with English abstract)
[3] 成静, 孙璇, 丁婷, 等.杜仲内生细菌DZBG07对小麦全蚀病的生防作用[J]. 生物学杂志, 2015, 32(6): 105-108. CHENG J, SUN X, DING T, et al. Biocontrol effect of endophytic bacteria DZBG07 fromEucommiaulmoidesoliver on wheat take-all[J].JournalofBiology, 2015, 32(6): 105-108.(in Chinese with English abstract)
[4] 蔡学清, 陈炜, 林娜, 等.内生细菌在荔枝体内的定殖及其防病保鲜功能[J]. 应用生态学报, 2011, 22(8): 2140-2146. CAI X Q, CHEN W, LIN N, et al. Colonization and disease control and fruit preservation functions of endophytic bacterial strains in lychee[J].ChineseJournalofAppliedEcology, 2011, 22(8): 2140-2146.(in Chinese with English abstract)
[6] GHIMIRE SR, CHARLTON N D, CRAVEN K D. The mycorrhizal fungus,Sebacinavermifera, enhances seed germination and biomass production in Switchgrass (PanicumvirgatumL)[J].BioEnergyResearch, 2009, 2(1): 51-58.
[9] 李洪连, 徐敬友. 农业植物病理学实验实习指导[M]. 北京: 中国农业出版社, 2007.
[10] 丁婷, 孙微微, 韩亚惠, 等. 杜仲内生真菌DZJ07在小麦根际定殖及对根部酶活的影响[J]. 核农学报, 2015, 29(6): 1149-1157. DING T, SUN W W, HAN Y H, et al. Rhizosphere colonization and effects of an endophytic fungus DZJ07 fromEucommiaulmoideson enzyme activities of wheat root[J].JournalofNuclearAgriculturalSciences, 2015, 29(6): 1149-1157. (in Chinese with English abstract)
[11] AQUINO-BOLANOS E N, SILVA E M. Effects of polyphenol oxidase and peroxidase activity, phenolics and lignin content on the browning of cut jicama[J].PostharvestBiologyandTechnology, 2004, 33(3): 275-283.
[12] FANG C, MIN W, YU Z, et al. Quantitative changes of plant defense enzymes and phytohormone in biocontrol of cucumber Fusarium wilt byBacillussubtilis, B579[J].WorldJournalofMicrobiologyandBiotechnology, 2010, 26(4): 675-684.
[13] HAN Y, WANG Y, BI J L, et al. Constitutive and induced activities of defense-related enzymes in aphid-resistant and aphid-susceptible cultivars of wheat[J].JournalofChemicalEcology, 2009, 35(2): 176-182.
[14] 梁军锋, 薛泉宏, 牛小磊, 等. 7株放线菌在辣椒根部定殖及对辣椒叶片PAL与PPO活性的影响[J]. 西北植物学报, 2005, 25(10): 2118-2123. LIANG J F, XUE Q H, NIU X L, et al. Root colonization and effects of seven strains of actinomyceteson leaf PAL and PPO activities of capsicum[J].ActaBotanicaBoreali-OccidentaliaSinica, 2005, 25(10): 2118-2123. (in Chinese with English abstract)
[15] 冯远娇, 王建武, 苏贻娟, 等. 茉莉酸在玉米地上部与地下部系统性诱导防御反应中的作用[J]. 中国农业科学, 2009, 42(8): 2726-2735. FENG Y J, WANG J W, SU Y J, et al. The role of jasmonic acid in the systemic induced defense response of aboveground and underground in corn (Zeamays)[J].ScientiaAgriculturaSinica, 2009, 42(8): 2726-2735. (in Chinese with English abstract)
[16] 牛吉山, 刘靖, 倪永静, 等. 茉莉酸对PR-1、PR-2、PR-5和Ta-JA2基因表达以及小麦白粉病抗性的诱导[J]. 植物病理学报, 2011, 41(3): 270-277. NIU J S, LIU J, NI Y J, et al. Induction ofPR-1,PR-2,PR-5,Ta-JA2 and wheat poedery mildew resistance in response to MeJA treatment[J].ActaPhytopathologicaSinica, 2011, 41(3): 270-277.(in Chinese with English abstract)
[17] 邱小燕, 张敏, 胡晓, 等. 枯草芽孢杆菌的定殖能力及对玉米纹枯病的防治效果[J]. 四川农业大学学报, 2010, 28(4): 492-496. QIU X Y, ZHANG M, HU X, et al. Colonization ability ofBacillussubtilisand its protective effect againstRhizoctoniasolani[J].JournalofSichuanAgriculturalUniversity, 2010, 28(4): 492-496.(in Chinese with English abstract)
[18] 毛腾霄. 枯草芽孢杆菌BS-8D防治玉米纹枯病(Rhizoctoniasolani)的研究[D]. 成都: 四川农业大学,2006. MAO T X, Study on the biocontrol of maize sheath blight (Rhizoctoniasolani) withBacillussubtilisBS-8D strain [D]. Chengdu: Sichuan Agricultural University, 2006. (in Chinese with English abstract)
[20] REN J H, LI H, WANG Y F, et al. Biocontrol potential of an endophyticBacilluspumilusJK-SX001 against poplar canker[J].BiologicalControl, 2013, 67(3): 421-430.
[21] CHOUDHARY D K, JOHRI B N. Interactions ofBacillusspp. and plants-with special reference to induced systemic resistance (ISR)[J].MicrobiologicalResearch, 2009, 164(5): 493-513.
[22] HOWELL C R. Mechanisms employed by Trichoderma species in the biological control of plant diseases: the history and evolution of current concepts[J].PlantDiseases, 2002, 87(1): 4-10.
[23] NGADZE E, ICISHAHAYO D, COUTINHO T A, et al. Role of polyphenol oxidase, peroxidase, phenylalanine ammonia lyase, chlorogenic acid, and total soluble phenols in resistance of potatoes to soft rot[J].PlantDisease, 2012, 96(2): 186-192.
[24] CONN V M, WALKER A R, FRANCO C M. Endophytic action bacteria induce defense pathways inArabidopsisthaliana[J].MolecularPlant-MicrobeInteractions, 2008, 21(2): 208-218.
[25] 王光达, 黄初女, 吴委林, 等. 不同玉米品种对大斑病的抗性与相关防御酶活性的关系研究[J]. 玉米科学, 2014, 22(5): 146-152. WANG G D, HUANG C N, WU W L, et al. Defense enzyme activities and the resistance to northern leaf blight of different hybrids in maize[J].JournalofMaizeSciences, 2014, 22(5): 146-152.(in Chinese with English abstract)
[26] ADIE B A, PÉREZ-PÉREZ J, PÉREZ-PÉREZ M M, et al. ABA is an essential signal for plant resistance to pathogens affecting JA biosynthesis and the activation of defenses inArabidopsis[J].PlantCell, 2007, 19(5): 1665-1681.
[27] 徐涛, 王建武, 骆世明. 玉米oxylipins信号途径关键基因的克隆及其在虫害诱导防御中的作用[J]. 科学通报, 2005, 50(20):2217-2225. XU T, WANG J W, LUO S M. Cloning of the key genes in maize oxylipins pathways and their roles in herbivore induced defense[J].ChineseScienceBulletin, 2005, 50(20): 2217-2225.(in Chinese)
[28] 冯远娇, 王建武, 骆世明. 外源茉莉酸处理对Bt玉米直接防御物质含量及其相关基因表达的影响[J]. 中国农业科学, 2007, 40(11): 2481-2487. FENG Y J, WANG J W, LUO S M. Effectsof exogenous jasmonic acid on concentrations of direct defense chemicals and expression of related genes inBt(Bacillusthuringiensis) corn (Zeamays)[J].ScientiaAgriculturaSinica, 2007, 40(11): 2481-2487. (in Chinese with English abstract)
(责任编辑 侯春晓)
Resistance mechanism of bio-control strain DZSY21 against maize sheath blight
SU Bo1, JIANG Hubiao2, QIAO Jianli3, PAN Jie2, XU Wei2, WU Anning2, DING Ting2,*
(1.AnhuiProvincialKeyLaboratoryofCropBiology,Hefei230036,China; 2.SchoolofPlantProtection,AnhuiAgriculturalUniversity,Hefei230036,China; 3.InstituteofPlantProtectionandAgriculturalChemistry,NanyangAcademyofAgriculturalSciences,Nanyang473083,China)
This study was carried out to explicit the resistance mechanism of endophytic bacteria DZSY21 against maize sheath blight. The colonization property of biocontrol strain DZSY21 in maize leaf sheath was analysed by antibiotic label method, and resistance of maize treated with DZSY21 at different growth stages to sheath blight were assessed through field experiments, then the related enzymes activity and expression ofPR-1 andPR-2agene in maize leaf sheath treated with DZSY21 at different growth stages were detected by spectrophotometry and quantitative real-time PCR. The results indicated that DZSY21 could successfully colonize maize leaf sheath, it had a symbiotic relationship with maize leaf sheath, and colonization of DZSY21 in maize leaf sheath could significantly enhance maize resistance to maize sheath blight. Activities of polyphenol oxidase (PPO), peroxidase (POD), phenylalnine ammonialyase (PAL) and expression of defense response genes (PR-1,PR-2a) in maize leaf sheath treated with DZSY21 were significantly higher than those of normal control groups at different growth stages. The results afforded scientific basis for the further research on bio-controlling mechanism and DZSY21 application.
maize sheath blight; polyphenol oxidase, peroxidase; phenylalnine ammonialyase; defense response gene; colonization
10.3969/j.issn.1004-1524.2017.03.15
2016-09-21
国家自然科学基金面上项目(31371980);安徽农业大学大学生创新基金项目
苏博(1990—),女,安徽淮北人,硕士,研究方向为植物病理学。E-mail: 1585376210@qq.com
*通信作者,丁婷,E-mail: dingting98@126.com
S435.13;S476
A
1004-1524(2017)03-0450-10
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(3): 450-459
http://www.zjnyxb.cn
苏博, 江胡彪, 乔建礼, 等. 玉米纹枯病生防菌DZSY21的抗病机制[J]. 浙江农业学报, 2017, 29(3): 450-459.
