VEGF与MMP-2在子宫腺肌病子宫内膜-肌层界面的表达及意义
2017-04-07刘秋红李红云李红玲
刘秋红,邹 颖,王 博,李红云,李红玲
(1.湖南省妇幼保健院,长沙410008;2.湖南省人民医院,长沙 410002)
VEGF与MMP-2在子宫腺肌病子宫内膜-肌层界面的表达及意义
刘秋红1,邹 颖1,王 博2,李红云1,李红玲2
(1.湖南省妇幼保健院,长沙410008;2.湖南省人民医院,长沙 410002)
目的:探讨血管内皮生长因子(vascular endothelial growth factor,VEGF)和基质金属蛋白酶-2(matrix metalloproteinase -2,MMP-2)在子宫腺肌病患者子宫内膜-肌层界面(endometrial-myometrial interface,EMI)的表达及意义。方法:采用免疫组化ElivisiongTMSuper法对40 例子宫腺肌病患者(观察组)子宫内膜(含部分肌层)和对照组40 例子宫肌瘤患者子宫内膜(含部分肌层)的组织进行标记、检测并比较。结果:观察组增生期及分泌期EMI处VEGF、MMP-2的表达均显著高于远肌层,且显著高于对照组。结论:子宫腺肌病患者EMI处VEGF的高表达,可促使异位内膜及其周围肌层血管生成,而EMI处MMP- 2的过度表达与子宫腺肌病内膜组织侵袭力和平滑肌大量增生有关,二者可能在子宫腺肌病的发生发展中起协同作用。
子宫内膜-肌层界面;血管内皮生长因子;基质金属蛋白酶-2;子宫腺肌病;免疫组化
1 资料与方法
1.1 一般资料 收集湖南省人民医院2008年1月~2011年12月间因子宫腺肌病行子宫切除的40例患者的子宫内膜(含部分肌层)标本作为观察组,取因子宫肌瘤行子宫切除的40例患者的子宫内膜(含部分肌层)标本作为对照组。每组增生期、分泌期各20例。观察组平均年龄43岁,对照组平均年龄45岁,两组患者年龄无差异。所有病例术前3月内无任何激素治疗史。
1.2 方法 所有的标本用10 %甲醛固定,石蜡包埋,5μm 切片,行免疫组化染色。鼠抗人VEGF单克隆抗体、即用型非生物素免疫组化ElivisiongTMSuper检测试剂盒、DAB染色液均购自福州麦新公司。所有操作严格按照试剂盒说明操作。
1.3 免疫组化分析及结果判断 免疫组化染色结果的评分按照参考文献[4]评分方法,阳性染色为细胞浆中出现浅黄色、棕黄色或棕褐色颗粒,根据阳性细胞百分率及显色深浅分级:(1)无细胞显色为0;< 25 %细胞显色为1;25 %~50 %细胞显色为2;51 %~75 %细胞显色为3;> 75 %细胞显色为4;(2)不显色或显色不清为0;浅黄色为1;棕黄色为2;棕褐色为3;(3)两项的乘积;0 分为阴性(-);1~4 分为弱阳性(+);5~8 分为中度阳性(+ +);9~12 分为强阳性(+ + +)。阳性率=阳性表达例数/总例数。
1.4 统计学分析 所有数据均应用SPSS 17.0 统计软件进行分析,计数资料用率表示,两样本均数间比较采用独立样本t检验,相关检验采用Spearman法,检验水准α=0.05,P<0.05 为差异有统计学意义。
2 结果
2.1 VEGF的表达情况 VEGF阳性的表达产物均定位于子宫内膜腺上皮细胞、血管内皮细胞、平滑肌细胞及间质细胞的胞浆中,呈淡黄色、棕黄色、棕褐色等不同强度染色。观察组和对照组增生期、分泌期EMI处VEGF的表达强度高于远肌层,差异有统计学意义(P< 0.05)。观察组增生期及分泌期在EMI处VEGF的表达强度高于对照组(P< 0.05)。观察组与对照组在远处肌层VEGF的表达比较无统计学差异。(P>0.05),见表1。
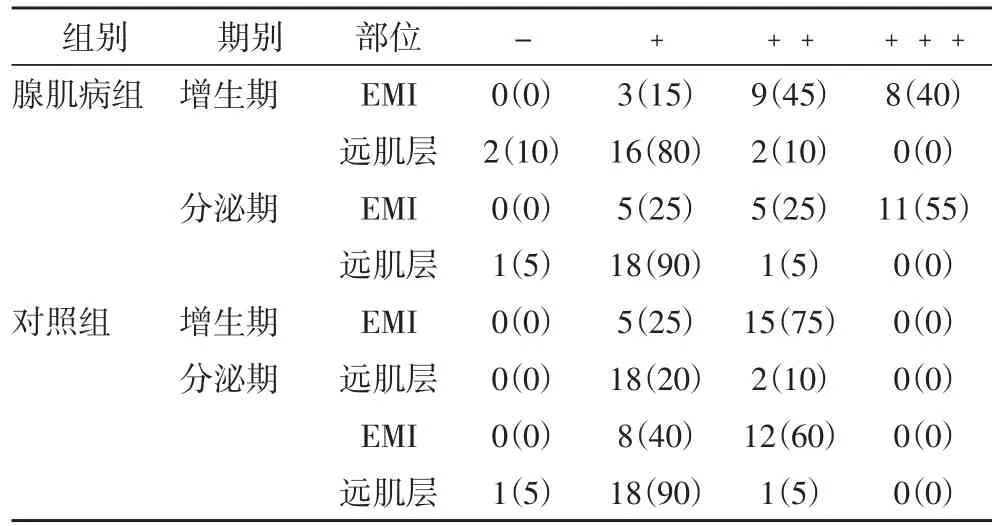
表1 两组不同部位VEGF水平比较[例(%)]
2.2 MMP-2的表达情况 MMP-2蛋白免疫组化显色主要位于子宫内膜腺上皮细胞、平滑肌细胞及间质细胞的胞浆内,呈棕黄色。观察组和对照组增生期、分泌期EMI处MMP-2的表达强度显著高于远肌层,差异有统计学意义(P< 0.05)。观察组增生期、分泌期在EMI处MMP-2的表达高于对照组(P< 0.05)。观察组与对照组在远处肌层MMP-2的表达比较无显著性差异。(P>0.05),见表2。
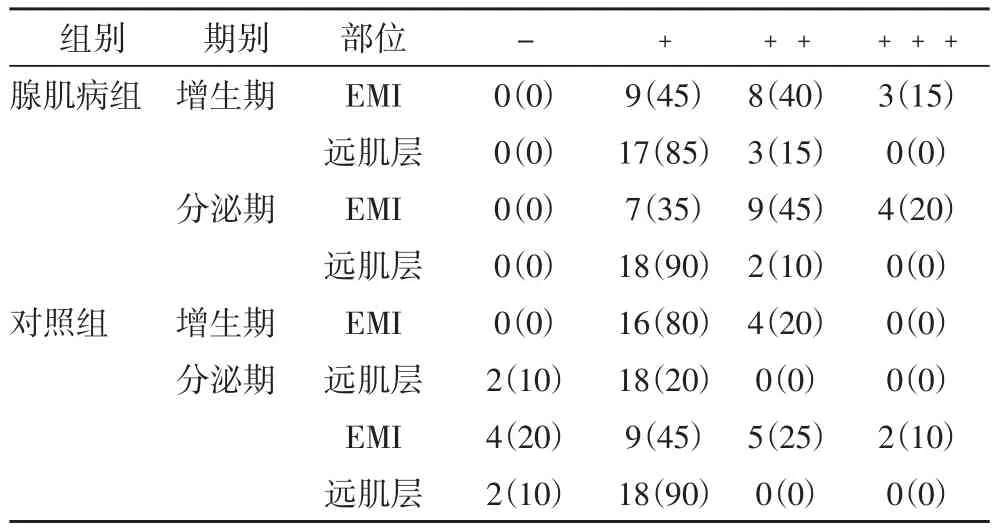
表2 两组不同部位MMP-2水平比较 [例(%)]
2.3 VEGF与MMP- 2表达的相关性分析 在腺肌病组增生期及分泌期EMI处VEGF与MMP- 2表达的相关系数r分别为0.457和0.488,P均 < 0.05,说明两因子表达呈正相关。
3 讨论
3.1 VEGF在子宫腺肌病发病机制中的作用 VEGF是血小板生长因子超家族的重要成员,是目前已知作用最强、最重要的促血管生成因子。它是内皮细胞特异性的有丝分裂原,能直接作用于内皮细胞,通过和其特异性受体结合,可促进血管内皮细胞的增殖和血管的生成,并可增加血管通透性,介导内皮细胞迁移、浸润,从而更有利于血管生成。其表达高低反映了该组织的血管生成的活性。研究[5]表明,子宫腺肌病患者VEGF表达的相对增强使子宫腺肌病患者在位、异位子宫内膜的血管形成能力大于正常妇女。近年来对于EMI的研究日益增多,对其与各种疾病发生的认识也越发深刻,比较成熟的观点认为子宫结合带结构和功能的异常与子宫腺肌病的发生关系密切。有研究表明子宫腺肌病患者EMI处肌细胞超微结构缺乏周期性、规律性变化,不同于正常子宫[6]。Ibrahim MG等[7]用电子显微镜及免疫组化证实子宫腺肌病EMI处肌纤维混乱,并且核膜不规则,存在超微创伤。并且子宫缺乏粘膜下层[8],因此粘膜向肌层侵入的屏障作用较弱,EMI易被破坏。贾喜菲等[9]研究发现子宫肌瘤合并子宫腺肌病的子宫结合带部位肌细胞功能减退及间隙连接蛋白43(connexin43,Cx43)的低表达可能与子宫肌瘤合并子宫腺肌病的发病有关。
本研究发现观察组增生期和分泌期EMI处VEGF的表达高于对照组,提示在整个月经周期中,EMI处子宫内膜中VEGF均可使子宫内膜间质血管渗透性增加,导致间质水肿和纤维素沉积,并可以诱导血管生成,促进并维持异位病灶及其周围组织的血管活性,为子宫内膜侵入子宫肌层创造条件,使异位内膜获得血供后得以侵袭、发展,使得病灶不断扩大[10]。这与我们前期研究结果一致[11]。有学者研究发现腺肌病患者病灶中VECF的表达水平明显高于原位内膜,且原位内膜VECF的表达亦显著高于正常子宫内膜[12,13]。我们推测EMI处VEGF的高表达,为子宫腺肌病内膜异位到子宫肌层创造了良好的内环境,使得内膜可以异位,且在肌层内诱导血管生成,并维持异位病灶周围组织的血管活性,使得异位病灶不断发展扩大。
3.2 MMP-2在子宫腺肌病发病机制中的作用 在正常情况下,子宫内膜基底层具有抵制内膜向肌层方向生长的作用,异位内膜组织必须降解基底膜和其它ECM成分,破坏正常间质细胞之间的连接并侵袭子宫肌层才能在子宫肌层深处浸润生长。因此,异位子宫内膜的侵袭性增强导致ECM降解和重建,是子宫腺肌病发病的关键环节。这个过程主要依靠基质金属蛋白酶(matrixmetalloproteinases,MMPs)、纤溶酶原激活剂、组织蛋白酶D蛋白水解酶等。其中MMPs在ECM的破坏和降解过程中起重要作用,它与妊娠和分娩、肿瘤侵袭等一系列生理、病理过程密切相关[9]。MMP-2又称明胶酶A,是MMPs家族中主要成员之一,能降解ECM中Ⅳ型、V型胶原和明胶筹主要成分,而这些成分是细胞侵袭必须跨越的屏障。有研究表明p21的激活激酶4(p21-activated kinase 4,PAK4)通过调控MMP-2的活动可增强子宫内膜细胞的侵袭力导致子宫腺肌病的发展[15]。
本研究发现观察组增生期、分泌期EMI处MMP-2的表达均高于对照组,提示EMI处MMP-2的高表达在月经期周期中使蛋白水解酶活性增强,改变ECM的生长和合成,使得其对组织的侵袭性增强,导致ECM降解和重建,长期作用造成EMI结构的破坏,使得子宫内膜腺上皮和间质细胞侵入肌层异位种植形成病灶而发病。3.3 VEGF与MMP-2的相关性分析 细胞的增殖能力以及免疫逃逸的能力的增加,会引起一个区域组织的增生,当达到一定点时,就必须有新生血管的形成提供血供才能进一步生长。血管内皮细胞必须穿越其基底膜才能形成新的血管。在血管生成过程中MMPs的活性对内皮细胞的侵入是非常重要的,抑制MMP-2与其底物作用可以减少血管的生成。本研究发现,MMP-2与VEGF之间呈正相关,在观察组增生期、分泌期EMI处,二者的表达均高于对照组。VEGF可以改变血管内皮细胞基因表达方式,促进MMPs的合成,使其对组织的侵袭性增强,导致ECM降解和重建,长期作用造成EMI结构破坏,为子宫内膜异位到肌层创造了良好条件。这也符合朗景和教授“在位内膜决定论”的观点[16]。由此可见,VEGF、MMP-2在EMI处高表达并呈正相关,二者可能在子宫腺肌病的发生、发展中有协同作用。
[1] Fujii E, Nakayama M, Nakagawa A. Concentrations of receptor for adcanced glycation end products, VEGF and CML in plasma follicular fluid, and peritoneal fluid in women with and without endometriosis[J]. Reprod Sci, 2008, 1(10): 1072.
[2] Jana S, Rudra DS, Paul S, et al. Curcumin delays endometriosis development by inhibiting MMP-2 activity[J]. Indian J Biochem Biophys, 2012, 49(5): 342-348.
[3] Uduwela AS, Perera MA, Aiqing L, et al. Endometrial-myometrial interface: relationship to adenomyosis and changes in pregnancy[J]. Obstet Gynecol Surv, 2000, 55(6): 390-400.
[4] Sillem M, Hahn U, Coddington CC 3rd, et al. Ectopic growth of endometrium depends on its structural integrity and proteolytic activity in the cynomolgus monkey(Macaca fascicularis)model of endometriosis[J]. Fertil Steril, 1996, 66(3): 468-473.
[5] 刘燕, 康佳丽, 王小霞, 等. VEGF、ENS、MVD在子宫腺肌病中的表达及意义[J]. 中国妇产科临床杂志, 2009, 10(50): 363-366.
[6] Zhang Y, Zhou L, Li TC, et al. Ultrastructural features of endometrialmyometrial interface and its alteration in adenomyosis[J]. Int J Clin Exp Pathol, 2014, 7(4): 1469-1477.
[7] Ibrahim MG, Chiantera V, Frangini S, et al Ultramicro-trauma in the endometrial-myometrial junctional zone and pale cell migration in adenomyosis. Fertil Steril, 2015, S0015-0282(15)01886-1885.
[8] 高桂琴. 子宫内膜的子宫肌层连接区与子宫腺肌病的研究进展[J].国外医学: 妇产科学分册, 2001, 28(6): 353-355.
[9] 贾喜菲, 宋静慧, 萨日娜. 子宫肌瘤、子宫肌瘤合并子宫腺肌病结合带的超微结构变化及Cx43表达[J]. 中华临床医师杂志, 2013, 7(19): 8688-8695.
[10] 韩燕华, 周应芳, 郑淑蓉. 子宫腺肌病患者血管内皮生长因子表达的研究[J]. 中华妇产科杂志, 2002, 37(9): 539-541.
[11] 刘秋红, 李劼, 李红玲. VEGF 在子宫腺肌病子宫内膜‐肌层界面的表达及意义[J]. 医学临床研究, 2014, 31(2): 374-375.
[12] 陈华, 金松, 卢斋, 等. NF-κB和MMP-9在子宫腺肌病中的表达及意义[J]. 海南医学院学报, 2012, 18(8): 1027-1029.
[13] 杨静, 杨苏安, 段智, 等. CD44v6及VEGF在子宫腺肌病中的表达及意义[J]. 中国现代医学杂志, 2012, 22(10): 52-55.
[14] Darakhshan S, Bidmeshkipour A, Khazaei M, et al. Synergistic effects of tamoxifen and tranilast on VEGF and mmp-9 regulation in cultured human breast cancer cells[J]. Asian Pac J Cancer Prev, 2013, 14(11): 6869-6874.
[15] Yi KW, Kim SH, Ihm HJ, et al. Increased expression of p21-activated kinase 4 in adenomyosis and its regulation of matrix metalloproteinase-2 and -9 in endometrial cells. Fertil Steril, 2015, 103(4): 1089-1097.
[16] 张玮, 方小玲. NF-κB和MMP-9在子宫腺肌病中的表达及意义[J].中国当地医药, 2013, 20(12): 9-11.
Expression and significance of vascular endothel growth factor and matrixmetalloproteinase-2 in the Endometrial-Myometrial Interface of Adenomyosis
Liu Qiu-hong1, Zou Ying1, Wang Bo2, Li Hong-yun1, Li Hong-ling2
(1. The Maternal And Child Health Hospital of Hunan Province, Changsha 410008, China; 2. Hunan Provincial People,s Hospital, Changsha 410002, China)
endometrial-myometrial interface; VEGF; MMP-2; adenomyosis; immunohistochemistry子宫腺肌病是子宫内膜腺体及间质侵入子宫肌层所致,常引起痛经、月经过多、子宫增大和不孕。其虽是良性疾病,却有浸润、转移、复发等类似恶性肿瘤的生物学行为。近年来其发病率逐年攀升,但发病机理尚不明确。很多学者发现子宫腺肌病的发生发展与子宫内膜侵袭力及局部血供的增加、血管形成密切相关[1]。VEGF是重要的血管生成因子,与血管的形成密切相关。MMP-2与组织侵袭有关,可引起细胞外基质(extracellar matrix,ECM)的降解和重建,与子宫内膜异位症、子宫腺肌病的发生、发展密切相关[2]。2000年Uduwela等[3]提出子宫内膜-肌层界面(endometrialmyometkial inferface,EMI)的概念,认为EMI在结构、功能上具有特殊性,是一个重要的区域。本研究旨在通过检测EMI处VEGF、MMP-2的表达,探讨二者与子宫腺肌病发生发展的关系。
R711.71
A
1673-016X(2017)01-0004-04
2016-10-11
邹颖,E-mail:506921055@qq.com
[Abstract]Objective To observe the expressions of vascular endothelial growth factor(VEGF)and matrix metalloproteinase-2(MMP-2)in the endometrial-myometrial interface(EMI)of adenomyosis. Methods Immunohistochemistry ElivisiongTMSuper method was adopted to determine the expressions of VEGF and MMP-2 in EMI of forty cases of adenomyosis and of forty cases of uterine fibroids subjects. Results The expression level of VEGF and MMP-2 were higher in EMI versus outer layer, and higher in adenomyosis group versus control group, both proliferative stage and progestational stage. Conclusion The high expression of VEGF in EMI of adenomyosis may facilitate the angiopoiesis of ectopic endometrium and myomemtrium, the overexpression of MMP-2 in EMI may be related to over growth of smooth muscle of uterus and invasiveness of endometrium tissue during progression of adenomyosis. MMP- 2 and VEGF are two important factors involved in progression of adenomyosis.
