Lgr5、β-catenin在卵巢上皮性癌组织中的表达及对SKOV3细胞增殖迁移的影响*
2017-04-07王金铭
张 展,朱 海,宋 华,王金铭
郑州大学第三附属医院妇产科 郑州 450052
Lgr5、β-catenin在卵巢上皮性癌组织中的表达及对SKOV3细胞增殖迁移的影响*
张 展△,朱 海,宋 华,王金铭
郑州大学第三附属医院妇产科 郑州 450052
△女,1959年9月生,博士,教授,研究方向:生殖免疫,E-mail:zhangzhanzdsfy@126.com
Lgr5;Wnt/β-catenin信号通路;卵巢上皮性癌;细胞增殖;细胞迁移;SKOV3细胞
目的:探讨G蛋白偶联受体家族Lgr5和β-catenin在卵巢上皮性癌中的表达及对SKOV3细胞增殖和迁移能力的影响。方法:收集卵巢正常、良性肿瘤及上皮性癌组织标本各30例,采用免疫组化法检测Lgr5和β-catenin蛋白的表达情况。用Lgr5 shRNA、NC shRNA转染卵巢癌 SKOV3细胞,同时以未转染细胞作空白对照,分别采用Western blot和实时荧光定量PCR法检测3组细胞中lgr5、β-catenin蛋白和mRNA的表达水平,分别采用CCK-8和划痕实验检测3组细胞的增殖和迁移能力。结果:卵巢上皮性癌组织中Lgr5、β-catenin阳性表达率分别为63.3%(19/30)、83.3%(25/30),二者表达水平均较良性肿瘤、正常卵巢组织升高(P<0.05),且两者表达呈正关联(rp=0.373,P=0.028)。与空白对照组、NC shRNA转染组比较, Lgr5 shRNA转染组SKOV3细胞中Lgr5、β-catenin蛋白和mRNA的表达均显著降低(P<0.05),细胞的增殖能力和迁移能力显著降低(P<0.05)。结论:Lgr5可能通过增强Wnt/β-catenin信号通路参与卵巢癌细胞增殖、迁移能力的调控。
卵巢上皮性癌是常见的妇科恶性肿瘤,致死率居妇科恶性肿瘤首位,严重威胁妇女的生命健康,其发病机制尚不清楚;解决早期诊断,控制复发、转移和化疗耐药等问题成为卵巢上皮性癌研究的热点[1-2]。Lgr5(leucine-rich repeat-containing g-protein coupled receptor 5),属于G蛋白偶联受体家族,在胚胎发育和成体干细胞的自我更新及维持中起重要作用,是多种组织和成体干细胞的标志物[3-5]。研究[6-9]表明,Lgr5可以加速细胞周期,促进细胞增殖,在许多恶性肿瘤组织中(如胃肠道肿瘤、肝癌、基底细胞癌、宫颈癌等)高表达,而正常组织中表达量较低。Wnt/β-catenin信号通路与肿瘤的发生发展密切相关,其核心分子β-catenin的异常高表达可能参与了肿瘤干细胞的形成[10],从而影响化疗耐受、肿瘤的复发、转移及预后[11]。近年来研究[12]发现,Lgr5在甲状腺癌、宫颈癌中可能通过上调β-catenin的表达,促进肿瘤细胞的增殖和迁移能力。因此,作者对卵巢上皮性癌组织中Lgr5、β-catenin的表达以及沉默Lgr5基因对卵巢癌细胞SKOV3增殖迁移能力的影响进行了观察。
1 材料与方法
1.1 试剂和仪器 通用型两步法免疫组化试剂盒PV9000购于北京中杉金桥生物技术服务公司,RPMI 1640培养基购于海克隆生物制品公司, 携带Lgr5 shRNA的绿色荧光标记质粒购于苏州吉玛生物公司,转染试剂Lipofectamine2000购于美国Invitrogen公司,Lgr5抗体购于美国Abcam公司,兔抗β-catenin抗体购于美国Cell Signaling公司,实时荧光定量PCR试剂购于日本东洋纺公司,CCK-8试剂盒购于日本同仁化学研究所。
1.2 卵巢上皮性癌组织中Lgr5和β-catenin蛋白表达的检测 选取2014年至2015年郑州大学第三附属医院病理确诊的卵巢组织石蜡切片,其中正常卵巢组织30例,卵巢良性肿瘤组织30例,卵巢上皮性癌组织30例;患者术前均未接受任何放疗、化疗等辅助治疗,临床病例资料完整。采用SP两步法免疫组化检测Lgr5和β-catenin的表达,按PV9000试剂盒说明书进行脱蜡、水化、抗原修复、封闭等操作,滴加一抗在4 ℃环境下过夜,滴加二抗37 ℃孵育1 h,DAB显色。结果判定:阳性细胞表现为胞浆棕褐色着色;20倍镜下,每张切片随机选取5个视野,每个视野计数200个细胞,计算阳性细胞百分比。
1.3 沉默Lgr5对SKOV3细胞增殖迁移能力影响的观察
1.3.1 实验分组 SKOV3细胞由该课题组保存,在体积分数5%CO2、37 ℃恒温培养箱中使用RPMI 1640培养基(含体积分数10%胎牛血清)培养,2~3 d传代1次。取对数生长期细胞,用2.5 g/L胰酶消化后以合适的细胞密度分3组接种于6孔板中,每组2孔,细胞长满约50%时,采用脂质体瞬时转染法进行Lgr5 shRNA质粒转染,按转染试剂说明书进行操作。同时设未转染对照组和NC shRNA转染组。转染24 h后用倒置荧光显微镜观察,高倍镜(40×)下每孔随机选取5个视野观察。实验重复3次。
1.3.2 Lgr5和β-catenin mRNA的检测 转染48 h后,采用实时荧光定量PCR法检测3组细胞中Lgr5和β-catenin mRNA。Trizol法提取细胞总RNA,按照反转录及相关试剂说明进行操作,引物由金唯智生物有限公司合成,表达量采用2-ΔΔCT方法计算。Lgr5上游引物序列:5’-GACAAGGGAGACCTG GAGAA-3’,下游:5’-GAGAAGGACAAGAAAGCCA CA-3’;β-catenin上游引物序列:5’-GAGTGCTGAAG GTGCTATCTGTC-3’,下游:5’-CTGAACAAGAGTC CCAAGGAGA-3’;内参β-actin上游引物序列:5’-AT GGTGGGAATGGGTCAGAAG-3’,下游:5’-TCTCCATG TCGTCCCAGTTG-3’。
1.3.3 Lgr5和β-catenin蛋白的检测 转染48 h后,采用Western blot法检测3组细胞中Lgr5和β-catenin蛋白。用RIPA提取细胞总蛋白,BCA法测蛋白浓度。蛋白上样量40 μg,80 V恒压30 min后转120 V恒压电泳约120 min,转膜,50 g/L脱脂奶粉室温封闭1 h,加入一抗(稀释度11 000)4 ℃过夜,TBS洗涤后室温孵育二抗(稀释度14 000)1.5 h,洗涤后用Odyssey CLx成像系统检测各条带的灰度值,以目的条带与内参条带灰度值的比值表示目的蛋白的表达水平。
1.3.4 增殖能力检测 将SKOV3细胞接种于96孔板中,每孔4 000~6 000个细胞、100 μL培养液,过夜贴壁后按1.3.1分组处理,每组6个复孔,48 h后每孔加入10 μL CCK-8试剂,37 ℃避光孵育,2 h内每30 min在波长450 nm处检测吸光度(A),计算细胞增殖抑制率。以不做任何处理的孔为增殖对照,以不含细胞而含100 μL培养液和10 μL CCK-8试剂的孔为试剂对照。增殖抑制率=(A增殖对照-A实验组)/(A增殖对照-A试剂对照)×100%。
1.3.5 迁移能力检测 采用划痕实验。将SKOV3细胞接种于6孔板,按1.3.1分组处理,每组2孔。24 h后用10 μL移液枪枪头在单层细胞上呈“一”字划痕,0、24、48 h后在倒置显微镜下每孔随机选择3个视野观察并拍照,用Image J软件测量图片中细胞划痕的长度。
1.4 统计学处理 采用SPSS 17.0进行统计学处理。3组卵巢组织中Lgr5和β-catenin阳性表达率的比较采用χ2检验,卵巢上皮性癌组织中Lgr5和β-catenin表达的关联性分析采用列联系数,3组细胞Lgr5、β-catenin蛋白和mRNA表达水平、增殖抑制率及划痕间距的比较采用单因素方差分析,两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1 卵巢上皮性癌组织中Lgr5和β-catenin蛋白的表达 Lgr5、β-catenin蛋白在卵巢上皮性癌组织中的阳性表达率高于正常卵巢组织和卵巢良性肿瘤组织,见图1和表1。卵巢上皮性癌组织中Lgr5和β-catenin蛋白的表达呈正关联,见表2。
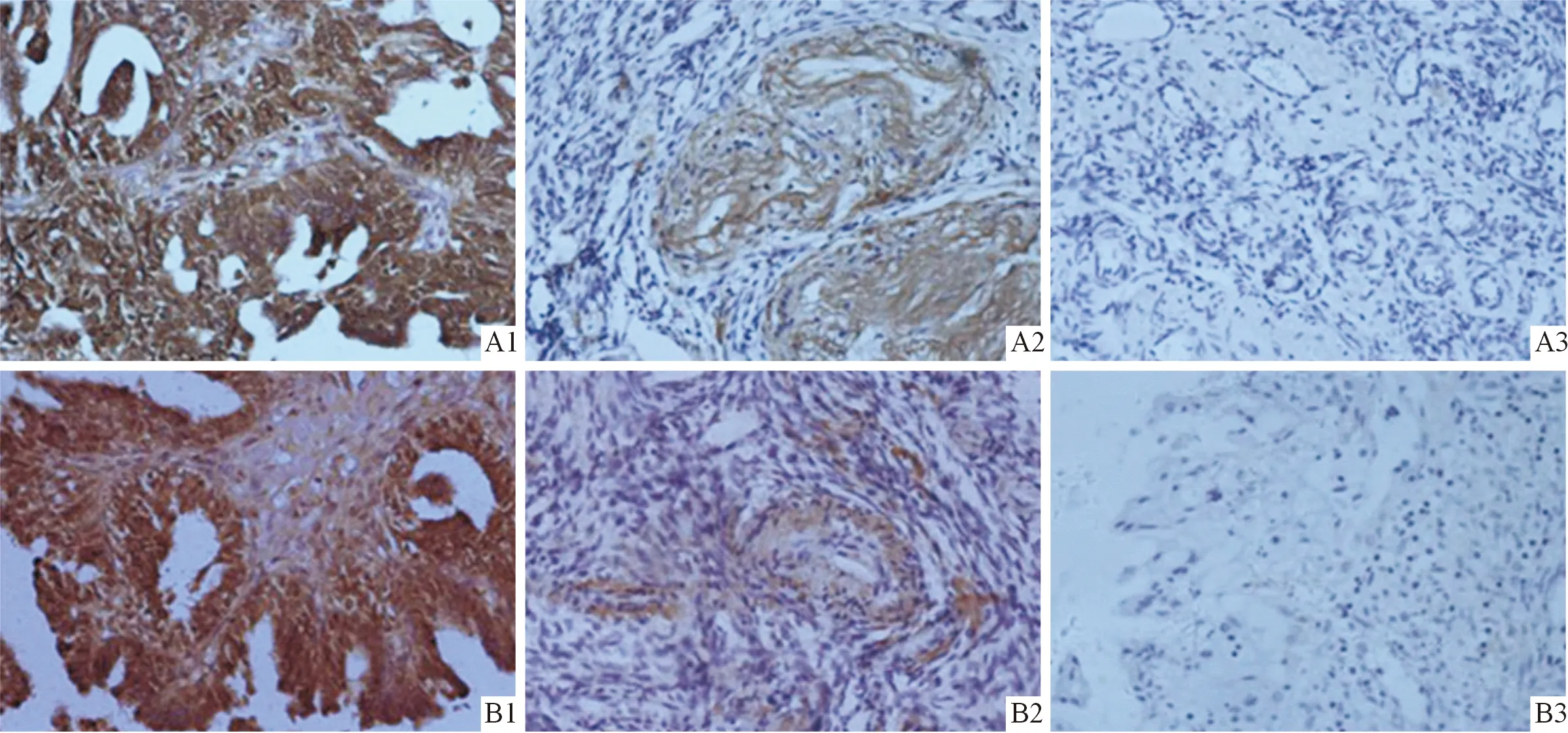
1:卵巢上皮性癌组织;2:卵巢良性肿瘤组织;3:正常卵巢组织。图1 3种卵巢组织中Lgr5(A)和β-catenin(B)蛋白的表达(×40)
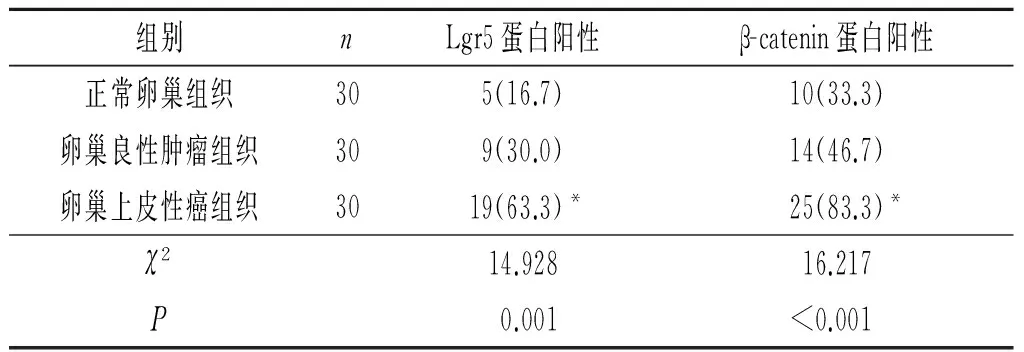
表1 卵巢上皮性癌组织中Lgr5和β-catenin蛋白的表达 例(%)
*:与正常卵巢、卵巢良性肿瘤组织比较,P<0.016。

表2 卵巢上皮性癌组织中Lgr5和β-catenin表达的关联性 例
rp=0.373,P=0.028。
2.2 沉默Lgr5基因后SKOV3细胞的表现
2.2.1 3组细胞中Lgr5、β-catenin蛋白和mRNA的表达 见图2和表3。Lgr5 shRNA转染组细胞中Lgr5、β-catenin蛋白和mRNA的表达均较空白对照组和NC shRNA转染组降低。

1、2:NC shRNA转染组;3、4:Lgr5 shRNA转染组;5、6:未转染对照组。图2 3组SKOV3细胞中Lgr5和β-catenin蛋白的表达

表3 3组SKOV3细胞中Lgr5和β-catenin的表达
*:与未转染对照组比较,P<0.05;#:与NC shRNA转染组比较,P<0.05。
2.2.2 3组细胞的增殖、迁移能力 见图3、表4。
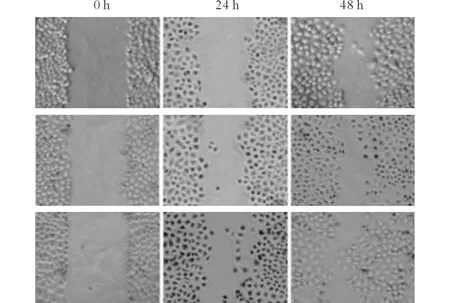
上排:Lgr5 shRNA转染组;中排:NC shRNA转染组;下排:未转染对照组。图3 3组细胞划痕实验表现

表4 3组细胞增殖抑制率和划痕间距的比较
*:与未转染对照组比较,P<0.05;#:与NC shRNA转染组比较,P<0.05。
3 讨论
卵巢上皮性癌是女性常见的恶性肿瘤之一,由于缺少有效的早期诊断方法,其5 a生存率较低,因此探讨其发生发展的分子生物学机制一直是研究的热点。Lgr5在胚胎干细胞、多种肿瘤细胞中高表达,可能参与调控细胞周期,在细胞的增殖过程中发挥重要作用[13-15]。Wnt/β-catenin信号通路在胚胎发育中具有重要作用,亦与多种肿瘤的发生发展息息相关。近年来有报道,在甲状腺癌及宫颈癌组织中,Lgr5可能通过Wnt/β-catenin信号通路影响癌细胞的增殖和迁移能力[16]。因此作者对卵巢上皮性癌组织中Lgr5和β-catenin蛋白的表达情况,以及沉默Lgr5对卵巢癌SKOV3细胞中β-catenin蛋白表达及细胞增殖迁移能力的影响进行了观察。
结果显示,在组织水平上,Lgr5与β-catenin在卵巢上皮性癌中的表达均较正常卵巢组织和卵巢良性肿瘤组织有显著升高,且Lgr5与β-catenin表达呈正关联,提示Lgr5和β-catenin可能协同在卵巢癌的发生发展中发挥作用,并有潜力作为生物标志物应用于卵巢上皮性癌的诊断。
结果还显示,在细胞水平上,转染Lgr5 shRNA后,SKOV3细胞中Lgr5 mRNA及蛋白表达明显降低,提示成功地靶向抑制了Lgr5基因的表达。进一步检测发现,随着Lgr5基因被靶向抑制,SKOV3细胞中β-catenin mRNA及蛋白表达亦显著降低,提示Lgr5可能作为上游基因调控β-catenin的表达。β-catenin是经典Wnt致癌通路中的核心物质,推测Lgr5可能通过Wnt/β-catenin信号通路参与SKOV3细胞的功能调控。
在细胞功能方面,CCK-8检测结果显示,靶向抑制Lgr5表达后SKOV3细胞的增殖抑制率显著升高,划痕实验中划痕间距增加,说明靶向抑制Lgr5表达后SKOV3细胞增殖能力和迁移能力均显著下降,提示Lgr5可能参与了SKOV3细胞增殖和迁移能力的调控。有文献[6]报道Lgr5高表达可能是肿瘤细胞异常增殖、细胞周期缩短的原因之一。该实验结果与上述文献报道相符。
总之,该研究结果表明Lgr5和β-catenin均在卵巢上皮性癌组织中特异性高表达,且呈正关联;Lgr5可能通过Wnt/β-catenin信号通路调节卵巢癌SKOV3细胞中β-catenin的表达,从而影响细胞的增殖和迁移能力,在卵巢癌的发生发展中起着重要作用。该研究结果为阐明卵巢上皮性癌发生发展的分子生物学机制提供了实验依据,为卵巢癌的防治提供了新思路。
[1]薛景戈,任琛琛,杨立,等.卵巢上皮性癌组织中IGF-1,E-cad蛋白的表达以及IGF-1对卵巢癌SKOV3细胞E-cad表达和侵袭力的影响[J].郑州大学学报(医学版),2016,51(3):396
[2]刘星烁,李红雨,赵书君,等.上皮性卵巢癌组织中 miR-126、EGFL7的表达与微血管密度的检测[J].郑州大学学报(医学版),2015,50(2):244
[3]NAKATA S,PHILLIPS E,GOIDTS V.Emerging role for leucine-rich repeat-containing G-protein-coupled receptors Lgr5 and LGR4 in cancer stem cells[J].Cancer Manag Res,2014,6:171
[4]PAIK DY,JANZEN DM,SCHAFENACKER AM,et al.Stem-like epithelial cells are concentrated in the distal end of the fallopian tube: a site for injury and serous cancer initiation[J].Stem Cells,2012,30(11):2487
[5]PLAKS V,BRENOT A,LAWSON DA,et al.Lgr5-expressing cells are sufficient and necessary for postnatal mammary gland organogenesis[J].Cell Rep,2013,3(1):70
[6]SNYDER JC,ROCHELLE LK,MARION S,et al.Lgr4 and Lgr5 drive the formation of long actin-rich cytoneme-like membrane protrusions[J].J Cell Sci,2015,128(6):1230
[7]FLESKEN-NIKITIN A,HWANG CI,CHENG C,et al.Ovarian surface epithelium at the junction area contains a cancer-prone stem cell niche[J].Nature,2013,495(7440):241
[8]HE S,ZHOU H,ZHU X,et al.Expression of Lgr5, a marker of intestinal stem cells, in colorectal cancer and its clinicopathological significance[J].Biomed Pharmacother,2014,68(5):507
[9]LIU SL,GONG ZY,CHEN MR,et al.Lgr5-positive cells are cancer stem cells in skin squamous cell carcinoma[J].Tumor Biol,2014,35(11):11605
[10]HASEBE T,FUJIMOTO K,KAJITA M,et al.Thyroid hormone activates Wnt/β-catenin signaling involved in adult epithelial development during intestinal remodeling inXenopuslaevis[J].Cell Tissue Res,2016,365(2):309
[11]LI B,CAI S,ZHAO Y,et al.Nerve growth factor modulates the tumor cells migration in ovarian cancer through the WNT/β-catenin pathway[J].Oncotarget,2016,7(49):81026
[12]MICHELOTTI G,JIANG X,SOSA JA,et al.Lgr5 is associated with tumor aggressiveness in papillary thyroid cancer[J].Oncotarget,2015,6(33):34549
[13]zAK M,VAN OORT T,HENDRIKSEN FG,et al.LGR4 and Lgr5 regulate hair cell differentiation in the sensory epithelium of the developing mouse cochlea[J].Front Cell Neurosci,2016,10(10):186
[14]CAPEL B.Ovarian epithelium regeneration by Lgr5(+) cells[J].Nat Cell Biol,2014,16(8):743
[15]SUN Y,JIA X,WU X.High expressions of Lgr5 and ALDH1 in primary epithelial ovarian cancer correlate with advanced tumor stage and grade as well as poor prognosis of the patients[J].Gynecol Obstet Invest,2015,8(1):162
[16]AMSTERDAM A,RAANAN C,SCHREIBER L,et al.Localization of the stem cell markers Lgr5 and Nanog in the normal and the cancerous human ovary and their inter-relationship[J].Acta Histochem,2013,115(4):330
(2016-12-28收稿 责任编辑王 曼)
Expressions of Lgr5 and β-catenin in epithelial ovarian cancer tissue and the effect on cell proliferation and migration of SKOV3 cells
ZHANGZhan,ZHUHai,SONGHua,WANGJinming
DepartmentofGynaecology,theThirdAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
Lgr5;Wnt/β-catenin signaling pathway;epithelial ovarian cancer;cell proliferation;cell migration;SKOV3 cells
Aim: To investigate the expressions of G protein coupled receptor Lgr5 and β-catenin in ovarian epithelial cancer tissue and the effect on the cell proliferation and migration of SKOV3 cells.Methods: The expressions of Lgr5 and β-catenin protein in tissue from 30 cases of ovarian cancer and 30 cases of ovarian benign tumor, as well as 30 normal ovarian tissue samples were detected by immunohistochemistry. The SKOV3 cells were transfected with Lgr5 shRNA, and those transfected with NC shRNA and without transfection were the control. The protein and mRNA expressions of Lgr5 and β-catenin in SKOV3 cells were detected by Western blot and qRT-PCR,respectively; cell proliferation was detected by CCK-8 assay and the cell migration was detected by scratch assay. Results: The positive rates of Lgr5 and β-catenin in epithelial ovarian cancer tissue were 63.3%(19/30) and 83.3%(25/30), which were higher when compared with the normal ovarian tissue and ovarian benign tumor tissue(P<0.05).There was positive correlation between the expressions of Lgr5 and β-catenin in epithelial ovarian cancer tissue(rp=0.373,P=0.028). Compared with the two control groups, the protein and mRNA expressions of Lgr5 and β-catenin in SKOV3 cells transfected with Lgr5 shRNA were significantly lower(P<0.05), and proliferation and migration capacity were significantly lower(P<0.05).Conclusion: Lgr5 may regulate the proliferation and migration of SKOV3 cells by enhancing the signal pathway of Wnt/β-catenin.
10.13705/j.issn.1671-6825.2017.02.008
*河南省科技厅基础与前沿项目 152300410190
R737.31
