miR-124靶向TNF-α促进猪皮下脂肪细胞分化
2017-04-06李虹仪李家标郑艺林吉卢琳张茂郑恩琴
李虹仪 李家标 郑艺林 吉卢琳 张茂 郑恩琴
(1. 龙岩学院生命科学学院 动物营养科研创新团队,龙岩 364012;2. 华南农业大学 广东省农业动物基因组学与分子育种重点实验室,广州 510642)
miR-124靶向TNF-α促进猪皮下脂肪细胞分化
李虹仪1李家标1郑艺林1吉卢琳1张茂1郑恩琴2
(1. 龙岩学院生命科学学院 动物营养科研创新团队,龙岩 364012;2. 华南农业大学 广东省农业动物基因组学与分子育种重点实验室,广州 510642)
前期研究中采用双萤光素酶报告基因验证了miR-124与脂解因子猪TNF-α之间的靶关系,以此为基础研究miR-124是否影响猪皮下脂肪细胞的分化。采用miR-124 模拟物mimics和抑制物inhibitor 分别转染猪脂肪前体细胞并诱导其分化成成熟脂肪细胞,检测细胞的聚脂情况,甘油及甘油三酯的含量变化,荧光定量检测脂肪细胞关键转录因子PPARγ,脂肪合成和分解的主要酶FASN和HSL基因的表达变化。结果显示,过表达miR-124 能抑制TNF-α蛋白的表达,脂肪细胞脂滴多于对照组,甘油三酯(TG)含量显著增加(P<0.01),甘油含量亦显著增加(P<0.05),PPARγ、FASNT和HSL的表达显著上调(P<0.01);抑制细胞miR-124的表达脂滴则较少,TG含量显著减少(P<0.05),PPARγ和FASN的表达均显著下调(P<0.05)。miR-124可能通过抑制TNF-α调节猪脂肪细胞的分化,为后续研究miR-124调节脂肪代谢的相关机制奠定基础。
miR-124;猪;脂肪分化;TNF-α
肿瘤坏死因子(Tumor necrosis factor-α,TNF-α)是一个多功能因子,由脂肪细胞产生并分泌,从多方面影响脂肪细胞的功能。TNF-α在脂肪组织中与多个基因相互联系,起着抑制脂肪生成[1]、促进脂肪细胞脂解[2]等作用。miRNA(microRNA)是近年来逐渐被关注的调控分子,能通过靶mRNA的编码区或3'非翻译区互补结合实施转录后调控。研究表明miRNA调控哺乳动物至少60%的基因[3],参与了几乎所有细胞的活动。越来越多的研究结果显示,miRNA对脂肪细胞的分化增殖及脂肪的沉积起至关重要的作用。如miR-130和miR-27家族均通过减少靶基因PPARγ的生物合成抑制人脂肪细胞的分化[4,5];而miR-148则是通过靶向CREB基因非翻译区,抑制其表达从而促进人脂肪细胞的分化[6]。
miR-124目前的研究大都与肿瘤相关,研究显示miR-124可抑制髓母细胞瘤细胞[7]、胃癌细胞[8]、乳腺癌细胞[9]、前列腺癌细胞[10]等癌症相关细胞的增殖。miR-124调控脂肪相关功能的研究较为少见,而猪作为沉积脂肪能力最强的动物之一,其与人类在生理生化方面有很多相似性,且存在着天然的脂肪型和瘦肉型品种,因此被认为是研究人类肥胖、糖尿病等脂肪代谢相关疾病最佳的模式动物。
在前期的研究中我们用双萤光素酶系统检测出miR-124与猪TNF-α有直接的靶关系,能显著抑制猪TNF-α的表达[11]。因此,本实验以猪皮下脂肪前体细胞为模型,研究miR-124对猪脂肪细胞分化的影响以及是否通过TNF-α起调节作用。
1 材料与方法
1.1 材料
细胞培养板培养瓶购自Corning公司;DMEM/F12培养基、胎牛血清、胰蛋白酶、I 型胶原酶、双抗(青、链霉素)购自GIBCO公司;地塞米松(Dexmethasone)、重组牛胰岛素(Insulin)、油酸(Oleic acid)和辛酸(Octanoic acid)购自SIGMA公司;油红O(Oil Red O)、PMSF购自Amresco公司;转染试剂Lipofectamine 2000、Trizol一步法总RNA提取试剂购自Invitrogen公司;96孔定量PCR板和定量PCR膜购自Axygen;miRNA mimics、inhibitor以及阴性对照(NC)由上海吉玛公司合成;甘油三酯检测试剂盒购自北京普利莱基因技术有限公司;RIPA细胞裂解液和BCA法总蛋白测定试剂盒购自北京百泰克生物技术有限公司。
1.2 方法
1.2.1 猪皮下脂肪前体细胞的分离培养 采用Zhou等[12]建立的分离培养方法,选取7日龄的长白仔猪,放血处死后用75%(V/V)酒精消毒,在无菌条件下分离背部皮下脂肪,眼科剪将脂肪组织剪碎后用0.1%的I型胶原酶于37℃水浴摇床消化1-2 h。消化液过筛后于800×g离心5 min,在沉淀细胞中加入10 mL红细胞裂解液,室温孵育10 min过筛,再用DMEM/F12洗涤细胞,800×g离心10 min后用含10%新生牛血清、100 000 U/L青霉素,100 mg/L的链霉素的DMEM/F12培养液重悬细胞,接种于75 cm2细胞培养瓶中,置于37℃、饱和湿度、5%CO2培养箱中培养。
1.2.2 细胞的转染及诱导 生长良好的脂肪前体细胞消化后以1.5×105cells/cm2接种到6孔板中,细胞24 h内汇合90%时,将70 ng miR-124 mimics或inhibitor与LipofectamineTM2000进行孵育,按照说明书操作方法转染细胞,并以NC作为阴性对照,每个处理设6个重复。转染24 h后用含胰岛素、地塞米松、油酸和辛酸(各50 nmol/L)的分化培养基进行对细胞诱导,连续诱导8 d。
1.2.3 油红O染色 将诱导8 d的脂肪细胞用DMEM/F12洗两次,加入200-250 μL 4%多聚甲醛固定液固定后加入油红O工作液染色30 min;染完用清水冲洗去掉残留的油红O,滴加适量甘油封孔,置于倒置显微镜下观察拍照。
1.2.4 甘油及甘油三酯检测 细胞诱导过程中收集细胞培养基进行甘油检测;诱导8 d后脂肪细胞用DMEM/F12洗两次,加入100 μL细胞裂解液(含1 mmol/L PMSF的RIPA细胞裂解液),轻轻摇动培养板充分裂解细胞,将细胞裂解液转移到500 μL离心管中,BCA(bicinchoninic acid)法测定每孔细胞总蛋白含量;甘油和甘油三酯测定分别根据试剂盒说明书进行检测,检测结果根据标准曲线计算待测样品中甘油和甘油三酯的浓度,所得数据均用总蛋白数据进行校正。
1.2.5 Western blot 检测 提取分化成熟脂肪细胞的总蛋白,用5%PAGE浓缩胶和10%SDS-聚丙烯酰胺凝胶分离胶对总蛋白进行电泳分离,分离完全后将胶上TNF-α蛋白和β-actin分别转到PVDF膜上,1×TBS洗涤膜10 min后用5% 脱脂奶粉室温封闭1 h。封闭后的PVDF膜加入2 mL适度稀释的蛋白一抗,4℃冰箱旋转孵育过夜。次日移出剩余的一抗,加入2 mL 1∶5 000稀释的红外二抗孵育1 h,蛋白显像用Odyssey红外成像仪(LI COR)扫描。
1.2.6 定量检测 Trizol一步法抽取诱导后皮下脂肪细胞总RNA,OligodT18反转录成cDNA,并以此为模板进行各相关基因的荧光定量PCR检测,所用引物如下:
PPARγ:S-CATTCGCATCTTTCAGGG,ATGGACGCCATACTTTAGGA;
FASN:S-ACCGAGTGGCTGGGTATT,A-CAAGAAGAGGTTGTTGTGGG;
HSL:S-GCCCGAGACGAGATTAG,ATGAAGGGATTCTTGACG。
检测结果以β-actin作为内参照,根据以下公式计算出目的基因相对于内参基因的比值来反应各基因mRNA表达丰度:2-ΔCt=2-(Ct目的基因-Ct内参基因)。
1.2.7 数据统计 组间差异采用t检验进行分析,以P<0.05作为差异显著性检验标准。所有数据分析均由SPSS19.0统计软件完成。
2 结果
2.1 猪皮下脂肪前体细胞的诱导分化
猪皮下脂肪前体细胞铺满培养板底90%时将培养基更换为含有含胰岛素、地塞米松、油酸和辛酸(各50 nmol/L)的分化培养基,隔天换液,连续诱导8 d。从显微镜下可以观察到(图1),诱导2 d后细胞开始出现黄色小脂滴,此后随着诱导天数的增加,脂滴的数量逐渐增多,体积逐渐增大。第8天时可以清楚地观察到细胞的形态以及脂滴在细胞中的分布,前期出现的脂滴在此时已变得饱满明亮,周围挤满了后期分化的脂滴。

图1 猪脂肪细胞分化模型
2.2 miR-124对猪脂肪细胞TNF-α表达的影响
前期研究工作中得出miR-124能通过种子序列抑制TNF-α的表达,为了进一步研究miR-124是否作用于猪脂肪细胞中TNF-α的表达,利用前体细胞的分化模型,以1.5×105cells/cm2的密度将前体细胞接种于6孔板中,待细胞铺满90%时,分别转染miR-124 mimics以及阴性对照NC,转染24 h后将培养基更换为分化培养基进行分化诱导,连续诱导8 d后收集细胞蛋白,Western blot 检测结果(图2)显示,过表达miR-124会抑制猪脂肪细胞中TNF-α的表达。
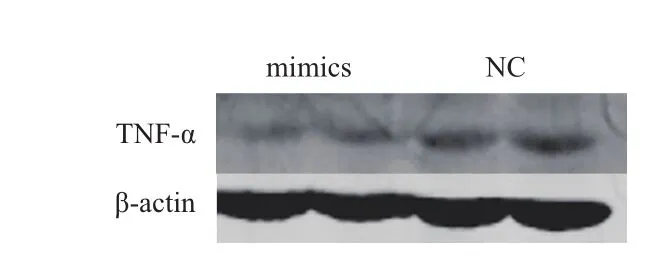
图2 miR-124抑制TNF-α蛋白表达
2.3 miR-124对猪皮下脂肪前体细胞分化的影响
为了研究miR-124对猪皮下脂肪前体细胞的调节作用,待细胞铺满90%时,分别转染miR-124 mimics、miR-124 inhibitors和NC,转染24 h后进行分化诱导,连续诱导8 d,收集细胞检测各处理细胞的总蛋白量及TG含量。校正结果(图3-A)显示,转染miR-124 mimics的细胞TG含量比对照组显著增加(P<0.01),转染miR-124 inhibitor 的细胞对照组TG含量比对照组显著降低(P<0.01)。油红O对脂肪细胞染色结果与TG检测结果一致。从图3-B和3-C可以看出,过表达miR-124时细胞脂滴增多,抑制则呈现相反的结果。同时,又对细胞的甘油含量进行了检测(图3-C),发现表过达miR-124的细胞甘油含量也显著增加(P<0.05)。
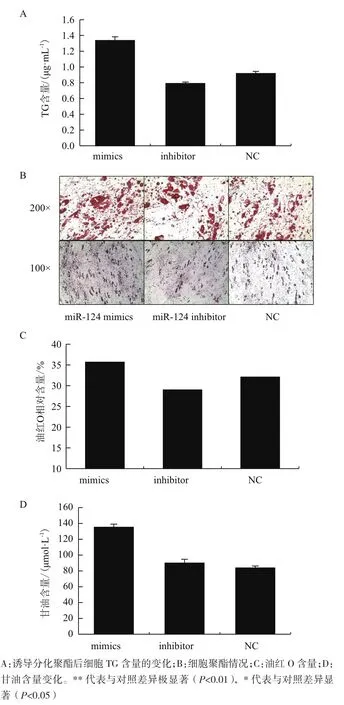
图3 miR-124调控脂肪细胞的聚酯分化
2.4 miR-124对脂肪前体基因表达的调节
为了验证miR-124是否通过TNF-α影响脂肪细胞的分化,收集诱导8 d的脂肪细胞进行RNA抽取并反转录为cDNA,荧光定量检测与TNF-α相互调节且对脂肪细胞分化起重要作用的转录因子和酶的表达,结果(图4)显示,转染miR-124 mimics的细胞PPARγ、FASN和HSL的表达均显著上调(P<0.01),而抑制miR-124表达的细胞PPARγ和FASN的表达显著下调(P<0.05),而HSL则同样显著下调(P<0.05)。
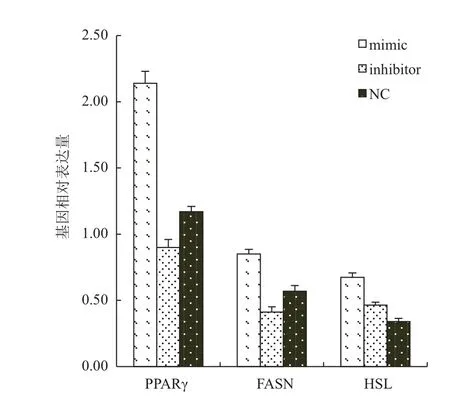
图4 miR-124调控脂肪细胞代谢相关基因的表达
3 讨论
本研究以猪皮下脂肪前体细胞为模型进行诱导分化,分化过程中可见细胞内的脂滴随着分化天数的增加不断变多、变大,且能被油红O所染色,说明猪皮下脂肪细胞培养成功,保证后续实验的开展。在前期实验中发现miR-124能抑制猪TNF-α的表达,而TNF-α在脂肪细胞中能够通过NIK-TAK1/TAB1轴激活NFκB对PPARγ进行抑制[13],从而起到一定的脂解作用。本研究中细胞过表达miR-124后表现为TNF-α蛋白含量减少,脂滴增多,甘油三酯含量显著增加,可能为细胞分化过程中miR-124通过抑制TNF-α的表达减缓对PPARγ的抑制,使细胞表现为促进脂肪合成。定量检测中显示PPARγ和FASN的表达显著上升,其中PPARγ是脂肪前体细胞分化中后期两个最重要的转录调控因子之一,而FASN在脂肪酸合成中起着至关重要的作用,影响着动物脂肪的沉积。定量的结果正好印证了上述推测观点。
过多的的脂肪将通过脂肪动员,在HSL的刺激下分解成甘油和游离的脂肪酸,但是,细胞上清甘油的含量和细胞HSL的表达并不如预测中般下降,而是上升。有研究也显示,TNF-α能够抑制HSL mRNA表达[14],因此,本研究中过表达miR-124提高HSL基因表达可能是通过抑制TNF-α的表达来完成的,且对应地表现为细胞甘油含量显著增加。猪脂肪细胞的合成与分解途径是相互协调的[15],因此推测实验中过表达miR-124使脂肪细胞合成代谢加快,TG含量显著增加,但细胞为了维持代谢平衡,提高内部分解代谢酶的表达,一定程度上促进了脂肪的分解,因此甘油含量比对照组高。即过表达miR-124同时促进了脂肪的合成代谢与分解代谢,合成代谢速度比分解代谢快使细胞表现为脂滴增多。
另外,实验还研究了抑制miR-124的表达细胞TNF-α蛋白水平和脂滴的变化,TG和甘油含量变化以及相关基因的表达变化,结果显示,细胞的聚酯情况,TG含量,PPARγ和FASN的表达均表现为与miR-124 mimics相反的作用,但TNF-α的蛋白水平及甘油含量均没显著变化,而HSL表达虽然不及mimics般显著但同样表现为上升,这可能为多个小RNA同时作用于相同靶基因,抑制之后其他小RNA会有一定的补偿效应。
4 结论
miR-124能通过调节TNF-α的表达调控脂肪细胞的分化,过表达miR-124将促进细胞的聚酯,提高TG的含量,提高相关基因的表达,而抑制miR-124的表达则结果相反。
[1]MacDougald OA, Mandrup S. Adipogenesis:forces that tip the scales[J]. Trends Endocrinol Metab, 2002, 13(1):5-11.
[2]Langin D, Arner P. Importance of TNFalpha and neutral lipases in human adipose tissue lipolysis[J]. Trends Endocrinol Metab, 2006, 17(8):314-320.
[3]Friedman RC, Farh KK, Burge CB, et al. Most mammalian mRNAs are conserved targets of microRNAs[J]. Genome Res, 2009, 19(1):92-105.
[4]Lee EK, Lee MJ, Abdelmohsen K, et al. MiR-130 suppresses adipogenesis by inhibiting peroxisome proliferator-activated receptor gamma expression[J]. Mol Cell Biol, 2010, 31(4):626-638.
[5] Karbiener M, Fischer C, Nowitsch S, et al. MicroRNA miR-27b impairs human adipocyte differentiation and targets PPARgamma[J]. Biochem Biophys Res Commun, 2009, 390(2):247-251.
[6] Shi C, Zhang M, Tong M, et al. MiR-148a is associated with obesity and modulates adipocyte differentiation of mesenchymal stem cells through Wnt signaling[J]. Sci Rep, 2015, 5:9930.
[7]Silber J, Hashizume R, Felix T, et al. Expression of miR-124 inhibits growth of medulloblastoma cells[J]. Neuro Oncol, 2013, 15(1):83-90.
[8]Xie L, Zhang Z, Tan Z, He R, et al. MicroRNA-124 inhibits proliferation and induces apoptosis by directly repressing EZH2 in gastric cancer[J]. Mol Cell Biochem, 2014, 392(1-2):153-159.
[9]Li W, Zang W, Liu P, Wang Y, et al. MicroRNA-124 inhibits cellular proliferation and invasion by targeting Ets-1 in breast cancer[J]. Tumour Biol, 2014, 35(11):10897-10904.
[10] Shi XB, Xue L, Ma AH, et al. Tumor suppressive miR-124 targets androgen receptor and inhibits proliferation of prostate cancer cells[J]. Oncogene, 2013, 32(35):4130-4138.
[11]. 李虹仪, 习欠云, 张永亮. 调节猪TNF-α表达的miRNAs鉴定[J]. 中国生物工程杂志, 2014, 34(10):35-40.
[12]Zhou GX, Wang SB, Wang ZG, et al. Global comparison of gene expression profiles between intramuscular and subcutaneous adipocytes of neonatal landrace pig using microarray[J]. Meat Science, 86(2010):440-450.
[13]Kralisch S, Klein J, Lossner U, et al. Isoproterenol, TNFalpha, and insulin downregulate adipose triglyceride lipase in 3T3-L1 adipocytes[J]. Mol Cell Endocrinol, 2005, 240(1-2):43-49.
[14]Cawthorn W, Sethi J. TNF-α and adipocyte biology[J]. Febs Letters, 2008, 582(1):117-131.
[15]Gardan D, Gondret F, Louveau I. Lipid metabolism and secretory function of porcine intramuscular adipocytes compared with subcutaneous and perirenal adipocytes[J]. Am J Physiol Endocrinol Metab, 2006, 291(2):E372-380.
(责任编辑 李楠)
miR-124 Regulates Porcine Adipocyte Differentiation Trough Targeting TNF-α
LI Hong-yi1LI Jia-biao1ZHENG Yi-lin1JI Lu-lin1ZHANG Mao1ZHENG En-qin2
(1.Animal Nutrition Scientific Research Innovation Team,College of Life Science,Longyan University,Longyan 364012;2.Guangdong Provincial Key Lab of Agro-animal Genomics and Molecular Breeding, South China Agricultural University, Guangzhou 510642)
In the previous research,porcine TNF-α was found to be the target of miR-124 by dual luciferase assay. Here we verify whether miR-124 has the effect on the differentiation of porcine adipocyte. Porcine pre-adipocyte was transfected with miR-124 mimics or inhibitor to over-express or to repress miR-124,and then induced into mature adipocytes. The accumulation of lipid droplets was observed using Oil Red O staining and the amount of glycerol and triglycerides(TG)were detected by TG assay and glycerol assay. The expressions of PPARγ(proliferator-activated receptor-γ),FASN(fatty acid synthase),and HSL(hormone-sensitive lipase)were detected by real time fluorescence quantitative PCR. The result showed that overexpression of miR-124 repressed the expression of TNF-α protein,therefore,lipid droplets were more than that in the control,TG increased significantly(P < 0.01),also the same for glycerol(P < 0.05),and the expressions of PPARγ,FASNT,and HSL significantly up-regulated(P < 0.01). Repressing miR-124 resulted in the reduction of lipid droplets and the significant decrease of TG,and the expressions of PPARγ and FASNT significantly down-regulated(P < 0.05). In conclusion,miR-124 might regulate the differentiation of porcine adipocyte by suppressing TNF-α,laying a foundation for future studies on the mechanism of miR-124 regulating lipid metabolism.
miR-124;porcine;adipocyte differentiation;TNF-α
10.13560/j.cnki.biotech.bull.1985.2017.03.025
2016-08-02
福建省大学生创新创业训练计划项目(201511312055),福建省自然科学基金项目(2014J05043),龙岩学院博士启动基金项目(LB2013012)
李虹仪,女,讲师,研究方向:动物营养生理与生物化学;E-mail:politician_137@163.com
张茂,男,讲师,研究方向:动物遗传;E-mail:zm18email@163.com
