莪术含药血清抑制HSCs中Shh和Gli1表达的机制研究
2017-04-06冯藜枥曹文富
冯藜枥+曹文富

[摘要]研究莪術含药血清抑制活化的大鼠肝星状细胞(hepatic stellate cells,HSCs)中Hedgehog(Hh)信号通路关键因子Shh(sonic hedgehog),Gli1(glioma-associated oncogene homolog-1)表达的机制。清洁级SD大鼠均分2组,分别给予莪术水煎剂、生理盐水灌胃取血制备含药血清。体外培养大鼠HSCs,分为7组:空白组、模型组、Hh通路抑制剂组、莪术组、Hh通路抑制剂+莪术组、Hh通路激动剂组、Hh通路激动剂+莪术组。除空白组外,其余各组均给予100 μg·L-1瘦素诱导后,各组再予以相应药物干预24 h,经MTT法检测HSCs增殖情况,RT-PCR法检测Shh,Gli1的mRNA表达,Western blot法检测Shh,Gli1蛋白表达及免疫荧光法检测Gli1蛋白表达。经瘦素活化的大鼠HSCs中Shh,Gli1的mRNA和蛋白表达均显著上调(与空白组比较P<0.01)。Hh通路抑制剂、莪术含药血清分别干预后,Shh,Gli1的mRNA和蛋白表达显著下调(与模型组比较P<0.01);莪术含药血清与Hh通路抑制剂协同干预后,Shh,Gli1 mRNA和蛋白表达显著下调(与模型组比较P<0.01);Hh通路激动剂干预后,Shh,Gli1 mRNA和蛋白表达显著上调(与模型组比较P<0.01)。用莪术含药血清干预Hh通路激动剂组后,Shh,Gli1 mRNA和蛋白表达显著下调(与Hh通路激动剂组比较P<0.01)。莪术含药血清可通过抑制瘦素诱导活化的HSCs中Shh,Gli1的表达,参与Hh信号通路抑制HSCs的活化,发挥抗肝纤维化的作用。
[关键词] 莪术; 肝星状细胞; Shh; Gli1; Hedgehog信号通路; 肝纤维化
[Abstract] To explore the mechanism of Ezhu-containing serum in inhibiting the expression of sonic hedgehog(Shh) and glioma-associated oncogene homolog-1(Gli1) in hepatic stellate cells(HSCs) induced by leptin. Twenty sprague-dawley (SD) rats were randomly divided into 2 groups (N=10), and given Ezhu-decoction and physiological saline by gavage for 10 days to prepare drug-containing serums. The HSCs during the exponential growth phase were divided into 7 groups: blank control group, model group, hedgehog pathway inhibitor(cyclopamine) group, Ezhu group, Ezhu and cyclopamine group, hedgehog pathway agonost(pumorphamine) group, Ezhu and purmorphamine group. HSCs were cultured in vitro and induced with 100 μg·L-1 leptin(except for the blank control group), then treated separately with the corresponding drugs for 24 hours. After the cells were collected, HSCs proliferation was detected using MTT colorimetric assay; the expressions of Shh and Gli1 were determined by PT-PCR, Western blot and immunofluorescence, respectively. The expressions of Shh and Gli1 were significantly increased after the HSCs of rats were induced by leptin (compared with the blank control group, P<0.01). After being interfered with Hh pathway inhibitor (cyclopamine) and Ezhu-containing serum, the expressions of Shh and Gli1 were decreased significantly(compared with the model group, P<0.01). After Ezhu-containing serum was used to interfere the Hh pathway inhibitor group, the mRNA and protein expressions of Shh and Gli1 were decreased significantly(compared with the model group, P<0.01). After Ezhu-containing serum was used to interfere the purmorphamine group, the mRNA and protein expressions of Shh and Gli1 decreased significantly(compared with the purmorphamine group, P<0.01). Ezhu-containing serum plays an important role in inhibiting HSCs activation by taking part in hedgehog signaling pathway, so as to regulate the expression of Shh and Gli1 in leptin-induced HSCs and then inhibit liver fibrosis.
[Key words] Ezhu; hepatic stellate cell; sonic hedgehog; glioma-associated oncogene homolog-1; hedgehog signaling pathway; hepatic fibrosis
肝纤维化(hepatic fibrosis,HF)是肝组织慢性损伤后的修复反应,可进一步发展为肝硬化,甚至肝癌[1-2]。目前已经证实HF是可逆的[3],但肝硬化却不可逆。因此,阻断和逆转肝纤维化具有重要的意义。HF主要由细胞外基质(extracellular matrix,ECM)异常增多和降解不足引起。活化的肝星状细胞(hepatic stellate cell,HSCs)是ECM的主要来源,其过度增殖是肝纤维化形成的关键[4-5]。抑制HSCs活化增殖,可促进ECM降解,从而逆转肝纤维化[6-7]。因此,抑制HSCs活化增殖已成为目前抗肝纤维化的主要策略[8-9]。
研究表明,过度或持续激活的Hedgeheg(Hh)信号通路可促进HSCs的活化增殖,从而加速肝纤维化的进程,通过干预Hh信号通路抑制HSCs的活化增殖被认为是抗肝纤维化的潜在靶点[10-11]。目前临床上尚无明确有效的抗纤维化西药[12],因此开发具有Hh阻断效应的中药具有重要意义。莪术在临床中常被用于防治肝纤维化,但目前对于莪术抗肝纤维化的基础研究,报道尚少。本实验通过观察莪术含药血清对活化的HSCs中Hh信号通路关键因子Shh,Gli1表达的影响,探讨莪术抗肝纤维化可能的作用机制。
1 材料
1.1 动物 SPF级SD大鼠20只(雌雄各半),体重180~220 g,由重庆医科大学实验动物中心提供,动物许可证号SYXK(渝)2012-0001。采用随机数字表法将大鼠分为空白组、莪术组,每组10只,进行灌胃实验。
1.2 细胞 大鼠肝星状细胞由重庆医科大学附属第二医院消化科提供。
1.3 药物 莪术饮片购自重庆医科大学附属第一医院药房,莪术经重庆医科大学中医药学院曹文富教授鉴定,符合2015年版《中国药典》规定标准。生理盐水购自重庆医科大学附属第一医院。
1.4 试剂与器材 兔抗鼠Shh多克隆抗体(BIOSS公司,货号bs-1544R,规格0.1 mL);兔抗鼠Gli1多克隆抗体(Santa Cruz公司,货号sc-20687,规格200 mg·L-1);瘦素(PeproTech公司,货号400-21-1000,规格200 μg);Hh通路抑制剂(Cyclopamine,Selleck公司,货号S3042,规格10 mg);Hh通路激动剂(Purmorphamine,Selleck公司,货号S1146,规格5 mg);逆转录试剂盒(Toyobo公司);倒置相差显微镜(型号CXX41,Olympus);核酸蛋白分析仪(BECKMAN DU640);PCR仪(Applied Biosy Stems);SDS-PAGE凝胶试剂盒(碧云天生物公司);CO2细胞孵箱(Thermo);超净工作台(AIRTECH);HH-W600型恒温水浴锅(江苏荣华仪器制造有限公司)。
2 方法
2.1 药物制备 莪术的临床人用剂量为0.25 g·kg-1,按“动物与人体的千克体质量折算系数表”成人与大鼠的折算系数为6.25,换算成SD大鼠的临床剂量作为低剂量,按照该剂量的2,4倍分别为中、高剂量,本实验选择高剂量6.25 g·kg-1为大鼠灌胃剂量。
2.2 含药血清制备 20只SPF级SD大鼠随机分为2组(每组10只):空白组、莪术组。各组均按10 mL·kg-1·d-1的浓度给药,每天1次,连续10 d,最后1次灌胃2 h后水合氯醛麻醉,无菌条件下心脏采血。血液静置于4 ℃冰箱过夜,离心(3 000 r·min-1,10 min)后收集含药血清。水浴灭活(56 ℃,30 min),0.22 μm滤器过滤收集的含药血清。
2.3 细胞培养 HSCs在5%CO2,37 ℃的细胞培养箱中用含10%胎牛血清的改良型1640培养液中培养。定期观察细胞生长情况,根据生长状态进行换液,当细胞生长至密度达到80%~90%时传代。
2.4 细胞干预 倒置显微镜下观察细胞生长至80%~90%融合率后,用0.25%胰酶消化,进行实验。实验分为7组:空白组、模型组、Hh通路抑制剂组、莪术组、Hh通路抑制剂+莪术组、Hh通路激动剂组、Hh通路激动剂+莪术组。空白组予以含10%正常鼠血清的1640培养基;模型组予以含100 μg·L-1瘦素和10%正常鼠血清的1640培养基;Hh通路抑制剂组予以含20 μmol·L-1 Hh通路抑制剂、10%正常鼠血清及100 μg·L-1瘦素的1640培养基;莪术组予以含10%莪术含药血清和100 μg·L-1瘦素的1640培养基;Hh通路抑制剂+莪术组予以含20 μmol·L-1 Hh通路抑制剂、10%莪术含药血清及100 μg·L-1瘦素的1640培养基;Hh通路激动剂组予以含1 μmol·L-1 Hh通路激动剂、10%正常鼠血清及100 μg·L-1瘦素的1640培养基;Hh通路激動剂+莪术组予以含10%莪术含药血清、1 μmol·L-1 Hh通路激动剂及100 μg·L-1瘦素的1640培养基。各组细胞在37 ℃,5%CO2培养箱中培养 24 h后收集细胞。
2.5 MTT法检测HSCs增殖活性 HSCs按1×105个/mL接种于96孔板,每孔100 μL,分为7组,每组6个复孔。在37 ℃,5% CO2培养箱内用含10%胎牛血清的1640培养基孵育,24 h后弃上清,按分组条件加入干预因素作用24 h后,于各孔分别加入MTT溶液20 μL,4 h后弃上清,每孔加入150 μL DMSO,振荡10 min,酶标仪在490 nm 波长处测定各孔吸光度(A)。
2.6 RT-PCR检测HSCs内Shh,Gli1的mRNA表达 HSCs按每孔5.0×105个/mL接种于6孔板,每孔2 mL,待细胞生长至80%~90%融合时,吸弃培养基,各组加入相应血清及试剂,24 h后收集细胞。提取细胞总RNA;PCR反条件为:94 ℃预变性5 min,95 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s,32个循环,最后72 ℃延伸10 min。反应结束后取PCR产物15 μL于1%琼脂糖凝胶上进行电泳分析。实验过程中以GAPDH作内参对照。Shh,Gli1基因上下游引物序列均由上海生工生物工程有限公司合成,见表1。
2.7 Western blot法检测HSCs内Shh,Gli1蛋白表达情况 HSCs接种、培养以及药物处理同2.6项。用蛋白裂解液裂解收集的细胞。分别取蛋白质样品50 μg上样,行10%SDS-PAGE电泳分离条带,转膜,封闭,TBS-T洗膜,加一抗,4 ℃过夜;TBST洗膜15 min×3次;二抗室温下孵育1 h,TBST洗膜15 min×3次,曝光显影,光密度扫描仪记录结果进行统计分析。以GAPDH表达水平为内参,目标蛋白的表达量以目标蛋白与内参照蛋白灰度值的相对比值表示。
2.8 免疫荧光法检测HSCs内Gli1蛋白表达情况 取对数生长期HSCs接种于装有小载玻片的6孔板中,培养及相应组别处理同2.6项,制备细胞爬片。弃上清液,PBS洗3 min×3次,4%多聚甲醛室温固定15 min,PBS洗3 min×3次,4 ℃,0.1%Triton-X打孔30 min,0.5%BSA封闭,一抗(1∶50)4 ℃孵育过夜,空白对照以PBS孵育过夜。PBS洗3 min×3次,荧光二抗37 ℃孵育1 h,DAPI(1∶100)室温染核10 min,荧光封片剂封片,荧光显微镜观察、拍照。
2.9 统计学方法 所有数据采用SPSS 19.0软件进行统计分析。所有数据以±s表示,各组样本间的比较采用单因素方差分析。P<0.05为有统计学意义,P<0.01为有显著统计学意义。
3 结果
3.1 莪术含药血清对HSCs增殖的影响 与空白组相比,模型组A显著增高(P<0.01)。与模型组相比,Hh通路抑制剂组、莪术组、Hh通路抑制剂+莪术组A均显著降低(P<0.01),Hh通路激动剂组A显著增高(P<0.01)。与Hh通路激动剂组相比,Hh通路激动剂+莪术组的A明显降低(P<0.01),见表2。
3.2 莪术含药血清对大鼠肝星状细胞Shh,Gli1 mRNA表达的影响 与空白组比较,模型组Shh,Gli1 mRNA显著上调(均P<0.01)。与模型组比较,Hh通路抑制剂组、莪术组、Hh通路抑制剂+莪术组Shh,Gli1 mRNA显著下调(均P<0.01)。与模型组比较,Hh通路激动剂组Shh,Gli1 mRNA显著上调(均P<0.01)。与Hh通路激动剂组比较,Hh通路激动剂+莪术组Shh,Gli1 mRNA显著下调 (均P<0.01),见表3。
3.3 Western blot 法检测莪术含药血清对大鼠肝星状细胞Shh,Gli1蛋白表达的影响 与空白组比较,模型组Shh,Gli1蛋白表达显著上调(均P<0.01)。
与模型组比较,Hh通路抑制剂组、莪术组、Hh通路抑制剂+莪术组Shh,Gli1蛋白表达显著下调(均P<0.01)。与模型组比较,Hh通路激动剂组Shh,Gli1蛋白表达显著上调(均P<0.01)。与Hh通路激动剂组比较,Hh通路激动剂+莪术组Shh,Gli1蛋白表达显著下调(均P<0.01),见图1,表4。
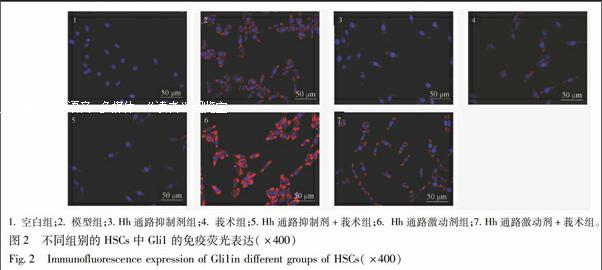
3.4 免疫荧光法检测莪术含药血清对大鼠肝星状细胞Gli1蛋白表达的影响 与空白组相比,模型组和Hh通路激动剂组中Gli1呈高表达,荧光显微镜下可见明显红色荧光。与模型组比较,Hh通路抑制剂组、莪术组、Hh通路抑制剂+莪术组Gli1表达明显减弱。与Hh通路激动剂组比较,Hh通路激动剂+莪术组Gli1表达明显减弱,见图2。
4 讨论
肝纤维化是由活化的HSCs转化成肌成纤维细胞(myofibroblast,MFB),大量合成和分泌ECM,并过度沉积所致。HSCs被激活是纤维化发生的始动环节,有效抑制HSCs的活化和增殖是抗纤维化的关键[13]。
临床上通过辨证论治,运用莪术治疗肝纤维化,疗效是肯定的,但其抗肝纤维化的作用机制尚未阐明。中医认为肝纤维化属于胁痛、积聚等范畴,多因寒、热、湿、毒等病邪反复刺激肝脏,日久则肝虚络瘀,功能受损。研究表明,瘀血阻滞存在于肝纤维化发生发展的始终[14]。瘀血阻滞肝脉,不通则痛,即出现胸胁胀痛。瘀血阻于内而形于外则可见舌质紫暗有瘀点瘀斑、脉涩等。其进一步发展可出现脾脏肿大、肝掌、蜘蛛痣等症状,符合中医学气滞血瘀之病变及莪术用药指征。因此,通过活血化瘀改善肝微循环是治疗肝纤维化的重要途径。莪术性味辛、苦、温,归肝、脾经,具有行气破血、消积止痛之功,中医临床常用于治疗肝纤维化。研究表明,莪术可保护肝细胞,改善血液循环,增加肝内循环血量,减少纤维组织增生,促进胶原纤维降解吸收[15]。
近年来,促进肝再生已成为防治肝纤维化的新途径。经典的Hh信号途径是一条高度保守的信号通路,在组织损伤后的修复、再生方面起着重要的作用[16]。该通路主要由Hh配体、膜蛋白受体、核转录因子Gli组成。经典的Hh活化机制是[17],当不存在Hh配体时,该通路处于抑制状态;Hh配体存在时,配体与膜蛋白受体结合,将Hh信号向细胞内传递,激活核转录因子Gli基因家族,Hh信号通路被激活。经典的Hh信号通路活化依赖于Hh配体存在,并与受体结合,从而活化信号通路。相关研究证实,Hh信号通路与各类慢性肝病的发生发展密切相关[18-19]。研究表明,Hh信号通路可通过调控HSCs的活化增殖,促进肝纤维化的发生发展,而阻断Hh信号通路可减轻肝纤维化的病变程度[20]。在正常肝脏中HSCs是静止的,肝组织受损时死亡的肝细胞释放Hh配体Shh激活Hh信号通路[21],促进静止的HSCs向MFB转化,且MFB自分泌或旁分泌的Shh使Hh信号通路持续激活,使HSCs进一步增殖,抑制凋亡[22-23]。Gli1作為Hh通路末端的核转录因子,是Hh通路激活的标志,在HSCs活化过程中必不可少[24-25]。Shh,Gli1是Hh信号通路首末两端的关键因子,其高表达是Hh信号通路激活的标志,因此本实验选择Shh,Gli1作为检测指标。
研究发现,瘦素可激活Hh信号通路,促进静止型HSCs向肌成纤维细胞转化[26]。本实验以瘦素为刺激因子,结果显示,瘦素诱导HSCs后,HSCs中Shh,Gli1分子的基因和蛋白表达水平均显著上调,提示Hh信号通路被广泛激活。研究显示Hh信号抑制剂环巴胺(cyclopamine)能有效地抑制Hh信号通路活性,抑制HSCs的活化和增殖,从而减轻肝纤维化程度[27]。本研究也显示,予以环靶胺、莪术含药血清分别干预,均能够明显抑制活化的HSCs中Shh,Gli1的表达水平。在环靶胺和莪术协同干预下,Shh,Gli1的表达水平进一步下调,说明莪术与环靶胺在抑制HSCs方面具有协同作用。予以Hh通路激动剂干预瘦素激活的HSCs,使HSCs被高度活化,再应用莪术干预高度活化的HSCs显示Shh,Gli1表达明显下调,说明莪术对不同活化状态的HSCs均能起到抑制作用。本研究显示,用莪术含药血清干预Shh,Gli1产生抑制作用,这提示抑制活化的HSCs中异常激活的Hh信号通路是莪术抗纤维化的作用机制之一。
本实验用环巴胺作为阳性对照。环巴胺是Hh信号通路特异性抑制剂[28],可通过抑制Hh信号通路而抑制HSCs活化和增殖,加速ECM降解,促进HSCs凋亡,逆转肝纤维化。但其具有严重致畸性,可导致在胚胎发育过程中产生前唇裂、腭裂、单眼畸形等,限制了其在临床应用。莪术是中医常用行气活血化瘀药物,功效显著,毒副作用小,价格低廉,中医临床广泛应用于治疗肝纤维化。本研究结果显示莪术具有环靶胺类似的功效。莪术含药血清可通过抑制活化的HSCs中Shh,Gli1的表达,参与Hh信号通路抑制HSCs的活化和增殖,发挥其抗纤维化作用,为临床应用莪术治疗肝纤维化提供了新的理论依据。
[参考文献]
[1] Matz-Soja M, Hovhannisyan A, Gebhardt R. Hedgehog signallingpathway in adult liver: a major new player in hepatocyte metabo-lism and zonation[J]. Med Hypotheses, 2013, 80(5): 589.
[2] Schuppan D, Afdhal N H. Liver cirrhosis[J]. Lancet, 2008, 371(6): 838.
[3] Ellis E L, Mann D A. Clinical evidence for the regression of liver fibrosis[J]. J Hepatol, 2012, 56(5): 1171.
[4] Mederacke I, Hsu C C, Troeger J S, et al. Fate tracing reveals hepatic stellate cells as dominant contributors to liver fibrosis independent ofits etiology[J]. Nat Commun, 2013(4): 2823.
[5] Hernandez-Gea V, Friedman S L. Pathogenesis of liver fibrosis[J]. Annu Rev Pathol, 2011(6): 425.
[6] Sato M, Suzuki S, Senoo H. Hepatic stellate cells: unique char-acteristics in cell biology and Phenotype[J]. Cell Struct Funct, 2003, 28(2): 105.
[7] Friedman S L. Mechanisms of hepatic fibrogenesis[J]. Gastroen-terology, 2008, 134(6): 1655.
[8] Anthony B, Allen J T, Li Y S, et al. Hepatic stellate cells and parasite-induced liver fibrosis[J]. Parasi Vectors, 2010, 3(1): 60.
[9] Yin C, Evason K J, Asahina K, et al.Hepatic stellate cells in liver development, regeneration,and cancer[J]. J Clin Invest, 2013, 123(5): 1902.
[10] Omenetti A, Choi S, Michelotti G, et al. Hedgehog signaling in the liver[J]. J Hepatol, 2011, 54(2): 366.
[11] Sicklick J K, Li Y X, Choi S S, et al.Role for hedgehog signaling in hepatic stellate cell activation and viability[J]. Lab Invest, 2005, 85(11): 1368.
[12] 劉平.肝纤维化肝硬化的中西医结合诊疗发展问题[J].中国中西医结合杂志,2015,35(3):268.
[13] Bolarin D M, Azinge E C. Biochemical markers extracelluar components in liver fibrosis and cirrhosis [J]. Nig Q J Hosp Med, 2007,17(1): 42.
[14] 骆欢欢,王新华.从肝瘀正虚论肝纤维化治疗思路[J].中医杂志,2010,51(5):463.
[15] 李金慈,陆兔林,毛春芹,等.莪术醋制前后抗复合因素致大鼠肝纤维化作用的比较研究[J].中草药,2013,44(19):2710.
[16] Omenetti A, Porrello A, Jung Y, et al. Hedehog signaling regulates epithelial mesenchymal transition during biliary fibrosis in rodents and humans[J]. J Clin Invest, 2008, 118(10): 3331.
[17] Archer T C, Weeraratne S D, Pomeroy S L. Hedgehog-GLI path-way in medulloblastoma[J]. J Clin Oncol, 2012, 30(17): 2154.
[18] 郑浩轩,李淳,王丽,等.Hedgehog信号通路与慢性肝损伤后肝再生的调控[J].中国中医药信息杂志,2013,20(5):38.
[19] 安佰全,姜曼,辛永宁,等.Hedgehog信号通路在非酒精性脂肪性肝纤维化进程中的作用[J].临床肝胆病杂志,2015,31(3):457.
[20] Lian N Q, Jiang Y Y, Zhang F, et al. Curcumin regulates cell fate and metabolism by inhibiting hedgehog signaling in hepatic stellate cells[J]. Lab Invest, 2015, 95(7): 790.
[21] Jung Y, Witek R P, Syn W K, et al. Signals from dying hepatocytes trigger growth of liver progenitors[J]. Gut,2010,59(5):655.
[22] Yang L,Wang Y, Mao H, et al.Sonic hedgehog is an autocrine viability factor for myofibroblastic hepatic stellate cells[J]. J Hepatol, 2008, 48(1): 98.
[23] Seong K H, Akimam H, Dai P, et al. Inhibition of the nuclear of import of cubitus interruptus by roadkill in the presence of strong hedgehog signal[J]. PLoS ONE, 2010, 5(12): e15365.
[24] Kasper M, Regl G, Frisechauf A M, et al. GLI transcription factors:mediators of oncogenic Hedgehog signaling[J]. Eur J Cancer, 2006, 42(4): 437.
[25] Kleiner D E, Chalasani N P, Lee W M, et al. Hepatic histologicalfindings in suspected drug-induced liver injury: systematic evaluation and clinical associations[J]. Hepatol, 2014, 59(2): 661.
[26] Choi S S, Syn W K, Karaca G F, et al. Leptin promotes the myofibroblastic phenotype in hepatic stellate cells by activating the hedgehog pathway[J]. J Biol Chem, 2010, 28(47): 36551.
[27] Rubin L L, de Sauvage F J. Targeting the Hedgehog pathway in cancer[J]. Nat Rev Drug Discov, 2006, 5(12): 1026.
[28] Li R, Cai L, Ding J, et al. Inhibition of hedgehog signal pathway by cyclopamine attenuates inflammation and articular cartilage damage in rats with adjuvant-induced arthritis[J]. J Pharm Pharmacol, 2015, 67(7): 963.
[責任编辑 张宁宁]
