重症急性胰腺炎2例死亡病例的多学科讨论
2017-04-04刘志勇黄耿文
刘志勇,黄耿文
(中南大学湘雅医院 1.重症医学科 2.胰胆外科,湖南 长沙 410008)
重症急性胰腺炎(SAP)发病急、并发症多、病死率高,其诊疗、救治需要多个学科协作。为体现SAP救治的多学科协作理念,笔者召集了本院一个多学科临床专家组对近半年内的2例SAP死亡病例进行讨论,旨在进一步提高SAP的救治成功率。
1 病例简介
1.1 病例1简介
刘志勇医师(中南大学湘雅医院重症医学科)
患者 男,58岁。因“突发上腹部疼痛1 d”于2017年1月7日入院。患者于1 d前无明显诱因出现上腹部刀割样疼痛,向腰背部放射,伴恶心、呕吐及肛门停止排气排便,伴皮肤巩膜黄染。无寒战发热。患者起病以来,未解大便,尿量较前明显减少。既往因“胆囊炎”在当地医院行保守治疗,复查超声未见胆囊内结石。体检:体温37 ℃、血压148/75 mmHg(1 mmHg=0.133 kPa)、呼吸30次/min、脉搏116次/min。皮肤巩膜中度黄染,双肺(-),心脏听诊心率快,腹部膨隆,腹肌紧张,全腹部压痛,以上腹部明显,无反跳痛。Murphy征(-),患者BMI:25 kg/m2。实验室检查:白细胞20.4×109/L、中性粒细胞91.5%、红细胞比容51%;血淀粉酶1 131 U /L,TBIL 233.3 μmmol/L,DBIL 119.5 μmmol/L,ALT 195.6 U/L,AST 159.5 U/L,尿胆红素(U-BIL)(++),尿胆原(URO)(-),甘油三酯3.2 mmol/L,肌酐211.4 μmol/L,Pct:12.6 ng/mL,PCO226 mmHg,PO298 mmHg,乳酸5.4 mmol/L。影像学检查:腹部C T提示胰腺体积增大,胰腺周围可见渗出性改变,符合急性胰腺炎表现(图1A)。入院诊断:SAP(胆源性);多器官功能障碍综合征(MODS)。治疗过程:入院后24 h内给予积极液体复苏治疗,之后给予限制性液体治疗;1月8日—1月13日给予呼吸机辅助呼吸;1月9日—1月12日给予血液净化治疗;1月7日至1月17日给予“头孢哌酮舒巴坦”预防感染;1月12日开始行肠内营养支持治疗,并逐渐加量。经以上积极治疗后,患者生命体征逐渐稳定,无发热,无腹胀,肠内营养耐受性正常,胆红素逐渐下降至正常。1月17日患者突然出现高热,体温达到40 ℃,血压下降,需“去甲肾上腺素”维持循环,腹胀明显加重,行CT检查可见腹膜后气泡征(图1B)。给予“亚胺培南西司他丁钠”联合“替加环素”抗感染,液体复苏抗休克。1月18日在床旁超声引导下放置16 F猪尾巴导管引流(图1C),后腹胀无明显缓解。1月19日,患者家属要求放弃转回当地。追踪回访:患者转回当地死亡。
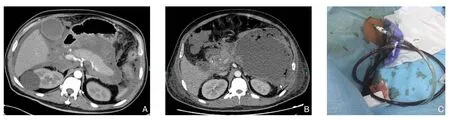
图1 病例1图片资料 A:CT影像学呈典型急性胰腺炎表现;B:CT示腹膜后胰周坏死积液腔内可见“气泡征”;C:彩超引导下经皮穿刺置管引流术(PCD)Figure 1 Picture data of case 1 A:Presentation of typical CT appearances of acute pancreatitis; B:CT image showing “air bubble sign”inside the retroperitoneal peripancreatic necrotic collections; C:Ultrasound-guided percutaneous catheter drainage (PCD)
1.2 病例2简介
魏伟医师(中南大学湘雅医院胰胆外科)
患者 男,36岁。因“饱餐后突发上腹部疼痛5 h”于2016年6月20日入外院。患者于5 h前进食油腻食物后出现上腹部刀割样疼痛,伴恶心、呕吐及肛门停止排气排便。患者起病以来,感呼吸困难逐渐加重。既往因“急性胰腺炎”反复数次住院,保守治疗后好转。查体:体温38.4 ℃、血压107/75 mmHg、呼吸33次/min、脉搏127次/min。神清,双肺(-),心脏听诊心率127次/min,腹部膨隆,腹肌紧张,全腹部压痛,以上腹部明显,无反跳痛。患者BMI 35 kg/m2。实验室检查:白细胞14.4×109/L、中性粒细胞83.5%、红细胞比容50%;血淀粉酶878 U/L,TBIL 16.3 μmmol/L,DBIL 7.5 μmmol/L,甘油三酯18.7 mmol/L,血小板压积2.6 ng/mL,CRP 231 mg/L,PCO229 mmHg,PO268 mmHg,乳酸4.4 mmol/L。影像学检查:腹部胰腺周围可见大量渗出性改变,胰腺轮廓不清晰,符合急性胰腺炎表现。入院诊断:SAP(高脂血症性);MODS。治疗过程:入院后,予以液体复苏;未使用预防性抗生素;起病第5天开始给予肠内营养支持治疗;6月21日—7月10日给予呼吸机支持通气;间断给予血液净化治疗。7月19日起,患者突发高热、腹胀加重,行PCD,术后因反复发热、腹腔出血,分别于7月26日及7月29日2次行开放手术,术后仍然存在发热及间断出血,于8月6日转入我院。8月7日在换药时,敞开伤口发现患者存在肠瘘(图2A),给予持续引流。8月12日在全身麻醉下行剖腹探查,胰周坏死组织清除术,空肠造瘘术,腹腔引流术(图2B)。术毕返回ICU后2 h,出现引流管内引流出大量鲜血,循环衰竭,给予积极补充血容量同时行DSA术,术中发现肠系膜上动脉一分支假性动脉瘤破裂(图2C),给予介入下栓塞成功。8月14日因患者出现高热、循环衰竭、肾功能衰竭死亡。
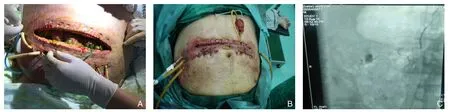
图2 病例2图片资料 A:感染性胰腺坏死腹腔开放且合并肠瘘;B:开腹胰腺坏死组织清除术后;C:DSA示肠系膜上动脉分支假性动脉瘤破裂出血Figure 2 Picture data of case 2 A:Infected pancreatic necrosis with open abdominal wound and intestinal fistula; B:View after open pancreatic necrosectomy; C:DSA showing rupture of a pseudoaneurysm arising from a branch of the superior mesenteric artery
2 病例讨论
2.1 SAP的诊断
刘志勇医师(中南大学湘雅医院重症医学科)
SAP的诊断分为定性诊断、病情严重程度的评估以及病因学诊断。根据中华医学会外科学分会胰腺外科学组制定的“急性胰腺炎诊治指南2014”[1],急性胰腺炎的诊断标准满足以下3项特征中的2项,即可诊断为急性胰腺炎(AP):⑴ 与AP相符合的腹痛;⑵ 血清淀粉酶和(或)脂肪酶活性至少高于正常值上限的3倍;⑶ 腹部影像学检查符合AP影像学改变。2例患者均表现为典型的胰腺炎腹痛,疼痛部位位于上腹部,呈刀割样剧痛,向腰背部放射;血清淀粉酶增高均超过正常值的3倍以上,且2例患者的腹部CT检查均提示胰腺体积增大,胰腺周围可见渗出性改变。因此,诊断为急性胰腺炎是成立的。2例患者均出现了包括呼吸功能及肾功能的损害,且持续时间超过48 h,按照修正的亚特兰大诊断标准[2],诊断SAP成立。文献[3]报道:急性胰腺炎的病因中,胆源性的因素是最常见的原因,大约占40%。而高甘油三酯血症是第三常见的原因,约占2%~5%。因AP本身可以导致脂质代谢的紊乱,引发血脂水平的增高。因此,当血清甘油三酯水平>11.3 mmol/L时可考虑高脂血症性急性胰腺炎。病例2的患者起病的甘油三酯达到18.7 mmol/L,病因的诊断是明确的。对于胆源性急性胰腺炎的诊断,主要依据影像学检查发现胆囊结石或者泥沙样沉淀,再结合肝脏酶学指标。超声内镜检查可发现更细微的胆囊或胆管结石。
杨俊文医师(中南大学湘雅医院消化内科)
对于胆源性急性胰腺炎患者,如果合并了胆管炎或者有胆总管梗阻的情况,可考虑在24~48 h内行经内镜逆行性胰胆管造影术(ERCP),对于全身情况不稳定的重症患者,如果评估ERCP无法安全的进行,可考虑行经皮穿肝的胆囊穿刺引流术(percutaneous transhepatic gallbladder drainage)。怀疑胆源性胰腺炎的患者,如果超声或CT未发现明确结石,可考虑行核磁共振下胰胆管成像术(MRCP)或行超声内镜检查,以提高胆源性胰腺炎的诊断敏感性。第1例患者,根据生化检查及既往史,诊断上考虑胆源性的SAP,但CT并未发现胆囊或但管内明确结石,可考虑行MRCP或者超声内镜检查,可能会发现泥沙样的结石。
2.2 急性胰腺炎发展为重症的预警指标
徐道妙(中南大学湘雅医院重症医学科)
SAP的治疗往往需要在监护措施更完善的重症监护室(ICU)内进行[4]。而临床医生很难判断哪些急性胰腺炎的患者会发展成重症。尽管目前存在诸多对于疾病严重程度的评分系统,如APACHEII评分、Marshall评分、BISAP评分等,对于急性胰腺炎发展为重症的预警能力,仍然存在各种不足[5]。临床医生早期需要综合一些患者的指标来预测是否将发展为重症的情况。这些指标包括:⑴ 患者的一般特征,如年龄>55岁、BMI>30 kg/m2、患者意识状态的改变以及合并基础疾病;⑵ 全身炎症反应综合征(SIRS)的持续存在;⑶ 血清尿素氮>7.14mmol/L、HCT>44%以及持续增高的血肌酐;⑷ 影像学改变,如胸腔积液、肺部渗出性改变以及广泛或多发的胰腺周围液体集聚。2例患者在发病早期均表现为持续的SIRS、HCT升高均超过44%,提示血液浓缩。第2例患者体重指数达到了30 kg/m2。这些指标都提示患者很可能发展为SAP,故此类患者早期应当进入ICU加强综合治疗。
2.3 SAP患者早期治疗
张丽娜医师(中南大学湘雅医院重症医学科)
SAP患者因大量炎性物质等因素增加了毛细血管通透性,导致大量液体渗漏至第三间隙,加之早期禁食、呕吐等多方面的原因,造成了SAP患者的血容量不足。直接的后果就是导致了胰腺组织的低灌注,加重了胰腺的坏死。早期积极的液体复苏可以通过增加有效血容量,改善胰腺的微循环,从而减少胰腺组织的坏死这些严重并发症的出现。因此,对于除外心血管等基础疾病的SAP患者,推荐12~24 h内,按照250~500 mL/h静脉补充乳酸林格液。然而,容量的过负荷也会增加患者腹腔内压力、加重ARDS,从而导致患者病死率的增加[6]。如何评估SAP患者的容量反应性,精确地进行血流动力学的管理显得尤为重要。传统的指标如:血清尿素氮水平容易被患者合并基础疾病以及因胰腺炎本身导致肾脏功能损伤的情况干扰;一些血流动力学指标如中心静脉压(CVP)以及平均动脉压(MAP)受患者腹内压增高的影响较大,个体差异性也影响了这些指标对于容量状态的判断。被动抬腿试验(passive leg raising,PLR)是ICU经常使用的能在床旁快速判断患者容量反应性的方法,简便易行。但由于SAP患者往往存在腹内压增高,导致PLR预测患者容量反应性的敏感性降低。对于机械通气的患者,每博量变异度(stroke volume variation,SVV)和脉搏压变异度(pulse pressure variation,PPV)能很好地反应患者的容量情况,这两个指标可通过PICCO技术直接获得。随着重症超声的不断发展,应用床旁超声评估容量状况指导液体管理已成为ICU内功能性血流动力学管理的重要手段。下腔静脉直径以及随呼吸的变异度在一定程度上可反映患者的容量状况,但这两个指标同样受到腹腔压力增高的影响。主动脉瓣速度时间积分变化(velocity time integral variation,ΔVTI)对于危重患者的容量反应性有很好的相关性[7],该指标不受腹腔压力的影响,而且可随时在床旁超声下获得,对于SAP早期液体复苏的容量管理有很强的指导意义。该2例患者在24 h内均完成了早期液体复苏,而且复苏后并未发生呼吸困难以及腹腔压力增高等容量过负荷的情况,是因为患者在24 h内未出现严重的毛细血管渗漏,且2例患者前24 h内液体的入量并未超出患者实际需要量。但如果在液体复苏的过程中,出现了严重的毛细血管渗漏或SIRS的状态持续存在,则在容量反应性的评估必须动态进行。随着重症超声的不断发展以及医务人员对于重症血流动力学管理的深入理解,使用超声评估ΔVTI可以让医务人员在床旁掌握SAP患者的容量反应性,值得今后在临床实践中推广。
黄勋医师(中南大学湘雅医院感染控制中心)
对于SAP预防性抗生素的使用是存在很大的争议的。美国胃肠道协会以及美国胰腺协会发布的急性胰腺炎诊治指南[2,8]推荐:对于没有合并感染的SAP患者,不推荐使用预防性抗生素。而2015年日本的胰腺炎诊治指南指出:对于SAP及坏死性胰腺炎的患者,72 h内预防性使用抗生素可能会改善患者的预后;中华医学会外科学分会胰腺外科学组[1]推荐,对于有胆道梗阻、免疫功能低下的急性胰腺炎患者,针对肠源性细菌易位,可预防性使用头孢菌素、喹诺酮类或碳青霉烯类抗生素。对于第1例患者,由于是胆源性的SAP,可考虑短时间(72 h内)使用抗生素。该患者使用了“头孢哌酮舒巴坦”,抗生素的选择是正确的,但患者持续使用了7 d,已超出指南推荐的疗程。长时间使用广谱抗生素可增加真菌等条件致病菌感染的发生,研究[9]表明,延长使用预防性抗生素治疗的病人中,局部和全身白色念珠菌感染增加3倍(从7%到22%),且长时间使用三代头孢可导致肠道菌群失调的风险,增加了难辨梭状芽胞杆菌性肠炎的发生[10-11],最终增加患者病死率。第2例患者为高脂血症性SAP,是否使用预防性抗生素,可综合患者循环、腹腔压力等指标综合考量。若患者存在休克的临床表现,则出现肠道菌群易位的风险必然增加,此时可短时间内预防性使用抗生素治疗。
艾宇航医师(中南大学湘雅医院重症医学科)
大量的研究结果已证实,合理的营养支持治疗对改善患者的临床结局有重要作用。营养支持治疗已成为临床规范化治疗的重要组成[12]。肠内营养支持治疗(EN)可通过多种机制保护肠道黏膜屏障功能,作为营养支持治疗的首选途径,已得到广泛共识。最新发布的美国营养学会的指南[13]对于SAP的营养支持治疗推荐是:24~48 h内完成了积极液体复苏治疗后,即可开始早期EN,而EN的途径可选择鼻胃管或鼻空肠管途径。2例患者早期均完成了积极液体复苏,但EN的启动时间均为5 d,不符合早期开始EN的观点,尤其是第1例患者,发病第9天即出现了肠源性细菌的严重感染,理应考虑肠道黏膜屏障功能的损害导致了肠道菌群易位,而正是因为严重的腹腔感染导致了患者的死亡。当然,SAP患者因合并腹内压增高、胃肠道功能损害等因素,增加了EN的启动及维持的难度。如何客观地评估SAP患者的胃肠道功能,对于SAP患者的EN开展有积极的指导作用。目前,暂没有非常客观的指标来判断不同时期SAP患者的胃肠道功能状况,可以参考2012年欧洲重症监护医学会(ESICM)推荐的急性胃肠道功能损伤(AGI)的专家共识[14]。
黄耿文医师(中南大学湘雅医院胰胆外科)
SAP早期患者,由于大量炎性介质的释放,表现为严重的SIRS,出现MODS。因此,SAP的早期治疗应当在ICU内以器官功能支持为主[15]。大多数SAP早期患者均表现为无菌性炎症反应,对于SAP早期的局部并发症如:急性胰周液体积聚(acute peripancreatic fluid collection,APFC)以及急性坏死物积聚 (acute necrotic collection,ANC)无症状者无需手术治疗,以避免穿刺导致的继发感染、出血等并发症。 对于症状明显,出现胃肠道压迫症状,影响肠内营养或进食者,或继发感染者,可在B超或CT引导下行PCD治疗。对于腹内压增高的患者,早期亦推荐给予促动力药物如:甲氧氯普胺针及红霉素针改善胃肠道动力,或给予胃肠道减压的方式处理。若腹内压进行性增加,出现腹腔间隔室综合征(ACS)经积极的保守治疗无效时,经多学科讨论后,可谨慎行剖腹减压术。手术后宜使用补片等材料临时覆盖切口,避免造成肠损伤等并发症[16]。对于局部并发症患者在保守治疗过程中,需密切监测,注意合并感染发生的情况。对于胆源性胰腺炎患者的手术时机,有研究[17-19]表明,对于胆源性胰腺炎患者若未行胆囊切除术,则因胆石症再入院率为15%~32%[17-19]。国内学者包文中等[20]认为:明确排除胆总管结石,胆囊结石合并轻中度急性胰腺炎在发病48 h内行LC是安全可行的。第1例患者考虑胆源性急性胰腺炎,但因该患者为重症,因此,胆囊切除手术应在临床症状缓解后再考虑手术切除胆囊。
2.4 SAP患者后期治疗
李宜雄医师(中南大学湘雅医院胰胆外科)
急性胰腺炎合并感染性胰腺坏死的病死率超过30%,而因胰腺感染导致脓毒症后,总的病死率上升到80%。感染性胰腺坏死合并多器官衰竭,如果非手术治疗,则病死率高达100%[21]。因此,对于SAP患者治疗过程中需要密切警惕感染的发生。在病程的7~10 d起,就应当密切注意感染的可能性了。就SAP本身来说,感染的最常见部位还是胰腺或胰腺周围坏死组织或液体聚集合并感染。因此,在治疗过程中,应当密切注意体温、血压、腹腔压力、白细胞、降钙素原(PCT)等与感染有关的体征或实验室指标。如果怀疑感染出现,目前不推荐行细针穿刺寻找病原学依据。血培养以及CT检查需要立即执行,如果CT检查发现气泡征,提示感染的存在。反复多次的血培养可提高病原学检出率。第1例患者在起病第10天出现了高热,尽管白细胞不高,但PCT迅速增高,提示细菌感染的发生;CT可发现小网膜囊内出现明显气泡征(图1B),提示该部位的感染发生。及时发现感染并积极处理,对于SAP后期的患者尤为重要。
黄勋医师(中南大学湘雅医院感染控制中心)
对于SAP后期患者,如高度怀疑感染的发生,需行进一步检查明确是否感染以及积极寻找病原学依据,应当根据穿刺液的培养结果而制定,但是,在培养结果出来之前,可考虑经验性应用抗生素,经验性治疗应覆盖大多数常见的病原体(大肠埃希菌,拟杆菌、肠杆菌、肺炎克雷伯菌、肠球菌以及其它的革兰氏阳性菌,如表皮葡萄球菌、金黄色葡萄球菌)。尽管在感染性胰腺坏死治疗方面,关于经验性抗生素的选择没有足够的证据给出明确建议,但一些研究已经着重观察各种抗生素在胰腺组织的渗透性。亚胺培南和厄他培南在胰腺组织和胰液中的渗透性好,单项小剂量的静脉用药后对常见的细菌就能达到最少抑药浓度(MIC90)[22]。对于存在脓毒症休克的患者,指南推荐经验性使用联合抗生素治疗,以最大范围的覆盖本地区最常见的可能的病原菌,后期可根据药敏结果降阶梯的方式使用窄谱抗生素,以减少广谱抗生素的副作用[23]。2例患者均在后期突发高热、休克,实验室检查以及影像学检查均提示感染的发生,因此,抗生素的选择应当考虑联合用药。结合近期我院耐碳青霉烯的肺炎克雷伯杆菌发生率逐渐增高,且第1例患者是在使用“头胞哌酮舒巴坦”的过程中出现的感染性休克,因此,抗生素的选择应当考虑需覆盖耐碳青霉烯的肺炎克雷伯杆菌。
孙维佳医师(中南大学湘雅医院胰胆外科)
对于SAP后期患者临床上出现脓毒血症,CT检查出现气泡征,可诊断为感染性坏死,需考虑手术治疗。手术治疗应遵循延期原则,一旦判断坏死感染可立即行针对性抗生素治疗,严密观察抗感染的疗效,稳定者可延缓手术。感染性胰腺组织坏死(IPN)一经确诊,大多数情况下须积极引流或清创。一旦感染不能控制,将导致接近100%的病死率。既往,传统的外科清创引流被认为是治疗这一严重疾病的金标准。但近年来,由于理念和技术的进步,包括PCD、微创腹膜后入路胰腺坏死组织清除术(minimal access retroperitoneal pancreatic necrosectomy,MARPN)、内镜下腹膜后坏死组织清除等各种微创方法应用于临床,使 IPN的治疗策略发生了重大转变,升阶梯治疗策略成为目前治疗IPN的主流[24]。微创手术方法与开放性手术方法有同等效果且出血等并发症的发生率较后者明显降低。我院SAP团队进行的以MARPN为重要方式的升阶梯或降阶梯治疗方案对于IPN的治疗取得了满意的效果[25]。对于MARPN出现严重并发症,如大出血或肠瘘、多次手术后仍残留较多坏死积液、脓毒症无法逆转者,应考虑中转开放手术。而对于MARPN的径路选择有困难、技术上不可行以及腹腔内有其他须行开放手术的原因时,也应果断选择开放胰腺坏死组织清除术。第1例患者在行PCD后,脓毒症的表现并未得到有效缓解,休克状态持续存在,此时,单纯的穿刺引流效果不佳,已无法改善脓毒症的休克状态,开放手术应当予以考虑。
3 总 结
该2例SAP患者最终因严重感染、脓毒症休克而死亡。感染是SAP后期最常见的并发症,因此,如何在早期预防感染以及对于后期感染的控制在SAP患者的救治中显得尤为重要。
在SAP早期的处理中,2例患者在完成积极液体复苏后,并未在24~48 h内开始早期肠内营养,而延迟的肠内营养治疗可导致肠黏膜屏障功能损伤,导致肠道菌群易位的发生;在预防性抗生素的使用上,病例1的疗程达到了10 d,这也增加二重感染的风险。在后期合并感染时,抗生素的选择需要综合患者的情况以及本地区常见致病菌的抗菌谱。因此,2例患者在脓毒症休克时,应选择联合使用抗生素的降阶梯疗法;对于感染性胰腺坏死组织的清除,目前多采用升阶梯的手术方式。当单纯的微创穿刺引流无法改善脓毒症的休克状态时,是否应当考虑开放手术。而病例1在行PCD后,脓毒症休克的表现持续存在,应当考虑选择开放手术。
SAP的病程长,涉及的相关科室众多,早期和后期呈现不同的病理生理改变。对于SAP早期患者,治疗方面应当以器官功能的支持和保护为主,治疗应在ICU内进行;后期可能出现感染、出血、瘘等严重并发症,需积极治疗。多学科综合治疗协作模式可提高SAP的救治水平。
参考文献
[1]中华医学会外科学分会胰腺外科学组.急性胰腺炎诊治指南(2014)[J].中国实用外科杂志,2015,35(1):4–7.doi:10.7504/CJPS.ISSN1005–2208.2015.01.02.Group of Pancreas Surgery,Chinese Society of Surgery,Chinese Medical Association.Guidelines for diagnosis and treatment of acute pancreatitis (2014)[J].Chinese Journal of Practical Surgery,2015,35(1):4–7.doi:10.7504/CJPS.ISSN1005–2208.2015.01.02.
[2]Tenner S,Baillie J,DeWitt J,et al.American College of Gastroenterology guideline:management of acute pancreatitis[J].Am J Gastroentel,2013,108(9):1400–1415.doi:10.1038/ajg.2013.218.
[3]Forsmark CE,Vege SS,Wilcox CM.Acute Pancreatitis.[J].N Engl J Med,2016,375(20):1972–1981.
[4]Greenberg JA,Hsu J,Bawazeer M,et al.Clinical practice guideline:management of acute pancreatitis[J].Can J Surg,2016,59(2):128–140.
[5]Mounzer R,Langmead CJ,Wu BU,et al.Comparison of existing clinical scoring systems to predict persistent organ failure in patients with acute pancreatitis[J].Gastroenterology,2012,142(7):1476–1482.doi:10.1053/j.gastro.2012.03.005.
[6]de-Madaria E,Soler-Sala G,Sánchez-Payá J,et al.Influence of fluid therapy on the prognosis of acute pancreatitis:a prospective cohort study[J].Am J Gastroenterol,2011,106(10):1843–1850.doi:10.1038/ajg.2011.236.
[7]Muller L,Toumi M,Bousquetet PJ,et al.An increase in aortic blood flow after an infusion of 100 ml colloid over 1 minute can predict fluid responsiveness:the mini-fluid challenge study[J].Anesthesiology,2011,115(3):541–547.doi:10.1097/ALN.0b013e318229a500.
[8]Working Group IAP/APA Acute Pancreatitis Guidelines.IAP/APA evidence-based guidelines for the management of acute pancreatitis[J].Pancreatology,2013,13(4 Suppl 2):e1–15.doi:10.1016/j.pan.2013.07.063.
[9]Maraví-Poma E,Gener J,Alvarez-Lerma F,et al.Early antibiotic treatment (prophylaxis) of septic complications in severe acute necrotizing pancreatitis:a prospective,randomized,multicenter study comparing two regimens with imipenem-cilastatin[J].Intensive Care Med,2003,29(11):1974–80.
[10]Haran JP,Hayward G,Skinner S,et al.Factors influencing the development of antibiotic associated diarrhea in ED patients discharged home:risk of administering IV antibiotics[J].Am J Emerg Med,2014,32(10):1195–1199.doi:10.1016/j.ajem.2014.07.015.
[11]Uchil RR,Kohli GS,Katekhaye VM,et al.Strategies to combat antimicrobial resistance[J].J Clin Diagn Res,2014,8(7):ME01–04.doi:10.7860/JCDR/2014/8925.4529.
[12]李宁.重视外科病人营养问题[J].中国实用外科杂志,2012,32(2):101–103.Li N.Focusing on nutrition in surgical patients[J].Chinese Journal of Practical Surgery,2012,32(2):101–103.
[13]McClave SA,Taylor BE,Martindale RG,et al.Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient:Society of Critical Care Medicine(SCCM) and American Society for Parenteral and Enteral Nutrition(A.S.P.E.N.)[J].JPEN J Parenter Enteral Nutr,2016,40(2):159–211.doi:10.1177/0148607115621863.
[14]Reintam Blaser A,Malbrain ML,Starkopf J,et al.Gastrointestinal function in intensive are patients:terminology,definitions and management.Recommendations of the ESICM Working Group on Abdominal Problems[J].Intensive Care Med,2012,38(3):384–394.doi:10.1007/s00134–011–2459–y.
[15]Nathens AB,Curtis JR,Beale RJ,et al.Management of the critically ill patient with severe acute pancreatitis[J].Crit Care Med,2004,32(12):2524–2536.
[16]Kirkpatrick AW,Roberts DJ,De Waele J,et al.Intra-abdominal hypertension and the abdominal compartment syndrome:updated consensus definitions and clinical practice guidelines from the World Society of the Abdominal Compartment Syndrome[J].Intensive Care Medicine,2013,39(7):1190–1206.doi:10.1007/s00134–013–2906–z.
[17]Hernandez V,Pascual I,Almela P,et al.Recurrence of acute gallstone pancreatitis and relationship with cholecystectomy or endoscopic sphincterotomy[J].Am J Gastoenterol,2004,99(12):2417–2423.
[18]Hwans SS,Li BH,Haigh PI.Gallstone pancreatitis without cholecystectomy[J].JAMA Surg,2013,148(9):867–872.doi:10.1001/jamasurg.2013.3033.
[19]Ito K,Ito H,Whang EE.Timing of cholecystectomy for biliary pancreatitis:do the data support current guidelines?[J].J Gastrointest Surg,2008,12(12):2164–2170.doi:10.1007/s11605–008–0603–y.
[20]包文中,孟翔凌,汤大纬,等.胆囊结石合并急性胰腺炎早期和延期腹腔镜胆囊切除术临床疗效分析[J].中国普通外科杂志,2013,22(9):1232–1234.doi:10.7659/j.issn.1005–6947.2013.09.027.Bao WZ,Meng XL,Tang DW,et al.Early and delayed laparoscopic cholecystectomy for cholecystolithiasis associated with acute pancreatitis:analysis of clinical effects[J].Chinese Journal of General Surgery,2013,22(9):1232–1234.doi:10.7659/j.issn.1005–6947.2013.09.027.
[21]Gloor B,Müller CA,Worni M,et al.Late mortality in patients with severe acute pancreatitis[J].Br J Surg,2001,88(7):975–979.
[22]Wittau M,Wagner E,Kaever V,et al.Intraabdominal tissue concentration of ertapenem[J].J Antimicrob Chemother,2006,57(2):312–316.
[23]Rhodes A,Evans LE,Alhazzani W,et al.Surviving Sepsis Campaign:International Guidelines for Management of Sepsis and Septic Shock:2016[J].Intensive Care Med,2017,43(3):304–377.doi:10.1007/s00134–017–4683–6.
[24]申鼎成,周书毅,黄耿文,等.多重耐药菌感染的包裹性胰腺坏死的外科治疗策略[J].中国普通外科杂志,2016,25(9):1319–1323.doi:10.3978/j.issn.1005–6947.2016.09.016.Shen DC,Zhou SY,Huang GW,et al.Surgical treatment strategies for wall-off pancreatic necrosis with multi-drug resistant organism infections[J].Chinese Journal of General Surgery,2016,25(9):1319–1323.doi:10.3978/j.issn.1005–6947.2016.09.016.
[25]黄耿文,申鼎成,亢浩,等.微创腹膜后入路胰腺坏死组织清除术治疗感染性胰腺坏死18例疗效分析[J].中国实用外科杂志,2016,36(11):1197–1199.Huang GW,Shen DC,Kang H,et al.Role of minimal access retroperitoneal pancreatic necrosectomy in the treatment of infected pancreatic necrosis:An analysis of 18 cases[J].Chinese Journal of Practical Surgery,2016,36(11):1197–1199.
