肺源性心脏病患者HRV、HRT和DC分析
2017-03-27王春光张志华
王春光,张志华
(1.河北北方学院附属第一医院心脏功能检查科,河北 张家口 075000;2.河北北方学院附属第一医院呼吸内科,河北 张家口 075000)
·论 著·
肺源性心脏病患者HRV、HRT和DC分析
王春光1,张志华2*
(1.河北北方学院附属第一医院心脏功能检查科,河北 张家口 075000;2.河北北方学院附属第一医院呼吸内科,河北 张家口 075000)
目的分析心率减速力(deceleration capacity of rate,DC)、心率变异性(heart rate variability,HRV)、心率震荡(heart rate turbulence,HRT)等动态心电图指标对肺心病患者的病情判断、治疗及高危预警价值。方法肺源性心脏病患者120例,其中心脏功能代偿期60例(B组),心功能失代偿期60例(C组)。正常对照组60例(A组)。动态心电图分析HRT、HRV、DC等指标。结果B、C 2组动态心率震荡(turbulence dynamics,TD)、震荡初始(turbulence onset,TO)值显著高于A组(P<0.05),震荡斜率(turbulence slope, TS)值显著低于A组(P<0.05); C组TD、TO值显著高于B组(P<0.05),TS值著低于B组(P<0.05)。 B、C 2组R-R间期总体标准差(stabdard devuatuion of NN intervals,SDNN),平均值标准差(standard diviation of average NN intervals,SDANN)值显著低于A组(P<0.05),C组相邻RR间期差值的均方根(root mean square of successive difference,RMSSD)显著低于A组(P<0.05);C组SDNN、SDANN值显著低于B组(P<0.05)。B、C 2组低频(low frequency,LF)和高频(high frequency,HF)值、DC值显著低于A组,DC<4.5 ms发生率高于A组(P<0.05);C组DC值、LF和HF值显著低于B组(P<0.05)。结论HRV、HRT和DC值对慢性肺源性心脏病具有重要的高危预警价值。
肺心病;心电描记术;心律失常,心性
慢性肺源性心脏病是临床常见心血管慢性病,可由支气管-肺组织、胸廓或肺血管病变引起,随着肺部疾病的迁延发展和肺血管阻力增加可引起右心结构、功能以及心脏传导等发生一系列改变,其基本发病机制为肺动脉高压。心肌重塑是导致肺动脉高压患者由于右心室压力负荷增加而引发右心室功能和结构改变的主要机制。发生心肌重塑的大小程度对患者的临床症状起着决定作用。右心室心肌重塑是多种原因(如法洛四联症、艾森曼格综合征等先天性疾病以及慢性缺氧、二尖瓣或肺动脉瓣狭窄血栓栓塞引起的肺部疾病等) 引起继发性或特发性肺动脉高压,导致右心室的压力负荷逐渐增加而产生适应性反应的一种现象。如何维持右心室压力负荷增加患者的每搏量和心输出量非常重要,因为它既在一定程度上能够反映出患者的临床症状,又是决定患者能否存活的重要因素之一[1]。当前揭示从肺源性疾病引起肺动脉高压导致右心室心肌发生肥厚、扩张等一系列动态改变,进而发展为肺源性心脏病的潜在病理机制研究众多,但从心电学角度对肺源性心脏病患者的系列研究相对较少。为此,本研究应用动态心电图技术对慢性肺源性心脏病患者进行心率变异性(heart rate variability,HRV)、心率震荡(heart rate turbulence,HRT)和心率减速力(deceleration capacity of rate, DC)分析,间接判断心脏自主神经功能,进而对肺源性心脏病病情作出判断,对其危险性进行预警。
1 资料与方法
1.1 一般资料 选取2014年7月—2015年7月在我院呼吸内科住院并已被诊断为慢性肺源性心脏病患者120例。经常规心电图检查确定均为窦性心律且均有室性期前收缩,根据症状及心脏彩超检查将其分为2组:肺心病心功能代偿期组(B组)60例,男性32例,女性28例,年龄34~80岁,平均(54.12±12.02)岁,室性期前收缩数为多发即>5次/min;肺心病心功能失代偿期(右心室肥大、右心衰竭)组(C组)60例,男性31例,女性29例,年龄33~79岁,平均(54.09±13.36)岁,室性期前收缩数为多发。另选取无心血管及呼吸系统疾病患者作为对照组(A组)60例,男性34例,女性26例,年龄32~78岁,平均(53.92±14.23)岁,室性期前收缩数为偶发即<5次/min,属于大致正常范围,因为大多数正常人可偶发室性期前收缩。3组患者无影响自主神经功能的药物和疾病存在,且性别、年龄差异均无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 数据采集 所有入选患者于入院2 d内安排上午固定时间段行24 h动态心电图检测。于24 h后应用DMS CardioScanⅡ动态心电图分析系统进行分析,检出A、B和C组HRT、HRV、DC等指标。
1.2.2 观察指标 ①应用动态心电图分析系统获取3组患者HRT指标:动态心率震荡(turbulence dynamics,TD)、震荡初始(turbulence onset,TO)和震荡斜率(turbulence slope,TS)。②应用动态心电图分析系统生成3组患者HRV时域指标,包括:R-R间期总体标准差(stabdard devuatuion of NN intervals,SDNN),平均值的标准差(standard diviation of average NN intervals,SDANN)及相邻RR间期差值的均方根(root mean square of successive difference,RMSSD)。③应用动态心电图分析系统获取3组患者DC、HRV频域指标:低频(low frequency,LF)和高频(high frequency,HF)。
1.2.3 评价标准 ①HRT各指标判定标准:TO中性值为0,TS中性值为2.5 ms/RRI,TO<0与TS>2.5 ms/RRI为正常,TO≥0与TS≤2.5 ms/RRI为异常[2]。②HRV时域分析指标正常参考范围:SDNN(141.7±29.2) ms,SDANN(130.9±28.3) ms,RMSSD(39.0±15.0) ms[3]。③DC≤4.5 ms被认为异常,DC>4.5~10 ms 为低风险;DC 2.5~4.5 ms 为中风险,DC<2.5 ms 为高风险[4]。
1.3 统计学方法 应用SPSS 17.0软件进行数据处理。计量资料比较分别采用单因素方差分析和q检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 3组HRT各指标间比较 B组和C组TD、TO值显著高于A组(P<0.05),TS值显著低于A组(P<0.05); C组TD 、TO值显著高于B组(P<0.05),TS值著低于B组(P<0.05)。见表1。
2.2 3组HRV时域指标比较 B组和C组SDNN、SDANN值显著低于A组(P<0.05),C组RMSSD值显著低于A组(P<0.05);C组SDNN、 SDANN值显著低于B组(P<0.05)。见表2。
2.3 3组LF、HF、DC以及DC高风险发生率比较 B、C 2组LF、HF、DC值均显著低于A组,DC<4.5 ms发生率高于A组(P<0.05);C组LF、HF、DC值显著低于B组(P<0.05)。见表3。


组别TD(ms/bpm)TO(%)TS(ms/RRI)A组0.013±0.004-1.55±2.8212.14±3.76B组0.066±0.031*0.65±1.85*6.82±5.44*C组0.086±0.022*#0.89±1.78*#5.35±4.66*#F180.23423.87850.395P0.0000.0000.000
*P<0.05与A组比较 #P<0.05与B组比较(q检验)

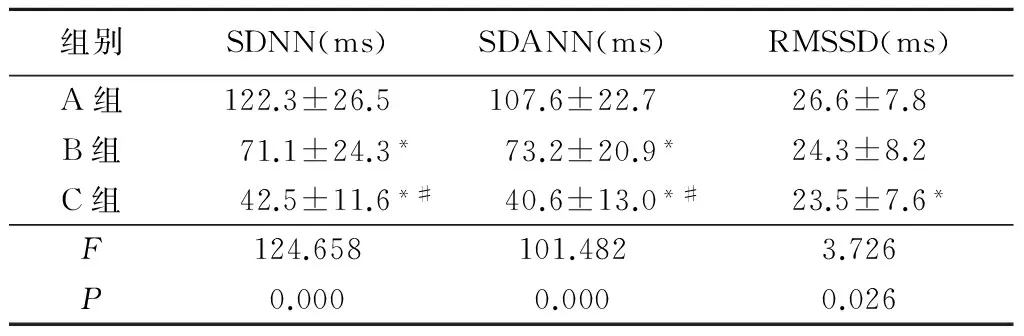
组别SDNN(ms)SDANN(ms)RMSSD(ms)A组122.3±26.5107.6±22.726.6±7.8B组71.1±24.3*73.2±20.9*24.3±8.2C组42.5±11.6*#40.6±13.0*#23.5±7.6*F124.658101.4823.726P0.0000.0000.026
*P<0.05与A组比较 #P< 0.05与B组比较(q检验)

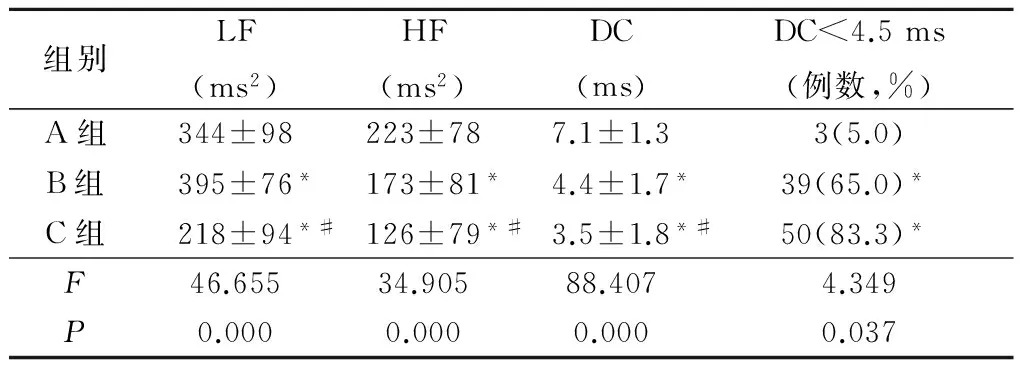
组别LF(ms2)HF(ms2)DC(ms)DC<4.5ms(例数,%)A组344±98223±787.1±1.33(5.0)B组395±76*173±81*4.4±1.7*39(65.0)*C组218±94*#126±79*#3.5±1.8*#50(83.3)*F46.65534.90588.4074.349P0.0000.0000.0000.037
*P< 0.05与A组比较 #P<0.05与B组比较(q检验或χ2检验)
3 讨 论
近年来,有研究学者提出,迷走神经对心脏调节作用的减弱[5]是发生恶性心律失常甚至心脏性猝死的重要因素,而并非是交感神经作用的增强所致。众所周知,迷走神经对心脏具有重要的保护作用,这一作用已被大量的实验和临床研究结果所证实。迷走神经作为心脏的减速神经,当其兴奋性降低时就会使心率加快,室颤阈值就会降低,对心脏的保护作用也随之下降,继而将会引发快速、致命性的心律失常,即发生所谓的“交感风暴”[6]。在心电信息中, HRV、HRT和DC检测越来越受到人们的关注,应用价值也越来越高,主要应用于各类高危心脏病的预警研究。
HRV能够定量评估心脏交感神经和迷走神经张力以及反映自主神经系统功能活性,根据其检测指标预测心脏性相关疾病发生心律失常甚至心脏性猝死的可能性,对心脏性相关疾病的病情判断及预防等都是一个有重要价值的指标[7]。迷走神经的兴奋性降低、交感神经的兴奋性增加是引发致命性的心律失常的重要因素。HRV代表了自主神经系统活动的量化并通过心率变化的程度所表现出来的一种量化标测,即通过测量连续正常R-R间期变化的变异性来反映心率变化的程度和规律,从而用于判断其对心脏相关活动的影响[8]。HRV升高为副交感神经张力增高的表现,能够提高室颤阈,属于保护心脏因素;HRV降低为交感神经张力增高的表现,可降低室颤阈,属于对心脏的不利因素。多数学者认为SDNN、SDANN等时域指标<50 ms,为HRV显著减低,病死率将会大大增高[9]。也有学者指出,HRV是反映逐次心跳周期差异的变化情况,既有神经体液因素对心脏血管系统信息的调节,又能实质上反映神经体液因素对窦房结的调节作用。在迷走神经活性增高或交感神经活性减低时,心率变异性增高,反之当迷走神经活性降低或交感神经活性升高时,心率变异性降低,也就是反映自主神经系统交感神经活性与迷走神经活性及其平衡协调之间的关系[10]。HRV的临床研究和应用已经有多年的时间,目前一致公认它是定量评估自主神经功能的有效方法之一[11]。本研究显示心率变异性降低与肺心病患者心脏不良事件的发生存在显著相关性,对预测肺心病患者病情和预后具有重要的意义和临床价值。事实上这些肺心病患者都具有重要器官逐步衰竭、交感神经系统被过度激活等共同特点,从这一点上来看,心率变异性的显著减低是机体功能失代偿与自主神经系统相互对抗的结果,能够反映出肺源性心脏病患者病情的严重程度和预后。
HRT是反映自主神经功能的变化,对心脏室性期前收缩内源性刺激的反应,以及在一次室性期前收缩后心室压力变化所引起的主动脉弓颈动脉压力反射调节机制的变化,与发生恶性心脏事件有密切关系的一种心电现象[12]。TO反映了发生室性期前收缩后心率的加速变化情况,TO的中性值定义为0,当TO<0时,表明室性期前收缩后窦性心律发生了减速现象;当TO>0时,表明室性期前收缩后窦性心律发生了加速现象[13]。TS是分析室性期前收缩后窦性心律发生减速情况的重要参数。TS的中性值定义为2.5 ms/RRI,当TS<2.5 ms/RRI时,表示窦性心律发生了减速,反之无减速发生[14]。本研究显示肺心病代偿期、失代偿期患者与对照组比较,TS明显降低,TO升高,失代偿期患者改变更甚。因此,HRT对肺源性心脏病患者心脏功能的评价具有重要的价值。
应用动态心电图检测可对迷走神经有调节作用的DC值进行定量分析,迷走神经和交感神经共同作用来支配心脏是自主神经对心脏调节的主要特点,两者分别从相反的方向对心肌进行调节以适应和满足机体的需要,当迷走神经对心脏的保护作用下降时,将导致心脏自主神经的双重支配作用强度不对等[15]。在夜间或静息状态下,迷走神经张力增大导致冠状动脉张力也增大,使其处于收缩状态而引起血流减慢、储备能力下降,继而发生心肌缺血和心律失常。DC值 ≤4.5 ms被认为异常,依据大量临床随访的结果显示将DC分为三级:一级为低风险,DC值范围>4.5~10 ms ;二级为中风险,DC值范围2.5~4.5 ms;三级为高风险,DC值范围<2.5 ms。本研究结果显示,根据肺源性心脏病患者代偿期与失代偿期DC值比较分析可知两者高风险发生率均增高,且失代偿期高风险发生率显著增高。说明DC测定能定量分析和测定迷走神经作用的强度,对肺源性心脏病患者发生心脏性不良事件的筛选和预警具有很好的临床价值。
综上所述,HRV、HRT和DC检测均对肺源性心脏病患者具有较高的预警价值和临床意义。通过HRV、HRT和DC检测可以尽早发现高危患者,以便采取有效及时的预防措施,进而降低肺源性心脏病患者心脏不良事件的发生率。
[1] 王春光,要彤,赵小祺,等.伴有心肌梗死史冠心病患者围手术期心电图研究[J].河北医科大学学报,2015,36(7):812-815.
[2] 郭继鸿.猝死预警新技术:连续心率减速力测定[J].临床心电学杂志,2012,21(3):227-233.
[3] 孙颖锋,郭继鸿.连续心率减速力的临床应用[J/CD].心电图杂志:电子版,2012,1(1):5-7.
[4] Ricca-Mallada R,Migliaro ER,Piskorski J,et al. Exercise training slows down heart rate and improves deceleration and acceleration capacity in patients with heart failure[J]. J Electrocardiol,2012,45(3):214-219.
[5] Metelka R. Heart rate variability--current diagnosis of the cardiac autonomic neuropathy[J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2014,158(3):327-338.
[6] Poddar MG,Kumar V,Sharma YP.Automated diagnosis of coronary artery diseased patients by heart rate variability analysis using linear and non-linear methods[J]. J Med Eng Technol,2015,39(6):331-341.
[7] Polikutina OM,Slepynina YS,Bazdyrev ED,et al. Impact of chronic obstructive pulmonary disease on one-year prognosis in patients with ST-segment elevation myocardial infarction[J]. Ter Arkh,2015,87(9):52-57.
[8] Chan YH,Tsai WC,Shen C,et al. Subcutaneous nerve activity is more accurate than heart rate variability in estimating cardiac sympathetic tone in ambulatory dogs with myocardial infarction[J]. Heart Rhythm,2015,12(7):1619-1627.
[9] Yagishita D,Chui RW,Yamakawa K,et al. Sympathetic nerve stimulation,not circulating norepinephrine,modulates T-peak to T-end interval by increasing global dispersion of repolarization[J]. Circ Arrhythm Electrophysiol,2015,8(1):174-181.
[10] Harris P, Stein P, Fung G,et al. Heart rate variability measured early in patients with evolving acute coronary syndrome and 1-year outcomes of rehospitalization and mortality[J]. Vasc Health Risk Manag,2014,10(5):451-464.
[11] Bissinger A,Ruxer J,Ahmed RB,et al. Heart rate turbulence in patients with poorly controlled diabetes mellitus type 2[J]. Arch Med Sci,2014,10(6):1073-1077.
[12] Kossaify A,Garcia A,Ziade F. Assessment of heart rate turbulence in hypertensive patients:rationale,perspectives,and insight into autonomic nervous system dysfunction[J]. Heart Views,2014,15(3):68-73.
[13] Yoshihisa A,Suzuki S,Takiguchi M,et al. Impact of sleep-disordered breathing on heart rate turbulence in heart failure patients[J]. PLoS One,2014,9(6):1307-1314.
[14] Dursun H,Onrat E,Ercan E,et al. Heart rate turbulence analysis in female patients with fibromyalgia[J]. Clinics,2015,70(4):296-300.
[15] Dimitropoulos G,Tahrani A,Stevens M,et al. Cardiac autonomic neuropathy in patients with diabetes mellitus[J]. World J Diabetes,2014,5(1):17-39.
(本文编辑:刘斯静)
2016-05-11;
2016-11-04
河北省医学科学研究重点课题(20150061)
王春光(1980-),男,河北卢龙人,河北北方学院附属第一医院主治医师,医学硕士,从事临床心电学研究。
*通讯作者。E-mail:lw8045217@126.com
R541.5
B
1007-3205(2017)03-0336-04
10.3969/j.issn.1007-3205.2017.03.021
