慢性肾脏病血管钙化小鼠模型的建立
2017-03-27王文伟田露露熊艳文陈启菁殷佩浩
王文伟,田露露,熊艳文,陈启菁,彭 文,殷佩浩
(1.复旦大学基础医学院生理与病理生理学系,上海 200032;2.复旦大学药学院药理学教研室,上海 201210;3.上海市普陀区利群医院中医科,上海 200333;4.上海中医药大学附属普陀医院肾内科,上海 200062;5.上海中医药大学附属普陀医院中西医结合肿瘤介入研究所,上海 200062)
·论 著·
慢性肾脏病血管钙化小鼠模型的建立
王文伟1,田露露2,熊艳文3,陈启菁2,彭 文4,殷佩浩5*
(1.复旦大学基础医学院生理与病理生理学系,上海 200032;2.复旦大学药学院药理学教研室,上海 201210;3.上海市普陀区利群医院中医科,上海 200333;4.上海中医药大学附属普陀医院肾内科,上海 200062;5.上海中医药大学附属普陀医院中西医结合肿瘤介入研究所,上海 200062)
目的提供一种慢性肾脏病血管钙化小鼠模型的建立方法。方法利用昆明种小鼠,采用腺嘌呤联合维生素D3,配合高磷饮食,建立慢性肾脏病血管钙化模型。结果以腺嘌呤联合维生素D3,配合高磷低蛋白饮食喂养小鼠6周后,模型组60只小鼠中,死亡6只,10只小鼠胸主动脉发生明显钙化(成功率约17%);模型小鼠血清中尿素氮、血肌酐、尿酸、血磷和血钙均较对照小鼠显著增加(P<0.05)。未发生明显钙化的小鼠血管均发生血管壁明显增厚、中层纤维变形的血管病变。结论采用腺嘌呤联合维生素D3和高磷饮食6周可导致慢性肾病血管钙化。 此方法简便易行、成模时间短、稳定性好,适于慢性肾病及血管钙化的研究。
肾疾病;血管钙化;疾病模型,动物
慢性肾脏病-矿物质和骨异常 (chronic kidney disease-mineral and bone disorder,CKD-MBD)是指由CKD引发的矿物质水平失调和机体系统骨代谢紊乱,具有钙、磷、维生素D、甲状旁腺激素(parathyroid hormone,PTH)代谢异常,骨翻转、骨质矿化、骨体积、骨强度或骨线性生长异常,血管及其他软组织钙化[1]等表现。成年CKD患者血管壁钙化几乎都是在中层[2-5]。目前有腺嘌呤大鼠肾毒性模型和六分之五肾切除(5/6 nephrectomy,5/6Nx)大鼠模型,但药物用量大且成模率不高,小鼠基因敲除模型制备耗时久、成本高,故无法广泛应用[6]。国内外尚未见腺嘌呤或5/6Nx切除诱导小鼠血管钙化模型的报道,本研究提供一种CKD血管钙化小鼠模型的建立方法,报告如下。
1 材料与方法
1.1 动物来源及分组 昆明种小鼠80只,雄性,6~8周龄,体质量20 g,随机分为模型组60只,对照组20只。所有小鼠均饲养在无特定病原体级动物房,光照每12 h明暗交替,温度(23±3) ℃,湿度60%,自由饮水,饮食。
1.2 造模方法 模型组:腺嘌呤100 mg/kg剂量每隔2 d灌胃1次,持续1周;第2周至第6周,每周给同样剂量的腺嘌呤1次;第2周至第6周,每隔2 d腹腔注射活性维生素D3骨化三醇1 μg/kg;第2周至第6周,模型鼠全部采用高磷饮食,含磷量为1.2%。
1.3 组织取材和血液指标测定 各组动物眼眶取血分离血清,小心分离胸主动脉,取双肾脏。所有组织分成两部分,一部分置于4%的多聚甲醛中,做常规石蜡包埋、切片,供病理和免疫组化检查,另一部分肾置于-80 ℃冰箱中备用。血清用自动生化分析仪测定血钙、血磷、尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,SCr)、尿酸(uric acid,UA)含量。
1.4 石蜡切片的制备 小鼠组织在4%多聚甲醛中固定48 h以上;乙醇梯度脱水:70%乙醇24 h,80%乙醇12 h,95%乙醇12 h,100%乙醇1 h,使石蜡渗透至组织内部;二甲苯(透明)∶二甲苯∶乙醇(1∶1∶1)10 min,二甲苯Ⅰ 20 min,二甲苯Ⅱ 20 min;浸蜡:石蜡Ⅰ 40 min,石蜡Ⅱ 90 min;石蜡包埋:将融化的石蜡倒入包埋框,用加温的镊子将浸蜡的组织块放入,控温在56 ℃;切片:每个标本取10张切片,每张切片厚3 μm。用0.1%多聚赖氨酸处理过的玻片贴片,烤片过夜,保存于4 ℃冰箱。
1.5 HE染色 石蜡切片置于二甲苯,脱蜡5~10 min;移入二甲苯和纯乙醇(1∶1)混合液,5 min;移入100%、95%、85%、70%乙醇,各2~5 min,最后经蒸馏水,水洗5 min后转入染液;Harris苏木精染5~10 min;水洗5 min;0.5%盐酸乙醇(70%乙醇配制)分色片刻,镜检控制,直至细胞核及核内染色质清晰,约30 s;水洗30 min,蓝化;75%乙醇,洗1 min;0.5%水溶性伊红Y乙醇染色液1 min;一次净70%、85%、95%、100%乙醇脱水,每级分别2~3 min;二甲苯透明2次,每次约5 min;擦去切片周围多余二甲苯,注意不要干涸,迅速滴加适量中性树胶,再加盖玻片封固。
1.6 Von kossa染色 切片脱蜡;日光下或紫外线灯下用2% 硝酸银浸染,20~60 min;蒸馏水洗,5 min;5%硫代硫酸钠水溶液处理,2 min;自来水洗,5 min;0.1%核固红染液复染,1~2 min;水洗,5~10 s;常规脱水,透明,中性树胶封闭。
1.7 统计学方法 应用SPSS 13.0统计学软件处理数据,计量资料比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 动物一般状态 60只小鼠造模,成功10只,死亡6只,成功率约17%。实验结束时,各动物称体质量,模型组小鼠体质量无明显变化,对照组小鼠体质量由初始平均20 g增长到平均42 g。
2.2 2组血清学指标比较 与对照组小鼠相比较,模型组小鼠血清BUN、SCr、UA、P和Ca均有显著增加,差异有统计学意义(P<0.05),见表1。
2.3 HE染色 与对照组小鼠相比较,模型组小鼠肾小球萎缩,系膜细胞增多,间质区增宽,说明小鼠肾脏结构发生明显病变即肾衰竭(图1)。
2.4 Von kossa染色 与对照组小鼠相比较,模型组小鼠血管壁均明显增厚,部分小鼠可以见到明显钙化的发生(黑色部分),未发生钙化的小鼠血管,其中层可见清晰的的弹力纤维并发生变性(图2),说明本方法可以有效导致血管向钙化病变发展。
表1 2组血清生化指标比较
Table 1 Comparison of serum biochemical indexes between two groups
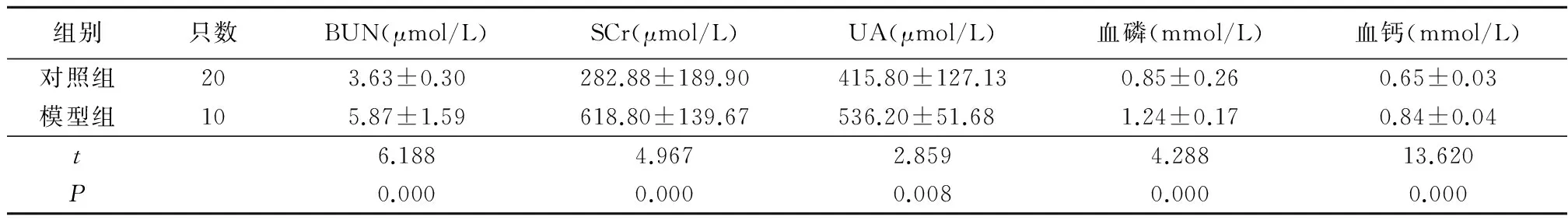
组别只数BUN(μmol/L)SCr(μmol/L)UA(μmol/L)血磷(mmol/L)血钙(mmol/L)对照组203.63±0.30282.88±189.90415.80±127.130.85±0.260.65±0.03模型组105.87±1.59618.80±139.67536.20±51.681.24±0.170.84±0.04t6.1884.9672.8594.28813.620P0.0000.0000.0080.0000.000
3 讨 论
目前CKD血管钙化模型,鉴定标准主要是根据血管的石蜡切片Von kossa 染色或者茜素红染色结果,Von kossa 染色有黑色沉积或茜素红染色有红色或紫红色钙结节染出都可视为模型成功[7]。本研究中,模型组小鼠表现明显的肾脏形态和功能损伤,血管出现明显的钙化,说明本研究制备的小鼠慢性肾病血管钙化模型是成功的。
CKD血管钙化的动物模型十分有限。血管钙化动物模型主要分为:药物诱导血管钙化(维生素D3诱导,华法令诱导,华法令和维生素D3联合诱导,维生素D3和尼古丁联合诱导,氯化钙诱导)、CKD引起的血管钙化(维生素 D3联合肾次全切除术,腺嘌呤喂养产生高甲状旁腺激素血症血管钙化)、基因敲除引起的血管钙化(基质 Gla 蛋白缺陷小鼠,骨保护素缺陷小鼠,载脂蛋白 E 缺陷小鼠,低密度脂蛋白受体缺陷小鼠,骨桥蛋白缺陷小鼠,胎球蛋白 A 缺陷小鼠,Klotho 基因缺陷小鼠,Smad6 基因缺陷小鼠,碳酸苷酶同功酶Ⅱ缺陷小鼠,原纤维蛋白 1 缺陷小鼠,核苷酸焦磷酸酶Ⅱ磷酸二酯酶 1 缺陷小鼠,锚蛋白缺陷小鼠)以及高脂、高胆固醇饮食喂养的近交系小鼠血管钙化。
大鼠模型中,维生素D3诱导的血管钙化会伴随气管、肺、胃、肠等脏器的广泛钙化,且这种钙化模型难以模拟临床血管钙化的病理过程,因为机体可以调节维生素D3的摄取和代谢的稳态,自然病程也很难诱导维生素D3的蓄积量达到这种诱导剂量。华法令诱导的血管钙化呈现不稳定性,与大鼠的年龄和生长状况有关。药物联合诱发的血管钙化致死率太高,并会发生多脏器的钙化,难以模拟临床血管钙化的病因。
慢性肾脏病引起的血管钙化模型较好模拟了临床血管钙化的进程,5/6Nx联合维生素D3诱导血管钙化的大鼠或小鼠模型成模率普遍不高,5/6Nx手术耗时且术后及后期钙化形成过程死亡发生率高,5/6Nx手术成活率约40%,动物成模率约30%,总体成模率约15%,使用这样的动物模型进行筛选、评价抗血管钙化的药物并不理想。腺嘌呤诱导的大鼠血管钙化模型主动脉钙化主要发生在中膜,与临床上慢性透析患者动脉钙化表现相似,且在其胃黏膜固有层和肌层有转移性钙化。可能是因为高浓度腺嘌呤损伤肾脏正常生理功能,PTH升高,血中肌酐和无机磷酸盐水平升高,血清钙的水平下降,但钙磷乘积升高,最终诱发肾衰竭,伴随钙盐在血管等软组织沉积。目前尚未有报道腺嘌呤诱导的小鼠钙化模型,相较大鼠而言,小鼠节约实验成本和实验空间,更利于应用在模拟临床血管钙化机制的研究中,且本研究小鼠腺嘌呤诱导CKD血管钙化方法成模率约为20%,高于上述其他模型。
基因敲除小鼠血管钙化模型是指在小鼠中利用基因敲除技术,使血管钙化的抑制分子的基因缺失或沉默来制备血管钙化。这种方法排除了饮食和药物的干扰,但其制备耗时久、成本高。尽管药物诱导、基因敲除、高脂和高胆固醇喂养、近交系培育等方法都可引起血管钙化,但它们在病理机制上都不适用于模拟人类CKD引起的血管钙化。因此,从病理机制来说,大鼠CKD血管钙化模型更适合于此方面研究。
目前常用的CKD引起血管钙化的动物模型有2种,即腺嘌呤大鼠肾毒性模型[8]和5/6Nx大鼠肾模型[9-10]。在这2个模型中,动物受到急性肾损伤后出现严重的高磷酸盐血症和甲状旁腺机能亢进,随后发展成CKD。在这2个疾病状态,饮食都是重要的因素。5/6Nx大鼠模型较经典,因肾脏被切除5/6,有效肾单位减少,导致肾小球灌流高、滤过高、内压高及通透性改变,且大鼠体质量下降严重,造模时间较久。肾小球坏死进程与慢性肾衰竭患者的病程相似,所发生的肾小球损伤与患者局灶节段性肾小球硬化相似,一般术后8~12周SCr、BUN升高,血钙低血磷高,呈现典型的慢性肾衰竭症状,并伴有血管钙化、骨密度下降等慢性肾衰竭并发症的表现。但该模型有如下缺点:①血管钙化出现率较低,在只存在慢性肾衰竭的情况下钙化发生率极低,需联合喂食高磷饮食来诱导高磷酸盐血症和血管钙化[11];②需通过一步法或两步法外科手术建立模型,5/6Nx手术耗时2周,增加了麻醉意外和手术感染的概率,且病死率较高;③建模周期较长,成功诱导血管钙化需耗时3个月。相比之下,腺嘌呤大鼠肾毒性模型因其简便易行,成活率高近年来引起较多关注,它比5/6Nx大鼠模型肾病进展更快更严重,甲状旁腺机能亢进,动脉钙化,一般给予含0.75%腺嘌呤的饮食4周后出现CKD症状,表现为继发性甲状旁腺功能亢进症,血液中PTH水平急剧升高,钙磷代谢失调,骨重吸收增强,动脉及软组织的钙化形成。主动脉钙化主要发生在中膜,与临床上典型的慢性透析患者动脉钙化相似,在其胃黏膜固有层和肌层有钙化[12]。可能因为高浓度腺嘌呤损伤肾脏的正常生理功能,PTH水平升高,SCr和P水平升高,血钙水平下降,但钙磷乘积升高,最终肾衰竭,钙盐沉积在血管等软组织。该模型喂食正常饮食即可,不需高磷饮食诱导。有趣的是,腺嘌呤肾毒性模型在低水平蛋白饮食条件下能产生更持续的动脉钙化[9]。但该模型存在两大缺点:一是由于大鼠自由进食,摄取腺嘌呤的量有较大差异,模型个体差异较大;二是该模型会引起大鼠严重的体质量下降,有些大鼠在建模后体质量几乎下降了50%。这给药物研究和筛选带来很大不利。因此,Terai改良了腺嘌呤大鼠肾毒性模型[13],给予大鼠灌胃600 mg·kg-1·d-1腺嘌呤,10 d后即造模成功,而且未见明显体质量下降。虽然该模型肾毒性和骨改变较明显,但改良模型的最大缺点是血管钙化发生率较低,只有15%左右。因此,本研究拟建立血管钙化发生率较高的改良模型。
以上模型都是大鼠模型,国内外尚未见腺嘌呤和5/6Nx诱导小鼠血管钙化模型的报道。本研究拟探索合适剂量和方法建立小鼠模型,这将缩短实验周期,便于实验操作,降低经济成本,在药物筛选中减少药物用量,对新药研究开发更有意义。
其他还有一些不常用的CKD血管钙化模型。在小鼠身上,外科手术诱导的急性肾损伤引起自发钙化,并发展为CKD,这是很难察觉的,除非伴随有导致动脉粥样硬化的基因异常,如低密度脂蛋白受体或ApoE基因的敲除[14-15]。另外,近年还报道了一个新的渐进性CKD-MBD的模型,即Cy/+大鼠[16]。正常磷饮食即自发产生CKD-MBD的3种病症,其益处是疾病自发进展,CKD早期可进行处理,以便更好地了解CKD-MBD的病理生理学。酪蛋白喂养的动物尿磷排泄升高,血清成纤维生长因子23升高[17],这样可观察CKD导致CKD-MBD过程的早期变化。但这些模型耗时长,需5~10个月才能完成CKD动物模型的整个过程,且动物需特殊来源,难以普及。
综上所述,本研究所制备的小鼠CKD血管钙化模型具有以下优点:①建模时间短,缩短了实验周期;②灌胃定量腺嘌呤代替自由饮食,克服模型个体差异;③建模后动物体质量不会出现明显下降;④给予维生素D显著提高血管钙化发生率及持续时间;⑤不需手术过程,简便易行。因此,此模型将为临床CKD引起的钙磷代谢紊乱继而诱发的心血管并发症及肾性骨病的相关研究提供一个快速可靠的动物模型,为临床有效新药筛选提供可靠的实验对象。(本文图见封三)
[1] Zheng CM,Zheng JQ,Wu CC,et al. Bone loss in chronic kidney disease:quantity or quality?[J]. Bone,2016,87:57-70.
[2] Wang C,Liu X,Zhou Y,et al. New conclusions regarding comparison of sevelamer and calcium-based phosphate binders in coronary-artery calcification for dialysis patients:a meta-analysis of randomized controlled trials[J]. PloS One,2015,10(7):e0133938.
[3] Russo D,Morrone LF,Imbriaco M,et al. Coronary artery calcification and outcomes in diabetic patients with and without chronic kidney disease[J]. Blood Purif,2013,36(1):17-20.
[4] Byon CH,Chen Y. Molecular mechanisms of vascular calcification in chronic kidney disease:the link between bone and the vasculature[J]. Current Osteoporosis Rep,2015,13(4):206-215.
[5] Tölle M,Reshetnik A,Schuchardt M,et al. Arteriosclerosis and vascular calcification:causes,clinical assessment and therapy[J]. Eur J Clin Invest,2015,45(9):976-985.
[6] 陈德君.血脂、cTnI和ET水平与肾脏病变程度的关系探讨[J].河北医科大学学报,2013,34(6):688-690.
[7] Fang Y,Ginsberg C,Sugatani T,et al. Early chronic kidney disease-mineral bone disorder stimulates vascular calcification[J]. Kidney Int,2014,85(1):142-150.
[8] Yamada S,Tokumoto M,Tatsumoto N,et al. Very low protein diet enhances inflammation,malnutrition,and vascular calcification in uremic rats[J]. Life Sci,2016,146:117-123.
[9] Phan O,Maillard M,Malluche HH,et al. Effects of sucroferric oxyhydroxide compared to lanthanum carbonate and sevelamer carbonate on phosphate homeostasis and vascular calcifications in a rat model of chronic kidney failure[J]. Biomed Res Int,2015,2015:515606.
[10] Ferrari GO,Ferreira JC,Cavallari RT,et al. Mineral bone disorder in chronic kidney disease:head-to-head comparison of the 5/6 nephrectomy and adenine models[J]. BMC Nephrol,2014,15:1-7.
[11] Lu KC,Wu CC,Yen JF,et al. Vascular calcification and renal bone disorders[J]. Scientific World Journal,2014,2014:637065.
[12] 徐金升,何雷,张胜雷.2015年肾脏病重要研究进展[J].临床荟萃,2016,31(2):168-174.
[13] Liu Y,Drozdov I,Shroff R,et al. Prelamin A accelerates vascular calcification via activation of the DNA damage response and senescence-associated secretory phenotype in vascular smooth muscle cells[J]. Circ Res,2013,112(10):e99-109.
[14] Shroff R,Long DA,Shanahan C. Mechanistic insights into vascular calcification in CKD[J]. J Am Soc Nephrol,2013,24(2):179-189.
[15] Pathak AS,Huang J,Rojas M,et al. Effects of restoration of blood flow on the development of aortic atherosclerosis in ApoE-/-mice with unilateral renal artery stenosis[J]. J Am Heart Assoc,2016,5(4):e002953.
[16] Liu W,Kang N,Seriwatanachai D,et al. Chronic Kidney Disease Impairs Bone Defect Healing in Rats[J]. Sci Rep,2016,6:23041.
[17] Yazdekhasti N,Brandsch C,Schmidt N,et al. Fish protein increases circulating levels of trimethylamine-N-oxide and accelerates aortic lesion formation in apoE null mice[J]. Mol Nutr Food Res,2016,60(2):358-368.
(本文编辑:许卓文)
Establishment of a mouse model of chronic renal vascular calcification
WANG Wen-wei1, TIAN Lu-lu2, XIONG Yan-wen3, CHEN Qi-jing2, PENG Wen4, YIN Pei-hao5*
(1.DepartmentofPhysiologyandPathophysiology,SchoolofBasicMedicineScience,FudanUniversity,Shanghai200032,China; 2.DepartmentofPharmacology,SchoolofPharmacy,FudanUniversity,Shanghai201210,China; 3.DepartmentofTraditionChineseMedicine,PutuoDistrictLiqunHospital,Shanghai200333,China; 4.DepartmentofNephrology,PutuoHospital,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai200062,China; 5.InterventionalCancerInstituteofChineseIntegrativeMedicine,PutuoHospital,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai200062,China)
Objective To establish vascular calcification mouse model derived from chronic kidney disease(CKD). Methods Murine CKD was induced by oral dosing with adenine. 1,25(OH)2D3and high-phosphate diet were used to accelerate vascular calcification. Serum urea nitrogen, serum creatinine, uric acid, calcium and phosphate were measured. HE staining and Von kossa staining were used to examine the morphological changes in kidney and aorta, respectively. Results After adenine dosing combined with 1,25(OH)2D3and high-phosphate diet, significant aortic calcification was detected in about 17% animals at 6 weeks, significantly increased serum urea nitrogen, creatinine, uric acid, serum calcium and phosphate were observed and all model animals showed significant arterial wall thickening and increased medial elastic fibers. Conclusion These data suggest that mice dosed orally with adenine in combination with 1,25(OH)2D3and high-phosphate diet were able to develop severe CKD and vascular disorder. The research provide a simple and stable mice modet to study vascular calcification in chronic kindney disease.
kidney diseases; vascular calcification; disease models, animal
2016-09-12;
2016-10-28
上海市卫生局科研课题(20124007,20134120)
王文伟(1966-),女,上海人,复旦大学基础医学院
R692.9
A
1007-3205(2017)03-0253-06
10.3969/j.issn.1007-3205.2017.03.002
实验师,医学硕士,从事心血管电生理研究。
*通讯作者。E-mail:yinpeihao1975@hotmail.com
