桉叶精油气相扩散抑菌活性及抑菌成分研究
2017-03-23任小玲岳淑丽刘荟雅
任小玲 - 岳淑丽 - 向 红 刘荟雅 -
(华南农业大学食品学院,广东 广州 510642)
桉树是桃金娘科(Myrtaceae)桉属(Eucalyptus)植物的总称,原产于澳大利亚,在全世界上百个国家和地区均有种植[1]。桉树自1890年引入中国,目前在中国的种植面积已超过3.60×106hm2[2]。从桉树叶中提取的桉叶精油具有广谱抑菌、抗氧化、消炎、抗病毒及杀虫驱蚊等作用,其主要有效成分为酚类、黄酮类、皂甙、萜类等[3-5]。桉叶精油因其广谱抑菌性而广泛应用于食品、医药等行业,但桉叶精油易挥发,难以长时间发挥抑菌作用[6-8]。微胶囊技术可使桉叶精油微胶囊化,利用微胶囊壁材的控释性,可实现桉叶精油长效抑菌[9]。将精油微胶囊应用到气调保鲜中,在保鲜的同时还可抑制有害微生物的生长,但微胶囊化后的桉叶精油只能以气态分子形式挥发到空间中。目前,国内外对桉叶精油抑菌方式的研究主要集中在液相扩散和固相扩散[3-5,10-13],对气相扩散抑菌方式的研究尚不多见。在桉叶精油添加量相同的情况下,气相、液相和固相扩散3种抑菌方式何种方式抑菌效果更好,尚无研究。
本试验拟以抑菌圈直径和最低抑菌浓度(MIC)为指标,将气相扩散抑菌效果与液相和固相进行对比,探究桉叶精油的气相扩散抑菌活性,并结合SPME/GC-MS测试结果,分析气态桉叶精油主要成分及主要抑菌成分,以期为桉叶精油在气调保鲜中的应用提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料与试剂
桉叶精油:广州市帕塞佳香精香料有限公司;
营养琼脂培养基、马铃薯葡萄糖琼脂培养基:广东环凯微生物科技有限公司;
牛肉浸膏、蛋白胨:生化试剂,国药集团化学试剂有限公司;
大肠杆菌、金黄色葡萄球菌、黑曲霉:华南农业大学食品学院生物工程实验室提供。
1.1.2 主要仪器设备
超净工作台:SW-CJ-1F型,苏州安泰空气技术有限公司;
生化培养箱:LRH-250-Ⅱ型,广东省医疗器械厂;
手提式不锈钢压力蒸汽灭菌锅:SYQ-DSX-280B型,上海申安医疗器械厂;
摇床培养箱:ZWY-100H型,广州市绿向生物科技有限公司;
气相色谱—质谱联用仪:GC-MS 7890B-5977A型,安捷伦科技有限公司;
手动SPME进样器:57324-U型,萃取纤维头为100 μL PDMS,美国Supelco公司。
1.2 方法
为对比桉叶精油在气相扩散(滤纸片法、平板法)方式下的抑菌效果(通过抑菌圈和MIC进行判定),本试验同时进行液相扩散(平板打孔法、试管二倍稀释法)和固相扩散(滤纸片法、平板稀释法)抑菌试验。
1.2.1 菌悬液的制备 用固体斜面培养基对供试菌进行活化,细菌采用平板计数法,霉菌采用显微镜直接计数法测菌体个数。根据计数结果,制成菌体浓度为106~107CFU/mL的均匀菌悬液,备用[14]。
1.2.2 含菌平板的制备 无菌条件下,向培养皿倒入20 mL冷却至45 ℃左右的培养基,待培养基自然冷却凝固后,滴入上述菌悬液100 μL,均匀涂布,静置待菌液被吸收即成含菌平板,备用。
1.2.3 精油气相扩散抑菌试验
(1) 抑菌圈的测定:采用滤纸片法[15]。无菌条件下,直径6 mm的无菌滤纸片贴于含菌平板的皿盖内中央,每皿盖中央放1片滤纸片,并使之展开,向滤纸片滴加桉叶精油,桉叶精油添加量依次为5,10,25 μL,以添加无菌水的滤纸片为空白对照,培养皿用保鲜膜密封。细菌于37 ℃条件下恒温培养20 h,霉菌于28 ℃条件下恒温培养4~5 d。培养结束,用十字交叉法测量各抑菌圈直径,结果取平均值。每个菌种重复试验9次[16]。
(2) 最低抑菌浓度(MIC)的测定:采用平板法[17]。气相抑菌试验中精油的浓度表示为培养皿内单位体积空气中的精油质量,即mg/L(空气)[18]。无菌条件下,向每个培养皿加入15 mL冷却至45 ℃左右的培养基,待培养基自然冷却凝固后滴入菌悬液100 μL,涂布均匀,待菌液被吸收后倒置放置。用移液枪吸取一定体积的桉叶精油至含菌平板的皿盖内中央,使细菌培养皿内空气中桉叶精油浓度分别达到0.180 0 ,0.090 00,0.045 00,0.022 50,0.011 25 mg/mL(空气),霉菌分别为0.720,0.360,0.180,0.090,0.045 mg/mL(空气)(9 cm培养皿去除培养基后的空间体积约为100 mL),以不添加桉叶精油的培养皿为空白对照。培养皿用保鲜膜密封,培养时间和温度同上。以不生长菌的样品的最低浓度为精油对该菌的气相MIC。每个菌种重复试验9次。
1.2.4 精油液相扩散抑菌试验
(1) 抑菌圈的测定:采用平板打孔法[19]。无菌条件下,直径为9 mm的无菌枪头在含菌平板中央打1个孔,无菌镊子剔去孔内培养基,用无菌移液枪吸取1滴上述45 ℃左右的培养基封底。向孔内滴加桉叶精油,桉叶精油添加量依次为5,10,25 μL,以添加无菌水为空白对照,培养皿用保鲜膜密封。培养温度和时间同1.2.3,测量抑菌圈大小。
(2) MIC的测定:取无菌试管9支,编号。第1~6号管采用试管二倍稀释法[20],依次配成含桉叶精油浓度为36.00,18.00,9.00,4.50,2.25,1.13 mg/mL液体培养基的系列浓度。无菌环境下向1~6号管中分别添加100 μL菌悬液,第7号管添加液体培养基和菌悬液,为阳性对照,第8号管仅添加液体培养基,第9号管仅添加精油。试管用硅胶塞塞紧,置于摇床培养箱中培养,转速180 r/min,温度和时间同1.2.3。以肉眼可见澄清透明的试管中精油的最低浓度为对应菌种的MIC。
1.2.5 精油固相扩散抑菌试验
(1) 抑菌圈的测定:无菌条件下,取1片直径6 mm的滤纸片贴于含菌平板琼脂表面中央,并使之展开,向滤纸片上滴加桉叶精油,滴加在滤纸片上的精油量依次为5,10,25 μL。以添加无菌水的滤纸片为空白对照,培养皿用保鲜膜密封。培养温度和时间同1.2.3,测量抑菌圈大小[18]。
(2) MIC的测定:采用平板稀释法[21]。桉叶精油以丙二醇为稀释剂,用二倍稀释法配置成不同浓度的溶液。准确量取20 mL冷却至45 ℃左右的培养基,加至含1 mL桉叶精油溶液的无菌平皿中,摇匀。待培养基凝固后滴入菌悬液100 μL,涂布均匀。精油浓度为36.00,18.00,9.00,4.50,2.25,1.13 mg/mL 培养基。培养时间和温度同1.2.3。以不生长菌的培养皿所对应的最低浓度为精油对该菌的固相MIC。
1.2.6 桉叶精油成分分析 采用气相色谱—质谱(GC-MS)联用技术[17]。
1.2.7 气相桉叶精油成分分析
(1) 样品前处理:取样品1 g,置于50 mL固相微萃取仪顶空采样瓶中,插入PDMS-100 μL纤维头在常温下萃取桉叶精油挥发物,快速抽出萃取头并立即插入气象色谱仪进样口(温度250 ℃)中,热解析4 min后进样[22]。
(2) 气相色谱和质谱条件:参照文献[17]。
2 结果与分析
2.1 抑菌效力测定结果
通过测定桉叶精油对供试菌抑菌圈的大小初步确定桉叶精油气相扩散的抑菌效力,结果见表1。抑菌圈试验的判定标准:>20 mm:极度敏感,15~20 mm:高度敏感,10~15 mm:中度敏感,7~10 mm:低度敏感,无抑菌圈者为不敏感[23-24]。
表1桉叶精油对供试菌的抑菌直径
Table 1 Inhibition zone diameters of tested microorganisms byEucalyptusessentialoil (n=9)mm
由表1可知,桉叶精油添加量为25 μL时,除对黑曲霉的固相抑菌圈直径为18.17 mm(高度敏感)外,各抑菌方式下的抑菌圈直径均低于20 mm(极度敏感范围)。在10 μL时,液相扩散抑菌圈直径比气相和固相略大,对大肠杆菌和金黄色葡萄球菌的抑菌圈直径在18~22 mm范围内,而对黑曲霉菌的抑菌圈直径为8~12 mm。在5 μL时,大肠杆菌和金黄色葡萄球菌表现为中高度敏感,黑曲霉表现为中低度敏感。
总体来看,桉叶精油在气相、液相和固相扩散抑菌方式下对供试菌均具有明显抑菌效力,且与剂量正相关,对大肠杆菌和金黄色葡萄球菌的抑制作用均优于黑曲霉,与岳淑丽等[17]的研究结果一致。气相扩散时桉叶精油的抑菌效力略低于液相,与固相扩散抑菌效力未有太大差异。固相扩散抑菌圈小是因为添加在滤纸片上的桉叶精油易挥发,作用浓度小,使抑菌效力减弱[25]。气相扩散抑菌圈小,一方面因为桉叶精油扩散到培养皿空间中,无法形成高浓度的抑菌点,另一方面桉叶精油中某些抑菌成分挥发性较弱或不挥发,气相桉叶精油中这部分抑菌成分含量较低,从而无法发挥抑菌作用[25]。
2.2 MIC值测定结果
在3种抑菌方式下测定桉叶精油对供试菌的MIC值,结果见表2。
表2的结果进一步证实了在3种抑菌方式下,桉叶精油对黑曲霉的抑制效果略差。桉叶精油气相扩散对供试菌的MIC值(0.045~0.36 mg/mL)显著低于液相的(4.5~18 mg/mL)和固相的(4.5~18 mg/mL),说明气相扩散时桉叶精油抑菌效果更好。桉叶精油不直接添加到培养基中,其挥发成分对供试菌仍具有较强的抑菌活性,这是因为精油挥发成分中某些单萜物质具有较强的渗透性,更易被细胞吸收,破坏微生物生长,因此较低剂量的桉叶精油即可抑制常见腐败菌[19],说明微胶囊形式可应用到气调保鲜中。

表2 桉叶精油对供试菌的最低抑菌浓度
2.3 桉叶精油成分分析结果
采用气质联用法测桉叶精油成分,其总离子流谱图见图1。采用顶空固相微萃取-气质联用法测定按叶精油挥发性成分,其总离子流谱图见图2。
图1 桉叶精油的总离子流图Figure 1 Total ion chromatogram of chemical components of Eucalyptus essential oil
图2 气相桉叶精油的总离子流图
Figure 2 Total ion chromatogram of chemical components of vapor-phaseEucalyptusessentialoil
图2中,由于桉叶精油挥发性成分中多种物质的离子出峰时间很接近,使得离子流图看起来出现了连峰。
利用计算机对图1和图2分离出的各组分提取质谱图,用NIST14标准谱库进行检索,根据质谱裂解规律进行核对,参考标准图谱和相关文献[17,26-28]确定各组分的化学结构,用峰面积归一化法计算各组分的相对百分含量,结果见表3。
由表3可知,桉叶精油共检测出66种物质,鉴定出其中的36个化合物,占精油总量的96.576%。含量超过1%的化学成分共有12种,按含量高低分别为α-蒎烯、1,4-桉叶素、右旋柠檬烯、o-伞花烃、莰烯、异松油烯、1,8-桉叶素、3-蒈烯、γ-松油烯、α-水芹烯、月桂烯、3-对薄荷烯。桉叶精油中,萜烯类化合物14种,占58.707%;烷烃类化合物7种,占1.893%;醇类化合物13种,占25.807%;苯类化合物1种,占9.516%;酮类化合物1种,占0.148%;醚类化合物1种,占0.504%。
气相桉叶精油共检测出32种物质,鉴定出其中的27个化合物,占气相成分总量的99.492%。含量超过1%的化学成分共有11种,按含量高低分别为α-蒎烯、右旋柠檬烯、波斯菊萜、右旋莰烯、1,4-桉叶素、3-蒈烯、异松油烯、(-)-反式蒈烷、月桂烯、蒈烷。气相桉叶精油中,萜烯类化合物14种,占82.042%;烷烃类5种,占5.448%;醇类化合物8种,占11.961%;苯类化合物1种,占0.041%。
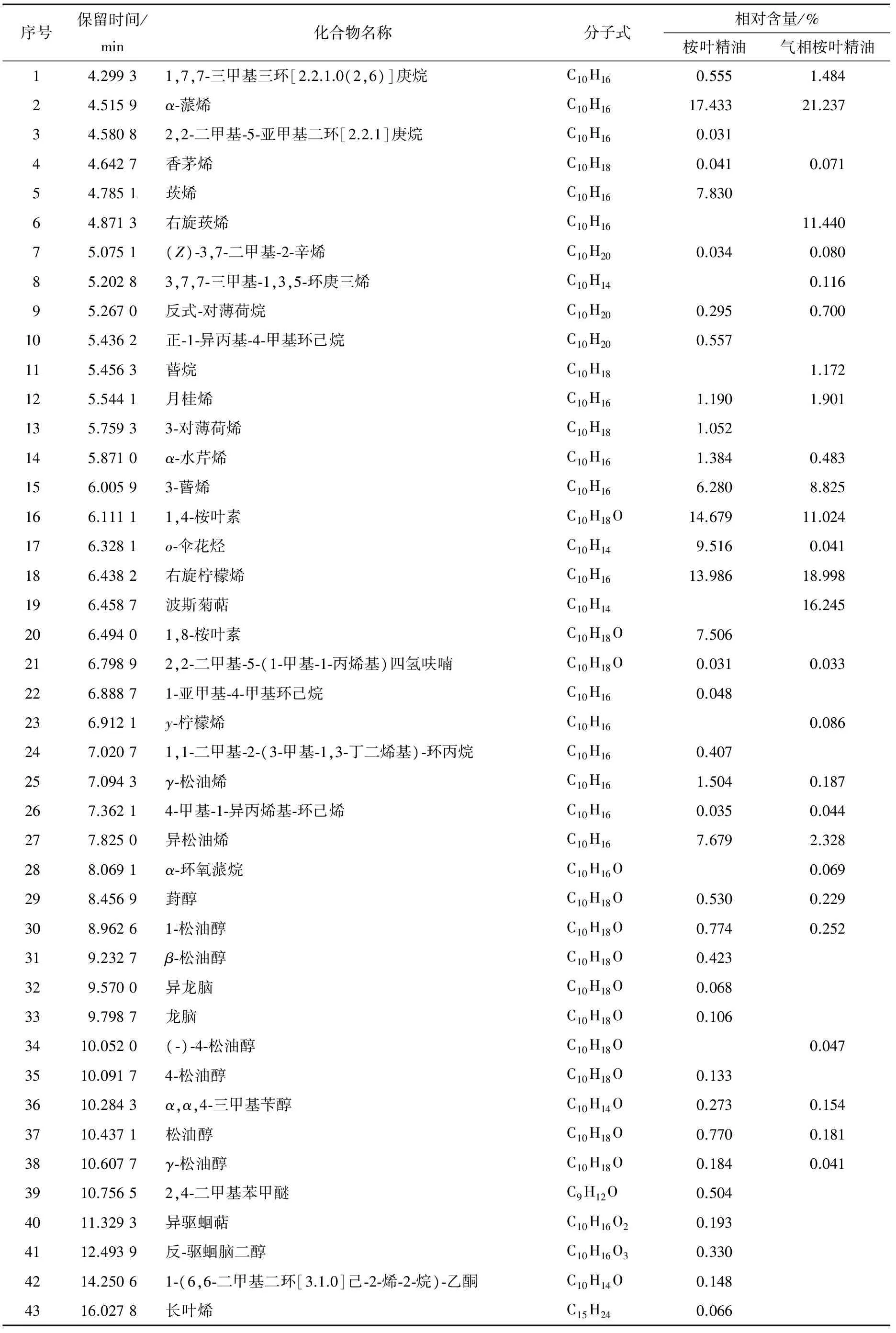
表3 桉叶精油及气相桉叶精油的化学成分及相对含量
由表3可知,物态的变化并未对桉叶精油的主要成分造成明显影响,桉叶精油与气相桉叶精油均以萜烯类和醇类物质为主[28-29]。气相桉叶精油中萜烯类化合物的相对含量升高了23.335%,烷烃类化合物的相对含量升高了3.555%,醇类化合物的相对含量减少了13.846%,苯类化合物的相对含量减少了9.475%,未检出酮类和醚类化合物, 结合2.1的抑菌圈试验结果可知这部分减少或消失的物质是气相抑菌效力稍差的原因[30-31]。据报道,小分子的萜烯类物质、酚类物质和醛酮类物质是精油的主要抑菌有效成分,醇类、醚类、苯类物质也具有一定的抑菌活性[32-34]。本试验测得的桉叶精油及气相桉叶精油中均含有萜烯类、醇类、苯类等物质,因此桉叶精油及气相桉叶精油均具有一定的抑菌活性。
结合2.2的结果可知,桉叶精油的抑菌活性与成分及其含量有关[20,28]。气相桉叶精油中减少的醇类物质主要为1,8-桉叶素和1,4-桉叶素,而抑菌活性却有所提高,与Tyagi A K等[19]的研究结果一致,可见萜烯类化合物的成分及其含量是影响桉叶精油抑菌活性的主要因素[17,20]。据报道[30,35-38],α-蒎烯、莰烯、右旋柠檬烯、1,8-桉叶素、3-蒈烯、异松油烯和月桂烯等物质具有一定程度的抑菌活性,说明气相桉叶精油的抑菌活性与α-蒎烯、右旋柠檬烯、3-蒈烯、异松油烯和月桂烯等单萜物质有关。
3 结论
本试验的结果表明气相桉叶精油具有明显抑菌活性,对大肠杆菌、金黄色葡萄球菌抑制作用较好,对黑曲霉抑制作用稍差。气相桉叶精油中减少或消失的醇类、苯类、酮类和醚类等不挥发或挥发性稍差的物质,是导致抑菌效力稍差的主要原因[10]。气相桉叶精油对供试菌的MIC值(0.045~0.36 mg/mL)显著低于液相的(4.5~18.0 mg/mL)和固相的(4.5~18.0 mg/mL),说明桉叶精油不直接添加到培养基中,其挥发成分对供试菌也有较强的抑制作用。桉叶精油物态的变化并未对其主要成分造成明显的影响,气相桉叶精油仍以萜烯类和醇类物质为主。气相桉叶精油的抑菌活性与α-蒎烯、右旋柠檬烯、3-蒈烯、异松油烯和月桂烯等单萜物质有关,萜烯类物质相对含量的升高导致抑菌活性变强,单萜物质在气相状态下更易被细胞吸收,从而更有效地发挥抑菌作用[15],说明桉叶精油的抑菌活性还与抑菌成分的物态形式有关,具体作用机制有待更深入的研究。总之,气相桉叶精油可以在空间中发挥抑菌作用,这为桉叶精油微胶囊应用到气调保鲜中提供了理论依据。
[1] GOLDBECK J C, NASCIMENTO J E, JACOB R C, et al. Bioactivity of essential oils from Eucalyptus globulus and Eucalyptus urograndis against planktonic cells and biofilms of Streptococcus mutans[J]. Industrial Crops and Products, 2014, 60: 304-309.
[2] 黄承标, 杨钙仁, 魏国余, 等. 按树林地枯枝落叶层的水文特性及养分贮量[J]. 福建林学院学报, 2011, 31(4): 289-294.
[3] 陈默, 余永莉. 桉叶油的化学成分及其生物活性研究进展[J]. 中国现代医药杂志, 2014(4): 97-100.
[4] ANNE K T, AYYAZ M. Antimicrobial potential and chemical composition of Eucalyptus globules oil in liquid and vapour phase against food spoilage microorganisms[J]. Food Control, 2011, 22(22): 1 707-1 714.
[5] GOLDBECK J C, NASCIMENTO J E, JACOB R G, et al. Bioactivity of essential oils from Eucalyptus globulus and Eucalyptus urograndis against planktonic cells and biofilms of Streptococcus mutans Malik A[J]. Ind. Crop. Prod., 2014, 60: 304-309.
[6] 王挥, 龚吉军, 唐静, 等. 肉桂与桉叶复合精油处理对“夏黑”葡萄保鲜质量的影响[J]. 食品安全质量检测学报, 2016, 7(9): 3 703-3 709.
[7] BATISH D R, SINGH H P, KOHLI R K. Eucalyptus essential oil as a natural pesticide[J]. Forest Ecol. Manag., 2008, 256(12): 2 166-2 174.
[8] 周春禾, 王建清, 金政伟. 尤加利精油制备微胶囊抗菌纤维素薄膜[J]. 包装工程, 2011, 32(1): 40-42.
[9] 任小玲, 岳淑丽, 向红, 等. 桉叶精油微胶囊工艺优化及缓释性能研究[J]. 包装工程, 2017, 38(9): 107-112.
[10] GILLESM, ZHAO J, AN M, et al. Chemical composition and antimicrobial properties of essential oils of three Australian Eucalyptus species[J]. Food Chemistry, 2010, 119(2): 731-737.
[11] OLOLADE Z S, OLAWORE N O, OLASOJI S O, et al. Chemical composition and bactericidal activities of the leaf essential oil of eucalyptus maculata hook[J]. Natural Product Chemistry Research, 2017, 5(2): 257-260.
[12] 周汉军. 桉叶精油提取、纳米乳化及其抑菌活性研究[D]. 长沙: 中南林业科技大学, 2016: 3-4, 21-23.
[13] 刘伟. 蓝桉叶精油微波无溶剂法提取及抗氧化、抗菌活性研究[D]. 哈尔滨: 东北林业大学, 2015: 25-28.
[14] 童迅, 高雯, 黄庭轩, 等. 浓缩果汁中耐热霉菌的分析及鉴定[J]. 食品科学, 2016, 37(20): 198-202.
[15] 刘晓丽, 钟少枢, 吴克刚, 等. 丁香和肉桂精油气相抑菌活性研究[J]. 食品与发酵工业, 2010, 36(1): 21-24, 38.
[17] 岳淑丽, 任小玲, 陈霞, 等. 桉叶精油包埋前后抑菌性能及成分比较研究[J]. 食品科学, 2017, 38(11): 155-160.
[18] 刘晓丽, 吴克刚, 柴向华, 等. 肉桂精油对储粮霉菌的抑制作用研究[J]. 安徽农业科学, 2012, 40(27): 13 570-13 572.
[19] TYAGI A K, MALIK A. Antimicrobial potential and chemical composition of Eucalyptus globulus oil in liquid and vapour phrase against food spoilage microorganisms[J]. Food Chem., 2011, 126: 228-235.
[20] 蓝亮美, 马丽, 郭占京, 等. 三种桂产桉叶油对常见致腐菌的抑制作用研究[J]. 食品工业科技, 2014, 35(22): 155-158.
[21] 郭俊贤, 刘晓丽, 吴克刚, 等. 11种精油对三种水产品特定腐败菌的抑制[J]. 中国食品添加剂, 2014(6): 54-57.
[22] 杨忠全, 阚建全, 陈光静, 等. 新鲜薏仁米与异味薏仁米挥发性成分对比分析[J]. 食品与机械, 2017, 33(7): 35-39.
[23] ROTA M C, HERRERA A, MARTINEZ R M, et al. Antimicrobial activity and chemical composition of Thymus vulgar is, Thymuszyg-is and Thymus hyemal is essential oils[J]. Food Control, 2008, 19(7): 681-687.
[24] 刘光发, 王建清, 赵亚珠. 牛至精油微胶囊的制备及其抑菌效果研究[J]. 包装工程, 2012, 33(3): 19-22.
[26] 田玉红, 周琪, 颇俊华, 等. 广林九号桉叶精油的抑菌活性研究[J]. 湖北农业科学, 2013(21): 5 193-5 196.
[27] KUMAR P, MISHRA S, MALIK A, et al. Compositional analysis and insecticidal activity of Eucalyptus globules (family: Myrtaceae) essential oil against housefly (Musca domestica)[J]. Acta. Trop., 2012, 122(2): 212-218.
[28] 叶舟. 大叶桉叶精油化学成分及其抑菌活性[J]. 福建林学院学报, 2007, 27(1): 48-51.
[29] AIT-OUAZZOU A, LORN S, BAKKALI M, et al. Chemical composition and antimicrobial activity of essential oils of Thymus algeriensis, Eucalyptus globulus and Rosmarinus officinalis from Morocco[J]. J. Sci. Food Agric., 2011, 91(14): 2 643-2 651.
[30] BAKKALI F, AVERBECK S, AVERBECK D, et al. Biological effects of essential oils: a review[J]. Food Chem. Toxicol., 2008, 46(2): 446-475.
[31] SPEROTTO A R M, MOURA D J, PÉRES V F, et al. Cytotoxic mechanism ofPipergaudichaudianumKunth essential oil and its major compound nerolidol[J]. Food Chem. Toxicol., 2013, 57(12): 57-68.
[32] TYAGI A K, MALIK A. Antimicrobial potential and chemical composition of Mentha piperita oil in liquid and vapour phase against food spoiling microorganisms[J]. Food Control, 2011, 22 (11): 1 707-1 714.
[33] TYAGI A K, MALIK A. In situ SEM, TEM and AEM studies of the antimicrobial activity of lemon grass oil in liquid and vapour phase against Candida albicans[J]. Micron., 2010, 41(7): 797-805.
[34] LEOPOLO J, GERHARD B, ALBERA S, et al. Composition quality control and antimicrobial activity of the essential oil of long time dill seeds from Bulgaria[J]. Chem. Nat. Compd., 2003, 51(2): 3 854-3 857.
[35] 夏忠弟, 毛学政, 罗映辉.α-蒎烯抗真菌机制的研究[J]. 湖南医科大学学报, 1999(6): 507-509.
[36] 郝静梅, 盛冉, 孙志高, 等. 柠檬烯抗菌性研究进展[J]. 食品与发酵工业, 2017, 43(2): 274-278.
[37] 关天旺, 刘嘉煜. 柠檬烯的防腐作用及抑菌机理研究进展[J]. 保鲜与加工, 2015(6): 83-87.
[38] 何丽芝, 王婧, 赵振东, 等. 3-蒈烯资源及其生物活性应用研究进展[J]. 林产化学与工业, 2011, 31(3): 122-126.
