植物、微生物对氮的吸收利用比较及微生物群落解析
2017-03-23李成乐马效芳
杨 毅,陶 权,梁 英,李成乐,李 跃,马效芳
(1.四川大学建筑与环境学院,成都 610065;2.四川省交通运输厅公路规划勘察设计研究院,成都 610041)
水环境污染主要来自于点源和面源两种不同类型的污染源排放,点源污染被逐渐控制之后,面源污染已成为水环境污染的关键因素,由其所导致的水体富营养化现象,已严重威胁着水环境生态安全[1-3]。近年来,伴随着我国城市内涝现象的频发,城市面源污染问题也逐渐成为人们普遍关注的焦点。国内外都对城市的面源污染开展了研究工作,发现我国城市由于降雨径流冲刷造成的污染相比于国外更加严重[4, 5],其携带的污染物对受纳水体的污染贡献相当大[6, 7]。特别是我国大中型城市降雨径流中NH+4-N污染恶化趋势十分明显[8-11],成为普遍和突出的水质污染问题之一。
人工湿地、生物滞留池和生物滤池等基于生态工程的水处理系统被越来越多地被应用于城市面源氮素污染的处理[12],此类系统去除N的主要方式包括微生物代谢和植物吸收[13]。 张荣社等[14]通过现场监测人工湿地的脱N效果发现植物对N的吸收量有限。Geronimo等[15]研究结果表明生物滞留池中植物对N的吸收并不是去除N的主要途径。但是也有报道证明植物的直接吸收对N的去除起到重要作用[16]。张鸿[17]等则发现人工湿地中植物不仅可以直接吸收N,其根系分泌物还可以促进嗜N菌的生长,从而促进N的释放转化。根际微生物数量也与培养液中N的浓度和植物生物量有关[18]。植物还能通过茎叶将光合作用产生的氧气一部分输送到根区部位[19],使根系微环境存在好氧和缺氧环境,从而使微生物提高反硝化作用[20]。Hatt[21]和Henderson[22]等研究发现在生物滞留池对N的去除过程中,植物和微生物起到关键的作用,缺少植物和微生物,滞留池内的填料可能成为一个不断释放污染物的污染源。Payne[23]等分析了生物滤池里影响N循环的主要因素,发现植物-微生物的相互作用以及植物根系的形态是影响N去除的关键因素。
微生物过程被认为是生态工程水处理系统中脱N尤其是去除NH+4-N的原动力,永久去除N主要依靠硝化-反硝化途径[13, 14, 24],但是传统的自养硝化、厌氧反硝化理论不足以解释复杂环境下N的迁移转化问题,异养硝化、好氧反硝化的发现提供了新的理论补充。随着分子生物学的快速发展,环境中微生物的研究方法已经跳出了传统的实验室纯培养限制[25]。宏基因组作为一种分子生物学新技术,能够更全面、更深入地解析微生物群落结构[26],尽可能真实地揭示原位环境中微生物群落的复杂性和多样性。由于宏基因组技术数据量庞大,需要高通量测序技术作为依托[27]。目前普遍应用的高通量测序技术主要有Roche/454焦磷酸测序、ABI/SOLiD连接酶测序和Illumina/ Solexa聚合酶合成测序[28, 29]。
微生物和植物是生态工程水处理系统中非常关键的部分,在对营养盐的去除中起到了至关重要的作用,但以往的研究对于N在包含植物、微生物的完整生态体系各部分中迁移转化的定量研究需要拓展,从而进一步了解微生物、植物对于N去除和利用的贡献。过去对于植物-微生物系统中微生物研究的尺度与深度不够,本文借助高通量宏基因组Solexa聚合酶合成测序技术研究了该系统中微生物群落结构,旨在分析微生物与植物在系统中的联合作用机理,为强化生态工程水处理系统的水质净化效果积累基础资料。
1 材料与方法
1.1 实验材料
1.1.1 植物和微生物
选用植物为具有良好抗涝、抗旱性的混播草。微生物来自于植物根系及周围的土壤。
1.1.2 液体培养基
雨水中COD含量普遍较高[30],采用葡萄糖模拟雨水COD的方法,添加的葡萄糖浓度为500 mg/L,对应COD浓度为533 mg/L;植物需求营养成分按霍格兰营养液[31]配制;根据成都市土壤中有效磷的含量(7.35 mg/kg)以及土壤容重(1.4 g/cm3)得到土壤总磷的含量为10.29 mg/L。最终液体培养基的主要成分与质量浓度:葡萄糖,500 mg/L;CaCl2,184.96 mg/L;KCl,124.25 mg/L;MgSO4,80.24 mg/L;KH2PO4,45.36 mg/L;FeCl3·6H2O,1.62 mg/L。
1.1.3 微生物抑制剂
分别将80、100万单位(1单位=1 μg)的青、链霉素溶液溶解到500 mL容量瓶里,再分别取31.25、25 mL上述溶液至500 mL容量瓶中,配制成浓度为10 万单位/L的微生物抑制剂。
1.2 实验方法
1.2.1 实验装置
本实验设计200、400、600 mg/L 3种不同NH+4-N浓度下的培养液,共设计4个大组,植物+微生物、植物、微生物和空白组。空白组只设计NH+4-N浓度为400 mg/L的装置,其余组各下设3种不同NH+4-N浓度的装置。实验装置塑料杯上、下底直径及高分别为9.5、6.7和6.5 cm,用锡箔纸将塑料杯包裹,所有装置均放置于室内,并保证有足够的自然光照。为了减少溶液的挥发,塑料杯上装有不透光的杯盖,植物根系可以穿过杯盖浸泡在培养液中。
各组别塑料杯中加入的物质与含量如表1所示。加入的微生物取自由土壤浸泡液制成的微生物悬浮液,液体培养基与微生物悬浮液的体积比为9∶1;微生物抑制剂青霉素和链霉素溶液各加入5 mL;植物取样后用超纯水反复对根系冲洗并用液体培养基预培养植物一周,在实验开始后的65 h再放入到装置里。每隔一定时间向装置里加入适量纯水,以保持溶液体积的恒定。

表1 各组加入的物质及含量Tab.1 Material and content of each group
1.2.2 取样方法
实验时间为2016年1月12日-2016年3月16日,总计1 536 h(64 d)。培养液中NH+4-N、NO-3-N、NO-2-N的测定采用耗竭法,NH+4-N采样时间分别为3、20、45、96、138、187、307、1 128、1 536 h,NO-x-N采样时间为307、1 128、1 536 h,每次取5 mL的培养液,经过0.45 μm滤膜过滤后测定,最后数据处理时需要从N的减少量中扣除取样造成的损失,植物体TN、微生物湿重测定需等实验结束后方能开始。
1.2.3 高通量测序样品预处理
对NH+4-N浓度为400 mg/L的微生物、空白组水样进行处理,混匀原始样品,样品足够时,取4 mL液体样品,分多次加入灭菌的2 mL离心管中,10 000 rpm室温离心3 min,弃置上层液体,倒置离心管于吸水纸上,直至没有液体流出;样品不足4 mL就全部离心。
1.3 分析项目与检测方法
1.3.1 主要指标测定
NH+4-N:参照《水质氨氮的测定水杨酸分光光度法(HJ 536-2009)》;植物体TN测定方法:采用浓硫酸-过氧化氢消煮,过硫酸钾氧化吸光光度法测定[32];微生物重量采用湿重法测定[33];NO-x-N:参照瑞士万通792 Basic IC离子色谱仪使用说明书;pH采用pHB-4便携式pH计(上海仪电科学仪器股份有限公司)测定;溶解氧采用LDO便携式溶氧仪(美国哈希)测定;镜检实验采用OLYMPUS CX41光学显微镜进行观察。
1.3.2 高通量宏基因测序分析
1.3.2.1 DNA提取、PCR扩增及DNA纯化回收
本实验委托上海生工生物工程股份有限公司完成。实验流程为:采用OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit的试剂盒,按照说明书步骤进行提取基因组DNA,采用琼脂糖凝胶检测DNA完整性。PCR第一轮扩增,利用Qubit2.0 DNA检测试剂盒对基因组DNA精确定量,以确定PCR反应加入的DNA量,细菌扩增V3-V4区域通用引物为341F(CCTACGGGNGGCWGCAG)和805R(GACTACHVGGGTATCTAATCC),真菌扩增NS1-FUNG区域通用引物为NS1(GTAGTCATATGCTTGTCTC)和Fung(ATTCCCCGTTACCCGTTG);第二轮扩增,引入Illumina桥式PCR兼容引物,结束后,PCR产物进行琼脂糖电泳检测。DNA纯化回收,对于细菌扩增的PCR产物和正常扩增片段在400 bp以上的PCR产物,选用0.6倍的磁珠(Agencourt AMPure XP)处理,对于真菌PCR产物和其他扩增片段小于400 bp的PCR产物,选用0.8倍的磁珠处理。定量混合,利用Qubit2.0 DNA检测试剂盒对回收的DNA精确定量,以方便按照1∶1的等量混合后测序,等量混合时,每个样品DNA量取10 ng,最终上机测序浓度为20 pmol。
1.3.2.2 基于Illumina平台的16S rDNA、18S rDNA宏基因组测序
获得DNA样品后采用在Illumina Miseq平台上进行双端测序。细菌和真菌采用质量控制软件Prinseq,拼接软件分别采用FLASH和PEAR对样品去除引物序列、短片段、低复杂度序列和低质量序列,完成对样品序列的质量控制。细菌质量控制后序列长度大部分分布在400~600 bp之间,平均长度为440 bp以上,各样本序列数均在500以上,满足基本分析要求。细菌和真菌分别利用Mothur、Usearch软件去除序列中的嵌合体。将多条序列按其序列间的距离,细菌通过Uclust软件、真菌通过Usearch软件进行聚类分成操作分类单元(OTU),相似度定为97%。对处理后序列进行物种分类,采用软件为RDP classifier,分类阈值为0.8。通过Mothur软件进行Alpha多样性分析,衡量样本物种多样性以及组间样本差别。
2 结果与讨论
2.1 N在植物、微生物作用下的迁移转化
2.1.1 不同组别pH值、溶解氧变化
各组别pH值随时间的变化如图1所示,随着时间增加,除微生物组pH值在1 080 h(45 d)时有明显上升外,所有组别pH值刚开始都下降,而后逐渐趋于平缓,NH+4浓度的大小对pH值变化基本没有影响。实验刚开始由于液体培养基的pH值为6.37,微生物悬浮液pH值为8.07,造成微生物、植物+微生物组的pH值要明显高于植物、空白组,但是随着时间的增加,这种差距逐渐减小。
从图2可以发现,各组别溶解氧浓度随时间的变化范围较大。实验刚开始18 h内,含有微生物组别的溶解氧水平远低于不含微生物组别,65 h时恢复到和不含微生物的组别一样的水平。添加植物后,植物、微生物、植物+微生物组溶解氧水平持续降低至185 h,且植物+微生物比微生物、植物组溶解氧降低更多,而后又开始上升。
2.1.2 培养液中NH+4-N浓度随时间的变化
各组别NH+4-N浓度随时间的变化如图3所示。所有组别均表现出刚开始250 h内快速降低,而后缓慢下降,且植物+微生物、植物组要比微生物、空白组降低更多且速率更快。NH+4-N初始浓度为200 mg/L时,植物+微生物、植物组约从200降至100 mg/L以下,而微生物组约从200降至150 mg/L左右;初始浓度为400 mg/L时,植物+微生物、植物组约从400降至150 mg/L左右,而微生物、空白组约从400降至250 mg/L左右;初始浓度为600 mg/L时,植物+微生物、植物组约从600降至250 mg/L左右,而微生物组约从600降至400 mg/L左右。可知植物+微生物、植物组随着NH+4-N浓度的增加,其对NH+4-N的利用也越多。实验后期植物+微生物组培养液中NH+4-N浓度最低,其次为植物、微生物组,且植物+微生物组的NH+4-N仍有持续降低的趋势,对NH+4-N的去除效率为:植物+微生物>植物>微生物。

图1 培养液中pH值随时间的变化 Fig.1 Changes of pH in the culture solution

图2 培养液中溶解氧随时间的变化Fig.2 Changes of DO in the culture solution

图3 培养液中NH+4-N浓度随时间的变化 Fig.3 Concentration variation of NH+4-N in the culture solution
2.1.3 不同组别植物各部位对N的吸收利用
实验结束后通过测定植物叶、茎、根含N量,与实验开始时保存的植物原样进行对比,可知植物在不同NH+4浓度及微生物环境下对N的吸收利用效果。以往研究表明植物不同部位对N的积累量不同,卢少勇等[34]发现处于生长期的植物,地上部N含量高于地下部,但是衰亡期N会转移到地下部;也有研究[35]发现地上部对N的积累和地下部相等,所以有必要对混播草不同部位的含N量进行测定。如图4所示,所有组别的植物总N量均高于原样,且植物+微生物含N量高于植物组,特别是NH+4-N浓度为200 mg/L的组别,植物+微生物含N量比植物组高13.8 mg/g。除此之外,植物各部位含N量的特点为:茎、叶含N量之和大于根含N量,N含量主要集中在茎、叶处。
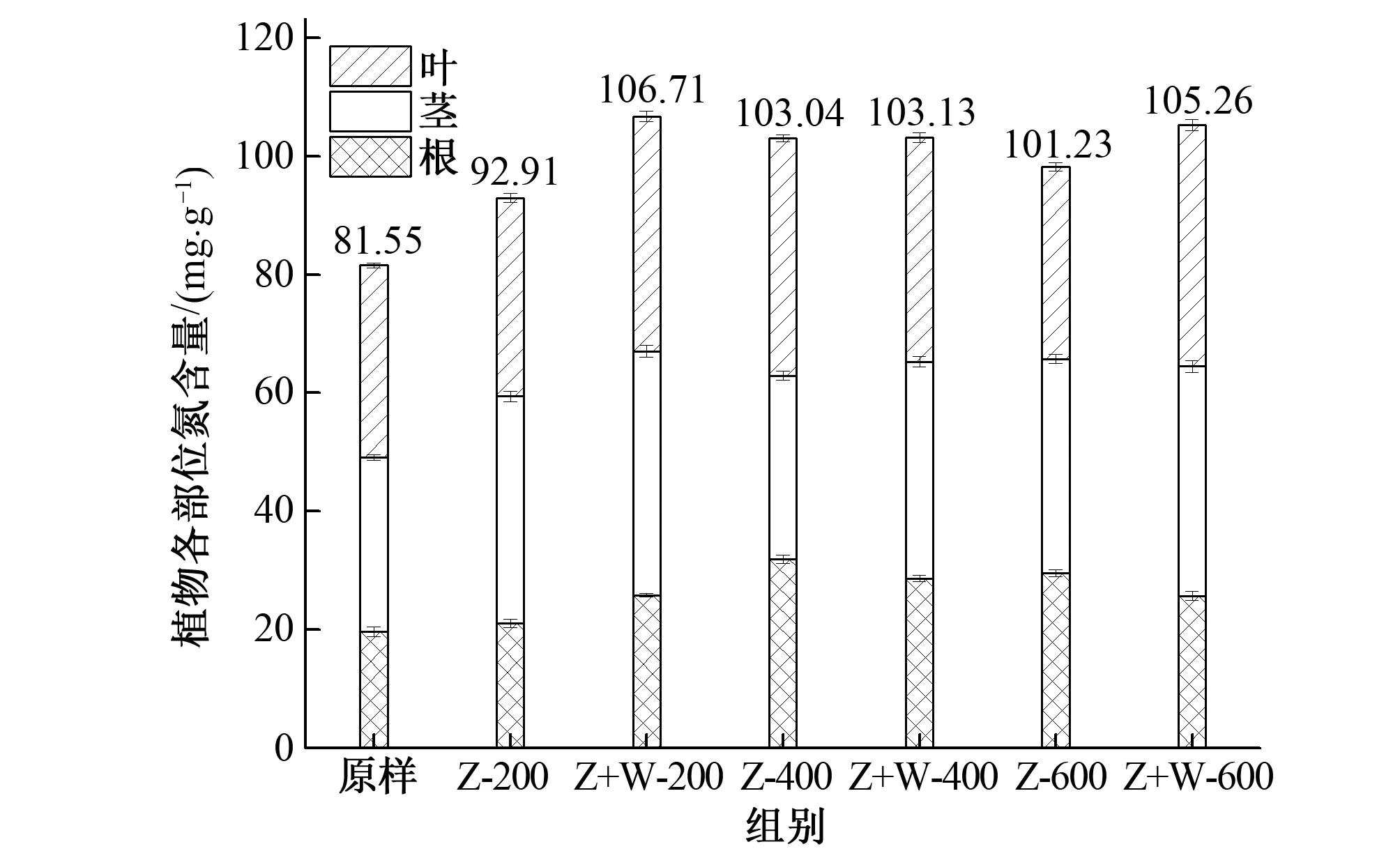
图4 植物各部位含N量 Fig.4 Content of N in different part of plant 注:图中Z-400,Z代表植物,400代表NH+4浓度为400 mg/L,其他相同。
为考虑植物对N的吸收情况,结合植物原样重量和含N量,植物各部位吸收N量如图5所示,植物+微生物吸收量均大于植物组,特别是NH+4-N浓度为200 mg/L的组别,植物+微生物组对N的吸收多出4.48 mg,说明微生物可以一定程度促进植物对N的吸收利用。植物可以通过根系为微生物提供氧气,同时根系分泌物也可作为微生物的碳源,为微生物生长创造良好的环境,同时微生物可以为植物提供各种形式的N,有利于植物的吸收,所以植物+微生物比单纯的植物更能促进N的转化利用。

图5 植物各部位吸收N量Fig.5 Content of the absorbed N in different part of plant
2.1.4 不同组别微生物对N的同化利用
实验过程中在微生物组培养液中观察到了白色絮状体,为衡量微生物同化作用对N的利用效果,在实验结束时通过湿重法得到微生物的重量,假设微生物干重∶湿重为1∶10,微生物细胞干重含N量为12.5%[36],得到细胞含N量,视为微生物同化作用利用的N。如图6所示,所有组别中均有微生物存在,且对所有不同NH+4浓度的组别,微生物湿重的大小依次为:植物+微生物>微生物>植物,微生物组中NH+4浓度为400 mg/L的组别中微生物生长状况最好。植物+微生物组中植物能为微生物提供附着场所和氧气,植物可生成发达的根系形成巨大的表面积[24]且其在根系周围形成根系生物圈增加微生物生物量[16],所以微生物湿重值比微生物组高;植物组由于微生物抑制剂的作用,微生物生长缓慢,所以湿重相对较低。

图6 微生物的湿重 Fig.6 The wet weight of microorganism
2.1.5 不同组别微生物硝化/反硝化对N的利用
通过分析各组别NO-2、NO-3浓度随时间的变化,可以得到微生物硝化甚至反硝化的能力。不同NH+4-N浓度下,培养液中NO+x含量随时间的变化如图7所示。在所有时间段各组别都检测到了NO-2,NO-3在实验的后期被检测到。13 d时所有组别都检测到NO-2,浓度约为1~2 mg/L,NO-3只在NH+4-N浓度为200 mg/L的植物组少量检测到,说明具有硝化功能的微生物开始作用;47 d时所有微生物组都检测出了NO-3和NO-2,浓度分别约3~4和1~2 mg/L,NO-2相比之前略有增加。植物组NO-2浓度略微增加,但NO-3未被检出,植物+微生物组与之相同,但在NH+4-N浓度为600 mg/L的组别检测到少量NO-3,由于根系能够利用NH+4和NO-3,从而可能导致有植物的组别NO-3几乎没有产生的假象;64 d时,除空白组外,其余组都检测到NO-3和NO-2,微生物组两者之和低于之前,而植物、植物+微生物组则相反其中NO-2浓度降低,NO-3增加,微生物组NO-3浓度的显著降低预示了反硝化作用的存在,而植物、植物+微生物组NO-3增加可能是之前积累的NO-2通过微生物被氧化成NO-3。总之,培养液中NO-x浓度复杂的变化现象预示了微生物、植物对N利用的活跃性。

图7 不同NH+4-N浓度培养液中NOx-的变化 Fig.7 Concentration variation of NOx- in the different culture solution
2.1.6 N迁移转化规律
通过对培养液各形态N浓度、植物体TN含量的测定,根据微生物含N量占其湿重的百分比估算其同化利用的N,由物料平衡[16]得到植物-微生物系统对N的转化利用关系:培养液NH+4-N减少量=植物吸收N量+硝化作用生成NO-x-N+微生物同化作用利用N量+氨氮挥发量+反硝化利用N量,其中NH+4-N减少量已经扣除了取样造成的损失,由于冬季氨氮挥发速率相当低,所以此实验取氨氮挥发量为其减少量的1%[37, 38]。做出各组别N的迁移转化,结果如表2所示,再做出各途径所占百分比,如图8所示。
通过分析表2可知,植物、微生物对NH+4-N浓度降低的贡献大小依次为:植物+微生物>植物>微生物组,降低量分别为25.01~39.97、11.88~40.96、4.62~8.97 mg,对应降低率为38.46%~55.39%、32.90%~37.22%和4.53%~12.83%。植物吸收N量大小顺序为:植物+微生物>植物组,吸收量分别为8.18~8.69和4.21~8.59 mg,对应吸收率为7.87%~19.24%、5.66%~11.66%。各组微生物硝化能力无法比较,因为各组存在的反硝化作用和植物对N的吸收利用会导致硝化作用产物的浓度降低,所以表中只列出了NO-x-N 的生成量。同化作用利用N能力的大小依次为:植物+微生物>微生物>植物组,利用量分别为2.12~3.78、1.64~2.29和1.13~1.49 mg。通过反硝化对N的去除能力大小:植物+微生物>植物>微生物组。
由图8分析可知,在NH+4-N的转化利用中,植物、植物+微生物组主要通过反硝化作用及植物的吸收利用来实现,其中反硝化作用贡献最大,为49%~79%,其次植物吸收为15%~37%;而微生物组主要通过反硝化和同化作用来实现,分别为51%~62%、26%~36%。
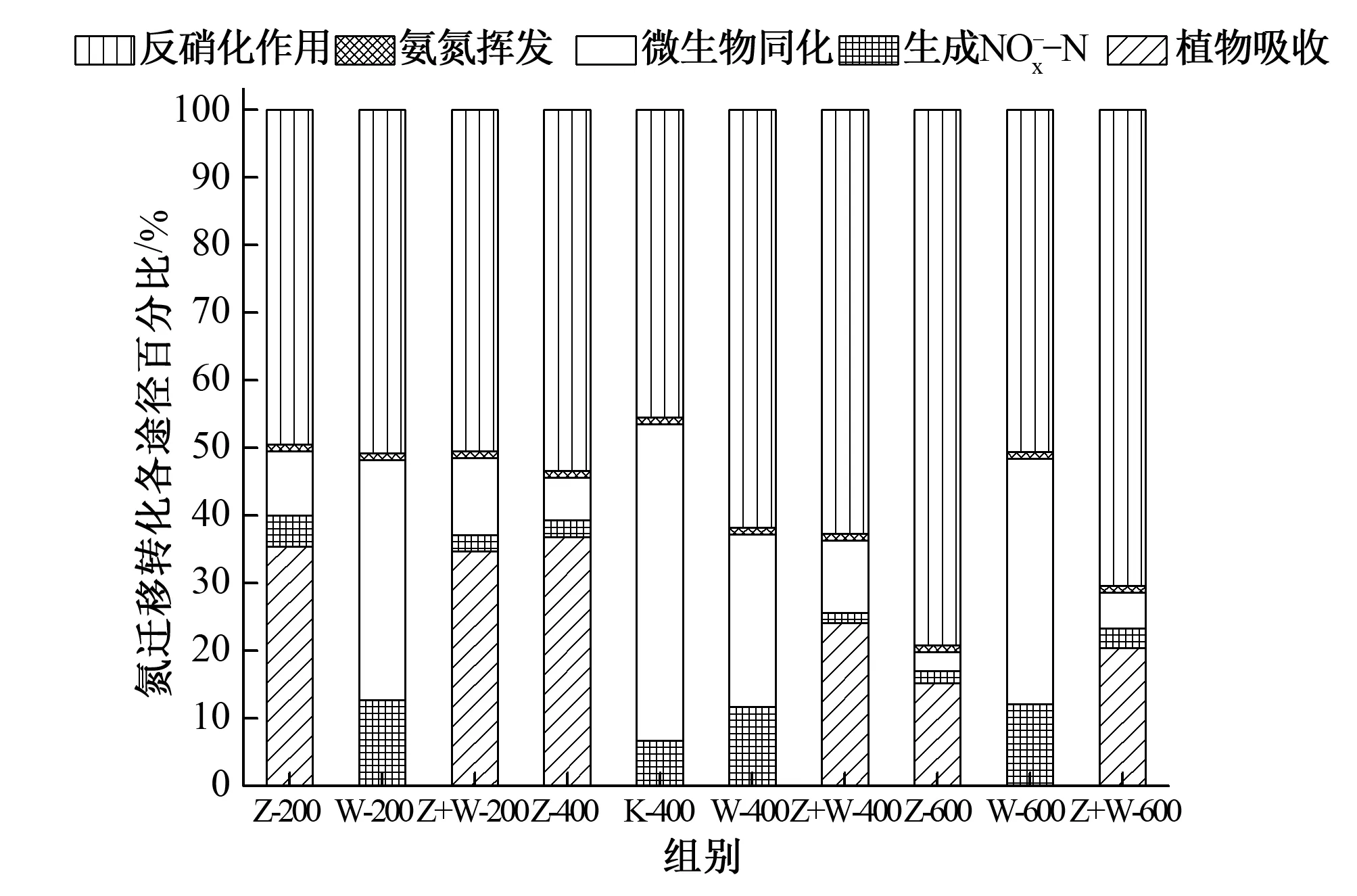
图8 各途径比例图 Fig.8 The fate of N in different groups
2.2 植物-微生物系统去N机理
2.2.1 植物体净重变化
通过测定植物净重判断不同组植物的长势。如图9所示,经过64 d的生长,所有组别植物净重均大于实验开始时原样净重,增加了4~5倍,长势正常[20]。相同NH+4-N浓度下,植物组中植物净重大于植物+微生物组。随着NH+4-N浓度增加,植物+微生物组微生物湿重分别是植物组的2.52、2.53和1.84倍,吸收N量分别为2.06、0.99和1.31倍,植物吸收N量倍数并没有随着微生物湿重倍数升高而变大。蒋先军等[39]在研究植物根系微生物硅酸盐细菌的代谢产物对植物生长的促进作用中发现,低浓度代谢物可促进植物生长,而高浓度代谢物作用则相反,微生物可通过其分泌物抑制植物对营养的有效吸收。

表2 各组N迁移转化Tab.2 The migration and transformation of N in each group

图9 不同组植物体烘干净重 Fig.9 Dry weight of plant in different group
2.2.2 宏基因组测序
实验过程中所有溶液均有白色絮状物产生,通过对培养液中微生物进行镜检观察发现微生物组含有大量的菌胶团和有隔菌丝,空白组以丝状菌和有隔菌丝为主,温东辉[36]在模拟生物沸石柱处理雨水的动态试验中发现沸石表面会出现以丝状菌为主的白色絮状物,并通过需N微生物纯培养实验发现硝化过程属于异养硝化,起硝化作用的微生物包含真菌。
2.2.2.1 微生物种群多样性分析
样本中Coverage值体现了微生物测序后组装得到的基因组序列占整个基因组的比例,如表3所示,本研究Coverage值均大于95%,能确保测序结果代表样品中的微生物组成。丰富度指数ACE和Chao1值越大则群落丰富度越高;多样性指数Shannon值越大则群落多样性越高,Simpson指数值越大则群落多样性越低。从表中可以看出微生物组细菌丰富度和多样性均高于空白组,微生物组真菌多样性高于空白组,丰度则略低于空白组。与其他研究[25, 40]对土壤细菌的测试结果相对比可知,本实验细菌种群丰度要高,而多样性却要低,可能由于培养液中较高的NH+4-N和葡萄糖浓度造成某些异养菌过度繁殖而自养菌却无法生长。就群落水平而言,种群多样性高的群落包含更多具有不同生物学和生态学特性的种群,系统稳定性更强[27]。

表3 不同样本的Alpha多样性Tab.3 Alpha diversity of the different samples
2.2.2.2 16S rDNA序列在门分类层面上的特征
本研究通过高通量测序技术从微生物组获得17446条高质量序列,从空白组获得15936条高质量序列,经项目分析,得到微生物组细菌由16个门、105个属组成,空白组细菌由13个门、66个属组成。在门分类水平的序列数和相对丰度如表4所示。其中,微生物组优势类群为变形菌门、酸杆菌门、绿弯菌门和蓝藻门,相对丰度分别占细菌群落的70.74%、26.72%、1.07%和0.95%;而空白组以变形菌门最为丰富,其次为酸杆菌门,分别占96.59%和2.97%。微生物测序结果和其他土壤类似,群落主要以变形菌门和酸杆菌门为主[25, 41]。另外,培养液较低的pH值也有利于某些酸杆菌的生长。
2.2.2.3 16S rDNA序列在属分类层面上的特征
深入解析植物-微生物系统的微生物种群结构,揭示在N迁移转化中起决定作用的细菌,将在属分类水平相对丰度较大和两组之间丰度存在显著差异的菌种列出并进行特征描述。如表5所示,可见微生物组优势菌属为Burkholderia、Terriglobus、Rhodanobacter、Acidisoma和Rhizobium,相对丰度分别占细菌群落的30.78%、26.02%、23.56%、9.64%和1.37%。其中Burkholderia、Rhodanobacter、Acidisoma和Rhizobium属于变形菌门,Terriglobus属于酸杆菌门。两组中物种丰度较大的菌属,Rhodanobacter、Burkholderia、Terriglobus和Acidisoma,多数可在pH值为3~6的酸性、偏盐环境中生长,培养液低pH和高盐环境决定了以上菌属相比其他菌属具有更显著的生长优势。微生物组中优势菌属基本上都属于化能异养型;Rhodanobacter、Rhizobium、Psedomonas、Bacillus属具有脱氮固氮功能,Nitrospira、Leifsonia、Afipia属能够将亚硝酸氧化成硝酸。

表4 细菌在门水平上的分布Tab.4 Taxonomic compositions of bacterial communitiesat the phylum level
菌种鉴定表明培养液中几乎不存在硝化细菌,而培养液中又检测到NO-3和NO-2,另外根据N在植物、微生物环境中的迁移转化关系可知,培养液中有相当一部分N是通过反硝化作用去除。Rhodanobacter属可以在缺氧条件下以NO-3、NO-2和N2O为电子受体而以葡萄糖、乙酸为电子供体将它们还原为N2[42];Rhizobium sp.可以实现同步硝化/反硝化,魏巍等[43]从水库底泥筛选出此根瘤菌,发现其具有异养硝化-好氧反硝化作用在硝化过程中NO-3、NO-2并没有大量积累;Psedomonas属也被证实具有异养硝化-好氧反硝化功能[44];Bacillus属在降解有机物和氨氮方面具有极大潜力,另外也可以利用NO-2反硝化生成N2。

表5 细菌在属水平上的分布(仅列出了两组中占有比例较多的属)Tab.5 Taxonomic compositions of bacterial communities at the genus level
注:上述各菌属的特征描述来源于中、外文献和《伯杰细菌鉴定手册(第八版)》。
2.2.2.4 18S rDNA序列在属分类层面上的特征
真菌在N循环过程中扮演重要角色[52],酸性土壤中硝化作用的主要承担者包括真菌,反硝化真菌能够将NO-3、 NO-2还原为N2O,并可通过真菌协同反硝化作用产生N2,另外,菌根真菌在植物对N的吸收中也起到关键作用[53]。真菌能够在各种浓度O2供应条件下生存,高浓度时进行有氧呼吸,低浓度时进行NO-3呼吸,完全厌氧时进行氨发酵[54]。
通过高通量测序技术从微生物组获得46073条高质量序列,从空白组获得50580条高质量序列,经项目分析,微生物组真菌由25个属组成,空白组由23个属组成。相对丰度如图10,仅列出了样品中相对丰度大于0.2%和参与N循环的属。微生物组中优势类群为Penidiella、Gibberella、Phaeosphaeria、Coniochaeta、Inonotus、Talaromyces 、Botryotinia,相对丰度分别占真菌群落的31.37%、18.16%、17.85%、14.99%、9.28%、2.83%、2.67%。Gibberella属能在低氧压条件下利用复杂的ATP产能系统进行反硝化作用[55],Talaromyces属进行反硝化作用的产物除了N2O、更多为NO[56],两者累积占真菌总数的20.83%;此外,Penicillium、Kluyveromyces、Rhizopus、Alternaria、Fusarium等具有产生N2O能力的菌属也在微生物或空白组样品中检测到,Jirout等[57]也为Gibberella、Penicillium、Fusarium属在产生N2O方面具有极大的潜力提供了强有力的证明。

图10 真菌在属水平上的分布Fig.10 Taxonomic compositions of fungi communities at the genus level
根据上述分析可知,开始阶段培养液中DO和COD含量较高,虽然NH+4-N浓度大,但硝化细菌很难生存,而具有异养硝化/好氧反硝化功能的细菌属Rhizobium、Psedomonas、Bacillus可以在低pH环境下快速生长并进行硝化反硝化作用,NH+4-N浓度随之快速降低。同时发酵产酸细菌属Bacillus、Enhydrobacter对葡萄糖进行分解活动,产生中间酸类产物,造成溶液pH值和DO浓度快速降低,进而抑制Rhizobium、Psedomonas、Bacillus属的硝化反硝化作用,NH+4-N浓度因此降低缓慢,而此时细菌属Rhodanobacter和真菌属Gibberella、Talaromyces开始作用,进一步消耗NH+4-N,并将NO-3、 NO-2还原为N2和N2O,所以可发现在实验的第47~64 d,微生物组中NO-3、NO-2浓度都发生了降低现象,特别是NO-3。除此之外,由于微生物组含有可将NO-2氧化成NO-3的菌属Nitrospira、Leifsonia、Afipia,所以才有13~47 d时NO-3浓度上升的现象,而空白组不含这几类菌属且NH+4-N可能经过同步硝化反硝化产生气体而直接排走,所以没有生成NO-3。
3 结 语
(1)植物、微生物对NH+4-N浓度降低的贡献大小依次为:植物+微生物>植物>微生物组,降低量分别为25.01~39.97、11.88~39.96、4.62~8.97 mg,对应降低率为38.46%~55.39%、 32.90%~37.22%和4.53%~12.83%。植物+微生物、植物组主要通过反硝化作用和植物吸收来去除N,其中反硝化作用贡献最大,为49%~79%,植物吸收占15%~37%;而微生物组主要通过反硝化和同化作用来实现,分别为51%~62%、26%~36%。
(2)不同NH+4-N浓度下,植物+微生物组中植物对N的吸收量均大于植物组,且所有组茎、叶含N量之和大于根含N量;微生物同化作用利用N能力的大小:植物+微生物>微生物>植物组;反硝化作用能力大小:植物+微生物>植物>微生物组,植物和微生物达成了相互促进的关系。
(3)通过高通量宏基因组测序得到微生物组细菌包括16个门,105个属组成,其中Proteobacteria门最丰富,其次为Acidobacteria门,相对丰度分别占细菌群落的70.74%、26.72%,在属分类水平上优势类群有Burkholderia、Terriglobus、Rhodanobacter、Acidisoma和Rhizobium,相对丰度分别为30.78%、26.02%、23.56%、9.64%和1.37%,同时检测到Psedomonas、Bacillus属。Burkholderia属可以促进植物的生长,Rhodanobacter属是植物-微生物系统的优势脱氮菌,Rhizobium、Psedomonas、Bacillus属具有异养硝化好氧反硝化功能,具有自养硝化功能的Nitrospira属几乎不存在。微生物组真菌由25个属组成,其中相对丰度分别占群落18.16%、2.83%的优势菌Gibberella、Talaromyces能够进行反硝化作用产生N2O或NO,Penicillium、Kluyveromyces、Rhizopus、Alternaria、Fusarium等具有产生N2O能力的菌属也被检测到。
□
[1] 李 娜, 韩维峥, 沈梦楠, 等. 基于输出系数模型的水库汇水区农业面源污染负荷估算[J]. 农业工程学报, 2016,(8):224-230.
[2] Arhonditsis G, Tsirtsis G, Angelidis M O, et al. Quantification of the effects of nonpoint nutrient sources to coastal marine eutrophication: applications to a semi-enclosed gulf in the Mediterranean Sea[J]. Ecological Modelling, 2000,129(2-3):209-227.
[3] 唐双成, 罗 纨, 贾忠华, 等. 雨水花园对不同赋存形态氮磷的去除效果及土壤中优先流的影响[J]. 水利学报, 2015,(8):943-950.
[4] 丁程程, 刘 健. 中国城市面源污染现状及其影响因素[J]. 中国人口.资源与环境, 2011,(S1):86-89.
[5] Laurenson G, Laurenson S, Bolan N, et al. The Role of Bioretention Systems in the Treatment of Stormwater[M]. SPARKS D L. San Diego: Elsevier Academic Press Inc, 2013:223-274.
[6] 李立青, 尹澄清, 何庆慈, 等. 武汉市城区降雨径流污染负荷对受纳水体的贡献[J]. 中国环境科学, 2007,(3):312-316.
[7] 余德辉, 金相灿, 国家环境保护总局科技标准司. 中国湖泊富营养化及其防治研究[M]. 北京:中国环境科学出版社, 2001.
[8] 颜文涛, 韩 易, 何 强. 山地城市径流污染特征分析[J]. 土木建筑与环境工程, 2011,(3):136-142.
[9] 侯立柱, 丁跃元, 冯绍元, 等. 北京城区不同下垫面的雨水径流水质比较[J]. 中国给水排水, 2006,(23):35-38.
[10] 欧阳威, 王 玮, 郝芳华, 等. 北京城区不同下垫面降雨径流产污特征分析[J]. 中国环境科学, 2010,(9):1 249-1 256.
[11] 程 江, 杨 凯, 黄民生, 等. 下凹式绿地对城市降雨径流污染的削减效应[J]. 中国环境科学, 2009,(6):611-616.
[12] 刘 安, 管运涛, 刘 梁. 流域与降雨特征对城区径流水质的影响[J]. 清华大学学报(自然科学版), 2014,(7):846-852.
[13] 张跃峰, 刘慎坦, 谢祥峰, 等. 人工湿地处理农村生活污水的脱氮影响因素[J]. 江苏大学学报(自然科学版), 2011,(4):487-491.
[14] 张荣社, 李广贺, 周 琪, 等. 潜流人工湿地负荷变化对脱氮效果的影响研究[J]. 环境科学, 2006,(2):253-256.
[15] Geronimo F K F, Maniquiz-Redillas M C, Kim L H. Fate and removal of nutrients in bioretention systems[J]. Desalination and Water Treatment, 2015,53(11):3 072-3 079.
[16] 杨文斌, 李 阳, 孙共献. 穗花狐尾藻对外源~(15)N在水-沉积物界面迁移转化的影响[J]. 中国环境科学, 2015,(6):1 855-1 862.
[17] 张 鸿, 陈光荣, 吴振斌, 等. 两种人工湿地中氮、磷净化率与细菌分布关系的初步研究[J]. 华中师范大学学报(自然科学版), 1999,(4):575-578.
[18] 唐静杰, 成小英, 张光生. 不同水生植物—微生物系统去除水体氮磷能力研究[J]. 中国农学通报, 2009,(22):270-273.
[19] 成水平, 吴振斌, 夏宜琤. 水生植物的气体交换与输导代谢[J]. 水生生物学报, 2003,(4):413-417.
[20] 陆松柳, 胡洪营, 孙迎雪, 等. 3种湿地植物在水培条件下的生长状况及根系分泌物研究[J]. 环境科学, 2009,(7):1 901-1 905.
[21] Hatt B E, Deletic A, Fletcher T D. Stormwater reuse: designing biofiltration systems for reliable treatment[J]. Water Science and Technology, 2007,55(4):201-209.
[22] Henderson C, Greenway M, Phillips I. Removal of dissolved nitrogen, phosphorus and carbon from stormwater by biofiltration mesocosms[J]. Water Science and Technology, 2007,55(4):183-191.
[23] Payne E G I, Fletcher T D, Cook P L M, et al. Processes and drivers of nitrogen removal in stormwater biofiltration[J]. Critical Reviews in Environmental Science and Technology, 2014,44(7):796-846.
[24] 吴 伟, 胡庚东, 金兰仙, 等. 浮床植物系统对池塘水体微生物的动态影响[J]. 中国环境科学, 2008,(9):791-795.
[25] 隋 心, 张荣涛, 钟海秀, 等. 利用高通量测序对三江平原小叶章湿地土壤细菌多样性的研究[J]. 土壤, 2015,(5):919-925.
[26] Guo F, Zhang T. Profiling bulking and foaming bacteria in activated sludge by high throughput sequencing[J]. Water Research, 2012,46(8):2 772-2 782.
[27] 闫 媛, 黎 力, 王亚宜, 等. 采用高通量测序分析全程自养脱氮(CANON)系统不同脱氮效能下的微生物群落结构[J]. 北京工业大学学报, 2015,(10):1 485-1 492.
[28] 赵 光, 马 放, 孙 婷, 等. 基于高通量测序的寒地沼气池微生物群落解析[J]. 哈尔滨工业大学学报, 2014,(4):36-42.
[29] 刘 伟, 王腾蛟, 唐海琳, 等. 高通量细菌鉴定方法研究进展[J]. 微生物学通报, 2014,(12):2 501-2 509.
[30] 罗艳红. 雨水生物滞留设施对道路径流中氮磷的控制效果研究及应用[D]. 北京:北京建筑大学, 2013.
[31] 王文斗, 那冬晨, 赵浩华. 常春藤无土栽培试验[J]. 北方园艺, 2009,(12):187-188.
[32] 景丽洁, 袁东海, 王晓栋, 等. 水生植物总氮测定中两种消化方法的比较[J]. 环境污染与防治, 2005,(5):392-394.
[33] 罗泰来, 申亮亮, 柏银兰, 等. 分枝杆菌计数方法的比较研究[J]. 第四军医大学学报, 2007,(4):373-375.
[34] 卢少勇, 金相灿, 余 刚. 人工湿地的氮去除机理[J]. 生态学报, 2006,(8):2 670-2 677.
[35] 郭长城, 胡洪营, 李锋民, 等. 湿地植物香蒲体内氮、磷含量的季节变化及适宜收割期[J]. 生态环境学报, 2009,(3):1 020-1 025.
[36] 温东辉. 天然沸石吸附-生物再生技术及其在滇池流域暴雨径流污染控制中的试验与机理研究[M]. 北京:中国环境科学出版社, 2003.
[37] 庄源益, 戴树桂, 张明顺. 水中氨氮挥发影响因素探讨[J]. 环境化学, 1995,(4):343-346.
[38] 黄翔峰, 闻 岳, 何少林, 等. 高效藻类塘对农村生活污水的处理及氮的迁移转化[J]. 环境科学, 2008,(8):2 219-2 226.
[39] 蒋先军, 黄昭贤, 谢德体, 等. 硅酸盐细菌代谢产物对植物生长的促进作用[J]. 西南农业大学学报, 2000,(2):116-119.
[40] 王伏伟, 王晓波, 李金才, 等. 施肥及秸秆还田对砂姜黑土细菌群落的影响[J]. 中国生态农业学报, 2015,(10):1 302-1 311.
[41] Dias A C F, Andreote F D, Rigonato J, et al. The bacterial diversity in a Brazilian non-disturbed mangrove sediment[J]. Antonie van Leeuwenhoek, 2010,98(4):541-551.
[42] Prakash O, Green S J, Jasrotia P, et al. Rhodanobacter denitrificans sp nov., isolated from nitrate-rich zones of a contaminated aquifer[J]. International Journal of Systematic and Evolutionary Microbiology, 2012,62:2 457-2 462.
[43] 魏 巍, 黄廷林, 苏俊峰, 等. 1株贫营养好氧反硝化菌的分离鉴定及其脱氮特性[J]. 生态环境学报, 2010,19(9):2 166-2 171.
[44] 陈香琪, 李 科, 张利平. 异养硝化-好氧反硝化菌株的筛选及初步鉴定[J]. 河南农业科学, 2014,(3):59-64.
[45] Estrada-de Los Santos P, Vinuesa P, Martinez-Aguilar L, et al. Phylogenetic Analysis of Burkholderia Species by Multilocus Sequence Analysis[J]. Current Microbiology, 2013,67(1):51-60.
[46] Baik K S, Choi J S, Kwon J, et al. Terriglobus aquaticus sp nov., isolated from an artificial reservoir[J]. International Journal of Systematic and Evolutionary Microbiology, 2013,63:4 744-4 749.
[47] Belova S E, Pankratov T A, Detkova E N, et al. Acidisoma tundrae gen. nov., sp nov and Acidisoma sibiricum sp nov., two acidophilic, psychrotolerant members of the Alphaproteobacteria from acidic northern wetlands[J]. International Journal of Systematic and Evolutionary Microgiology, 2009,59:2 283-2 290.
[48] 罗小溪, 高建忠, 陈再忠, 等. 新型脱氮菌Rhizobium radiobacter的分离鉴定及其硝化特征分析[J]. 生物技术通报, 2015,(5):167-172.
[49] 孙 涛. 水的深度处理生物安全性及自养反硝化研究[D]. 北京:中国地质大学(北京), 2009.
[50] Staley J T, Irgens R L, Brenner D J. Enhydrobacter aerosaccus gen. nov., sp. nov., a Gas- Vacuolated, Facultatively Anaerobic, Heterotrophic Rod[J]. International Journal of Systematic Bacteriology, 1987,37(3):289-291.
[51] 孟 佳. 养猪废水厌氧消化液的亚硝化调控与功能微生物分析[D]. 哈尔滨:哈尔滨工业大学, 2013.
[52] Laughlin R J, Rutting T, Mueller C, et al. Effect of acetate on soil respiration, N2O emissions and gross N transformations related to fungi and bacteria in a grassland soil[J]. Applied Soil Ecology, 2009,42(1):25-30.
[53] Wilson G W T, Hartnett D C. Effects of mycorrhizae on plant growth and dynamics in experimental tallgrass prairie microcosms[J]. American Journal of Botany, 1997,84(4):478-482.
[54] Hayatsu M, Tago K, Saito M. Various players in the nitrogen cycle: Diversity and functions of the microorganisms involved in nitrification and denitrification[J]. Soil Science and Plant Nutrition, 2008,54(1):33-45.
[55] 黄 莹, 龙锡恩. 真菌对土壤N2O释放的贡献及其研究方法[J]. 应用生态学报, 2014,(4):1 213-1 220.
[56] 黄 灿, 何清明, 邬红东, 等. 真菌异化硝酸盐还原机理的研究进展[J]. 微生物学通报, 2009,(7):1 052-1 057.
[57] Jirout J, Simek M, Elhottova D. Fungal contribution to nitrous oxide emissions from cattle impacted soils[J]. Chemosphere, 2013,90(2):565-572.
