一种高盐废水去除硬度的方法及最佳工艺参数探讨
2017-03-15蒋小友刘斯勤
蒋小友,于 望,吴 军,刘斯勤
(揭阳市表面处理生态工业园有限公司,广东 揭阳 522000)
1 引言
目前我国水资源匮乏,污水再生利用是解决水资源短缺的重要战略和必要途径。但是污水成分复杂,除含有常规化学污染物外,还存在多种多样的微量有毒有害化学污染物和致色致臭物质。由于反渗透系统对污水中有机物、病原微生物、硝酸盐氮以及难降解有机物具有良好的去除效果,已逐渐在污水再生利用领域得到推广利用。反渗透系统在生产高质量再生水的同时,会有副产物RO浓水产生。RO浓水的水量通常占进水量的25%~50%,具体取决于RO系统的回收率[1]。随着世界范围内反渗透工艺使用范围和数量的不断扩大,RO浓水水量也不断增加,RO浓水的直接排放除了水资源浪费外,还会严重影响日益严峻的水环境系统。由于海水淡化反渗透和苦咸水脱盐反渗透历史较久,一些污水处理项目采用将反渗透浓水通过海水淡化反渗透及苦咸水脱盐反渗透进一步浓缩,提高污水的回用率同时也减少了浓盐水的排放,经过浓缩处理的浓盐水通过蒸发结晶实现资源化利用。但是浓盐水中的钙镁等物质会使蒸发器结垢,如果不采取预处理将会降低蒸发器的使用寿命同时也增大了运行劳动强度,本文以广东某电镀园区零排放项目为研究背景探讨浓盐水除钙镁的工艺及最佳工艺的运行参数。
2 工艺探讨
本文以阻垢剂法、石灰软化法、石灰纯碱软化法、混凝沉淀法、沸石法及氧化铝法为研究对象,探讨了浓盐水除硬度的工艺。
2.1 阻垢剂法
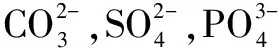
2.2 石灰软化法
石灰软化法是利用石灰去除水中二氧化碳及碳酸盐硬度并将镁的非碳酸盐硬度转变成相应的钙硬度。
为了避免生石灰的粉尘污染,本文实验采取将生石灰溶解水中形成氢氧化钙进行实验。方程式如下:
CaO+H2O=Ca(OH)2
Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2+Ca(HCO3)2=2CaCO3↓+2H2O
Ca(OH)2+Mg(HCO3)2=CaCO3↓+ MgCO3+2H2O
MgCO3+Ca(OH)2=CaCO3↓+ Mg(OH)2↓
形成的碳酸钙及氢氧化镁都是难溶物质,从水中沉淀析出。
2.3 石灰纯碱软化法
石灰纯碱软化法适用于硬度高、碱度低的水质,在投加石灰的同时补充适量的碳酸钠达到去除硬度的目的。反应如下:
CaSO4+Na2CO3=CaCO3↓+Na2SO4
CaCl2+Na2CO3=CaCO3↓+2NaCl
MgSO4+Na2CO3=MgCO3↓+2NaCl
MgCO3+Ca(OH)2=CaCO3↓+ Mg(OH)2↓
Ca(OH)2+Ca(HCO3)2=2CaCO3↓+2H2O
Mg(HCO3)2+2Ca(OH)2=2CaCO3↓+Mg(OH)2↓+2H2O
2.4 混凝沉淀法
混凝法的基本原理是在废水中投入混凝剂,因混凝剂为电解质,在废水里形成胶团,与废水中的胶体物质发生电中和,形成绒粒沉降。混凝沉淀不但可以去除废水中的粒径为10-6~10-3mm的细小悬浮颗粒,而且还能够去除色度、油分、微生物、氮和磷等富营养物质、重金属以及有机物等。
废水在未加混凝剂之前,水中的胶体和细小悬浮颗粒的本身质量很轻,受水的分子热运动的碰撞而作无规则的布朗运动。颗粒都带有同性电荷,它们之间的静电斥力阻止微粒间彼此接近而聚合成较大的颗粒;其次,带电荷的胶粒和反离子都能与周围的水分子发生水化作用,形成一层水化壳,阻碍各胶体的聚合。一种胶体的胶粒带电越多,其电位就越大;扩散层中反离子越多,水化作用也越大,水化层也越厚,因此扩散层也越厚,稳定性越强。按机理,混凝可分为压缩双电层、吸附电中和、吸附架桥、沉淀物网铺4种。本文选用铝矾土+PAM进行实验。
2.5 沸石法
沸石是一种含水的碱或碱土金属的铝硅酸盐矿物,是由硅氧四面体和铝氧四面体组成的架状硅酸盐。其铝氧四面体中氧原子有一价未得到饱和,整个铝氧四面体带有负电,由附近带正电的阳离子如K+、Na+、Ca2+、Mg2+等碱或碱土金属离子来补偿平衡。沸石晶格内部有很多大小均一的通道和孔穴,孔穴之间通过开口的通道彼此相连,并且与外界沟通,孔穴和孔道可占沸石晶格体积的30%以上,其中存在着许多可以脱附的水。沸石晶格中的K+、Na+、Ca2+等阳离子易与周围水中的阳离子发生交换作用,交换后沸石晶格结构不会被破坏。沸石可用做吸附剂、干燥剂、催化剂及洗涤剂。
2.6 氧化铝法
氧化铝吸附剂为白色球状多孔性颗粒,粒度均匀,表面光滑,机械强度大,吸湿性强,吸水后不胀不裂保持原状,产品无毒、无味、无臭,不溶于水及有机溶剂,氧化铝吸附剂具有许多毛细孔道,表面积大,可作为吸附剂、干燥剂及催化剂使用。同时还根据吸附物质的极性强弱来确定,对水、氧化物、醋酸、碱等具有较强的亲合力,活性氧化铝是一种微水深度干燥剂,也是吸附极性分子的吸附剂。
3 实验分析
3.1 实验水质:
本实验取用二级海水淡化膜后的浓盐水做为实验水,实验水在原水的基础上进行了约15倍的浓缩,浓盐水经过预处理后进更高压力的膜设备,在进高压膜设备之前需要进一步去除废水中的硬度,因为硬度太高,影响后续设备的正常运行;实验的水质情况详见表1。

表1 浓盐水水质
3.2 实验器材
实验所用的器材为:磁力搅拌仪,雷磁pH检测仪,哈希DR6000,电子天平及玻璃烧杯。
3.3 实验方法
在同等实验条件下各取100 mL浓盐水分别加入不同的药剂进行实验,探索同等条件下不同药剂对浓盐水中的硬度的影响,其中各种药剂的量都是过量,具体各种药剂的实验步骤如下。
(1)阻垢剂法去除硬度实验:取100 mL水投加过量反渗透阻垢剂溶液、控制pH值为10,磁力搅拌10 min,静止沉淀观察上清液情况并过滤后检测硬度。
(2)石灰软化法去除硬度实验:取100 mL浓盐水投加过量5%氧化钙溶液,静止沉淀观察上清液情况并过滤后检测硬度、控制pH值为10。
(3)石灰纯碱软化法去除硬度实验:取100 mL浓盐水投加过量5%氧化钙溶液后继续投加过量的5%碳酸钠溶液、控制pH值为10、磁力搅拌10 min,静止沉淀观察上清液情况并过滤后检测硬度。
(4)混凝沉淀法去除硬度实验:取100 mL浓盐水投加过量铝矾土固体加入适量的PAM溶液、控制pH值10、磁力搅拌10 min,静止沉淀观察上清液情况并过滤后检测硬度。
(5)沸石法吸附处理去除硬度实验:制作简易过滤柱,将沸石投入其中,控制流速0.3 L/h~0.5 L/h,处理100 mL浓盐水,反应结束后检测硬度、控制pH值为10。
(6)氧化铝法吸附处理去除硬度实验:制作简易过滤柱,将氧化铝投入其中,控制流速0.3 L/h~0.5 L/h,处理100 mL水样,反应结束后检测硬度、控制pH值为10。
3.4 结果与讨论
3.4.1 除硬度方法筛选
按照实验过程分别实验后,检测结果见表2。

表2 硬度检测数据
从表2中数据可知:阻垢剂法是使成垢阳离子形成螯合物,达到去除硬度的目的,去除率达到83.1%石灰软化法是把镁硬度转换成相应的钙硬度,总硬度没有得到很好的去除,去除率为23.4%;石灰纯碱软化法是利用石灰补充碱度投加碳酸钠,很好的使陈垢阳离子形成沉淀去除,使总硬度降低,去除率达到97.8%;混凝沉淀法主要去除胶体粒子及悬浮物,去除率19.9%,说明浓盐水中影响硬度的物质中胶体粒子少,从而去除率不高;沸石法是利用阳离子的交换作用去除硬度,去除率73.5%;氧化铝法的去除率32.6%,说明能被吸附的硬度不高;在同等实验条件下,石灰纯碱软化法的效果最好。
3.4.2 废水盐分对去除硬度的影响
在上述实验的基础上,在高盐分废水中去除硬度的方法是石灰纯碱软化法,针对筛选出来的方法是否具有推广意义,选取不同浓度的盐分的废水进行实验。各取100 mL废水,TDS分别为10000 mg/L、15000 mg/L、20000 mg/L、25000 mg/L、30000 mg/L、35000 mg/L、40000 mg/L,分别加入过量5%氧化钙溶液后继续投加过量的5%碳酸钠溶液,控制废水的PH10,采用磁力搅拌器匀速搅拌10分钟后静止,分层后分别取上清液检测硬度,数据如表3。
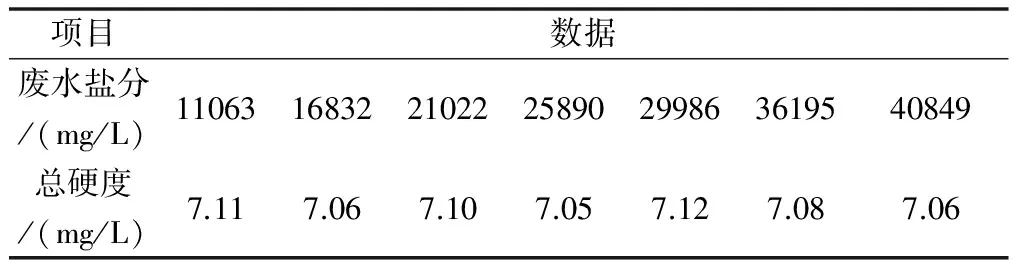
表3 硬度检测数据
从表3数据分析来看,实验的废水盐分从11063mg/L至40849 mg/L变化,在同等条件下,测试废水后的硬度变化不大,盐分对去除硬度没有影响。
根据上述实验可以得到,处理高盐废水去除硬度最理想的方法是石灰纯碱软化法,并且此方法不受废水盐分的浓度影响,能够稳定去除硬度。
4 最佳工艺运行参数探讨
根据上述实验确定了最佳工艺即石灰纯碱软化法,接下来探讨其最佳运行参数。
4.1 实验废水水质
废水水质见表4。

表4 废水水质情况
4.2 实验步骤
4.2.1 氧化钙投药量影响因素
取100 mL水样加6%氧化钙5 mL,反应完全测其上清液; 取100 mL水样加6%氧化钙5 mL,继续加5%碳酸钠9 mL,反应完全测其上清液; 取100 mL水样加6%氧化钙10 mL,反应完全测其上清液; 取100 mL水样加6%氧化钙10 mL,继续加5%碳酸钠9 mL,反应完全测其上清液; 取100 mL水样加6%氧化钙15 mL,反应完全测其上清液; 取100 mL水样加6%氧化钙15 mL,继续加5%碳酸钠9 mL,反应完全测其上清液; 取100 mL水样加6%氧化钙15 mL,反应完全测其上清液; 取100 mL水样加6%氧化钙15 mL,继续加5%碳酸钠9 mL,反应完全测其上清液; 数据见表2。
从表中数据可知:加入氧化钙会去除部分钙硬度及镁硬度,但是加入过量会导致结果升高,投加碳酸钠除去多余的氧化钙同时碱度提高,硬度的去除率也同时提高。适合本实验废水的最佳氧化钙投药量为100 mL废水需要0.6氧化钙。
4.2.2 碳酸钠投药量影响因素
在前文的基础上探讨碳酸钠的最佳投药量,实验过程如下: 100 mL废水投加6%氧化钙10 mL,继续投加5%碳酸钠6 mL,反应完全测其上清液; 100 mL废水投加6%氧化钙10 mL,继续投加5%碳酸钠9 mL,反应完全测其上清液; 100 mL废水投加6%氧化钙10 mL,继续投加5%碳酸钠12 mL,反应完全测其上清液; 100 mL废水投加6%氧化钙10 mL,继续投加5%碳酸钠15 mL,反应完全测其上清液。数据见表6。

表5 氧化钙加药量实验数据(在同一条件下实验,保持一个参数变化)

表6 碳酸钠投药量实验数据
从表中数据可知,在同等条件下,加5%碳酸钠12 mL,效果最佳。
4.2.3 最佳pH值影响因素
在前文的基础上确定最佳pH值反应条件。实验过程如下: 取100 mL原液调节pH到8.5,投加6%氧化钙10 mL,继续投加5%碳酸钠12 mL反应完全取其上清液进行检测; 100 mL原液调节pH到9.5,投加6%氧化钙10 mL,继续投加5%碳酸钠12 mL反应完全取其上清液进行检测; 100 mL原液调节pH到10.5,投加6%氧化钙10 mL,继续投加5%碳酸钠12 mL反应完全取其上清液进行检测; 100 mL原液调节pH到11.5,投加6%氧化钙10 mL,继续投加5%碳酸钠12 mL反应完全取其上清液进行检测,见表7。
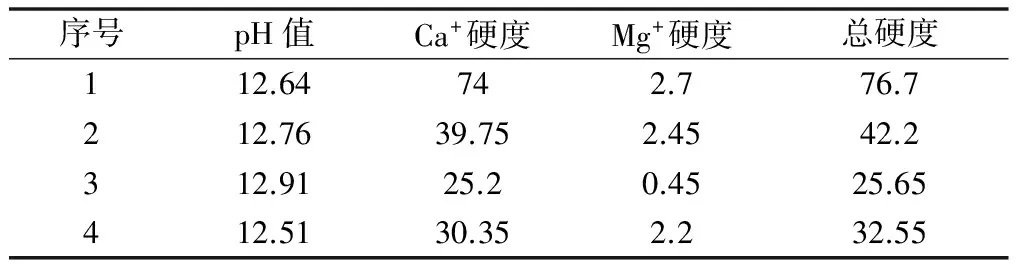
表7 最佳pH值实验结果
从表7中数据知最佳反应pH值为10.5。
5 结果与讨论
本文就高盐废水去除硬度的方法选择进行了筛选,并且探索了高盐废水盐分对去除硬度的影响因素,最终得出对于高盐废水去除硬度最理想的方法是石灰纯碱软化法,并且此方法不受废水盐分的浓度影响,能够稳
定去除硬度。同时探讨石灰纯碱软化法除硬度最佳运行参数,从实验数据知适合该电镀园区浓盐水最佳pH值为10.5,100 mL浓盐水需要0.6g氧化钙,0.6g碳酸钠。
[1]孙迎雪,胡洪营,高 岳,等.城市污水再生处理反渗透系统RO浓水处理方法分析[J].西南给排水,2010(6).
[2]曹 霞.去除水中硬度处理方法探讨[J].西南给排水,2011(11).
[3]杜春文,王 萍,刘雯文.BI沸石去除硬度与重金属离子的交换特性[J].甘肃科学学报,2016(7).
[4]蔡月圆,费学宁,苑宏英,等.浓盐水处理技术研究发展[J].环境科学与管理,2001(6).
