Axceed 260测定人血清中糖类抗原50性能验证
2017-03-13刘小萍林家坤文跃辉齐迅捷田云霞
刘小萍,林家坤,文跃辉,齐迅捷,刘 萍,田云霞,丁 军
(1、萍乡市中医院检验科,江西萍乡337000;2、博奥赛斯(天津)生物科技有限公司,天津300300;3、天津市医疗器械技术审评中心,天津300191)
Axceed 260测定人血清中糖类抗原50性能验证
刘小萍1,林家坤1,文跃辉1,齐迅捷1,刘 萍2,田云霞2,丁 军3
(1、萍乡市中医院检验科,江西萍乡337000;2、博奥赛斯(天津)生物科技有限公司,天津300300;3、天津市医疗器械技术审评中心,天津300191)
目的验证Axceed 260磁微粒全自动化学发光免疫分析系统(MCLIA)检测人血清中糖类抗原50(CA50)的分析性能。方法依照美国临床实验室标准化协会(CLSI)公布的EP15-A2、EP28-A3c、EP6-A、EP7-A2标准指南文件,对Axceed 260检测CA50项目的精密度、正确度、参考区间、线性范围、分析干扰进行验证。结果Axceed 260检测CA50项目的批内精密度、实验室内精密度变异系数分别为3.45~4.95%和3.35~4.64%;定值参考物测值在验证区间内;测定线性范围与厂商提供的范围一致;参考区间适用于本地区人群;与CA199,CA125无交叉反应;常规干扰物(胆红素(0.2mg/ml)、血红蛋白(5mg/ml)、甘油三酯(10mg/ml))对试剂盒无影响。结论Axceed 260磁微粒全自动化学发光免疫分析仪检测糖类抗原CA50的主要分析性能与厂家声明一致,适用于临床检测需求。
化学发光免疫分析;磁微粒;糖类抗原50(CA50);性能评价
Axceed 260全自动磁微粒化学发光免疫分析仪是本院检验科新引进的用于传染病、肿瘤标志物、肝纤维化等多种检测项目的分析系统。磁微粒化学发光免疫分析技术(magnetic particles chemiluminescence immunoassay,MCLIA)原理是用磁微粒作为分离固相,孵育反应过程后,在施加磁场的作用力下,通过洗涤将没有结合的游离蛋白与免疫夹心复合物分离,以酶催化化学发光体系作为检测体系,实现对待测抗原的测定[1]。该检测方法广泛的应用血清学检测以及食品中鸡蛋卵清蛋白含量的检测。
参照美国《临床实验室改进法规修正案》(CLIA'88)的要求,临床实验室应评估新引入的检验仪器和检验项目等检测系统的基本性能,与实验室的检测标准进行比对或与制造商所声明的性能对比,以验证该检测分析系统是否达到临床检测的要求。本文根据美国临床实验室标准化协会(CLSI)标准指南EP15-A2[2]、EP5-A2[3]、EP28-A3c[4]、EP6-A[5]、EP7-A2[6]从正确度、精密度、线性范围、参考区间等方面对Axceed 260检测CA50项目进行了性能评价。现在将结果报告如下。
1 材料与方法
1.1 仪器与试剂仪器Axceed 260磁微粒全自动化学发光免疫分析仪,来自博奥赛斯(天津)生物科技有限公司。
试剂仪器配套原装试剂CA50试剂盒(批号130327001)、高值质控品QcH(批号13032772-01)、低值质控品QcL(批号13032772-02)。伯乐质控购于伯乐公司(批号54600)。
样本来源收集样本来自2015年11-12月萍乡市中医院检验科体检者,溶血、黄疸、脂血等标本剔除。空腹静脉血采集后,分离出血清立即用于分析,或于4℃冰箱中保存(24h以内),长期(24h以上)存放应保存在-20℃以下,并避免反复冻融。
1.2 方法
1.2.1 仪器校准和室内质控每天对仪器进行维护保养和常规质控,每次实验时测定2个浓度水平的室内质控,质控在控条件下,实验数据方可接受。
1.2.2 精密度验证取博奥赛斯原装CA50项目的试剂,每天取低和高两个浓度的样本,在同一实验批次内进行3次重复测定,连续测定5d。每天静置复融时间一致。按EP15-A2文件进行实验数据的统计处理,计算批内不精密度(Sr)和实验室不精密度(Sl),以判断是否符合(不大于)说明书标注的不精密度水平,不符合时需进一步计算验证值并与Sr,Sl之比较。
1.2.3 正确度验证选择两个浓度水平的伯乐质控,分装5支,实验室回温30min,上下颠倒各一次混合均匀。与精密度评价试验同一实验批内,重复测定2次,连续进行5d。记录数据并按照EP15-A2文件中公式计算验证区间,如果计算的验证区间包含参考物定值,则通过正确度验证。
1.2.4 线性测量范围验证参照EP6-A2标准指南,设定临床实验室对CA50项目可接受的允许误差范围为5.0%,重复性可接受范围不得大于5.0%。选取接近厂商标明线性范围的上限和下限的高值样本(H)和低值样本(L),而后按照L、0.8L+ 0.2H、0.6L+0.4H、0.4L+0.6H、0.2L+0.8H、H配制成6组梯度样本,上述6组试验样品在检测系统中按随机顺序进行测定,每组样品测试两次。计算重复性(SDr)并在其符合设定要求的条件下,利用统计学软件进行多项式回归分析。将数据分别拟合为一次(Y=b0+b1X),二次(Y=b0+b1X+b2X2)和三次多项式(Y=b0+b1X+b2X2+b3X3),根据t检验判断非线性多项式(二次或三次)拟合数据是否比线性(一次)具有统计学意义,如果无统计学意义(P>0.05),则认为以上6组梯度浓度的检测范围成线性。否则该组数据存在非线性关系,需要计算线性偏差来进一步评价非线性度。
1.2.5 参考区间验证依照CLSI EP28-A3c[5]标准指南,选取健康体检者,年龄分布在18~70岁男性和女性血清标本各20例,按照检测系统常规的操作程序进行检测。判别标准:需要验证的参考区间是否包含随机选取的40例健康体检者测定值,若40例健康体检者测定值落在参考区间外的值不多于4个(R≥90%,R=落在参考区间例数/实验总例数),则表明本实验室可以直接利用制造商提供的参考区间。
1.2.6 携带污染率根据EP10-A2[7]推荐方法,选取高低值样本(H、L),将高值样本和低值样本分别连续测定3次(H1、H2、H3、L1、L2、L3),携带污染率计算公式为[(L1-L3)/(H3-L3)]×100%,其计算值小于0.5%为通过携带污染率的验证。
1.2.7 干扰实验
1.2.7.1 配对差异实验基础样本:依据EP7-A2,CA50选择20U/ml和100U/ml两个浓度的新鲜血清(无溶血、黄疸、和脂血)作为基础样本,重复测试10次,得到均值和批内标准差(s)。选用3种常用的干扰物质:胆红素、血红蛋白、甘油三酯。配制20倍浓储液(胆红素:4mg/ml;血红蛋白:100mg/ml;甘油三酯:200mg/ml),胆红素用二甲亚砜溶解,血红蛋白用工艺用水溶解,甘油三酯用乙醇溶解作为贮存液和相对应的溶剂作为空白液。用基础样本稀释空白液作为对照样本(T),分别稀释3种干扰物的贮存液作为测试样本(C),稀释后测试样本中胆红素、血红蛋白、甘油三酯的浓度分别是0.2mg/ ml;5mg/ml;10mg/ml。干扰物的添加量为样本中可能出现的最高浓度。
1.2.7.2 重测次数n的确定(95%置信区间)首先计算最大允许干扰值与批内标准差比值(dmax/s),查表1得出CA50两个浓度水平进行干扰物评价试验需要的重测次数(n)。本实验室设定CA50的临床可接受最大允许干扰值dmax为12.5%。
1.2.7.3 检测要求按照此顺序(C1T1C2T2C3T3C4T4C5T5…)交替检测测试样本(T)和对照样本(C)。如果检测系统受携带污染影响,可以按照在两次连续重复测定之间增加额外的样本(C1T1CXTXC2T2CXTXC3T3CXTXC4T4CXTXC5T5…)使检测系统免受来自测试样本携带污染的影响,试验结束后应舍弃增加的额外对照样本结果。
1.2.7.4 点估计将所获得数据进行干扰效应的“点估计”,即dobs(dobs=X检测-X对照)(测试样本均值和对照样本均值之间的差值),与临界值dc比较。如果点估计dobs≥dc,说明存在干扰。则需要进行干扰计量效应实验。如果dobs<dc,说明没有干扰,则不需要进行干扰计量效应实验。
1.2.8 交叉反应临床上对CA50有干扰作用的交叉反应物为糖类抗原15-3(CA15-3)和糖类抗原125(CA125)[8]。用CA50项目的试剂盒检测200U/ mL的糖类抗原15-3(CA15-3),500U/ml的糖类抗原125(CA125)样品,其测得结果是否超出CA50检测项目的检测限低值,如果未超过检测限低值,则表明没有交叉反应。
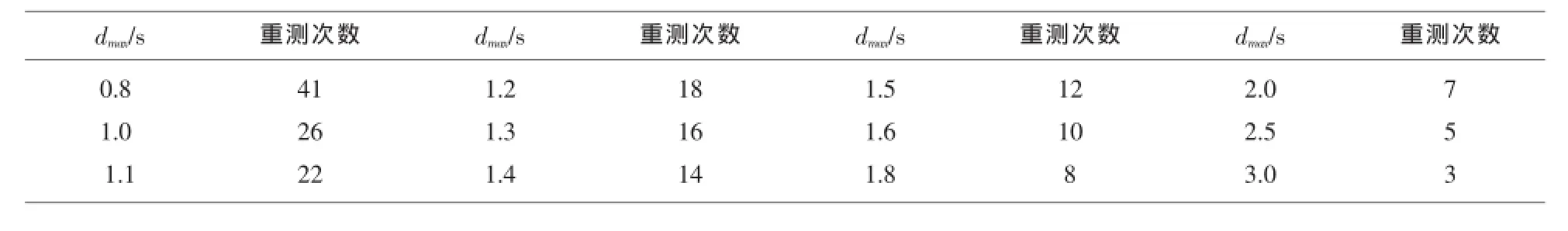
表1 dmax/s与重测次数对应表
2 结果
2.1 精密度试验验证CA50测定的不精密度见表2,两个水平浓度的不精密度均小于厂商声明的不精密度(厂商声明CA50浓度在5.0~200U/ml范围内批内不精密度(CV%)应不高于8.0%;总不精密度(CV%)应不高于15.0%)。
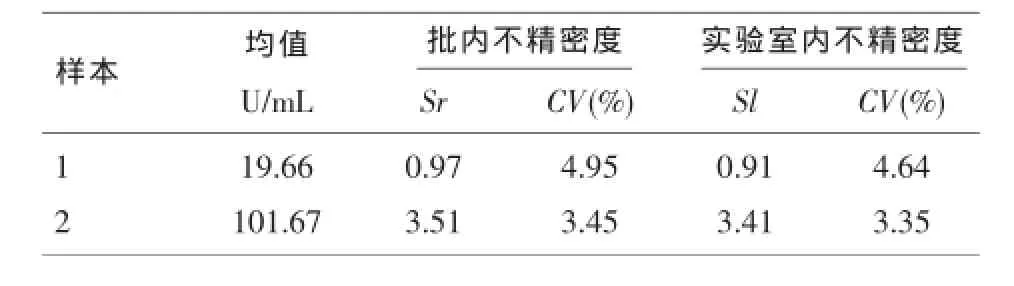
表2 CA50测定的不精密度
2.2 正确度验证结果两水平浓度的有值参考物在5d测定的均值以及按EP15-A2公式计算各均值的验证区间,两水平浓度的有值参考物其定值均包含在验证区间内。见表3。
2.3 线性验证结果CA50线性范围和6组梯度标本测定结果均值经计算重复检测方差(SDr)为1.7%,小于实验室设定允许范围5%。SPSS 13.0统计软件进行多项式回归分析,CA50项目指标b2、 b3与0比较差异均无统计学意义(P>0.05),验证的检测范围成线性,CA50线性方程为Y=1.0189X-1.0316,R2=0.9998(P<0.05)。该项目的试验线性范围与厂家声明的线性范围一致,通过线性验证。见表4、图1。

表3 正确度验证结果(U/ml)
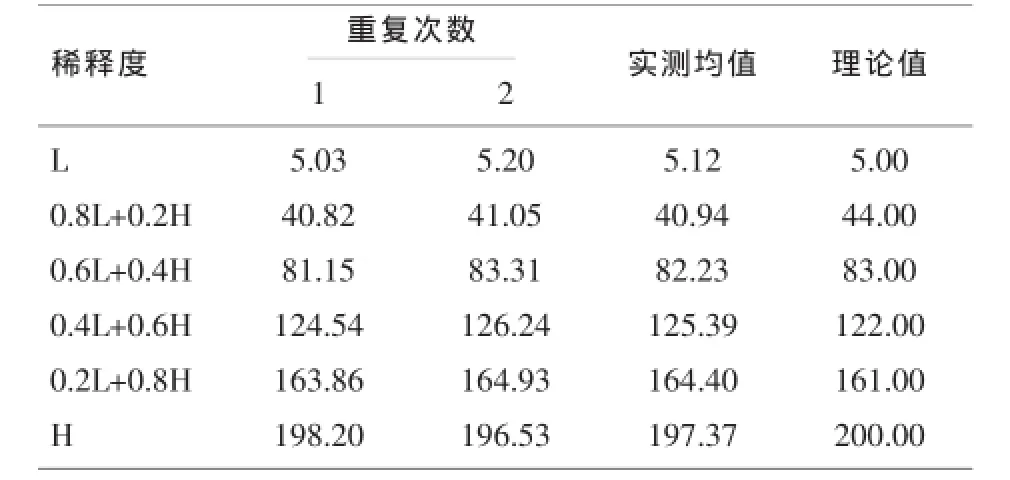
表4 CA50线性统计结果(U/ml)

图1 CA50的线性分析图
2.4 参考区间验证在本实验室中共检测40例健康体检者标本,40例标本测值结果均在厂家提供的参考区间之内,R=100%>90%。
2.5 携带污染试验结果携带污染率试验结果得到的污染率是0.42%,携带污染率小于0.5%为合格。见表5。

表5 携带污染试验结果(U/ml)
2.6 干扰筛选实验结果
2.6.1 重测次数的确定20U/ml基础样本重复10次测定CA50的均值为19.96U/ml、dmax为2.5、s为0.77;100U/ ml基础样本重复测定10次的均值为101.07U/ml、dmax为12.63、s为3.13。CA50两个浓度水平的dmax/s均>3。查表1可知,CA50两个浓度水平重测次数为3次。
2.6.2 干扰效应结果胆红素水平为0.2mg/ml时,利用全自动化学发光分析仪检测CA50,低浓度CA50的dobs和dc分别为-0.59和0.87(-dobs<dc),高浓度CA50的dobs和dc分别为-1.76和3.54(-dobs<dc),表明0.2mg/ml的胆红素水平对检测无干扰。5mg/ml血红蛋白水平时,低浓度CA50的dobs和dc分别为-0.75和0.87(-dobs<dc),高浓度CA50的dobs和dc分别为-2.34和3.54(-dobs<dc),表明5mg/ml血红蛋白水平对检测无干扰。10mg/ml甘油三酯水平时,低浓度CA50的dobs和dc分别为0.12和0.87(dobs<dc),高浓度CA50的dobs和dc分别为-2.69和3.54(-dobs<dc),表明10mg/ml甘油三酯水平对检测无干扰。
2.6.2 交叉反应检测200U/ml的糖类抗原15-3(CA15-3),500U/ml的糖类抗原125(CA125),其实测浓度值分别为0.29、0.32U/ml,均未高于检测低限0.32U/ml,表明对CA50检测结果无明显交叉反应。
3 讨论
恶性肿瘤严重威胁着人类健康,CA50是一种以唾液酸酯和唾液酸糖蛋白为主的广谱肿瘤相关抗原[9],临床广泛应用于恶性肿瘤的筛查、诊断及预后评估[10]。因此,血清中CA50检测对恶性肿瘤的诊断鉴别诊断具有重要意义[11]。为满足临床需要,本科室引进博奥赛斯(天津)生物科技有限公司Axceed 260全自动磁微粒化学发光法分析仪,此仪器说明书中提供的性能指标都是厂商在最佳条件下得到的参数,是通过其封闭检测系统来完成对CA50项目的检测,这与本实验室的的水质、实验操作条件、人员操作习惯等实际外部条件存在差异。因此,本实验室通过对肿瘤标志物CA50测定的性能分析,对该仪器的检测性能进行评价。
磁微粒化学发光技术的自动化程度高[12,13],减少了手工操作带来的人为误差。Axceed 260拥有30个冷藏试剂仓位、60个样本位、90个恒温反应位,检测速度可以达到每小时150管,无论是单个样本还是大量样本都可以进行快速检测,适用门诊和急诊,该方法在免疫分析中具有较好的应用前景,部分检测项目在逐步开展中[14,15]。
精密度反映分析过程中随机误差的大小。既是临床检验的方法评价,也是仪器性能评价的重要指标之一。美国临床实验室标准化协会(CLSI)关于精密度评价有EP5-A2及EP15-A2两个指南文件。EP5-A2文件适用于制造商建立新开发方法的精密度性能,EP15-A2则适用于临床实验室用最简单的方法对厂商提供的精密度性能的有效性进行确认。实验结果表明,本研究中Axceed 260检测CA50项目20U/ml和100U/ml低高两水平浓度的批内精密度CV分别为4.95%和3.45%,实验室内精密度的CV分别为4.64%和3.35%,均远小于说明书声明的批内精密度和实验室内精密度的要求8%和15%,显示Axceed 260检测CA50的精密度良好。按照CLSI的标准指南文件EP15-A2对CA50项目进行验证得到的批内精密度和实验室内精密度都与厂家声明的一致。
本实验室利用伯乐公司的标准质控品进行正确度的验证,符合EP15-A2标准指南对正确度评估的要求。本实验室的检测结果以及计算的验证区间包含有值参考物的定值,两个浓度水平的定值参考物均包含在验证区间内,顺利通过正确度验证,表明Axceed 260正确度性能符合临床检验要求。
线性范围验证实验所得到的结果呈良好的线性趋势。根据厂家提供的说明书,Axceed 260检测CA50项目的测量线性范围为5~200U/ml。本实验室检测CA50项目的在5.12~197.37U/ml浓度范围内的平均6组浓度水平呈良好的线性关系。研究验证的CA50检测项目的线性范围与厂家声明的基本一致。
本研究按照CLSI EP28-A3c标准指南,对CA50项目的生物参考区间进行验证。结果推荐的参考区间包括所有检测CA50项目的40例健康人群检测数据,符合标准指南的要求。故可以直接引用厂商提供的参考区间作为CA50检测项目的参考区间。检测系统的参考区间是制造商收集所在地区的人群进行统计得到的结果,其生活方式和饮食习惯等各类原因都存在着一定的地域的差别,可能会导致参考区间的不同。国产仪器制造商筛选适用人群统计的参考区间相对于进口仪器可能更加适合于本国内人群的使用。
携带污染是指检测结果可能受到其他标本的污染。Axceed 260在加入标本和试剂前会自动冲洗加样针,且标本检测时,一个项目一个独立的反应管,这将会极大限度降低样本间的携带污染率。本次验证的CA50项目污染携带率与厂家声明的一致,见表5,检测结果准确可靠。
干扰验证实验按照EP7-A2干扰筛选的方法评估临床实验室的主要干扰物(胆红素、血红蛋白、甘油三酯)。结果表明,Axceed 260的CA50试剂声明的胆红素(0.2mg/ml)、血红蛋白(5mg/ml)、甘油三酯(10mg/ml)对CA50检测结果无影响。与200U/ml CA153、500U/ml CA125没有交叉反应。
综上,Axceed 260磁微粒全自动化学发光分析仪检测CA50项目的方法学性能良好,能够为临床患者样本的检测提供准确可靠的检验结果,满足临床检测的性能要求。
[1]Fu X,Meng M,Zhang Y,et al.Chemiluminescence enzyme immunoassay using magnetic nanoparticles for detection of neuron specific enolase in human serum[J].Anal Chim Acta,2012,722:114-118.
[2]CLSI.User verification of performance for precision and trueness;Approved Guideline-Second Edition.CLSI document EP5-A2[S]. Wayne,PA:Clinical and laboratory Standards Institute;2005.
[3]CLSI.Evaluation of precision performance of quantitative measurement methods;Approved Guideline-Second Edition.CLSI document EP5-A2[S].Wayne,PA:Clinical and laboratory Standards Institute;2004.
[4]CLSI.Defining,Establishing,and Verifying Reference Intervals in the Clinical Laboratory;Approved Guideline-Third Edition.CLSI Document EP28-A3c[S].Wayne,PA:Clinical and Laboratory Standards Institute,2010.
[5]CLSI.Evaluation of the linearity of quantitative measurement procedures;Approved Guideline-Second Edition.CLSI document EP6-A[S].Wayne,PA:Clinical and laboratory Standards Institute;2003.
[6]CLSI.Interference testing in clinical chemistry;Approved Guideline-Second Edition.CLSI document EP7-A2[S].Wayne,PA:Clinical and Laboratory Standards Institute;2005.
[7]CLSI.EP10-A2 Preliminary Evaluation of Quantitative Clinical LaboratoryMethods;ApprovedGuideline-SecondEdition[S]. Wayne,PA,USA:CLSI,2004.
[8]强新晨,张晓峰,虞竟峰,等.CA50时间分辨荧光免疫分析法的建立及对肿瘤诊断的临床应用[J].肿瘤防治研究,2009,36(9):762-765.
[9]Pentti K,Caj H,Roberts PJ.Comparison of a new tumor marker CA242 with CA19-9、CA50 and carcinoembryonic antigen(CEA) in digestive tract disease[J].British J Cancer,1991,63(4):636-640.
[10]陶晓军,冯晓鸿,孙业富.CA72-4、CA19-9、CA50、CA242联合检测在胃癌诊断中的应用[J].实验与检验医学,2012,30(2):169-171.
[11]王自正.现代医学标记免疫学[M].北京:人民军医出版社,2000:58.
[12]刘海波,常虹,鲜尽江,等.磁微粒化学发光检测HBsAg试剂盒的研制及其临床应用[J].重庆医学,2008,37(9):981-982.
[13]朱小燕,黎兴盛,李智珍,等.磁微粒化学发光法在术前四项定量检测中的应用价值[J].实验与检验医学,2015,33(6):767-769. [14]郑国金,陈惠,应希堂,等.管式磁微粒化学发光免疫分析法测定玉米样品中的黄曲霉毒素B1[J].中国科学,2011,41(41):1177-1183.
[15]郑国金,方卢秋,陈慧,等.管式磁微粒化学发光免疫分析法测定人尿液中的雌三醇[J].分析化学,2011,39(1):62-66.
Performance of verification of Axceed 260(MCLIA)in detecting Carbohydrate antigen 50 in human serum
LIU Xiaop-ing1,LIN Jiakun1,WEN Yuehui1,QI Xunjie1,LIU Ping2,TIAN Yunxia2,DING Jun3△.1.Clinical Laboratory,Hospital of Traditional Chinese Medicine of Pingxiang,Pingxiang Jiangxi 337000,China;2.Bioscience(Tianjin)DiagnosticTechnology,Tianjin 300300,China;3.Center for Medical Device Evaluation.Tianjin 300191,China
Objective To verfiy the analytical performance of the full-automatic magnetic particles chemiluminescence immunoassay(MCLIA)system in the Axceed 260 analyzer for detecting Carbohydrate antigen 50(CA50).Methods The precision,accuracy,linear range,reference intervals and interference of MCLIA system in the detection of CA50 were evaluated according to the Clinical and Laboratory Standards Institute(CLSI)evaluation protocols including EP15-A2,EP28-A3c,EP6-A and EP7-A2 documents.Results The within-run precision and between-run precision experiment CV of CA50 were both less than 5%.The linear range was consistent with manufacturer’s claim.Verification interval including the assigned value of reference materials and reference intervals were suitable for the local crowd.There was no cross reactivity with a high concentration of Cancer Antigen15-3(CA15-3)and Cancer Antigen 125(CA125).No interferences were detected from bilirubin(0.2mg/ml),hemoglobin(5mg/ml)and triglycerides(10mg/ml).Conclusion The main analytical performance of the Axceed 260 analyzer in the detection of CA50 is consistent with manufacturer’s claim,which could be used for clinical laboratory routine testing.
Chemiluminescence immunoassay;Magnetic particle;Carbohydrate antigen 50;Performance evaluation
R446.62
A
1674-1129(2017)01-0009-05
10.3969/j.issn.1674-1129.2017.01.003
2016-08-26;
2016-11-30)
国家国际科技合作专项(2015DFA30420)。
刘小萍,1967年生,女,副主任技师,学士,主要从事临床检验工作。
丁军,主任。
