人羊膜间充质干细胞移植后慢性酒精性肝损伤大鼠血生化指标含量的变化
2017-03-13韩海燕宋文广崔云涛薛占国
韩海燕,宋文广,刘 锦,崔云涛,薛占国
(1.武警后勤学院附属医院检验科,天津 300162;2.武警后勤学院附属医院生殖医学研究中心,天津 300162; 3.大同市第五人民医院重症医学科,山西 037000)
研究报告
人羊膜间充质干细胞移植后慢性酒精性肝损伤大鼠血生化指标含量的变化
韩海燕1,宋文广2,刘 锦1,崔云涛1,薛占国3
(1.武警后勤学院附属医院检验科,天津 300162;2.武警后勤学院附属医院生殖医学研究中心,天津 300162; 3.大同市第五人民医院重症医学科,山西 037000)
目的 有研究表明人羊膜间充质干细胞(human amniotic mesenchymal stem cells,hAMSCs)具有多种分化和增殖功能,其可以诱导分化成肝样细胞,从而对肝损伤有一定的修复作用。方法 体外复苏培养人羊膜间充质干细胞,66只健康雌性 Wistar 大鼠,随机取22只,不做任何处理为正常对照组,余44只采用白酒灌胃30 d的方式建立大鼠慢性酒精性肝损伤模型,建模后将其随机分为模型组(尾静脉注射1 mL PBS),hAMSCs组(经尾静脉注入1 mL hAMSCs(2×106个),每组各22只。于移植后4周,采用全自动生化分析仪分别检测各组大鼠血清丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、血清总胆红素(TBIL)、血清白蛋白(ALB)、血清总蛋白(Tp);同时检测检测各组大鼠肝脏超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH- PX)、过氧化氢酶(CAT)、以及丙二醛(MDA)、IL- 4含量变化;免疫荧光显微镜观察PKH-26 标记的 hAMSCs分布情况,TUNEL法检测各组肝细胞凋亡情况。结果 各组大鼠血生化检测结果显示,与正常对照组比较,模型组中ALT、AST、TBIL、Tp含量均显著升高,而与模型组比较,hAMSCs移植组中ALT、AST、TBIL、Tp含量均显著下降(P<0.05),与正常对照组比较,模型组中ALB含量明显下降,而与模型组比较,hAMSCs移植组中ALB含量明显升高(P<0.05);与模型组比较,hAMSCs移植组SOD、GSH- PX、CAT含量均显著增高,MDA、IL- 4 含量均显著下降,与正常对照组比较,hAMSCs移植组SOD、GSH- PX、CAT含量均降低,MDA、IL- 4含量均升高(P<0.05);移植组可见移植的PKH-26 标记阳性的hAMSCs细胞分布于肝脏组织内,其余各组未见此类细胞分布(P<0.05);TUNEL法检测各组肝细胞凋亡可见凋亡细胞数,模型组最多(34.27±5.71),hAMSCs移植组次之(18.42±3.95),正常对照组未见凋亡细胞。结论 人羊膜间充质干细胞移植能够改善大鼠肝硬化的血生化指标水平,hAMSCs移植后可以减轻慢性酒精性肝损伤大鼠的肝脏细胞凋亡。
人羊膜间充质干细胞;大鼠;移植;修复作用;酒精性肝损伤;
酒精性肝损伤是一系列肝功能损害的总称,主要因长期大量饮酒引起,按照发病的不同阶段可分为肝脂肪变性→肝炎→肝纤维化,随着病情的逐渐加重最终发展成为肝硬化[1,2],其最主要的致病因素是长期过量饮酒,但同时还受包括环境因素、遗传因素在内的其他因素的影响[3]。慢性酒精性肝损伤是指肝功能损害病程需超过6个月,调查研究发现在2010年全球共有493 300 人死于酒精引起的肝硬化[4],人们精神及心理压力随着社会的发展逐渐增加,酒品的销量也相应增加,也因此慢性酒精性肝损伤的发病率逐年增高,成为影响人类健康的又一因素。戒酒为酒精性肝损伤进一步发展的最为主要的治疗方式,对于已经造成严重肝功能损害的患者,目前尚无有效的药物治疗,临床中多以支持治疗进行调节,但临床效果一般[5]
干细胞可以在特定条件下分化成为不同的组织[6-10],因此被广泛地用于各种疾病治疗的研究中,大量研究将干细胞移植运用于各种疾病的治疗中,试图依靠干细胞移植来解决先前存在的治疗方法无法解决的问题,并且已经取得了令人嘱目的进展[11-14],包括肝脏疾病的治疗[15-17]。在干细胞移植相关研究中不断地发现问题解决问题,使得相关研究逐渐深入,人羊膜间充质干细胞(human amniotic mesenchymal stem cells,hAMSCs)也逐渐走进我们的研究视野,hAMSCs不仅来源广泛,而且具有较强的分化能力及强大的增殖能力,这些特点使得hAMSCs成为继骨髓干细胞之后干细胞研究领域中的又一热点[18-20]。本文旨在利用hAMSCs的多种分化和增殖功能,观察其对肝损伤的修复作用。
1 材料和方法
1.1 主要材料及来源
PKH-26 体外标记试剂盒(产品编号 MINI26)(Sigma-Aldrich公司)、Konelab PRIME 30 型全自动生化分析仪(美国 Thermo 公司)、天冬氨酸氨基转移酶(AST)试剂盒(批号:20120626)、丙氨酸氨基转移酶(ALT)试剂盒(批号:20120625)、白蛋白(Alb)试剂盒(批号:20120607)、总蛋白(TP)试剂盒(批号:20120410)、超氧化物歧化酶(SOD)试剂盒(批号:20120628)、丙二醛( MDA)试剂盒(批号:20120514)、微量还原型谷肌甘肤(GSH)试剂盒(批号:20120621)均购自北京百奥莱博科技有限公司、freedom evolyzer 全自动酶免工作站(瑞士TECAN公司)、TUNEL 细胞凋亡原位检测试剂盒(北京中昊生物,批号 1103110)。
1.2 方法
1.2.1 建立大鼠模型及实验分组:将66只健康的Wistar 大鼠进行随机分组,分别为正常对照组,模型组,hAMSCs组,共3组,每组22只,分组后对各组动物进行不同处理,其中正常对照组不做任何处理,模型组各只大鼠经过43%白酒按照10 mL/kg·d剂量灌胃处理30 d,30 d后经尾静脉为各只大鼠注射PBS,剂量为1 mL,频率为每天1次,共注射4周;hAMSCs组的各只大鼠采用与模型组相同的方式、使用相同的白酒灌胃处理30 d,30 d后经尾静脉分别为各只大鼠注射1 mL hAMSCs,约2×106个hAMSCs细胞,频率为每天1次,共注射4周。实验动物生产许可证号:SCXK(津)2013-0021,实验动物使用许可证号:SYXK(津)2013-0001。
1.2.2 体外复苏培养人羊膜间充质干细胞: 从冰箱中取出储存在冻存管中冻存的hAMSCs(在天津医科大学总医院,经医院伦理委员会批准,批准(号:201458)并经家属同意,取产后弃置的完整胎盘组织,将羊膜层与绒毛膜层钝性分离,用含有双抗的平衡液反复冲洗,尽可能去除血污,用酶消化法从羊膜中分离和培养 hAMSCs,然后冻存备用。)将冻存管放置在37℃的水箱中进行水浴,使hAMSCs进行快速解冻并复苏,经过1 min解冻处理,hAMSCs已彻底解冻,1 min后将冻存管取出,将冻存管中的hAMSCs倒入培养瓶再取适量α-MEM培养基加入其中,将培养瓶放置在培养箱中培养,观察细胞生长情况,将培养箱的条件设置为37℃,含有5% CO2。
1.2.3 检测各组大鼠ALT、 AST、TBIL、ALB、Tp含量变化:于移植后4周后,分别从各只大鼠眼眶静脉取血,各组中不同大鼠采用相同的方法采血,采血量相同,把收集到的血液样本静置30 min,调整离心机为3 000 r/min状态,将收集的血液标本进行离心处理,10 min后取出离心管用胶头滴管取血清置于-20℃冰箱进行保存。使用全自动生化分析仪测定ALT、 AST、TBIL、ALB、Tp。具体操作按照相关说明书进行。
1.2.4 检测各组大鼠SOD、GSH- PX、CAT、MDA、IL- 4含量变化:于移植后4周后,分别将各组大鼠腹腔注射法麻醉后进行固定,用注射器针头进行心脏穿刺处死大鼠,取出肝脏并从中剪取部分进行反复冲洗后进行保存备用。检测时从液氮中取出肝脏迅速解冻,剪取肝脏同一部位肝组织200 mg,加入适量PBS液 (pH 7.4),匀浆后定容至2 mL,离心收取上清液,采用全自动酶免工作站检测SOD、GSH- PX、CAT、MDA、IL- 4含量的变化。
1.2.5 免疫荧光显微镜观察PKH-26 标记的 hAMSCs分布情况:用荧光染料PKH-26对hAMSCs进行标记,所有操作均严格按照相关说明书进行,具体操作步骤如下:取少量事先准备好的于培养瓶中进行贴壁生长达90%以上的细胞,加入胰酶消化细胞形成单细胞悬液,收集2×107细胞于离心管,向其中加1 mL稀释液C制备成细胞悬液保证细胞完全散离,染色前准备4×10-6mol/L的PKH-26染液,用稀释液C稀释后置于离心管,尽快加1 mL 2×细胞到1 mL 2×染料,立即用吸管均匀快速混合样品,为保证液体充分混合需过一段时间将离心管来回倒置数次,此过程孵育时长约为2 min。加入等量FBS中止染色反应,孵育1 min。400 r/min离心10 min,去上清液。用DMEM洗3次,然后调整细胞浓度至所需浓度。收集PKH-26标记后的hAMSCs注射入hAMSCs移植组及联合组大鼠体内,24 h后处死大鼠, 显微镜下观察PKH-26 标记的 hAMSCs分布情况。
1.2.6 TUNEL法检测各组肝细胞凋亡情况:于移植后4周,分别将各组大鼠腹腔注射法麻醉后,将大鼠进行固定,然后用注射器针头进行心脏穿刺将大鼠处死后,打开腹腔取出肝脏组织,经过石蜡包埋后进行切片处理,切片厚薄一致,约6 μm,将制备好的切片浸入1×PBS 3次;滴加100 μL proteinase K工作液。制阳性片,具体操作步骤如下,滴加100 μL DNase I反应液→浸入1×PBS三次(注:样本片和阴性片不加DNase I反应液)→加50 μL TdT酶,漂洗→标记、显色→透明、封片→观察。在高倍镜下随机选择3个视野进行观察并计算出细胞的凋亡情况,具体方法为计数200个细胞中阳性细胞数作为凋亡指数。
2 结果
2.1 人羊膜间充质干细胞形态观察
取冻存的h AMSCs进行复苏后接种于培养瓶中进行培养,接种浓度为1×105个/mL,24 h后培养瓶中可见少量细胞贴壁(图1A),随着时间的延长贴壁细胞数逐渐增多,48 h后差不多全部细胞均已贴壁,且贴壁较为牢固晃动培养瓶时不易脱离(图1B),显微镜下观察细胞形态时可见大部分细胞具有较为一致的形态,多呈梭形,呈旋窝状生长。
2.2 各组大鼠ALT、 AST、TBIL、ALB、Tp检测结果
采用全自动生化分析仪对各组大鼠血液中ALT、 AST、TBIL、ALB、Tp含量进行测定,将各组结果进行比较,结果显示,模型组与正常对照组相比,模型组中ALT、AST、TBIL、Tp含量均显著升高,而ALB含量则明显下降,而与模型组比较,hAMSCs移植组中ALT、AST、TBIL、Tp含量均显著下降,而ALB含量明显升高,差异有显著性意义。如表1。
2.3 各组大鼠肝脏SOD、GSH- PX、CAT、MDA、IL- 4检测结果
采用全自动酶免工作站检测各组中SOD、GSH- PX、CAT、MDA、IL- 4含量的变化,结果显示:将hAMSCs移植组与模型组相比,SOD、GSH- PX、CAT含量在hAMSCs移植组中显著增高,而相反MDA、IL- 4 含量则比模型组显著下降,与正常对照组比较,SOD、GSH- PX、CAT含量在hAMSCs移植组均降低,相反MDA、IL- 4含量均升高( P<0.05),见表2。
2.4 PKH-26 标记的 hAMSCs分布情况
以PKH-26 标记的 hAMSCs后将各组肝组织置于显微镜下进行观察,观察阳性细胞的分布情况,被标记成功的细胞显微镜下呈红色荧光,将各组观察结果进行比较时发现在hAMSCs移植组肝脏组织中绝大部分的 hAMSCs均有红色荧光,这说明该方法具有较好的标记敏感性,标记率高,而其余各组未见相似细胞出现(P<0.05),如图2所示。
2.5 细胞凋亡情况
如图3TUNEL 结果显示:正常细胞核不着色,当细胞凋亡后,细胞核呈棕黄色,形态也发生相应的改变,变得小而圆。将三组结果对比,模型组凋亡率升高,凋亡细胞数是3组中最多的为(34.27±5.71),hAMSCs移植组次之,凋亡细胞数为(18.42±3.95),在正常对照组(0.00±0.00)则没有发现凋亡的细胞。

表1 各组大鼠血液中ALT、AST、TBIL、ALB、Tp含量变化比较
注:P<0.05。 Note.P<0.05.

表2 各组大鼠肝脏组织中SOD、GSH- PX、CAT、MDA、IL- 4含量变化比较
注:P<0.05。Note.P<0.05.

图1A : 24 h后h AMSCs;图1B:48h后h AMSC图1 hAMSCs的形态观察(标尺=100 μm)Fig.1A:hAMSCs at 24 h;Fig.1B:hAMSCs at 48 hFig.1 Morphological observation of the hAMSCs(Bar=100 μm)
3 讨论
随着社会的发展,人民的精神压力、心理压力也逐渐增加,酒精的销量逐年增加,为人类的健康造成了严重的威胁[21-25]。饮酒后酒精主要在肝脏进行代谢,在肝脏内先后转化成为乙醛、乙酸,最终以二氧化碳及水的形式排除体外[26-27],当大量长期饮酒后,酒精的中间代谢产物在肝内大量蓄积,对肝脏造成慢性损伤,此外乙醛还能使肝细胞发生脂质过氧化反应破坏肝细胞结构以及诱导自身免疫反应,使肝细胞发生变性坏死[28]。
随着干细胞的相关研究越来越多,使其成为多个领域中的研究热点当然也包括肝损伤在内。大量研究显示干细胞可以在特定条件下分化成各种组织器官,这为多种疾病寻找新的治疗方案提供了新的思路。hAMSCs作为干细胞的另一个来源因其取材方便,来源广泛受到广泛关注,研究证实hAMSCs在体外可以稳定增殖传代,同样具有干细胞的特性,即具有高度分化的潜能。本实验即利用hAMSCs的本特点将其用于慢性酒精性肝损伤的治疗,观察其对肝损伤的修复作用。
本研究在建立慢性酒精性肝损伤模型后,为 hAMSCs组的各只大鼠经尾静脉注入 hAMSCs进行治疗,通过测定血生化判断 hAMSCs对肝损伤的修复作用。本研究主要从血生化及肝细胞凋亡情况来判断这种作用。首先在将各组血生化值进行相应比较时发现,将模型组与正常对照组的各项血生化值对比时,ALT、AST、TBIL、Tp含量在模型组中显著高于正常对照组,而ALB含量则相反是明显低于正常对照组的;其次比较hAMSCs移植组与模型组两组结果,ALT、AST、TBIL、Tp含量及MDA、IL- 4 含量在hAMSCs移植组中较模型组显著下降,而ALB及SOD、GSH- PX、CAT含量升高较为显著,以上比较差异均有显著性意义;hAMSCs移植组与正常对照组比较,hAMSCs移植组SOD、GSH- PX、CAT含量均降低,MDA、IL- 4含量均升高(P<0.05);此外研究还发现用PKH-26 标记的hAMSCs阳性细胞,在hAMSCs移植组可见移植细胞分布于肝脏组织,其余各组未见(P<0.05);而当采用TUNEL法检测各组肝细胞凋亡时可见其在模型组中是最多,正常对照组则没有发现凋亡细胞,hAMSCs移植组的细胞凋亡数介于二者之间。
综上所述:hAMSCs移植能够改善大鼠肝硬化的血生化指标水平,且可以减轻慢性酒精性肝损伤大鼠的肝脏细胞凋亡。本实验为大鼠大鼠肝硬化的实验研究提供了理论依据。

图2A:正常对照组;图2B:模型组;图2C:hAMSCs移植组图2 各组PKH-26 标记的 hAMSCs分布(标尺=100 μm)Note.A:Normal control group;B:Model group;C:hAMSCs groupFig.2 Distribution of PKH-26-labelled hAMSCs in each ±s)(Bar=100 μm)
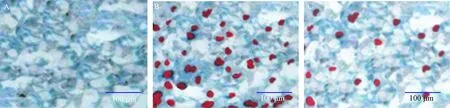
图3A:正常对照组;图3B:模型组;图3C:hAMSCs移植组图3 各组大鼠细胞凋亡变化(标尺=100 μm)Note.A:Normal control group;B:Model group;C:hAMSCs groupFig.
[1] Bruha R,Dvorak K,Petrtyl J A,et al.Alcoholic liver disease[J].World J hepatol,2012,4 (3) :81-90.
[2] 厉有名,范建高,土炳元,等.酒精性肝病诊疗指南[J].临床肝胆病杂志,2010,7 (3):229-232.
[3] Williams JA, Ding WX. A mechanistic review of mitophagy and its role in protection against alcoholic liver disease[J]. Biomolecules 2015, 5:2619-2642.
[4] Rehm J, Samokhvalov AV, Shield KD. Global burden of alcoholic liver diseases [J]. J Hepatol 2013, 59: 160-168.
[5] 王燕.酒精性肝损伤保护作用的研究进展[J].科技展望,2014, (20):221.
[6] Lindenmair A,Hatlapatka T, Kollwig G, et al.Mesenchymal stem or stromal cells from amnion and umbilical cord tissue and their potential for clinical applications[J]. Cells, 2012,1(4): 1061-1088.
[7] 胡泽斌,王立生,崔春萍,等.干细胞临床应用安全性评估报告[J].中国医药生物技术,2013,8(5):349-361.
[8] 何金秋,潘兴南,王崇国,等.自体骨髓间充质干细胞移植治疗终末期肝病 39 例[J].中国组织工程研究与临床康复,2010,14(45):8521-8525.
[9] Kharaziha P,Hellström PM,Noorinayer B,et al.Improvement of liver function in liver cirrhosis patients after autologous mesenchymal stem cell injection: a phase I-II clinical trial[J].Eur J Gastroenterol Hepatol,2009,21(10):1199-1205.
[10] 杨华强,张荣环,杜玲,等.脐带间充质干细胞移植治疗脊髓损伤的临床研究[J].现代生物医学进展,2012,12(3):518-521.
[11] Amable RP, Teixeira MV, Carias RB,et al.Protein synthesis and secretion in human mesenchymal cells derived from bone marrow, adipose tissue and Wharton’s jelly[J].Stem Cell Res Ther,2014,5(2): 53.
[12] de Girolamo L, Lucarelli E,Alessandri G, et al.Mesenchymal stem/stromal cells: a new “cells as drugs” paradigm. efficacy and critical aspects in cell therapy[J].Curr Pharm Des,2013,19: 2459-2473.
[13] 牟乐明,孙占胜,王伯珉,等.骨髓间充质干细胞移植对脊髓损伤大鼠Toll样受体4表达的影响[J].山东大学学报:医学版,2014,52(1):37-41.
[14] Sun ZM,Liu HL,Geng LQ,et al. HLA-matched sibling transplantation with G-CSF mobilized PBSCs and BM decreases GVHD in adult patients with severe aplastic anemia[J].J Hematol Oncol,2010,3: 51.
[15] Manuelpillai U,Moodley Y,Borlongan CV,et al.Amniotic membrane and amniotic cells: Potential therapeutic tools to combat tissue inflammation and fibrosis[J].Placenta,2011,32: S320-325.
[16] Takami T,Terai S,Sakaida I.Advanced therapies using autologous bone marrow cells for chronic liver disease[J].Discov Med,2012,14( 74): 7-12.
[17] Russo FP,Parola M.Stem cells in liver failure[J].Best Pract Res Clin Gastroenterol,2012,26(1) : 35-45.
[18] Kita K,Gauglitz GG,Phan TT,et al.Isolation and characterization of mesenchymal stem cells from the sub-amniotic human umbilical cord lining membrane[J].Stem Cells Dev,2010,19(4): 491-502.
[19] Perin L,Sedrakyan S,Giuliani S.Protective effect of human amniotic fluid stem cells in an immunodeficient mouse model of acute tubular necrosis[J].PLo S One,2010,5(2): e9357.
[20] Portmann-Lanz CB,Schoeberlein A,Portmann R,et al.Turning placenta into brain: placental mesenchymal stem cells differentiate into neurons and oligodendrocytes[J].Am J Obstet Gynecol,2010,202(3): 294. e1-294.e11.
[21] Mattson SN, Crocker N, Nguyen TT. Fetal alcohol spectrum disorders: Neuropsychological and behavioral features[J]. Neuropsychol Rev, 2011, 21(2): 81-101.
[22] Guerri C, Bazinet A, Riley EP. Foetal alcohol spectrum disorders and alterations in brain and behavior [J]. Alcohol 2009, 44(2): 108-114.
[23] Ahmed-Landeryou MJ. Fetal central nervous system development and alcohol—the evidence so far [J].Fetal Pediatr Pathol 2012, 31(6): 349-359.
[24] Wang J, Zhang Y, Zhang H, et al. Toxic effects of fluoride on reproductive ability in male rats: Sperm motility, oxidative stress, cell cycle, and testicular apoptosis [J]. Fluoride 2009, 42(3): 174-178.
[25] Laslett AM, Ferris J, Dietze P, et al. Social demography of alcohol-related harm to children in Australia [J]. Addiction 2012, 107(6): 1082-1089.
[26] 翟红梅,肖颖,肖霄,等.酒在人体内的代谢及酒精中毒[J]. 石家庄学院学报,2010,12(3):27-29.
[27] 周晓娟,王超.槲皮素对大鼠慢性酒精性肝损伤的保护作用[J].长江大学学报(自科版) 医学下旬刊,2013,10(11): 8-10.[28] 韵海霞,穆志龙,俞科贤,等.帕珠丸对慢性酒精性肝损伤大鼠肝组织SOD、CAT 活性及 MDA 含量的影响[J].青海医学院学报,2014,35(1): 57-59.
Changes of blood biochemical indexes in the rats with chronic alcoholic liver injury after transplantation of human amniotic mesenchymal stem cells
HAN Hai-yan1,SONG Wen-gGuang2, LIU Jin1, CUI Yun-tao1, XUE Zhan-guo3
(1. Department of laboratory medicine, The Affiliated Hospital of the Armed Police Ligistics College,Tianjin 300162, China;2.Research Center of Reproductive Medicine, the Affiliated Hospital of the Armed Police Logistics College, Tianjin 300162;3.Department of Care, Datong Fifth People’s Hospital, Shanxi 037000 )
Objective Studies have suggested that human amniotic mesenchymal stem cells (hAMSCs) have multiple differentiation and proliferation functions, and can be induced to differentiate into hepatocyte-like cells to repair the liver injury.Methods Human amniotic mesenchymal stem cell swere prepared by resuscitation of frozen cells. Sixty-six healthy female Wistar rats were divided randomly into normal control group (n=22) without any treatment,and rat models of chronic alcoholic liver injury(n=44) treated by gastric gavage of alcohol for consecutive 30 days. After modeling,22 of those 44 rats were randomly divided into model group (tail vein injection of 1 mL PBS), ad another 22 rats as hAMSCs group which received tail vein injection of 1 mL (2 ×106) hAMSCs.Four weeks after the transplantation, the rat serum alanine aminotransferase (ALT),aspartate aminotransferase(AST), total bilirubin (TBIL), albumin (ALB), total protein (TP)were detected by a full automatic biochemical analyzer, and the catalase (CAT), superoxide dismutase (SOD), glutathione peroxidase(GSH PX), malondialdehyde (MDA) and IL-4 content in the liver tissue were detected,the distribution of PKH-26 labeled hAMSCs was observed by immunofluorescence microscopy, and TUNEL staining was used to detect apoptosis in liver cells.Results The rat blood biochemical test showed that compared with normal control group, the serum content of ALT, AST, Tp and TBIL in the model group was significantly higher,compared with those of the model group; the serum contents of ALT, AST, TBIL and Tp in the hAMSCs transplantation group were significantly decreased(P<0.05), compared with hose of the normal control group. The content of ALB in the model group was significantly decreased, and the content of ALB in hAMSCs transplantation group was significantly higher (P<0.05)compared with those of the model group. The contents of SOD GSH- PX and CAT in the liver tissues were significantly increased in the hAMSCs transplantation group. The contents of MDA and IL-4 were decreased significantly, compared with those of the normal control group. The contents of SOD GSH- PX, CAT in the liver tissues were decreased in the hAMSCs transplantation group, and the content of MDA and IL-4 in the liver tissues were significantly increased(P<0.05). PKH-26-labeled positive hAMSCs cells were observed to be distributed in the liver tissue of the hAMSCs transplantation group but not in the liver tissue of other groups (P<0.05).TUNEL assay detected apoptotic cells in the liver of all model groups, with the highest number in the model group (34.27±571) and less in the hAMSCs transplantation group (18.42±3.95), but not found in the normal control group.Conclusions Human amniotic mesenchymal stem cell transplantation can improve the blood biochemical indexes of rats with cirrhosis, and hAMSCs can reduce the apoptosis in liver cells in rats with chronic alcoholic liver injury.
Human amniotic mesenchymal stem cells; Rat; Transplantation; Repair; Alcoholic liver injury
韩海燕(1983-),女;宋文广(1982-),男。研究方向:医学检验。E-mail: hanhaiyangyh@126.com。
薛占国(1983-),男,研究方向:重症医学。E-mail: weiyanxiahn@163.com。
R-33
A
1671-7856(2017) 02-0049-06
10.3969.j.issn.1671-7856. 2017.02.009
2016-09-09
