金花茶花丝愈伤组织培养及其对抗生素敏感性研究
2017-03-10黄丽丽张佩霞邹春萍孙映波
于 波,朱 玉,袁 霖,黄丽丽,张佩霞,邹春萍,孙映波
(1.广东省农业科学院环境园艺研究所/农业部华南都市农业重点实验室/广东省园林花卉种质创新综合利用重点实验室,广东 广州 510640;2.中华生物资源应用协会,台湾 宜兰 26047;3.广州市玉田山茶生物科技有限公司,广东 广州 510650)
金花茶〔Camellia chrysantha(hu)Tuyama〕,山茶科山茶属金花茶组植物,花金黄色,为我国国宝级植物之一,被列为我国一级保护植物,主要分布于我国广西和越南等地。《本草纲目》记载了金花茶药用功能,现代医学研究发现金花茶具有抑制肿瘤以及降血压、胆固醇等功效[1]。目前,金花茶产业化开发方兴未艾。金花茶组织培养研究始于20世纪80年代,在体细胞胚和愈伤组织诱导方面取得了很多重要研究进展,由子叶、幼胚及茎段培养获得了体细胞和愈伤组织[2-10]。近年来,人们研究了光源或培养基成分对金花茶愈伤组织中DFR(二氢黄酮醇4-还原酶)、LAR(无色花色素还原酶)与PPO(多酚氧化酶)表达及总儿茶素含量的影响[10];同时,还建立了金花茶组织培养和植株快繁体系[11-12],但仍然有待优化完善。目前,转基因技术已经成为主要粮食、油料、蔬菜和花卉作物的重要育种方法。山茶属植物转基因技术虽然已经在茶树(茶组植物)上获得了突破[13-24],但在包括金花茶在内的茶花上还未见报道。在目前金花茶组培技术仍未完善成熟的情况下,利用金花茶愈伤组织进行转基因的前期研究是一条可行的途径。本研究利用金花茶幼嫩花蕾进行体外培养,建立了花丝愈伤组织培养体系,在此基础上研究了卡那霉素和潮霉素对愈伤组织诱导和增殖培养的影响,为下一步开展金花茶转基因研究提供技术参考。
1 材料与方法
1.1 试验材料
供试金花茶种植于广东省农科院环境园艺研究所山茶种质资源圃。
1.2 试验方法
1.2.1 外植体表面消毒 试验于2015年1月开始进行,摘取刚刚金花茶露黄、但尚未开放的幼嫩花蕾,在超净工作台上用70%乙醇分别浸泡1、3、5、10、15 min,然后用灭菌水冲洗 3次,用刀片剥掉花瓣和萼片,取出雄蕊,将花丝和花药分别接种到诱导培养基上,25(±1)℃,暗培养。诱导培养基成分为MS+TDZ(0.25、0.5、1.0、2.0 mg/L)+2,4-D 1.0 mg/L,附加蔗糖 30 g/L、琼脂 5.0 g/L,pH 5.8,121℃高温高压灭菌20 min,冷却至60℃时在超净工作台上分装至无菌培养皿(直径9 cm)中。8周后,观察和统计不同消毒时间对金花茶花丝外植体污染和愈伤组织诱导等情况的影响,计算公式如下:
污染率(%)=(污染的外植体数÷接种的外植体总数)× 100
愈伤组织诱导率(%)=(诱导出愈伤组织的外植体数÷接种的未污染外植体总数)×100
1.2.2 愈伤组织增殖培养 用手术刀将金花茶花丝诱导获得的愈伤组织切割破碎成直径0.5 mm的组织块,转移至MS+TDZ 0.5 mg/L+2,4-D 1.0 mg/L+蔗糖30 g/L(pH 5.8)的培养基中进行增殖培养,培养条件为黑暗、25(±)1℃。培养基分装在无菌培养皿(直径9 cm)中,每皿分装25 mL并放置5块愈伤组织。培养4周后,观察愈伤组织增殖情况。
1.2.3 愈伤组织诱导和增殖培养过程对抗生素敏感性测定 分别在愈伤组织诱导和增殖阶段进行卡那霉素和潮霉素的敏感性试验。在固体培养基MS+TDZ 0.5 mg/L+2,4-D 1.0 mg/L+蔗糖30 g/L+琼脂 8.0 g/L(pH 5.8)中加入不同浓度梯度的抗生素,具体设置为:卡那霉素0(CK)、25、50、75、100、125、150 mg/L,潮霉素 0(CK)、5、10、15、20、25、30、35、40 mg/L。将花丝外植体和愈伤组织块接种到各种培养基上。愈伤组织诱导阶段的试验培养8周,记录和统计各个试验处理的外植体存活率和愈伤组织诱导率。愈伤组织增殖阶段试验培养4周,记录和统计各个试验处理的愈伤组织增殖率,计算外植体存活率和愈伤组织增殖率:
外植体存活率(%)=(存活的外植体数÷接种的外植体总数)× 100
愈伤组织增殖率(%)=(形成新愈伤组织数÷接种的愈伤组织总数)× 100
上述试验每个处理3次重复,每个重复50个外植体或愈伤组织块。
试验数据方差分析使用SAS V8.0软件,差异显著性测验采用邓肯氏(1955)多重比较。
2 结果与分析
2.1 金花茶外植体表面消毒和愈伤组织诱导培养
将花丝和花药外植体分别接种至愈伤组织诱导培养基上,暗培养8周后,统计花丝外植体在各个消毒处理中污染情况。结果表明,70%乙醇浸泡消毒1 min,外植体污染率最高、达58.7(±6.1)%;浸泡3 min时,污染率仍达35.3(±4.2)%;随着70%乙醇浸泡时间的延长,污染率逐渐下降,当乙醇浸泡5 min时,污染率下降至14.0(±4.0)%;乙醇浸泡10 min和15 min时,污染率均为0。各处理间差异显著。
两种外植体暗培养8周过程中,花药外植体表面全部褐化,没有形成愈伤组织(图1A,封二)。部分花丝外植体两端伤口部位膨大形成突起,逐渐形成愈伤组织(图1B,封二),这些愈伤组织呈乳白色至浅黄色、半透明状。不同TDZ和2,4-D组合培养基上花丝诱导愈伤组织观察结果表明,当培养基中2,4-D浓度固定在1.0 mg/L时,愈伤组织诱导率随着TDZ浓度的变化而不同:当TDZ浓度为0.25 mg/L时,愈伤组织诱导率为72.7(±3.1)%;当TDZ浓度为0.5 mg/L时,愈伤组织诱导率最高达100%;随着TDZ浓度的提高,愈伤组织诱导率逐渐下降,TDZ浓度为1.0 mg/L时诱导率为86.7(±4.2)%,TDZ浓度为2.0 mg/L时诱导率为62.0(±3.5)%。各处理间差异显著。
2.2 金花茶愈伤组织增殖培养
将诱导获得的愈伤组织切割破碎成直径0.5 mm的组织块,转移至新的培养基上继续培养,黑暗条件下培养4周后,所有愈伤组织块均明显增殖。连续多次继代培养后,愈伤组织颜色形态与初代愈伤组织保持基本相同,呈现乳黄色半透明状(图2,封二)。
2.3 金花茶愈伤组织诱导对卡那霉素和潮霉素的敏感性
卡那霉素和潮霉素对金花茶愈伤组织诱导阶段的影响如图3、图4所示。在不添加任何抗生素的对照组,金花茶外植体存活率和愈伤组织诱导率均达100%。添加卡那霉素或潮霉素对金花茶外植体存活和愈伤组织诱导均有不同程度的影响,并且随着抗生素浓度的提高其影响也越大。当卡那霉素浓度为25 mg/L或潮霉素浓度为5 mg/L时,外植体存活率分别为64.0%和79.3%,愈伤组织诱导率分别为55.3%和66.0%,随着两种抗生素浓度的提高,金花茶外植体存活率和愈伤组织诱导率明显下降,当卡那霉素浓度达75 mg/L或潮霉素浓度达20 mg/L时,花丝外植体上不再形成愈伤组织,卡那霉素100 mg/L或潮霉素30 mg/L条件下花丝外植体全部死亡。
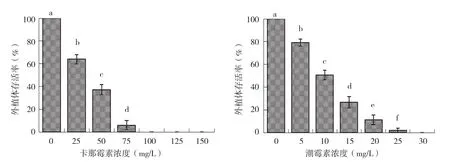
图3 卡那霉素和潮霉素对金花茶外植体存活率的影响

图4 卡那霉素和潮霉素对金花茶愈伤组织诱导率的影响
2.4 金花茶愈伤组织增殖培养对卡那霉素和潮霉素的敏感性
从图5可以看出,在不添加任何抗生素的对照组,金花茶愈伤组织增殖率均达100%。当卡那霉素浓度为25 mg/L或潮霉素浓度为5 mg/L时,愈伤组织的增殖率分别为60.7%和68.7%。随着两种抗生素浓度的提高,愈伤组织增殖率明显下降。当卡那霉素浓度为100 mg/L或潮霉素浓度为25 mg/L时,金花茶愈伤组织的增殖被完全抑制,最终全部褐化死亡。

图5 卡那霉素和潮霉素对金花茶愈伤组织增殖率的影响
3 结论与讨论
目前,在山茶属植物愈伤组织诱导研究中多数采用叶片、茎段和茎尖等[25-28],本研究采用幼嫩花蕾中的花丝为外植体,高频率的诱导获得了愈伤组织。包括茶花在内的山茶属植物组织培养以往通常采用酒精和升汞配合使用进行外植体表面消毒[25-28],步骤较繁琐,本研究采用金花茶刚刚露黄的幼嫩花蕾进行组培研究,取得较好的效果。由于此时花序尚未打开,花蕾由花瓣和萼片紧紧包裹,故表面消毒剂只采用70%乙醇。结果表明,70%乙醇浸泡10 min即可达到理想的消毒效果。本研究不仅简化了表面消毒操作步骤,还避免了使用氯化汞等剧毒试剂可能带来的风险。
山茶属转基因研究报道主要集中于茶树(茶组植物)[14-25],茶花上还未见转基因成功的报道。已有报道中,转基因的选择剂多数采用卡那霉素或超霉素。在转基因筛选阶段,卡那霉素浓度一般在30~200 mg/L,潮霉素浓度一般在10~75 mg/L。本研究在金花茶花丝愈伤组织诱导阶段,卡那霉素100 mg/L或潮霉素30 mg/L导致花丝外植体全部褐化死亡;卡那霉素75 mg/L或潮霉素20 mg/L能够抑制愈伤组织从花丝外植体上产生。在愈伤组织增殖阶段,卡那霉素100 mg/L或潮霉素25 mg/L则能够完全抑制愈伤组织的增殖,并导致最终褐化死亡。金花茶的花丝外植体或愈伤组织对两种抗生素均表现出一定敏感性,且无论是愈伤组织诱导阶段还是增殖阶段,金花茶对潮霉素均更加敏感,因此,今后金花茶转基因研究中使用潮霉素时要严格掌握工作浓度。
综上所述,本研究利用金花茶幼嫩花丝成功建立了愈伤组织诱导和增殖培养体系,在此基础上,研究了不同培养阶段金花茶对卡那霉素和潮霉素的敏感性,为下一步开展金花茶转基因研究提供重要技术参考。
[1]叶创兴.关于金花茶学名更替小记[J]. 广西植物,1997,17(4):309-313.
[2]庄承纪,梁汉兴. 金花茶子叶在离体培养中胚状体的发生和小植株的形成[J]. 云南植物研究,1985,7(4):446-457.
[3]程金水,熊和平. 金花茶胚和子叶离体培养诱导植株的研究[J]. 北京林业大学学报,1986,8(3):31-33.
[4]廖汉刃,周传明,董学军,等. 金花茶组织培养及其试管苗嫁接繁殖试验初报[J]. 广西农业生物科学,1987(2):66-71.
[5]彭艳华,庄承纪,段金玉. 金花茶胚状体中游离氨基酸含量及花氨酸、丝氨酸对胚状体发育的影响[J]. 武汉植物学研究,1990,8(3):268-272.
[6]郭玉琼,赖钟雄,郭志雄,等. 茶树生物技术研究进展[J]. 福建农林大学学报(自然科学版),2002,31(4):470-475.
[7]林莉,赖钟雄,周双珠,等. 金花茶离体培养研究 Ⅰ. 茎段不定芽诱导与增殖[J]. 福建农林大学学报(自然科学版),2003,32(S):191-193.
[8]林莉,赖钟雄. 金花茶离体培养研究:次生胚的增殖//陈振光,赖钟雄,杨柏云,等. 植物组织培养与试管育苗[M]. 北京:中国农业科学技术出版社,2004.
[9]林莉. 金花茶离体培养研究[D]. 福州:福建农林大学,2005.
[10]钟春水,赖瑞联,刘生财,等.光源或培养基成分对金花茶愈伤组织中DFR、LAR与PPO基因表达及总儿茶素含量的影响[J]. 广西植物,2016,36(12):1410-1415.
[11]林茂,杨舒婷,唐庆,等. 金花茶离体培养体系的建立[J]. 南方农业学报,2017,48(3):475-480.
[12]李桂娥,李志辉,罗燕英,等. 金花茶组培快繁体系的建立[J]. 农业科学研究,2017,38(3):17-20,24
[13]林莉,赖钟雄. 金花茶成年树茎段离体器官发生[J]. 亚热带农业研究,2005,1(4):25-29.
[14]黄小荣. 金花茶种质资源离体培养保存的研究[D]. 南宁:广西大学,2005.
[15]Prashant M,Vinay K,Paramvir SA,et al.Agrobacterium-mediated silencing ofCaffeine ynthesisthrough root transformation inCamellia sinensisL[J]. Molecular Biotechnology,2011,48:235-243.
[16]Jeyaramraja P R,Nithya M. Agrobacterium tumefaciens-mediated transformation of embryogenic tissues of tea〔Camellia sinensis(L.)O. Kuntze〕[J]. Plant Molecular Biology Reporter,2006,23:299-300.
[17]Mondal T K,Bhattacharya A,Ahuja P S,et al. Transgenic tea〔Camellia sinensis(L.)O. Kuntze cv. Kangra Jat〕 plants obtained byAgrobacterium-mediated transformation of somatic embryos[J]. Plant Cell Reports,2001,20:712-720.
[18]Sandal I,Saini U,Lacroix B,et al.Agrobacterium-mediated genetic transformation of tea leaf explants:effects of counteracting bactericidity of leaf polyphenols without loss of bacterial virulence[J]. Plant Cell Reports,2007,26:169-176.
[19]Mohanpuria P,Rana N K,Yadav S K. Transient RNAi based gene silencing of glutathione synthetase reduces glutathione content inCamellia sinensis(L.)O. Kuntze somatic embryos[J]. Biologia Plantarum,2008,52(2):381-384.
[20]骆颖颖,梁月荣. Bt基因表达载体的构建及对茶树遗传转化的研究[J]. 茶叶科学,2000,20(2):141-147.
[21]吴姗,梁月荣,陆建良,等. 基因枪及其与农杆菌相结合的茶树外源基因转化条件优化[J].茶叶科学,2005,25(4):255-264.
[22]项威,史成颖,贺志荣,等. 根癌农杆菌介导茶树转基因体系的建立[J]. 安徽农业大学学报,2012,39(5):721-724.
[23]奚彪,刘祖生,梁月荣,等. 发根农杆菌介导的茶树遗传转化[J]. 茶叶科学,1997,17(S):155-156.
[24]赵东,刘祖生,陆建良,等. 根癌农杆菌介导茶树转化研究[J]. 茶叶科学,2001,21(2):108-111.
[25]汪结明,周倩,李瑞雪. 不同激素配比对诱导栓壳红山茶愈伤组织的影响[J]. 中国农学通报,2011,27(13):112-115.
[26]杨国伟,兰蓉,王晓杰,等. 茶树愈伤组织诱导和组织培养[J]. 江苏农业科学,2006(4):122-126.
[27]黄莉雅,张日清,马锦林,等. 不同培养条件对油茶愈伤组织和芽诱导的影响[J]. 安徽农业科学,2010,38(4):1718-1719,1740.
[28]刘亚军,王正荣,王婕,等. 茶树愈伤诱导及不同儿茶素含量细胞系筛选[J]. 安徽农业大学学报,2014,41(4):564-568.
