原子力显微镜在纤维素研究中的应用
2017-03-08杨海艳郑志锋马建锋史正
杨海艳, 郑志锋, 王 堃, 马建锋, 史正
(1.西南林业大学 材料工程学院, 云南 昆明 650224;2.北京林业大学 材料科学与技术学院,北京 100083;3.国际竹藤中心, 北京 100102)
原子力显微镜在纤维素研究中的应用

YANG Haiyan
(1.西南林业大学 材料工程学院, 云南 昆明 650224;2.北京林业大学 材料科学与技术学院,北京 100083;3.国际竹藤中心, 北京 100102)
原子力显微镜(AFM)作为一种重要的表面成像技术,可在不同工作模式(接触式、非接触式和敲击式等)下通过对探针与样品表面作用力的监测表征纤维素及其衍生物的大分子结构特征和纤维素材料的表面形态特征。通过AFM观测发现:在结构上天然纤维素以纤维二糖为重复单元,结晶区内单斜晶系和三斜晶系紧密相关并以1/4重复单元的错位排列;在细胞壁中,微纤丝之间通过半纤维素相连形成网状结构,且分子微细结构随植物种类、细胞壁区域的不同而变化。在纤维素的应用研究中, AFM对纤维素基材料的研究起到了有效的推动作用,为纸浆性能的提高、纸张保存、材料制备中反应历程和机理的探索提供了理论依据。
原子力显微镜;纤维素;细胞壁;结构;应用
世界范围的环境恶化和能源紧缺问题吸引了越来越多学者关注生物质资源的研究与开发利用,并致力于将生物质转化为可取代化石资源的能源和化工原料产品。纤维素是生物质资源中最重要的一类天然高分子化合物,在植物细胞壁中的质量分数可达35%~50%[1],来源广泛,储量丰富,常常作为原料被广泛地应用于纺织工业、食品工业以及医药行业,因此,对纤维的结构研究十分重要。对高分子化合物结构研究的先进技术,目前主要有核磁共振波谱(NMR)、X射线衍射(XRD)、扫描电子显微镜(SEM)和透射电子显微镜(TEM)等等,但是这些技术的操作条件苛刻或样品制备过程复杂,并不利于天然高分子化合物在生理状态下的结构表征。原子力显微镜(AFM)是扫描探针显微镜(SPM)的一种,可在固体状态下或溶液中通过探针与样品表面作用力的监测进行样品表面形态、分子结构的分析。20世纪80年代后期,AFM开始应用于生物学中测定蛋白质、磷质生物膜和DNA等大分子的形态特征[2-4],发展至今,AFM已可以将天然大分子生理状态下的结构研究推进到一个动态的纳米水平。AFM的这些发展,无疑为致力于纤维的微观结构研究的学者们提供了一种更为简洁有效的分析工具。由于植物化学成分的结构复杂,AFM在纤维素方面的研究还远远落后于其它生物材料。本文对AFM工作原理、天然纤维素和细胞壁纤维素在AFM下的形态,以及纤维素应用研究中AFM的作用进行总结,以期为AFM应用于纤维素的研究,进一步高效开发、合理利用纤维素提供充实的理论依据。
1 原子力显微镜(AFM)工作原理
原子力显微镜(AFM)是表面成像技术中重要的进展之一,其工作原理如图1所示[5]。AFM通过光栅扫描带有微小探针的弹性悬臂来获得信息。探针针尖原子与样品表面原子的相互作用力使悬臂产生偏差,并被光学检测器记录成像,但这个垂直偏差最大只有6 nm,超过这个范围则不能使用AFM成像。
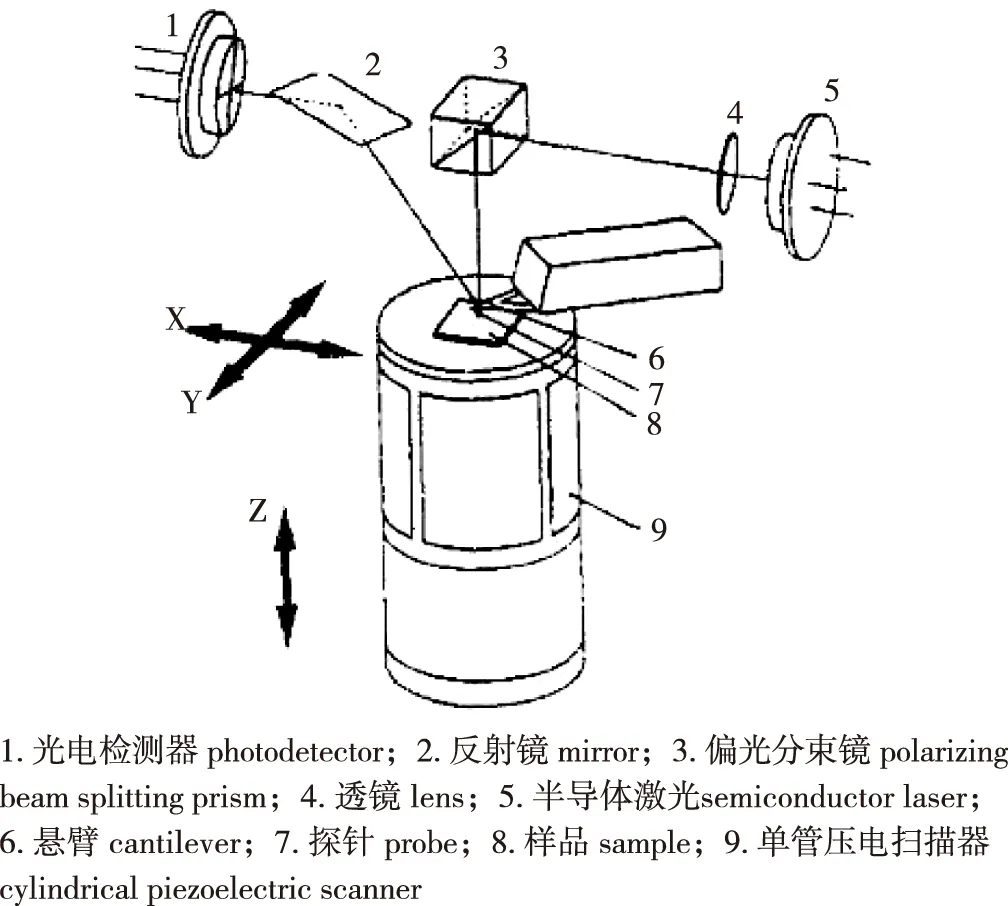
图1 AFM原理图[5]Fig.1 General principle of AFM[5]
根据样品与探针的接触情况,AFM的工作模式分为:接触式、非接触式和敲击式等,其中接触式应用最为广泛。在接触模式下,样品表面的形态特征可以采用2种扫描方式来构建,恒高式即恒定高度下样品以表面与探针相互作用力的变化来表征样品表面形态;恒力式即在恒定压力下以样品与探针之间的距离变化来表征样品的表面形态。在成像过程中,检测器与探针之间一直保持着连接,因此具有较高的分辨率,但会引起探针的磨损、污染以及低弹性样品表面划痕,同时还会由于环境中的水分在样品和探针之间形成毛细力,引起粘合力的明显提高而影响成像效果,甚至对软性生物大分子造成损坏。流动池的发明解决了环境中水分对成像效果的影响,使AFM在生物学上的应用得到了突破。通过使用流动池,可以在有水环境,或者模拟的生理环境中对生物分子进行AFM检测,同时还能通过改变盐的浓度来研究其对构象迁移产生的影响。
AFM的另一大重要突破就是非接触模式的应用,此项技术在高分子聚合物和生物大分子的结构研究中应用广泛。在非接触模式下,探针始终保持在样品上方,两者之间的作用力为范德华力,远小于接触模式下的排斥力,因此具有更高的灵敏度,但分辨率较低,且不适用于液体环境成像[6]。在敲击模式和磁振荡模式下,悬臂在扫描样品的同时垂直振荡,使探针与样品间歇性地接触,并记录产生的摩擦力和横向力,测量多糖分子或生物分子时,即使产生的力很小,也能被记录并用于成像。此外,AFM通过探针的受力(样品表面的范德华力、静电力、氢键作用力和分子剪切力等)与位移的关系,还可以为样品提供大量的物理性能参数[7],如黏弹性、表面张力、电势电位等,这些性能参数为天然高分子在更多领域的应用提供了可靠的理论依据。
虽然AFM在一些方面还存在着缺陷,如尖锐的探针在使用的过程中变钝而影响其灵敏度须经常更换;尖锐探针的固有宽度会产生“扩展效应”,使小于针尖物质的测量值偏大[8];测量一些黏度较大的物质时,易引发针尖的污染而影响成像质量,但AFM是基于原子之间的相互作用力而成像,这就使得操作条件能够不受环境限制,同时也降低了对样品的要求。而且,通过AFM可以得到皮牛顿级分辨率的作用力信息,以及纳米级分辨率的图像信息,能够为各种化合物尤其是大分子的结构形态研究提供可靠的依据。
2 AFM在纤维素研究中的应用
2.1 天然纤维素
2.1.1 纤维素大分子结构 纤维素是D-葡萄糖分子通过β-1,4-糖苷键连接而成的聚合物,由不同聚合度的分子组成,大量的羟基在分子间、分子内形成复杂的氢键连接使纤维素聚集成为结晶区和非结晶区的交错结合体系。天然纤维素的结晶格子常被称为纤维素I,每个结晶区(微晶体)长度约100~200 nm。在天然纤维素的结晶区中存在着两种形态,即:单斜晶系(Iβ)和三斜晶系(Iα),其分子内、分子间氢键的连接模式如图2所示[9-10]。

图2 Iα和Iβ纤维素分子内和分子间的氢键连接模式[9-10]Fig.2 Hydrogen-bonding patterns in cellulose Iα and Iβ[9-10]
1998年,Baker等[11]利用AFM扫描结晶纤维素发现,无论是Iα纤维素还是Iβ纤维素,真正的重复单元都是纤维二糖而并非葡萄糖。在整个结晶区内,单斜晶系和三斜晶系紧密相联,在排列上有1/4个重复单元的错位,如图3所示。经过热处理后,热亚稳型的三斜晶系可以转化成为稳定的单斜晶系[12-13]。此外,由于纤维素本身含有极性羟基使其表面带有负电荷,因此AFM观测时所选用的基体表面的电荷性质对纤维素在AFM下的形态也有着重要的影响。在基体带有阳离子时,纤维素舒展地附着于表面;当基体表面带有负电荷时,纤维素则会形成紧凑的球形结构存在于表面[14]。
2.1.2 纤维素在植物细胞壁中的结构 2006年,王小青等[15]详细叙述了AFM在木材细胞壁结构及木材表面形态与力学性质研究中的应用,发现木材细胞中聚合物的排列方式对力学性能影响很大,其中微纤丝的排列方式引起了广大研究人员的兴趣。

图3 AFM下的结晶纤维素表面形态[11]Fig.3 AFM topography images of the crystal cellulose[11]

图4 典型的初生壁表面AFM成像[17]Fig.4 AFM image of the typical primary cell wall surface structure[17]
在自然界中,纤维素的分子链之间通过氢键连接组成原细纤维,原细纤维组成微细纤维,微细纤维组成细纤维,最后构成了细胞壁中的纤维素。Yan等[8,16]发现在初生壁和次生壁的边界区域,微纤维丝之间通过直径约为5~10 nm的半纤维素分子联接,形成一个网状结构,少量的木质素也呈球形无规则地随机分布于网状结构上。Ding等[17]用AFM观测到,虽然细胞壁中细纤维呈规整的平行排列,但大纤维则会分散排列在细胞壁表面,如图4所示。此外,纤维素的结构形态在不同种类的植物或同一植物不同类型细胞中也存在着很大的差异。Yu等[18]利用AFM成像技术发现麦秆细胞中,由于生长过程中表皮细胞对外界压力抵抗有着重要作用,微纤维在表皮细胞的排列比薄壁细胞更为规则有序;在一些藻类植物的纤维素中还存在着类似于微纤维的扭曲结构[19]。
2.2 纤维素的工业应用
2.2.1 制浆造纸 造纸工业是纤维素应用中的一个重要领域,AFM对制浆工艺的改善起着重要作用。AFM对各工段浆料纤维表面的观测发现:高温蒸煮使原料中大量物质溶出并以薄层(主要成分为半纤维素、提取物、熔融木质素)和颗粒(主要为未熔融木质素)形式附着于纤维表面;经漂白后纤维表面附着物含量降低,但残留附着物的主要成分受漂白剂种类的影响,过氧化氢和连二亚硫酸盐影响半纤维素和提取物,而臭氧主要影响木质素[20-24]。因此,AFM的应用有助于制浆工艺的优化和纸浆性能的提高。此外,AFM在纸张的性能研究中也起着重要作用。Coluzza等[25]利用AFM研究了老化处理和氧化处理对滤纸的影响,结果表明:虽然未经处理的样品和老化、氧化处理的样品表面高度呈高斯分布,但老化、氧化处理后,纤维素聚合度降低,这为纸张的保存提供了有力的理论依据。
2.2.2 纤维素材料 随着科技的发展,纤维素的应用越来越广泛,改性技术也越来越成熟。经处理、改性后可制成各种基于纤维素的材料,如酯化纤维素、羧甲基纤维素、纳米纤维素和纤维素膜等。AFM液体环境中成像的优势,使学者能够探寻纤维素基材料制备过程中的反应历程及机理。Cetin等[26]利用AFM监测碳酸钾催化棉毛纤维与醋酸乙烯的反应过程发现,最初只有表面的纤维素羟基被改性,而随着时间的增加,结晶区的纤维素才会发生反应,最后生成具有小尺寸和低结晶度的纤维素材料,且在四氢呋喃中有很好的稳定性。为了提高纤维素的反应速度和效率,不少学者尝试将纤维素溶解再生破坏结晶结构后再进行改性利用,在溶解再生过程中,通过AFM可观察到随着结晶结构的变化,纤维素形态也发生了巨大变化,且不同的溶剂体系对纤维形态的影响也不尽相同。Yan和Liang等利用AFM技术研究纤维素在氢氧化钠/硫脲体系中溶解时发现[27-28],随着氢氧化钠与纤维素羟基之间的不断反应,纤维素被润胀,然后分离成许多微纤丝或者纳米纤维的碎片,最后溶解于体系中,结合扫描电镜和元素分析发现,在这个过程中氢氧化钠分子深入到了纤维素聚合物的中心,而硫脲则更多地分布在纤维素表面。Yan等[29]还发现当采用氯化锂/N,N-二甲基乙酰胺体系溶解纤维素时,纤维素在溶液中呈现出具有流苏的胶体状结构,随着溶剂的蒸发聚合物浓度增加,胶状结构聚集成为不规则的碎片结构。
基于纤维素的膜材料是纤维素应用的另一个重要领域。在膜的制备过程和性能检测中,Tabe-Mohammadi和Liu利用AFM发现[30-31]溶剂的性质和聚合物的浓度对生成的醋酸纤维素膜表面结构有重要影响,必须选择具有合适沸点的溶液才能既保证聚合物形成稳定浓厚的膜结构,又能使溶剂完全挥发,而聚合物的浓度则决定膜的厚度和微孔膜的孔径等,同时也就决定了膜的通量和选择性。然而,AFM成像范围小,且扫描速度慢,容易产生膜材料表面形态的热漂移,这在一定程度上限制了AFM在膜材料中的深入应用。
纳米材料的优良性能吸引了众多学者的眼球,纳米纤维素更是凭借其卓越的机械性能、化学性质以及生物可降解性被称为“绿色”纳米材料,其表面大量的羟基也为各种功能基团的引入提供了良好的条件。Lahiji等[32]利用AFM在跳跃模式下对木材纤维素的单个纳米微晶结构的结构形态、黏性、弹性以及硬度进行了研究,结果表明:每个纤维素纳米微晶体纵向各点的硬度和黏度一致。Aulin等[33]还通过AFM发现在电荷稳定的纤维素凝胶溶液中,阴离子纤维素和阳离子纤维素的微纤丝能通过静电力和空间排斥力的协同作用分层堆积自组装形成薄膜(见图5),根据体系中微晶纤维素的类型,膜的黏性和厚度都有差异,自组装形成的分层填积聚合物浓度越大,膜越厚。

图5 云母表面纳米纤维素多层结构在敲击模式下的高度图和相位图[33]Fig.5 Height and phase images of the multilayer films on silica under tapping mode of AFM[33]
此外,AFM探测结果表明:溶液性质对纤维素的分子形态具有显著影响。羧甲基纤维素在溶液中的螺旋状结构比在水中伸展得更长;溶液中不同的阳离子会使羧甲基纤维素呈现不同的结构,如在Ni2+中为纤丝状聚合物,在Na+中呈网状结构[34-35]。
3 结 语
纤维素是自然界存在最为广泛的一种天然大分子,但纤维素大分子的应用受到其复杂结构的限制。AFM作为一个超微结构分析工具,其应用为纤维素的结构研究提供了重要信息。AFM图像信息显示,纤维素结构复杂性不仅在于天然纤维素大分子存在非结晶区和结晶区两种形态,结晶区内还存在单斜晶系和三斜晶系。此外,在细胞壁结构中,半纤维素在微纤丝之间相互交连形成网状结构,而木质素则随机分布在网状结构上,两者一起将纤维素有效地包裹起来。目前,纤维素广泛应用于造纸、食品、材料等领域,在纤维素基化学品、材料研究中,AFM能够为其工艺优化、反应机理探索、自组装行为研究提供依据,AFM的应用必将促进纤维素的资源开发。
[1]杨淑蕙.植物纤维化学[M].北京:中国轻工业出版社,2005:163-208. YANG S H.Lignocellulosic Chemistry[M].Beijing:China Light Industry Press,2005:163-208.
[2]MORRIS V J,KIRBY A R,GUNNING A P.Atomic Force Microscopy for Biologists[M].London:Imperial College Press,1999.
[3]SHAO Z,MOU J,CZAJKOWSHY D M,et al.Biological atomic force microscopy: What is achieved and what is needed[J].Advances in Physics,1996,45(1):1-86.
[4]JENA B P,HORBER J K H.Atomic Force Microscopy in Cell Biology,Methods in Cell Biology[M].San Diego:Academic Press,2002.
[5]张添德,何昆,张飒,等.原子力显微镜发展近况及其应用[J].现代仪器,2002 (3):6-9. ZHANG T D,HE K,ZHANG S,et al.The development for atomic force microscopy recently and the brief introduction of application[J].Modern Instruments,2002(3):6-9.
[6]刘小虹,颜肖慈,罗道明,等.原子力显微镜及其应用[J].自然杂志,2002,24(1):36-40. LIU X H,YAN X C,LUO D M,et al.Atomic force microscope and its application[J].Chinese Journal of Nature,2002,24(1): 36-40.
[8]YAN L F,ZHU Q S.Direct observation of the main cell wall components of straw by atomic force microscopy[J].Journal of Applied Polymer Science,2003,88(8):2055-2059.
[9]NISHIYAMA Y,LANGAN P,CHANZY H.Crystal structure and hydrogen-bonding system in cellulose Iβfrom synchrotron X-ray and neutron fiber diffraction[J].Journal of The American Chemical Society,2002,124(31):9074-9082.
[10]NISHIYAMA Y,SUGIYAMA J,CHANZY H,et al.Crystal structure and hydrogen bonding system in cellulose Iα from synchrotron X-ray and neutron fiber diffraction[J].Journal of The American Chemical Society,2003,125(47):14300-14306.
[11]BAKER A A,HELBERT W,SUGIYAMA J,et al.Surface structure of native cellulose microcrystals by AFM[J].Applied Physics A,1998,66:s559-s563.
[12]YAMAMOTO H,HORII F,ODANI H.Structural-changes of native cellulose crystals induced by annealing in aqueous alkaline and acidic solutions at high temperatures[J].Macromolecules,1989,22(10):4130-4132.
[13]DEBZI E M,CHANZY H,SUGIYAMA J,et al.The Iα→Iβtransformation of highly crystalline cellulose by annealing in various mediums[J].Macromolecules,1991,24(26):6816-6822.
[14]WAN Z Z,LI L,CUI S X.Capturing the portrait of isolated individual natural cellulose molecules[J].Biopolymers,2008,89(12):1170-1173.
[15]王小青,刘君良.原子力显微镜在木材科学研究中的应用[J].世界林业研究,2006,19(1):38-41. WANG X Q,LIU J L.A review of the application of atomic force microscopy in wood science research[J].World Forestry Research,2006,19(1):38-41.
[16]YAN L F,LI W,YANG J L,et al.Direct visualization of straw cell walls by AFM[J].Macromolecular Bioscience,2004,4(2):112-118.
[17]DING S Y,HIMMEL M E.The maize primary cell wall microfibril: A new model derived from direct visualization[J].Journal of Agricultural and Food Chemistry,2006,54(3):597-606.
[18]YU H,LIU R G,SHEN D W,et al.Arrangement of cellulose microfibrils in the wheat straw cell wall[J].Carbohydrate Polymers,2008,72(1):122-127.
[19]HANLEY S J,REVOL J F,GODBOUT L,et al.Atomic force microscopy and transmission electron microscopy of cellulose from micrasterias denticulata; evidence for a chiral helical microfibril twist[J].Cellulose,1997,4(3):209-220.
[20]GUSTAFSSON J,CIOVICA L,PELTONEN J.The ultrastructure of spruce kraft pulps studied by atomic force microscopy (AFM) and X-ray photoelectron spectroscopy (XPS)[J].Polymer,2003,44(3):661-670.
[21]KOLJONEN K,ÖSTERBERG M,JOHANSSON L S,et al.Surface chemistry and morphology of different mechanical pulps determined by ESCA and AFM[J].Colloids and Surfaces A: Physicochemical and Engineering Aspects,2003,228(1):143-158.
[22]LI K C,TAN X Q,YAN D B.The middle lamella remainders on the surface of various mechanical pulp fibres[J].Surface and Interface Analysis,2006,38(10):1328-1335.
[23]SIMOLA J,MALKAVAARA P, ALÉN R,et al.Scanning probe microscopy of pine and birch kraft pulp fibres[J].Polymer,2000,41(6):2121-2126.
[24]BÖRÖS L,GATENHOLM P.Surface composition and morphology of CTMP fibers[J].Holzforschung,1999,53(2):188-194.
[25]COLUZZA C,BICCIERI M,MONTI M,et al.Atomic force microscopy application for degradation diagnostics in library heritage[J].Surface and Interface Analysis,2008,40(9):1248-1253.
[26]CETIN N S,TINGAUT P,ÖZMEN N,et al.Acetylation of cellulose nanowhiskers with vinyl acetate under moderate conditions[J].Macromolecular Bioscience,2009,9(10):997-1003.
[27]YAN L F,CHEN J,BANGAL P R.Dissolving cellulose in a NaOH/thiourea aqueous solution: A topochemical investigation[J].Macromolecular Bioscience 2007,7(9/10):1139-1148.
[28]LIANG S M,ZHANG L N,LI Y F,et al.Fabrication and properties of cellulose hydrated membrane with unique structure[J].Macromolecular Chemistry and Physics,2007,208(6):594-602.
[29]YAN L F,ZHU Q S.Direct observation of the fringed micelles structure of cellulose molecules solvated in dimethylacetamide/LiCl system[J].Polymer International,2002,51(8):738-739.
[30]TABE-MOHAMMADI A,GARCIA VILLALUENGA J P,KIM H J,et al.Effects of polymer solvents on the performance of cellulose acetate membranes in methanol/methyl tertiary butyl ether separation[J].Journal of Applied Polymer Science,2001,82(12/13):2882-2895.
[31]LIU W Y,LIU R G,LI Y X,et al.Self-organized ordered microporous thin films from grafting copolymers[J].Polymer,2009,50(12):2716-2726.
[32]LAHIJI R R,XU X,REIFENBERGER R,et al.Atomic force microscopy characterization of cellulose nanocrystals[J].Langmuir,2010,26(6):4480-4488.
[33]AULIN C,JOHANSSON E,WÅGBERG L,et al.Self-organized films from cellulose Ⅰ nanofibrils using the layer-by-layer technique[J].Biomacromolecules,2010,11(4):872-882.
[34]WANG J,SOMASUNDARAN P.Adsorption and conformation of carboxymethyl cellulose at solid-liquid interface using spectroscopic,AFM and allied techniques[J].Journal of Colloid Interface Science,2005,291(1):75-83.
[35]UENO T,YOKOTA S,KITAOKA T,et al.Conformational changes in single carboxymethylcellulose chains on a highly oriented pyrolytic graphite surface under different salt conditions[J].Carbohydrate Research,2007,342(7):954-960.
Application of Atomic Force Microscope in Cellulosic Ivestigation
YANG Haiyan1, ZHENG Zhifeng1, WANG Kun2, MA Jianfeng3, SHI Zhengjun1
(1.College of Material Engineering,Southwest Forestry University, Kunming 650224, China; 2.College of Material Science and Technology,Beijing Forestry University, Beijing 100083, China; 3.International Centre for Bamboo and Rattan, Beijing 100102, China)
Atomic force microscope (AFM) plays an important role in the surface imaging technologies. The basic principle of AFM is the measurement of the force between a sharp tip and sample surface. In order to profile the structure characteristics of biopolymers, AFM can work under contact mode, non-contact mode and tapping mode, respectively. High-resolution images of cellulose from AFM show that cellobiose is the repeat unit of cellulose, and triclinic and monoclinic crystal systems naturally exist in the same microfibril of cellulose with a displacement of adjacent chains by a quarter of cellobiose units. In cell wall, fibers contact with each other by hemicelluloses to form a network. However, the structure of fiber ranges with variety of plants and cell wall region. Furthermore, AFM promotes the application research on cellulose. The results from AFM images are important for improving of pulp properties, paper conservation, and exploration of reaction mechanism.
atomic force microscope; cellulose; cell wall; structure; application
10.3969/j.issn.0253-2417.2017.01.002
2016- 06-17
云南省科技厅基础研究青年项目(2015FD023);国家自然科学基金资助项目 (31260165,31560195)
杨海艳 (1986— ),女,重庆人,讲师,博士,主要从事生物质资源化利用方面的研究
*通讯作者:史正军,副教授,硕士生导师,主要从事植物资源化利用方面的研究工作;E-mail:shizhengjun1979@163.com。
TQ35
A
0253-2417(2017)01- 0014- 07
杨海艳,郑志锋,王堃,等.原子力显微镜在纤维素研究中的应用[J].林产化学与工业,2017,37(1):14-20.
