肿瘤家族史与癌症患者预后相关性的Meta分析
2017-02-22崔熙娟杨薇粒
崔熙娟, 陈 硕, 金 犇, 杨薇粒, 单 涛, 龙 泳*(
第四军医大公共卫生学院流行病学教研室,西安 710032;2西安交通大学医学院第二附属医院普外科; *通讯作者,E-mail: longyong@fmmu.edu.cn)
肿瘤家族史与癌症患者预后相关性的Meta分析
崔熙娟1, 陈 硕2, 金 犇2, 杨薇粒2, 单 涛2, 龙 泳1*(1
第四军医大公共卫生学院流行病学教研室,西安 710032;2西安交通大学医学院第二附属医院普外科;*通讯作者,E-mail: longyong@fmmu.edu.cn)
目的 采用Meta分析方法对肿瘤家族史及癌症患者术后生存率的相关性进行研究。 方法 检索Cochrane Library、MEDLINE、CANCERLIT和EMBASE数据库截止2014年6月收录的相关文献资料。利用Reman5.0软件分析计算总生存率(overall survival,OS)、无复发生存率(recurrence-free survival,RFS)和无病进展率(the disease-free survival,DFS)及95%置信区间(95% CI),I2检验数据间的异质性。 结果 本研究最终纳入30项研究。分析显示肿瘤家族史对肿瘤患者的总生存率(OS)有一定影响,但达不到统计学差异(HR=0.94,95% CI 0.87-1.02);若一级亲属有1个有肿瘤史,其HR=0.99,95% CI 0.84-1.17;若一级亲属有≥2个有肿瘤史,其HR=1.10,95%CI 0.75-1.62。提示患者的生存率与具有癌症家族史的一级亲属的人数无明显相关。此外,无病进展率(DFS)和无复发生存率(RFS)的HR值分别为0.79(95%CI 0.55-1.15)和0.83(95%CI 0.63-1.08)。相对于欧美(HR=0.96,95%CI0.91-1.01),阳性家族史对亚洲人预后有保护作用(HR=0.93, 95%CI 0.90-0.97),但没有统计学差异。类似的,阳性消化系统(HR=0.94, 95%CI 0.84-1.05)、泌尿系统(HR=1.22,95%CI1.00-1.48)和呼吸系统肿瘤家庭史(HR=0.88,95%CI 0.72-1.08)对生存率没有显著性影响。 结论 本研究提示阳性肿瘤家族史及癌症家族史阳性人数与术后生存率无明显相关。肿瘤家族史患者对无病进展率(DFS)和无复发生存率(RFS)并无显著影响。就人群分布而言,有肿瘤家族史的亚洲人比欧美人的生存率高。有无肿瘤家族史对不同类型肿瘤术后生存无显著影响。
肿瘤家族史; Meta分析; 预后; 生存率
癌症是现代社会常见死亡原因,但至今其预后因素仍未完全阐明。肿瘤家族史一直被认为是癌症发生的重要危险因素。部分研究显示肿瘤家族史将肿瘤发生发展的危险系数提高了1.5-3.5倍,但其对生存率的影响仍存在争议[1]。对不同类型的癌症而言,散发的癌症患者和具有肿瘤家族史的患者预后是不同的。研究显示具有家族史的结直肠癌患者和没有家族史的结直肠癌患者的临床病理特征没有差异[1]。另有调查显示结直肠癌患者的家族史与肿瘤的早期分期[2,3]、肿瘤发生位置[4]或者发病年龄[5]有关。一些研究报道称有结直肠癌家族史与较好的肿瘤预后有关[3,6],然而其他研究则认为家族史与之无关,甚至可能不利于提高患者的生存率和促进癌症复发[2]。其他的研究表明家族性食管癌与散发性食管癌相比,其起病较早且预后较差[6]。有研究报道称一级亲属胃癌家族史与Ⅲ期或者Ⅳ期胃癌患者的生存率的提高有关[7]。据我们了解,现有有限的关于食管癌、胃癌和结直肠癌的研究数据是不确切的。本研究的目的是通过对目前已经公开发表的文献进行系统回顾,探究家族史与癌症患者生存率的相关性。
1 材料和方法
1.1 文献检索和纳入指标
本研究检索了截止2014年6月由Cochrane Library、MEDLINE、CANCERLIT和EMBASE电子数据库收录的文献资料。检索关键词如下:(“tumor”,“tumour”,“cancer”,“neoplasm”)AND(“family”,“familial”,“family history”)AND(“recurrence”,“death”,“survival”or“prognosis”,“mortality”)。另外,本研究回顾和评价了可能有相关性的文献,并复查了纳入文献的引用文献列表以得到其他切题的已发表文献。
文献纳入标准为:①已发表的英文文献;②观察性研究中报道了肿瘤家族史HR值及其95%CI,或者提供了充足的数据能计算出HR值及其95%CI;③将家族史作为癌症预后的标志进行了评价;④组织学和细胞学证实癌症。排除关于癌症细胞系和动物模型的综述、非原始性文章和研究。
观察指标定义:总生存率(overall survival,OS)指从手术至任何原因导致的死亡或者最后一次随诊的时间。无复发生存率(recurrence-free survival,RFS)指从手术到肿瘤复发及复发所致的死亡或者新发肿瘤出现的时间。无病进展率(the disease-free survival,DFS)是指从手术到肿瘤复发、或者新发癌症出现、或者任何原因导致的死亡的时间。
两位作者独立阅读文献的标题和摘要,并删除无关的文献和对纳入的文献进行全面仔细的阅读。综合分析和评价纳入指标以后,以上两位作者决定研究纳入与否。如果出现分歧,两位作者进行讨论或者征求第三位研究者的意见直至意见统一。
1.2 数据提取及文献质量评价
以上两位作者使用标准的数据摘录表格独立地从纳入的研究中提取数据,并以Newcastle-Ottawa Scale(NOS)文献质量评价量表[8]对纳入文献进行质量评价,讨论数据摘录过程中出现的分歧。从每个研究中摘录的数据包括:研究名称、发表年限、研究地区、研究年限、平均年龄、研究样本量、随访时间、家族史的定义、癌症家族史类型和研究截止时间。
1.3 数据分析
本研究按照Meta分析要求整理数据并建立数据库,使用Review Manager(RevMan)5.0 和Stata version 11统计分析软件行数据综合分析处理。
摘录每一项研究的ln(OR/RR)值和SE值或通过公式计算得到,并在Review Manager(RevMan)5.0中采用一般倒方差法(generic inverse variance)进行二分类变量分析。由于大多数的研究没有直接给出ln(OR/RR)和SE,所以本研究通过以下公式进行数据转换,SE=[ln(OR/RR-upper)-ln(OR/RR-lower)]/3.92[9]。当不同研究间具有同质性,采用固定效应模型;当不同研究间具有异质性,采用随机效应模型。如果95%CI和1没有重叠(即P<0.05),则认为存在统计学差异。
I2值描述的是由不同研究差异而不是偶然因素所致的差异在所有研究变异中的百分比,因此采用I2值来判断研究间的异质性。如果I2值大于50%且卡方分析的P值小于0.10,表示两研究间的确存在异质性。如果存在显著的异质性,我们进行亚组分析探究异质性存在的可能来源。同样的,我们使用Egger回顾性测试检测漏斗图的对称性,即如果P值小于0.05说明发表偏倚存在。敏感性分析采用去除任意一篇纳入的文献,观察结果是否稳定。
2 结果
2.1 相关研究鉴定
最初检索了266篇文献,经过详细的纳入分析和剔除分析以后,最终纳入30篇[1-3,6,7,10-34]合适的文献研究(见图1)。
2.2 纳入研究的描述
表1为本研究分析所纳入的研究数据的主要特征。大多数研究由欧美研究者发表,少数研究由中国和日本研究者发表。本研究中患有癌症的一级亲属的家族史定义是最不严格的。一些研究使用较多的受影响的亲属或限制亲属确诊的年龄。多因素分析模型中的共同因素变异很大,最常用于分析的死亡危险因素包括:年龄、性别和肿瘤分期。
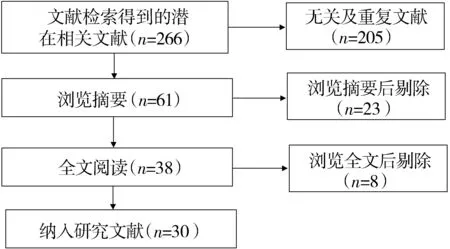
图1 文献筛选流程Figure 1 Flow chart of article screening and selection process
表1 纳入文献的一般情况
Table 1 Baseline characteristics of studies on family history and cancer included in the Meta analysis

纳入研究发表时间国家发表杂志FH+FH-随访时间肿瘤类型NOS评分Thalib等[14]2004SwedenBJC21751492036月乳腺结肠8Chan等[32]2008USAJAMA1958925.6年7Zell等[1]2008USACEBP2089469.3年结直肠8Han等[29]2012KoreaJCO49278160.8月胃8Lee等[30]2014KoraeJDD6390856.9月结直肠8Egbers等[26]2014NetherlandsIJC10013654.6年膀胱7Gao等[13]2009ChinaBMC4219733年胃肠8Guo等[21]2013ChinaCEM64815.5年胃7Palli等[16]2000ItalyCancer84298134月胃9Minami等[7]2014JapanIJC2707635.3年胃8Liss等[31]2015USAJU48335876711.6年前列腺7Birgisson等[3]2009SwedenFC252856年结直肠7Kirchhoff等[23]2008USAFC26211297.9年结直肠6Bass等[2]2008USAACS163838No结直肠8Ji等[10]2008SwedenAO803025No卵巢7Haraguchi等[28]2012JapanIJMS119889No肺6Morris等[6]2013UKBJC16779085No结直肠7Fang等[12]2013ChinaTBRI66260No胃7Phipps等[19]2014USACEBP7443540No结直肠7Jacobs等[17]2009USACCC1687138No胰腺7Ganti等[33]2009USALC148412No肺8Bagshaw等[34]2014USANIH386132571月前列腺8Cao等[22]2011ChinaETM34834555.7月乳腺8Figueiredo等[15]2007USBCRT3496185.9年乳腺7
No是指原文献中随访数据由当地卫生主管部门的数据库调取数值
2.3 Meta分析结果
2.3.1 肿瘤家族史对癌症总生存率的影响 图2的森林图显示了具有肿瘤家族史和没有肿瘤家族史患者总生存率的HR值比较,HR=0.94,95%CI 0.87-1.02,研究间存在较大的异质性(I2=77%)。若一级亲属有1个患者有肿瘤史,其HR=0.99(95%CI 0.84-1.17,见图3);若一级亲属有≥2个患者有肿瘤史,其HR=1.10(95%CI 0.75-1.62,见图4)。
总之,以上结果支持肿瘤家族史有较好的总生存率,虽然没有达到统计学意义,而且受累家族成员的数量对总生存率无显著影响。
2.3.2 家族史对无病进展率和无复发生存率的影响 图5的森林图显示了4个不同研究中家族史有无的无病进展率的HR值比较结果,其中总HR值为0.79(95%CI=0.55-1.15)。以上研究显示肿瘤家族史对癌症无病进展率的没有显著的差异。另外,4个研究的Meta分析显示肿瘤家族史是无复发生存率有利因素(HR=0.83,95%CI=0.63-1.08,见图6)。

图2 肿瘤家族史对总生存率的影响Figure 2 Effect of family history of cancer on overall survival

图3 仅1位1级亲属肿瘤史对生存率的影响Figure 3 Effect of only one affected member in first degree on overall survival
总之,森林图结果支持肿瘤家族史阳性的患者无病复发及生存率一定程度上优于家族史阴性的患者,但差异没有统计学意义。但支持本研究结果的研究报道非常有限,因此研究结果所显示的关联性同样是有限的。

图5 肿瘤家族史对无病进展生存率的影响Figure 5 Effect of family history of cancer on DFS

图6 肿瘤家族史对无复发生存率的影响Figure 6 Effect of family history of cancer on RFS
2.3.3 亚组分析及敏感性分析 亚组分析是严格根据人口分布并从合适的研究中分组,分为美欧和亚洲两个组。相对于欧美(HR=0.96,95%CI 0.91-1.01),阳性家族史对亚洲人预后具有保护作用(HR=0.93,95%CI 0.90-0.97)。此外,对癌症的亚组分析显示消化系统、呼吸系统肿瘤阳性家族史对患者预后无显著差异,其总HR值为0.94(95%CI 0.84-1.05)和0.88(95%CI 0.72-1.08),而泌尿系统肿瘤家族史HR为1.22(95%CI 1.00-1.48)。由于对呼吸系统和泌尿系统肿瘤家族史的研究稀少,整体上发表偏倚是存在的(见图7),需要更多的大样本研究。
3 讨论
近年来,癌症发病率和死亡率急剧增长。本研究探究了家族史与癌症预后的相关性,分析显示家族史阳性提示较好的癌症总生存率。此外,肿瘤家族史与无复发生存率和无病进展率无明显的相关性。本文中特异性的癌症亚组分析没有发现差异。根据系统分析结果,我们认为本回顾分析将为临床预防及治疗提供有用的信息。

图7 发表偏倚分析Figure 7 Publication bias analysis
据我们所知,目前至少已经有30项研究探讨了阳性癌症家族史与癌症预后的关系,其中大多数研究来自西方国家且结果不一致。有一项研究[2]结果与其他同类研究结果明显相悖,可能与其将研究对象局限于女性及缺少术后治疗相关数据有关。已有的研究[30]表明家族史的亲属级别是癌症预后的一个独立因素。一些其他类型癌症的研究结果显示家族史与癌症预后之间的关联性是不同的,其与亲属级别和受累亲属人数[2,6]以及亲属罹患癌症类型[31]有关。本Meta分析研究考虑到了与不同亲属罹患的不同癌症相关的HR值。未来需要进行更大的研究以评价不同级别亲属及家族史对癌症患者生存率的影响。
本研究的结果显示较大的异质性,其原因可能主要有:纳入的研究来自世界各地,具有人种及地区差异,不同的肿瘤种类可能具有差异,不同研究在方法上存在差异,如对家族史统计方法不同,一些研究只计算一类亲属,而部分研究计算一类及二类亲属。
谈及家族史的亲属级别,癌症家族史与倾向较好的无病生存期和无复发生存期,但还没有显著相关性。可能由于有家族史的患者更有定期体检的愿望,做到早发现,早期治疗可能,相对提高预后。然而,无论是一级亲属还是二级亲属,家族史与总生存率没有统计学显著影响。 缺少与罹患癌症的二级亲属相关的HR值,因而可信度较差。更重要的是,这些Meta分析研究中的家族史由被调查者口述,缺乏临床证据。且被调查者口述的结果可能导致部分二级亲属癌症家族史未被报道,因被调查者更清楚一级亲属的疾病状况而不是二级亲属乃至三级亲属。一个最近的回顾分析显示二级亲属和三级亲属癌症史的报道的可信度总是较低的[32]。因此,就远房亲属癌症家族史的调查应当严谨一些。
在亚组分析中,当我们将癌症类型局限在特定癌症时(如:消化系统癌症、呼吸系统癌症、泌尿系统癌症),家族史与癌症生存率没有显著相关性。已有的研究[10]表明癌症家族史增加了癌症的死亡危险。因此,特定类型的癌症家族史或许会影响家族史与癌症生存率的关系。另外,有肿瘤家族史的亚洲人比欧美人的生存率高,我们认为其中原因比较复杂,可能与饮食、肥胖等因素的影响有关[33,34],具体原因有待进一步验证。
另外某些尚未明确的基因和(或者)癌症综合征可能对癌症家族史阳性患者的生存率有影响也可能是本研究异质性的来源。虽然绝大多数的癌症病例是散发的,但大约有1%-3%的癌症表现出遗传性癌症倾向综合征,诸如遗传性非息肉病性结直肠癌(hereditary non-polyposis colorectal cancer, HNPCC)、Li-Fraumeni综合征、家族性腺瘤样息肉、Peutz-Jeghers综合征。在研究中,只有一个研究排除了遗传性胃癌。
本Meta分析具有许多局限性。其一,研究中纳入的DFS和RFS相关的研究只有4个,因此某些分层分析没有条件进行。例如一个研究显示虽然胃癌家族史与Ⅰ期和Ⅱ期患者的生存率无关,但是对Ⅲ期和Ⅳ期患者而言,一级亲属癌症家族史可显著降低癌症复发风险或DFS的死亡风险。然而,其他的研究并没有就肿瘤分期进行分层分析或者限制分析。由于同样的原因,本研究无法评价性别和年龄的影响。此外,虽然自我陈述信息的可信度是公认的可能导致癌症家族史研究偏倚的潜在性因素,但是目前尚无研究通过临床记录证实之。最后,本研究限制性也可能是由于以英文发表的文章或许也是一个选择性报道的来源,比如以英文发表的文章较多青睐阳性研究结果。
总之,本观察性研究的Meta分析提供了一个强有力的证据,即癌症家族史患者有较好的总生存率,且具有癌症家族史患者的无病生存期和无复发生存期较理想。就人群分布来看,具有癌症家族史的亚洲人比欧美人的生存率较高。以上结果可以为临床医师向患者解释癌症的死亡风险时提供参考。
[1] Zell JA,Mceligot AJ,Ziogas A,etal.Differential effects of wine consumption on colorectal cancer outcomes based on family history of the disease[J].Nutr Cancer,2007,59(1):36-45.
[2] Bass AJ,Meyerhardt JA,Chan JA,etal.Family history and survival after colorectal cancer diagnosis[J].Cancer,2008,112(6):1222-1229.
[3] Birgisson H,Ghanipour A,Smedh K,etal.The correlation between a family history of colorectal cancer and survival of patients with colorectal cancer[J].Fam Cancer,2009,8(4):555-561.
[4] Kao PS,Lin JK,Wang HS,etal.The impact of family history on the outcome of patients with colorectal cancer in a veterans’ hospital[J].Int J Colorectal Dis,2009,24(11):1249-1254.
[5] Mahdavinia M,Bishehsari F,Ansari R,etal.Family history of colorectal cancer in Iran[J].BMC Cancer,2005,5:112.
[6] Morris EJ,Penegar S,Whitehouse LE,etal.A retrospective observational study of the relationship between family history and survival from colorectal cancer[J].Br J Cancer,2013,108(7):1502-1507.
[7] Minami Y,Kawai M,Fujiya T,etal.Family history, body mass index and survival in Japanese patients with stomach cancer: a prospective study[J].Int J Cancer,2015,136(2):411-424.
[8] Stang A.Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses[J].Eur J Epidemiol,2010,25:603-605.
[9] Deeks J,Altman DG,Bradburn MJ.Statistical Methods for Examining Heterogeneity and Combining Results from Several Studies in Meta-analysis[M]//Egger M,Smith DG.Altman DG.Systematic Reviews in Health Care.2nd ed.London: BMJ Books,2007:285-312.
[10] Ji J,Forsti A,Sundquist J,etal.Survival in ovarian cancer patients by histology and family history[J].Acta Oncol,2008,47(6):1133-1139.
[11] Kikuchi S.Family history and mortality in the Japan Collaborative Cohort Study for Evaluation of Cancer(JACC)[J].Asian Pac J Cancer Prev,2007,8(Suppl):21-24.
[12] Fang WL,Chang SC,Lan YT,etal.Molecular and survival differences between familial and sporadic gastric cancers[J].Biomed Res Int,2013,2013:396272.
[13] Gao Y,Hu N,Han X,etal.Family history of cancer and risk for esophageal and gastric cancer in Shanxi,China[J].BMC Cancer,2009,9:269.
[14] Thalib L,Wedren S,Granath F,etal.Breast cancer prognosis in relation to family history of breast and ovarian cancer[J].Br J Cancer,2004,90(7):1378-1381.
[15] Figueiredo JC,Ennis M,Knight JA,etal.Influence of young age at diagnosis and family history of breast or ovarian cancer on breast cancer outcomes in a population-based cohort study[J].Breast Cancer Res Treat,2007,105(1):69-80.
[16] Palli D,Russo A,Saieva C,etal.Dietary and familial determinants of 10-year survival among patients with gastric carcinoma[J].Cancer,2000,89(6):1205-1213.
[17] Jacobs EJ,Rodriguez C,Newton CC,etal.Family history of various cancers and pancreatic cancer mortality in a large cohort[J].Cancer Causes Control,2009,20(8):1261-1269.
[18] Verkooijen HM,Rapiti E,Fioretta G,etal.Impact of a positive family history on diagnosis,management,and survival of breast cancer:different effects across socio-economic groups[J].Cancer Causes Control,2009,20(9):1689-1696.
[19] Phipps AI,Ahnen DJ,Campbell PT,etal.Family history of colorectal cancer is not associated with colorectal cancer survival regardless of microsatellite instability status[J].Cancer Epidemiol Biomarkers Prev,2014,23(8):1700-1704.
[20] Malone KE,Daling JR,Doody DR,etal.Family history of breast cancer in relation to tumor characteristics and mortality in a population-based study of young women with invasive breast cancer[J].Cancer Epidemiol Biomarkers Prev,2011,20(12):2560-2571.
[21] Guo W,Dong Z,Guo Y,etal.Aberrant methylation and loss expression of RKIP is associated with tumor progression and poor prognosis in gastric cardia adenocarcinoma[J].Clin Exp Metastasis,2013,30(3):265-275.
[22] Cao AY,He M,Di GH,etal.Influence of a family history of breast and/or ovarian cancer on breast cancer outcomes[J].Exp Ther Med,2011,2(5):917-923.
[23] Kirchhoff AC,Newcomb PA,Trentham-Dietz A,etal.Family history and colorectal cancer survival in women[J].Fam Cancer,2008,7(4):287-292.
[24] Li N,Shao K,Chen Z,etal.The impact of positive cancer family history on the clinical features and outcome of patients with non-small cell lung cancer[J].Fam Cancer,2011,10(2):331-336.
[25] Margolin S,Johansson H,Rutqvist LE,etal.Family history,and impact on clinical presentation and prognosis,in a population-based breast cancer cohort from the Stockholm County[J].Fam Cancer,2006,5(4):309-321.
[26] Egbers L,Grotenhuis AJ,Aben KK,etal.The prognostic value of family history among patients with urinary bladder cancer[J].Int J Cancer,2015,136(5):1117-1124.
[27] Russo A,Herd-Smith A,Gestri D,etal.Does family history influence survival in breast cancer cases?[J].Int J Cancer,2002,99(3):427-430.
[28] Haraguchi S,Koizumi K,Mikami I,etal.Clinicopathological characteristics and prognosis of non-small cell lung cancer patients associated with a family history of lung cancer[J].Int J Med Sci,2012,9(1):68-73.
[29] Han MA,Oh MG,Choi IJ,etal.Association of family history with cancer recurrence and survival in patients with gastric cancer[J].J Clin Oncol,2012,30(7):701-708.
[30] Lee SD,Kim BC,Han KS,etal.Influence of family history on survival in patients with colon and rectal cancer[J].J Dig Dis,2014,15(3):108-115.
[31] Liss MA,Chen H,Hemal S,etal.Impact of family history on prostate cancer mortality in white men undergoing prostate specific antigen based screening[J].J Urol,2015,193(1):75-79.
[32] Chan JA,Meyerhardt JA,Niedzwiecki D,etal.Association of family history with cancer recurrence and survival among patients with stage Ⅲ colon cancer[J].JAMA,2008,299(21):2515-2523.
[33] Ganti AK,Loberiza FJ,Kessinger A.Association of positive family history with survival of patients with lung cancer[J].Lung Cancer,2009,63(1):136-139.
[34] Bagshaw H,Ruth K,Horwitz EM,etal.Does family history of prostate cancer affect outcomes following radiotherapy?[J].Radiother Oncol,2014,110(2):229-234.
[35] Slattery ML,Kerber RA.The impact of family history of colon cancer on survival after diagnosis with colon cancer[J].Int J Epidemiol,1995,24(5):888-896.
Correlation of family history with prognosis of patients with cancer: a Meta analysis
CUI Xijuan1, CHEN Shuo2, JIN Ben2, YANG Weili2, SHAN Tao2, LONG Yong1*
(1DepartmentofEpidemiology,FourthMilitaryMedicalUniversity,Xi’an710032,China;2DepartmentofGeneralSurgery,SecondAffiliatedHospitalofMedicalCollege,Xi’anJiaotongUniversity;*Correspondingauthor,E-mail:longyong@fmmu.edu.cn)
ObjectiveTo evaluate the effect of family history of cancer on survival.MethodsMEDLINE, CANCERLIT,and Cochrane library were searched of retrieving the studies up to June 2014. Meta analysis was performed to estimate hazard ratio(HR) and 95% confidence interval(CI) for overall survival(OS), recurrence-free survival(RFS),or the disease-free survival (DFS) with random-effects model. Sensitivity and subgroup analyses were also conducted in the Meta analysis. Homogeneity of effects across studies was assessed usingχ2test and quantified byI2.ResultsA total of 30 studies were eligible for the Meta analysis. Patients with a family history of cancer had better overall survival(HR=0.94, 95%CI 0.87-1.02). When there was one affected family member in a first-degree family history of cancer, HR was 0.99(95%CI 0.84-1.17); and when there were≥2 affected family members in a first-degree family history of cancer, HR was 1.10(95%CI 0.75-1.62). In addition, HR was 0.79(95%CI 0.55-1.15) for DFS and 0.83(95%CI 0.63-1.08)for RFS. In population distribution, compared with the American and European(HR=0.96,95%CI 0.91-1.01),the positive family history was a protective factor for the Asian (HR=0.93, 95%CI 0.90-0.97). Similarly, the survival showed no difference in patients with family history of gastric cancer(HR=0.94,95%CI 0.84-1.05),urinary cancer(HR=1.22,95%CI 1.00-1.48)or respiratory cancer(HR=0.88,95%CI 0.72-1.08).ConclusionThis Meta analysis of observational studies provides strong evidence that family history of cancer and the number of affected family members are not significantly associated with survival of cancer patients after surgery. While, it suggests that patients with family history of cancer have no effects on survival of DFS and RFS. In population distribution, family history of cancer is a better survival mark in the Asian than those in the American and European. Family history of cancer does not affect the survival of patients with different cancers.
family history; Meta analysis; prognosis; survival
崔熙娟,女,1984-04生,硕士,E-mail:cxj840309@163.com
2016-08-27
R73-31
A
1007-6611(2017)01-0047-07
10.13753/j.issn.1007-6611.2017.01.011
