影响黄龙藻类群落结构的环境因子分析
2017-02-21张存凯李琼芳张清明吕治州张文静
张存凯, 李琼芳*, 唐 淑, 张清明, 陈 超, 吕治州, 张文静
1.西南科技大学生命科学与工程学院, 四川 绵阳 621010 2.黄龙国家级风景名胜区管理局, 四川 阿坝 623300
影响黄龙藻类群落结构的环境因子分析
张存凯1, 李琼芳1*, 唐 淑2, 张清明2, 陈 超1, 吕治州1, 张文静1
1.西南科技大学生命科学与工程学院, 四川 绵阳 621010 2.黄龙国家级风景名胜区管理局, 四川 阿坝 623300
为了探讨引起黄龙钙华沉积区附着藻类大量滋生的原因、持续发展的趋势以及对钙华景观产生的影响,于2015年春、夏、秋季采集景区内12个典型样地的藻样和水样,在进行群落结构分析和环境因子分析的基础上,采用CCA(典型对应分析)以探明影响群落结构的主要环境因子.结果表明:①试验共检出藻类88种,隶属于5门9纲18目20科37属,优势种以贫营养土著型为主;②随季节更替,物种丰度、生物量和Margalef指数增加,Pielou指数下降,Shannon-Wiener指数和Simpson指数变化稳定;③基于CCA结果发现,pH(F=1.6,P=0.02)和海拔(F=1.5,P=0.04)是影响群落结构的主要环境因子.研究显示,当前环境下,自然因子较人为因子对群落结构的影响更为显著,后期在制订水环境评估及钙华资源保护方案时,应当充分考虑特定环境因子的影响.
黄龙风景区; 附着藻类; 群落结构; 环境因子; 优势种
着生藻类(periphytic algae)又名周丛藻类,是一种生活在水体基质上的附着生物[1].作为生态系统的重要组成部分、食物链的基础环节[2- 3],其种类组成和分布不但对环境因子的变化具有指示作用,而且还影响到生态系统的结构与功能.同时环境条件的改变也直接或间接影响到藻类群落结构[4- 6].Lotter等[7]对阿尔卑斯山脉的68个小湖泊表层着生硅藻进行研究发现,贫—中营养湖泊主要以链形小环藻(Cyclotellacatenata)为优势种,中—富营养湖泊的硅藻优势种有美丽星杆藻(Asterionellaformosa)、微小冠盘藻(Stephanodiscusparvus)等;Labrenz等[8]发现,黄石国家公园温泉的石灰华沉积物中生活着一些杆状细菌和硅藻,这些微生物的胞外聚合物(EPS)通过不断吸附Ca2+,在生物膜表面使碳酸盐微晶体沉淀并钙化,从而参与和影响喀斯特沉积过程;在对若尔盖湿地调查[9]过程中发现,当地硅藻植物具有明显的北半球高山咸水的特点,拥有常见一些典型的高山冷水种,如雪花泥生藻(Luticolanivalis)等.
黄龙沟整个钙华沉积区均分布有各种着生藻类,其对钙华景观的作用:①增色作用[10],其多样的色泽为黄龙沟五彩缤纷的景色平添无数变化;②参与钙华沉积作用[11],藻类通过与沉积物颗粒紧密结合形成藻席,成层加积和侧向延伸,与水文、地形等因素共同引导和控制钙华景观的形成和规模;③溶蚀钙华景观[12],当藻类分泌酸性物质或其呼吸作用占主导地位时,对钙华景观的破坏更突出;尤其后2种作用受到强调,因藻类具有庞大的生物量及多样的代谢方式,在钙华地貌的形成过程中比其他生物受到更广泛的关注.
目前,黄龙沟藻类存在大量滋生的状况,为对该现象产生原因、发展趋势以及对钙华的影响进行初步探讨,于2015年春、夏、秋季对沟内水体理化性质、藻类群落结构变化进行连续系统的分析,以期提出可能的治理措施,为后期水环境综合管理以及钙华景观保护提供指导意见.
1 材料与方法
1.1 研究区域概况
黄龙风景区位于四川省阿坝藏族羌族自治州松潘县境内,钙华资源数量众多且形态各异,于1992年被联合国教科文组织列为世界自然遗产[13].研究区域定在游客人数众多的黄龙沟主景区,属高原温带亚寒带季风气候类型,终年干燥寒冷,年均气温7 ℃,年均降水量约760 mm,集中于5—10月.
1.2 样本采集及处理
于2015年选择沟内12个最具代表性的样地进行取样,包括典型彩池(如五彩池)、滩流(如金沙铺地)等,冬季(11月—翌年4月)景区内各景点冰雪覆盖,无地表水流淌,故未做冬季的相关研究,只采得春、夏、秋三季样品.采用高精度手持GPS (MobileMap,美国麦哲伦公司)记录各样地的地理位置与海拔.
定量样品采集及处理:在各样地上下游50 m范围内,依据生境(流速、透明度)的不同,挑选10个钙华壁,从各钙华壁上用小铲轻轻刮取面积为60 cm2(4 cm×15 cm的矩形塑料环)的着生藻类,全部刮到盛有蒸馏水的500 mL样品瓶中,用鲁戈氏液固定,贴上标签,带回实验室.直接静置沉淀24 h后,小心弃去上清液,余下90~95 mL沉淀物转入100 mL定量瓶中,再用上清液少许冲洗容器几次,定容至100 mL.
定性样品采集及处理:仍按上述方法,经固定后的藻类带回实验室做种类鉴定.
水样采集及处理:无菌水瓶收集水样1 L,并用0.45 μm孔径的纤维素薄膜过滤除杂.
各样地采集2个平行水样和藻样,置于低温保温箱中,于48 h内带回实验室.
1.3 水环境因子分析
水环境因子检测共9项,包括pH、EC、水温和ρ(DO) 4项物理因子及ρ(TOC)、ρ(TP)、ρ(TN)、ρ(CODMn)和ρ(NO3-) 5项化学因子,所有因子检测按文献[14]进行.pH、EC、水温和ρ(DO)采用便携式多参数水质分析仪(DR2800,美国HACH公司)现场测定;ρ(CODMn)采用COD分析仪(HH- 3,美国HACH公司)测定;ρ(TOC)采用总有机碳分析仪(Liqui TOCⅡ,德国Elementar公司)测定;ρ(TP)和ρ(TN)采用总磷总氮快速测定仪(LH- 3BN,北京连华公司)测定;ρ(NO3-)采用离子色谱仪(ICS- 900,美国赛默飞公司)测定.
1.4 数据分析与处理1.4.1 藻类群落结构特征分析
取0.1 mL经充分摇匀的藻样滴加于0.1 mL计数框中,在光学显微镜(Olympus BX51,江南光电股份有限公司) 1 000倍油镜下进行形态学鉴定[15- 16]和计数[17],计数100个视野,计数2片,取其平均值,如2片计数结果个数相差15%以上则进行第3片计数,取其中个数相近的2片计数结果平均值.所有标本力求鉴定到种,用划“正”的方法记录每个物种的个体数,并对其中部分种类显微摄像.丰度和生物量的计算参照《河流生态调查技术方法》[18]进行.
采用Margalef指数(dMar)、Pielou指数(J′)、Shannon-Wiener指数(H′)、Simpson指数(D)、优势度作为物种多样性的测度指数.具体计算方法:
dMar=(S-1)lnNi
(1)

(2)
J′=H′lnS
(3)

(4)
Y=fiP
(5)
式中,S为某样地种属数,Ni为该地点的种类数,N为总种数,P为某地点种类数占总种数的比率,fi为第i个物种出现频率.将Y≥0.02定为优势种.
通过Origin 8.0中制作箱形图以分析各季节藻类丰度、生物量和多样性变化范围,利用SPSS 19.0对各参数季节间差异进行评价,并通过非参数独立样本检验法(Mann-Whitney U)检验差异的显著水平.
1.4.2 藻类群落结构与环境因子相关性分析
CCA(典型对应分析)是将对应分析和多元回归分析结合,每一步计算结果都与环境因子回归,详细研究物种与环境关系的一种排序方法[19].物种数据矩阵和环境数据矩阵(除pH外)分析前经过lg(x+1)转换处理,使数据接近正态化分布,进而利用Canoco 5.0软件分析环境因子与藻类群落结构的关系.
2 结果与分析
2.1 黄龙藻类群落结构特征2.1.1 藻类群落组成及优势种分析
根据调查统计,12个样地中共检出藻类88种,隶属于5门9纲18目20科37属(见表1).其中,硅藻门23属62种(占70.45%),黄藻门2属12种(占13.64%),蓝藻门5属5种(占5.68%),绿藻门6属7种(占7.96%),裸藻门1属2种(占2.27%).各季节藻类群落结构存在差异,春季共发现藻类4门18属41种,夏季5门32属73种,秋季5门36属83种.
优势度分析结果表明,春季、夏季、秋季的优势藻分别为6、15、20种(见表2).其中,桥弯藻属的部分物种(如新月形桥弯藻、近平截桥弯藻等)及舟形藻属的长圆舟形藻三季均有出现,扁圆卵形藻和膨大曲壳藻新增为夏季、秋季的优势种,奥地利弯肋藻、普通肋缝藻、念珠状等片藻待入秋后才繁殖迅速.
2.1.2 丰度、生物量的季节变化
由图1可见,藻类丰度和生物量季节间差异不明显,二者变化规律极为相似.春季、夏季、秋季丰度平均值分别为2.10×104、2.53×104和3.32×104L-1,生物量平均值分别为0.03、0.04和0.04 mgL.春季,藻类丰度和生物量均较低;夏季,水体营养盐含量的增加使藻类生长进入对数期;秋季,藻类生长逐渐进入平稳期,表现为丰度和生物量略微增加.
2.1.3 物种多样性分析
由图2可见,Margalef指数与季节的相关性显著(P<0.05),表现为随季节更替逐渐增加.Margalef指数春季介于1.44~2.87之间,夏季(1.73~5.55)大幅上升,秋季(2.58~5.71)虽有所增加,但程度并不明显.同Margalef指数相比,Pielou指数随季节更替则呈逐渐下降趋势,春季、夏季、秋季平均值分别为0.18、0.14和0.13.Shannon-Wiener多样性指数和Simpson指数受季节的影响不显著(P=0.10),分别在0.33±0.04及0.82±0.18之间波动.
2.2 水环境因子季节性变化特征
由表3可见,pH相对于其他指标季节性变异最小,春季、夏季、秋季其变异系数分别为4.23%、4.15%和4.91%,水质总体呈弱碱性.ρ(TOC)季节性变异最大,变异系数分别为101.48%,34.01%和56.58%,随季节更替ρ(TOC)逐渐增加,主要出现在五彩池、飞瀑流辉、迎宾池等地.水温普遍在15 ℃以内,ρ(DO)均大于7.5 mgL.ρ(TP)随季节的更替逐渐增加,最大值均未超过0.10 mgL,春季超标率为62.51%,夏季、秋季均为100%.ρ(TN)表现为夏季>秋季>春季,三季中五彩池中其值均为最高,春季、夏季、秋季分别超标11.05、12.70及13.57倍.ρ(CODMn)春季最低,均值为41.41 mgL;夏季、秋季其值相当,不分伯仲,平均值分别为65.83和68.53 mgL,最低值均高于40 mgL.由此可见,黄龙景区水环境从某种程度来说已经受到了影响.
2.3 影响黄龙藻类群落结构的环境因子分析
将10种环境因子(包括海拔及9种水环境因子)与藻种类分布情况进行CCA,其中环境因子用带有箭头的矢量线表示,三角表示物种种类.由图3可见,藻类与轴1和轴2的相关性好,前两轴的特征值分别为0.21和0.20,它们共解释藻类物种数据累积方差值的41.25%.环境因子与藻类群落结构的相关性大小为pH>海拔>ρ(TN)>EC>ρ(CODMn)>ρ(TOC)>水温>ρ(DO)>ρ(NO3-)>ρ(TP).通过蒙特卡罗检验对各因子影响程度进行显著性检验发现,自然因子pH(F=1.6,P=0.02)、海拔(F=1.5,P=0.04)是显著影响藻类群落结构的环境因子,而人为因子ρ(TN)(F=1.4,P=0.066)和ρ(CODMn) (F=1.3,P=0.066)对藻类群落结构的影响程度次于自然因子.
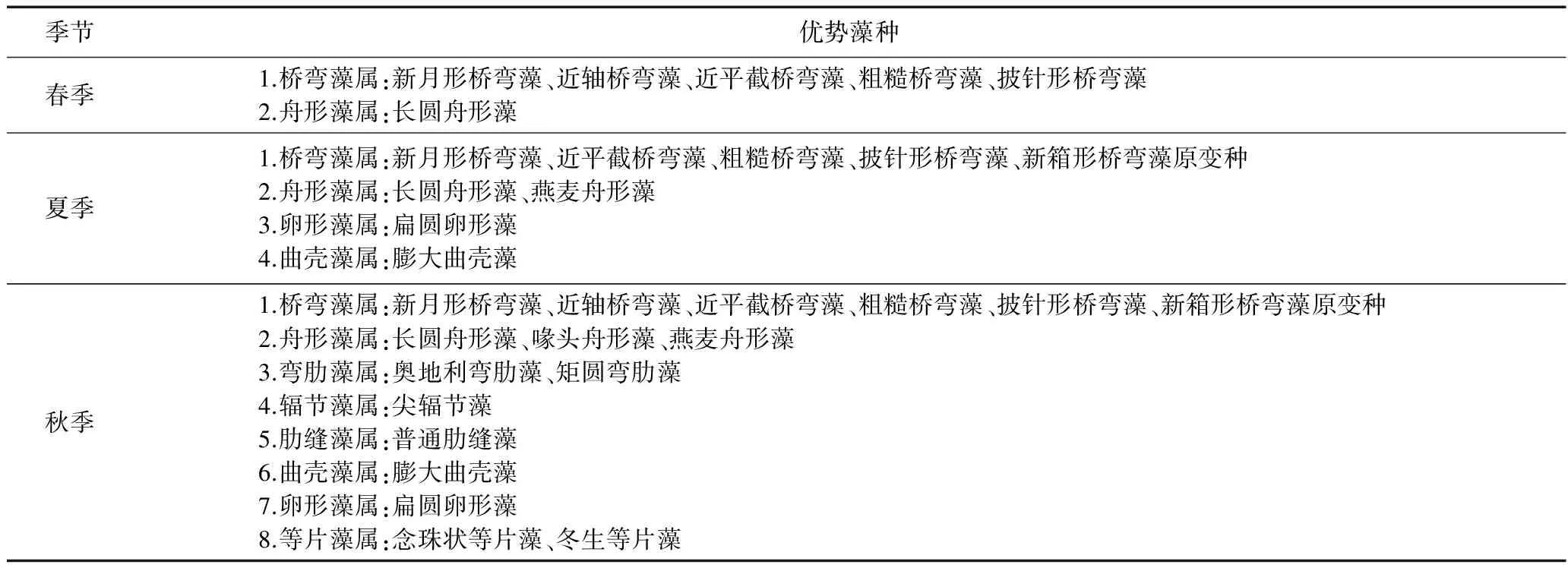
表2 黄龙藻类不同季节优势种

图1 黄龙藻类丰度和生物量的季节变化Fig.1 The seasonal variation of algal abundance and biomass in Huanglong Scenic Area

图2 黄龙藻类物种多样性指数的季节变化Fig.2 The seasonal variation of algal species diversity in Huanglong Scenic Area

季节统计值pHEC∕(mS∕cm)水温∕℃ρ∕(mg∕L)DOTOCTPTNCODMnNO3-最小值7.413.455.707.710.300.010.0320.621.08最大值8.357.5413.509.155.100.042.4169.972.90春季平均值7.945.4611.008.421.500.031.1341.411.85标准差0.341.392.520.581.520.010.7216.930.66变异系数∕%4.2325.4522.876.87101.4841.4563.9840.8935.46最小值7.283.616.107.602.010.042.6052.861.44最大值8.176.5614.208.998.580.092.9572.523.29夏季平均值7.734.769.708.455.540.052.7565.832.01标准差0.320.942.280.441.880.010.107.160.48变异系数∕%4.1519.7223.605.1734.0131.103.5810.8824.14最小值7.253.893.307.620.920.061.9052.501.55最大值8.778.428.809.7312.950.082.9178.601.89秋季平均值8.155.165.808.586.030.072.0468.531.65标准差0.401.471.820.603.410.010.289.410.09变异系数∕%4.9128.4231.636.9856.588.8313.7613.735.57

图3 环境因子与藻类群落的典范对应分析Fig.3 Canonical correspondence analysis(CCA) of species-environmental relationships
3 讨论
3.1 黄龙藻类群落结构特征
纵观黄龙各季节藻类群落结构可发现,每个样地群落成分不尽相同,但却表现出共有特征,即由丝状藻类构成整个群落的框架结构,单细胞藻类星点状镶嵌其中.硅藻门和黄藻门的藻类覆盖度(80%以上)较大,硅藻门以粗糙桥弯藻、长圆舟形藻等为主,黄藻门以近缘黄丝藻、狭细黄丝藻等为主,这些种类分布范围广,常生活在贫营养、低电导水环境,水体自净能力高,可作为寡污带生态环境的指示种类[20];由于黄龙水环境中性偏碱、长年低温[21],独特的生态环境使得外来物种不论是种类上还是数量上都不占优势,据此推测,这些优势藻类应为土著物种.这也与其他高海拔、高寒地区的水体极易出现以硅藻、黄藻为优势类群的群落特征基本一致[22- 23].
物种丰度、生物量、Margalef指数随旅游旺季(5—10月)呈上涨趋势.究其原因,可能是因为入夏后景区游客活动频繁,丰沛的水量、充裕的有机质以及充足的光照,为藻类繁殖提供良好的条件;而秋季水流逐渐减缓,藻类由于前一时期水流的迁移作用在各区域分布趋于稳定,丰度、生物量和Margalef指数基本持于同一水平[24].Margalef指数增加,从某种程度上会引起Pielou指数的下降[25].
春季由于物种丰富度低,均匀度表现得很高,集中体现为春季Pielou指数明显大于夏秋两季,并且在夏秋两季较为稳定,变化较小.春季最高可能是藻类多数处于休眠期,种属数单一而物种数丰富的缘故[26];夏季水量充沛,水流迁移与稀释作用无形中增加了各区域物种组成的相似性,即Pielou指数在各样地趋于一致,加上藻类共生等综合因素,使得夏季物种均匀度高于秋季[25].
分析Simpson指数和Shannon-Wiener多样性指数发现,调查区域藻类成分复杂,种类繁多,各样地种类均有交叉,相似程度不一,群落结构虽因水量、水温等环境因素变化在一定程度上出现时空的改变,却从总体上维持着恒定的物种多样性[25].
3.2 藻类群落结构与环境因子的关系
由CCA结果(见图3)可知,自然因子(pH、海拔)相比人为因子〔ρ(TN)、ρ(CODMn)〕对藻类群落结构的影响更显著.欣顿桥弯藻、喙头舟形藻等单细胞藻类受海拔影响大,上游坡度陡且落差大,造成大量藻类同有机质被湍急的水流冲刷至地势平坦、水流平缓的低海拔处,有机质等营养物质的富集使得物种丰度增加,种类更丰富.谭啸等[27]采用模拟升温的方法研究升温过程对藻类复苏的影响发现,绿藻和硅藻在9 ℃已开始复苏,而蓝藻在12.50 ℃左右才开始复苏,黄龙风景区地处川西北高原地区,终年气候严寒,尚未见类似蓝藻爆发水华的现象.未来,随着全球气候变暖加剧以及游客人数猛增,在有机质持续增加的情况下,随藻类光合作用对有机质的利用,水体有机质不断减少,导致pH不断升高[28],pH在 6.50~9.50 范围内,铜绿微囊藻(Microcystisaeruginosa)等多污带物种均有较高的生长量[29],最终水质恶化,爆发水华,取代原先的土著物种成为优势种,破坏当地生态系统.
五彩池、飞瀑流辉、迎宾池是游客较集中的样地,水质难免会受到旅游活动的影响,ρ(TN)、ρ(CODMn)随旅游旺季持续不断上升.国庆节后,五彩池中近缘黄丝藻生长繁茂,同时还能偶见点形平裂藻(α中污带种类),ρ(CODMn)为57.50 mgL,超春季(17.70 mgL)2倍,Margalef指数与ρ(CODMn)表现出明显正相关(P<0.01).飞瀑流辉、迎宾池的ρ(TN)在持续增长的情况下,藻类群落依旧以贫营养型物种为主,同时可见一定量的α中污带物种,如奥克尼颤藻、变异直链藻等,附着于钙华壁上.氮和磷是藻类繁殖过程中必不可少的元素,氮磷浓度增加,在促进藻类生长的同时也加速湖泊营养化进程[30].近些年游客人数的激增使得景区内餐饮、购物等服务行业得到迅速发展,在对景区整个旅游季节水样采集分析后发现,随游客人数的增减,水中氮磷浓度变化趋势与之一致;同时,氮磷浓度增加对水藻生长也有着明显的促进作用[31].一般来说,藻类健康生长及生理平衡所需氮磷比为16∶1,而环境会优先选择与之相适应的优势物种,形成适者生存的群落,所以水体氮磷比例对藻类种群结构有重要决定作用[32].结合水质参数分析结果发现,游客集中的景点氮磷比普遍大于30∶1,磷成为限制藻类正常生长的关键因子,这与王勇等[33]在研究淡水生态系统中水藻生长限制因子的结果相一致.
水体中潜在的污染因子改变着藻类生长的局部微环境,而藻类以其微小的个体和巨大的比表面积对周围环境变化表现得异常敏感,并做出迅速响应,不同营养需求的藻类在生长速度和数量上发生分化,原有群落内部发生生态位交替,如局部富营养化使得富营养型藻类大量繁殖,而贫营养型藻类生长受抑[34- 35].目前,各种营养型藻类共处同一群落,这种暂时性的平衡状态在未来以何种方式被打破,将取决于环境变化朝哪一方向倾斜;同时还发现,沿途地表水在流动过程中不断下渗,并且相当一部分转变为地下水,由于长期缺乏岩溶水滋养,藻类死亡,藻类遗体在其他微生物作用下可氧化分解成具有溶蚀作用的草酸,侵蚀石灰岩[36].众所周知,岩溶环境本身是一种脆弱的生态环境,极易受到人类活动的影响而恶化,一旦破坏将很难恢复.综上所述,应引起黄龙管理局的高度重视,现阶段加强水质实时监测,及时掌握动态变化;引导游客文明游览,适当减少旺季人数;控制污染物排放量,恢复水体正常生态;加强监管恢复力度,实现可持续发展.
4 结论
a) 试验共检出藻类88种,隶属于5门9纲18目20科37属,其中硅藻种类占绝对优势,含23属62种;其次为黄藻、蓝藻和绿藻,分别含2属12种、5属5种以及6属7种;裸藻最少,仅含1属2种.土著藻类主要以贫营养型物种为主,中—富营养型藻类繁殖具有季节性.
b) 随季节更替,物种丰度、生物量、Margalef指数逐渐增加,Pielou指数下降,Shannon-Wiener指数和Simpson指数变化不明显.
c) 目前,自然因子(pH和海拔)是影响藻类群落结构的主导环境因子,而人为因子〔ρ(TN)和ρ(CODMn)〕的影响程度次于前者.
d) 研究初步认为黄龙水体营养化防治应以控制污染物排放为主,及时回收景区垃圾,规范景区商业摊点,适当减少旺季游客人数.
致谢: 野外考察工作得到黄龙景区管理局的支持,室内分析测试工作得到西南科技大学水处理及污染试验控制中心的老师和同学的帮助,文章撰写和修改得到导师和各位专家的指点,特此一并致谢!
[1] LOMAN J.Effects of tadpole grazing on periphytic algae in ponds[J].Wetlands Ecology and Management,2001,9(2):135- 139.
[2] BORDUQUI M,FERRAGUT C.Factors determining periphytic algae succession in a tropical hypereutrophic reservoir[J].Hydrobiologia,2012,683(1):109- 122.
[3] DUNCK B,BORTOLINI J C,RODRIGUES L,etal.Functional diversity and adaptative strategies of planktonic and periphytic algae in isolated tropical floodplain lake[J].Brazilian Journal of Botany,2013,36(4):257- 266.
[4] VYVERMAN W.Multivariate analysis of periphytic and benthic diatom assemblages from Papua New Guinea[J].Hydrobiologia,1992,234(3):175- 193.
[5] HÜRLIMANN J,SCHANZ F.The effects of artificial ammonium enhancement on riverine periphytic diatom communities[J].Aquatic Sciences,1993,55(1):40- 64.
[6] DUONG T T,COSTE M,FEURTET-MAZEL A,etal.Responses and structural recovery of periphytic diatom communities after short-term disturbance in some rivers (Hanoi,Vietnam)[J].Journal of Applied Rhycology,2012,24(5):1053- 1065.
[7] LOTTER A F,BIRKS H J B,HOFMANN W,etal.Modern diatom,cladocera,chironomid,and chrysophyte cyst assemblages as quantitative indicators for the reconstruction of past environmental conditions in the Alps.II.nutrients[J].Journal of Paleolimnology,1997,19(4):395- 420.
[8] LABRENZ M,DRUSCHEL G K,THOMSEN-EBERT T,etal.Formation of sphalerite (ZnS) deposits in natural biofilms of sulfate-reducing bacteria[J].Science,2000,290(5497):1744- 1747.
[9] 刘琪.四川若尔盖湿地及其附近水域硅藻的分类及生态研究[D].杭州:浙江大学,2015:1- 8.
[10] 傅华龙,韩福山,周绪纶,等.四川黄龙钙华景观中的藻类植物[J].资源开发与保护杂志,1989,5(3):40- 41. FU Hualong,HAN Fushan,ZHOU Xulun,etal.The algae exist in Huanglong travertine landscape,Sichuan Province[J].Resources Exploitation and Conservation,1989,5(3):40- 41.
[11] 张捷.地表喀斯特沉积中藻类作用的观察研究[J].地理研究,1992,11(2):26- 33. ZHANG Jie.Observation on algal effects on subaerial karst sedimentation[J].Geographical Research,1992,11(2):26- 33.
[12] LI Yongxin.Effects of algae in tufa landscapes of Huanglong Scenic Area[J].Journal of Landscape Research,2011,3(1):52- 55.
[13] 刘再华,袁道先,何师意,等.四川黄龙沟景区钙华的起源和形成机理研究[J].地球化学,2003,32(1):1- 10. LIU Zaihua,YUAN Daoxian,HE Shiyi,etal.Origin and forming mechanisms of travertine at Huanglong Ravine of Sichuan[J].Geochimica,2003,32(1):1- 10.
[14] 国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002:836.
[15] B.福迪,罗迪安.藻类学[M].上海:上海科学技术出版社,1980:474.
[16] 胡鸿钧,魏印心.中国淡水藻类:系统、分类及生态[M].北京:科学出版社,2006:1516.
[17] 金相灿,屠清瑛.湖泊富营养化调查规范[M].2版.北京:中国环境科学出版社,1995:316.
[18] 孟伟,张远,渠晓东,等.河流生态调查技术方法[M].北京:科学出版社,2011:176.
[19] TERBRAAK C J F.Canonical correspondence analysis:a new eigenvector technique for multivariate direct gradient analysis[J].Ecology,1986,67(5):1167- 1179.
[20] WHITFORD L A,SCHUMACHER G J.Communities of algae in North Carolina streams and their seasonal relations[J].Hydrobiologia,1963,22(22):133- 196.
[21] 石岩.黄龙水环境特征与钙华景观演化趋势研究[D].成都:成都理工大学,2005:26- 27.
[22] SERRA T,COLOMEN J,BASERBA C,etal.Quantified distribution of diatoms during the stratified period of Boadella reservoir[J].Hydrobiologia,2002,489(1):235- 244.
[23] SUN S Y,DONG F Q,EHRLICH H,etal.Metabolic influence of psychrophilic diatoms on travertines at the Huanglong Natural Scenic District of China[J].International Journal of Environmental Research and Public Health,2014,11(12):13084- 13096.
[24] 刘明学,董发勤,孙仕勇,等.黄龙钙华水体藻多样性及分布规律研究[J].环境科学与技术,2013,36(1):182- 186. LIU Mingxue,DONG Faqin,SUN Shiyong,etal.Diversity and distribution of tufa water algae in Huanglong national scenic spot[J].Environmental Science & Technology(China),2013,36(1):182- 186.
[25] MAGURRAN A E.Measuring biological diversity[M].Oxford,UK:Blackwell Science,2004.
[26] ANIL A C,MITBAVKAR S,D′SILVA M S,etal.Effect of ageing on survival of benthic diatom propagules[J].Journal of Experimental Marine Biology and Ecology,2007,343(1):37- 43.
[27] 谭啸,孔繁翔,于洋,等.升温过程对藻类复苏和群落演替的影响[J].中国环境科学,2009,29(6):578- 582. TAN Xiao,KONG Fanxiang,YU Yang,etal.Effects of enhanced temperature on algae recruitment and phytoplankton community succession[J].China Environmental Science,2009,29(6):578- 582.
[28] 王培,曹建华,李亮,等.不同来源小球藻对岩溶水Ca2+、HCO3-利用的初步研究[J].水生生物学报,2013,37(4):626- 631. WANG Pei,CAO Jianhua,LI Liang,etal.Utilization of Ca2+and HCO3-in Karst water by chlorella from different sources[J].Acta Hydrobiologica Sinica,2013,37(4):626- 631.
[29] LU Zhiying,ZHANG Yongyuan,GAO Yunni,etal.Effects of pyrogallic acid onMicrocystisaeruginosa:oxidative stress related toxicity[J].Ecotoxicology and Environmental Safety,2016,132:413- 419.
[30] CONLEY D J,PAERL H W,ROBERT W,etal.Controlling eutrophication:nitrogen and phosphorus[J].Science,2009,323(5917):1014- 1015.
[31] 张金流,王海静,刘再华.旅游活动对黄龙景区磷酸盐浓度和水藻生长的影响[J].地球学报,2011,32(4):463- 468. ZHANG Jinliu,WANG Haijing,LIU Zaihua.The impact of tourist activities on PO43-concentrations and aquatic algae growth at the Huanglong Scenic Spot,Sichuan Province[J].Acta Geoscientica Sinica,2011,32(4):463- 468.
[32] GÜSEWELL S.N∶P ratios in terrestrial plants:variation and functional significance[J].New Phytologist,2004,164(2):243- 266.
[33] 王勇,焦念志.营养盐对浮游植物生长上行效应机制的研究进展[J].海洋科学,2000,24(10):30- 32. WANG Yong,JIAO Nianzhi.Research progresses in nutrient bottom-up effect on phytoplankton growth[J].Marine Sciences,2000,24(10):30- 32.
[34] KEITHROACH M J,BRYAN N D,BARDGETT R D,etal.Seasonal changes in the microbial community of a salt marsh,measured by phospholipid fatty acid analysis[J].Biogeochemistry,2002,60(1):77- 96.
[35] PETERSON A T.Uses and requirements of ecological niche models and related distributional models[J].Biodivers Inform,2006(3):59- 72.
[36] 王福星,曹建华,黄俊发,等.生物岩溶[M].北京:地质出版社,1993:61.
Effects of Environmental Factors on Algal Community Structure in Huanglong Scenic Area
ZHANG Cunkai1, LI Qiongfang1*, TANG Shu2, ZHANG Qingming2, CHEN Chao1, LÜ Zhizhou1, ZHANG Wenjing1
1.School of Life Science and Engineering, Southwest University of Science and Technology, Mianyang 621010, China 2.Huanglong National Scenic Spot Administration, Aba 623300, China
Periphytic algae are breeding rapidly in the travertine deposition landscapes of Huanglong, Sichuan Province, China. In order to ascertain the reasons, trends and effects of this situation, an investigation was carried out in 2015. Water and algae samples were collected in spring, summer and autumn from twelve typical sampling spots. According to the analysis results of environmental factors and community structure, canonical correspondence analysis (CCA) was applied to find out the key environmental factors affecting the community structure. The results showed that: (1) A total of 88 species of algae affiliated with 5 phyla, 9 classes, 18 orders, 20 families and 37 genera were identified. Meanwhile, the oligotrophic and native species were dominant in the community. (2) As the seasons changed, the species abundance, biomass and Margalef index increased, the Pielou index decreased, and the index of Simpson and Shannon-Wiener smoothed. (3) Based on the results of CCA, pH (F=1.6,P=0.02) and altitude (F=1.5,P=0.04) were thought to be crucial factors for the community structure. The research indicated that, at the present environmental conditions, the influence of natural factors was greater than human factors. To formulate a strategy of water quality assessment and travertine resources protection, the effects of special environmental factors should be considered.
Huanglong Scenic Area; periphytic algae; community structure; environmental factors; dominant species
2016- 03- 01
2016- 10- 26
国家自然科学基金项目(41472309,41572035);西南科技大学研究生创新基金项目(15ycx094)
张存凯(1991-),男,贵州贵阳人,zhangcunkai1991@sina.com.
*责任作者,李琼芳(1973-),女,四川绵阳人,副教授,博士,主要从事微生物生态学研究,liqiongfang1992@126.com
X171
1001- 6929(2017)02- 0224- 08
A
10.13198j.issn.1001- 6929.2017.01.36
张存凯,李琼芳,唐淑,等.影响黄龙藻类群落结构的环境因子分析[J].环境科学研究,2017,30(2):224- 231.
ZHANG Cunkai,LI Qiongfang,TANG Shu,etal.Effect of environmental factors on algal community structure in Huanglong Scenic Area[J].Research of Environmental Sciences,2017,30(2):224- 231.
