安子合剂对抗磷脂抗体阳性流产小鼠TLR4/MyD88/NF-κB信号通路的影响Δ
2017-02-18陆启滨南京中医药大学附属医院妇科南京210029
柳 静,陆启滨(南京中医药大学附属医院妇科,南京 210029)
安子合剂对抗磷脂抗体阳性流产小鼠TLR4/MyD88/NF-κB信号通路的影响Δ
柳 静*,陆启滨#(南京中医药大学附属医院妇科,南京 210029)
目的:研究安子合剂对抗磷脂抗体(APA)阳性流产小鼠Toll样受体4(TLR4)/髓样分化因子88(MyD88)/核因子κB(NF-κB)信号通路的影响,探讨其抗APA阳性流产作用机制。方法:将BALB/c小鼠(♀)随机分为空白对照组、模型组、阿司匹林组(阳性对照,0.019 5 g/kg)和安子合剂低、中、高剂量组(37.7、75.4、150.8 g/kg,以生药计),每组10只。除空白对照组外,其余各组小鼠均以人β2-糖蛋白Ⅰ为诱导剂建立APA阳性流产模型。从妊娠第1天起,各给药组小鼠ig相应药物,空白对照组和模型组小鼠ig等体积生理盐水,每天1次,连续9 d。分别采用实时荧光定量聚合酶链反应法和免疫组化法测定胎盘组织TLR4、髓样分化蛋白2(MD2)、MyD88、NF-κB mRNA及其蛋白表达水平。结果:与空白对照组比较,模型组小鼠胎盘组织TLR4、MD2、MyD88、NF-κB mRNA及其蛋白表达水平均显著升高(P<0.01)。与模型组比较,阿司匹林组和安子合剂低、中剂量组小鼠胎盘组织TLR4、MD2、MyD88 mRNA及其蛋白表达水平,安子合剂高剂量组小鼠胎盘组织TLR4蛋白表达水平,以及各给药组小鼠胎盘组织NF-κB蛋白表达水平均显著降低(P<0.05或P<0.01);安子合剂低剂量组小鼠胎盘组织TLR4、MD2 mRNA表达水平和MD2、MyD88蛋白表达水平较阿司匹林组更低(P<0.05或P<0.01)。结论:安子合剂可抑制APA阳性流产小鼠TLR4/MyD88/NF-κB信号通路转导,这可能是其抗APA阳性流产的作用机制之一。
安子合剂;抗磷脂抗体;TLR4/MyD88/NF-κB信号通路;流产小鼠;胎盘组织
抗磷脂抗体(Antiphospholipid antibody,APA)阳性流产是自身免疫流产中最为常见的一种,可引起复发性流产以及严重的产科并发症(如早产、宫内生长迟缓或胎盘机能不全等),危害女性生殖健康[1]。APA包括抗心磷脂抗体(Anticardiolipin antibody,ACA)、抗β2-糖蛋白Ⅰ抗体(Anti-β2-glycoproteinⅠantibody)和狼疮抗凝物(Lupus anticoagulant),其中抗β2-糖蛋白Ⅰ被认为是妊娠丢失的独立危险因素。研究发现抗β2-糖蛋白Ⅰ可与其抗原结合形成复合物,活化Toll样受体4(Toll-like receptor 4,TLR4),引起髓样分化蛋白2(Myeloid differentiation-2,MD2)的分泌,启动髓样分化因子88(Myeloid differentiation factor 88,MyD88)进行细胞内信号转导,最终激活核因子κB(Nuclear factor-κB,NF-κB),诱导内皮细胞活化,释放血栓及炎症相关细胞因子,导致妊娠排斥和丢失。TLR4/MyD88/NF-κB信号通路转导异常成为APA阳性流产机制研究中新的研究热点[2]。
中医安胎法源远流长,是中医妇科学中颇有优势和特色的治法之一。南京中医药大学附属医院妇科研制的安子合剂由续断、桑寄生、菟丝子、苎麻根、丹参、黄芩、白术、太子参、甘草等12种中药材组成,具有补肾健脾、清热活血的功效,其自1999年成为院内制剂以来,临床应用的保胎成功率达90.0%[3]。前期研究表明,安子合剂具有降低孕鼠外周血ACA滴度、调节免疫功能、影响细胞增殖等作用[4-6],但其作用靶点尚不十分明确。本研究在前期工作及相关文献报道[4-6]的基础上,以人β2-糖蛋白Ⅰ为免疫原建立APA阳性流产小鼠模型,探讨安子合剂对模型小鼠胎盘组织TLR4/MyD88/NF-κB信号转导通路中关键分子的影响,旨在从免疫炎症角度揭示其抗APA阳性流产的作用机制。
1 材料
1.1 仪器
DX-45光学显微镜(日本Olympus公司);Mikro 200R冷冻离心机(德国Hettich公司);Nanodrop 2000核酸定量仪(美国Thermo公司);Veriti@96 Well Thermal Cycler实时荧光定量聚合酶链式反应(RT-PCR)系统(美国ABI公司)。
1.2 药品与试剂
安子合剂(南京中医药大学附属医院制剂部自制,批号:1308002,规格:250 mL/瓶,其中含原药材0.58 g/mL);阿司匹林肠溶片(石药集团欧意药业有限公司,批号:018140883,规格:每片25 mg);人β2-糖蛋白Ⅰ(以色列ProSpec公司,批号:PRO-388,纯度:>98%);弗氏完全佐剂(CFA)、弗氏不完全佐剂(IFA)购自美国Sigma公司;反转录试剂盒、Trizol试剂(日本Takara公司,批号:A4537、AA2103-1);TLR4、MD2抗体(英国Abcam公司,批号:ab13556、ab73550);MyD88、NF-κB抗体(美国CST公司,批号:4283S、8242P);TLR4、MD2、MyD88、NF-κB引物均由南京金斯瑞公司合成;TLR4、MD2、MyD88、NF-κB免疫组化试剂盒(美国Bio-world公司,批号:20317592-1、203106740-1、20300164-1、20300068-1)。
1.3 动物
SPF级健康BALB/c小鼠90只[♀:60只,8周龄,体质量(25±2)g;♂:30只,8~10周龄,体质量(25±2)g],均购自常州卡文斯实验动物有限公司,动物许可证号为SCXK(苏)2011-0003,合格证号为201401513。采用SPF级小鼠标准全营养饲料饲养。
2 方法
2.1 分组、造模与给药
将60只BALB/c小鼠(♀)随机为6组,每组10只,分别为空白对照组、模型组、阿司匹林组(阳性对照,0.019 5 g/mL)[5-6]和安子合剂低、中、高剂量组(以生药计给药剂量分别为37.7、75.4、150.8 g/mL,按成人临床剂量的1、2、4倍剂量换算而得)。除空白对照组外,其余各组小鼠参照文献[7-8]中方法以人β2-糖蛋白Ⅰ为免疫原建立APA阳性流产小鼠模型:将β2-糖蛋白Ⅰ溶于无菌磷酸盐缓冲液(PBS)中,调整质量浓度为400 μg/mL。从实验第1天开始ip人β2-糖蛋白Ⅰ与CFA体积比为1∶1的混合液50 μL;实验第8天以IFA代替CFA加强免疫1次,剂量同第1次免疫。于实验第18天,各组♀小鼠与♂小鼠以2∶1的比例合笼,自合笼之日起,每天早上8:00和下午14:00分别观察1次,若观察到角化细胞中夹有大量精子和/或见到阴栓则计为妊娠第0.5天。从妊娠第1天起各给药组小鼠均按0.1 mL/10 g ig给药,空白对照组和模型组小鼠ig等体积蒸馏水,每天1次,连续9 d。在妊娠第9.5天时颈椎脱臼法处死小鼠,留取胎盘组织进行相关指标测定。
2.2 RT-PCR法测定小鼠胎盘组织TLR4、MD2、MyD88、NF-κB mRNA表达水平
采用Trizol液处理剪碎的胎盘组织并提取总RNA,根据反转录试剂盒说明书进行反转录合成cDNA,以cDNA为模版进行扩增。反应体系:Real-time PCR Master Mix混合液10 μL,上、下游引物各0.4 μL,cDNA模板2 μL,灭菌双蒸水7.2 μL,体系共20 μL。在基因表达的半定量分析中,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,通过与GAPDH表达量比较实现待测基因表达量的标准化。反应条件:扩增阶段为95℃、5 min;95℃、15 s,60℃、60 s,共40个循环;溶解曲线阶段为95℃、15 s,60℃、1 min,95℃、15 s。用RT-PCR系统自带软件进行溶解曲线分析,以2-ΔΔct法[9]计算目的基因mRNA的相对表达量。基因引物序列及产物长度见表1。
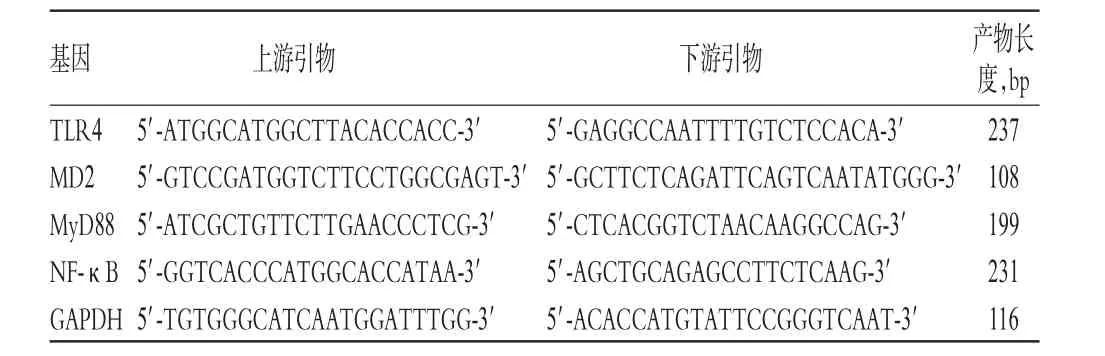
表1 基因引物序列及扩增长度Tab 1 Gene primers and amplification length
2.3 免疫组化法测定小鼠胎盘组织TLR4、MD2、MyD88、NF-κB蛋白表达水平
常规制备小鼠胎盘组织石蜡切片。常规脱蜡、脱水,PBS冲洗3次,每次3 min;3%双氧水(H2O2)常温孵育15 min,PBS冲洗3次,每次3 min;3%牛血清白蛋白(BSA)封闭30 min后加入相应一抗,湿盒4℃孵育过夜,PBS冲洗3次,每次5 min;加入50 μL生物素标记的二抗,室温孵育20 min,PBS冲洗3次,每次5 min;加辣根过氧化物酶标记的链霉素卵白素工作液,室温孵育20 min后PBS冲洗3次,每次5 min;加入二氨基联苯胺(DAB)显色液,室温下显色2~5 min,镜下控制;苏木精复染,常规脱水、透明、封片。阳性产物均定位于细胞浆,以细胞浆着色呈棕褐色为阳性细胞。以计算机图像分析软件(Image-Pro Plus,IPP)分析TLR4、MD2、MyD88、NF-κB的积分光密度(IOD)值,以此反映阳性表达的强弱。
2.4 统计学方法
3 结果
3.1 各组小鼠胎盘组织TLR4、MD2、MyD88、NF-κB mRNA表达水平测定结果
与空白对照组比较,模型组小鼠胎盘组织TLR4、MD2、MyD88、NF-κB mRNA表达水平均明显升高(P<0.01);与模型组比较,阿司匹林组和安子合剂低剂量组小鼠胎盘组织TLR4、MD2、MyD88、NF-κB mRNA表达水平均明显降低(P<0.01),安子合剂中剂量组小鼠胎盘组织TLR4、MD2、MyD88 mRNA表达水平降低(P<0.05或P<0.01),安子合剂高剂量组上述指标差异均无统计学意义(P>0.05);与阿司匹林组比较,安子合剂低剂量组小鼠胎盘组织TLR4、MD2、MyD88、NF-κ B mRNA表达水平降低更为明显,其中TLR4、MD2 mRNA表达水平差异有统计学意义(P<0.01),结果详见表2。
表2 各组小鼠胎盘组织TLR4、MD2、MyD88、NF-κB mRNA表达水平测定结果(±s,n=10)Tab 2 The mRNA expression levels of TLR4,MD2,MyD88 and NF-κB in placental tissue of mice in each group(±s,n=10)
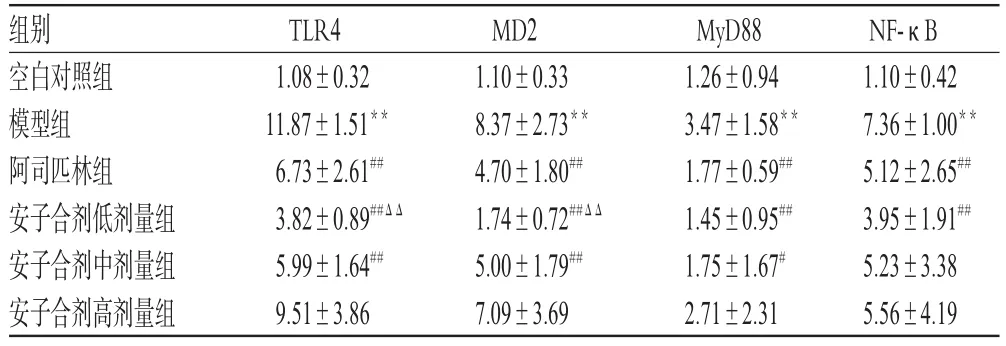
表2 各组小鼠胎盘组织TLR4、MD2、MyD88、NF-κB mRNA表达水平测定结果(±s,n=10)Tab 2 The mRNA expression levels of TLR4,MD2,MyD88 and NF-κB in placental tissue of mice in each group(±s,n=10)
注:与空白对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与阿司匹林组比较,ΔΔP<0.01Note:vs.blank control group,**P<0.01;vs.model group,#P<0.05,##P<0.01;vs.aspirin group,ΔΔP<0.01
组别空白对照组模型组阿司匹林组安子合剂低剂量组安子合剂中剂量组安子合剂高剂量组NF-κB 1.10±0.42 7.36±1.00**5.12±2.65##3.95±1.91##5.23±3.38 5.56±4.19 TLR4 1.08±0.32 11.87±1.51**6.73±2.61##3.82±0.89##ΔΔ5.99±1.64##9.51±3.86 MD2 1.10±0.33 8.37±2.73**4.70±1.80##1.74±0.72##ΔΔ5.00±1.79##7.09±3.69 MyD88 1.26±0.94 3.47±1.58**1.77±0.59##1.45±0.95##1.75±1.67#2.71±2.31
3.2 各组小鼠胎盘组织TLR4、MD2、MyD88、NF-κB蛋白表达水平测定结果
与空白对照组比较,模型组小鼠胎盘组织TLR4、MD2、MyD88、NF-κB蛋白表达水平明显升高(P<0.01);与模型组比较,各给药组小鼠胎盘组织TLR4、MD2、MyD88、NF-κB蛋白表达水平不同程度地降低,除安子合剂高剂量组小鼠胎盘组织MD2、MyD88蛋白表达水平降低不显著外其余各组差异均有统计学意义(P<0.05或P<0.01);与阿司匹林组比较,安子合剂低剂量组小鼠胎盘组织中MD2、MyD88表达水平明显降低(P<0.05),结果详见表3、图1。
表3 各组小鼠胎盘组织TLR4、MD2、MyD88、NF-κB蛋白表达水平测定结果(±s,n=10)Tab 3 The protein expression levels of TLR4,MD2,MyD88 and NF-κB in placental tissue of mice in each group(±s,n=10)
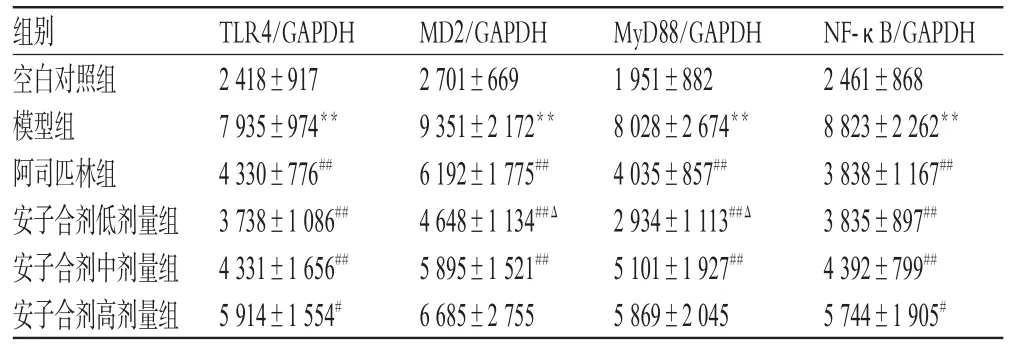
表3 各组小鼠胎盘组织TLR4、MD2、MyD88、NF-κB蛋白表达水平测定结果(±s,n=10)Tab 3 The protein expression levels of TLR4,MD2,MyD88 and NF-κB in placental tissue of mice in each group(±s,n=10)
注:与空白对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与阿司匹林组比较,ΔP<0.05Note:vs.blank control group,**P<0.01;vs.model group,#P<0.05,##P<0.01;vs.aspirin group,ΔP<0.05
组别空白对照组模型组阿司匹林组安子合剂低剂量组安子合剂中剂量组安子合剂高剂量组NF-κB/GAPDH 2 461±868 8 823±2 262**3 838±1 167##3 835±897##4 392±799##5 744±1 905#TLR4/GAPDH 2 418±917 7 935±974**4 330±776##3 738±1 086##4 331±1 656##5 914±1 554#MD2/GAPDH 2 701±669 9 351±2 172**6 192±1 775##4 648±1 134##Δ5 895±1 521##6 685±2 755 MyD88/GAPDH 1 951±882 8 028±2 674**4 035±857##2 934±1 113##Δ5 101±1 927##5 869±2 045
4 讨论
APA阳性流产是临床难治性流产,西医学采用抗血小板凝聚、免疫抑制等方法进行治疗,但在药物使用剂量、给药途径、安全性等方面需要进一步探讨。南京中医药大学附属医院妇科自20世纪90年代起对APA阳性免疫性流产类疾病相继开展了流行病学、临床及药理学机制等研究工作,认为脾肾两虚、血热夹瘀是其发病过程中的关键病机,并在此理论基础上研制了具有益肾健脾、清热和血和安胎作用的院内制剂——安子合剂。方中君药续断、桑寄生、菟丝子等益肾安胎以治其本,有取古方寿胎丸之意;太子参、甘草与白术相伍,健脾以补肾;苎麻根清热凉血、止血安胎,有滋阴益肾之效;黄芩清心肝之火,配白术清热安胎;丹参养血和血、疏通脉络、调畅胞宫气血,以养胎元。诸药合用,则标本兼顾。
有研究表明,在复发性自然流产中TLR4影响了免疫耐受调节细胞CD4+CD25+调节性T细胞(Treg)的表达[10-11],TLR4信号通路下游分子NF-κB活化产生的肿瘤坏死因子α(TNF-α)等炎性因子能抑制CD4+CD25+Treg细胞的表达[12]。结合本课题组前期研究结果:APA阳性先兆流产患者外周血CD4+CD25+Treg细胞比例较正常孕妇减少[4]。推测APA可通过激活TLR4/MyD88/NF-κB信号通路,介导炎症反应,同时还可能影响CD4+CD25+Treg细胞的数量和功能,引起免疫耐受失衡,使母体对胚胎组织产生免疫排斥反应,最终导致妊娠丢失。
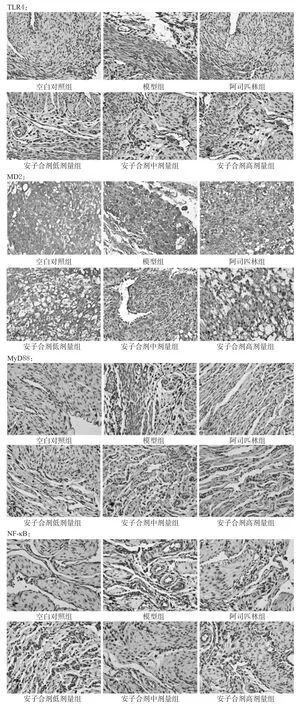
图1 各组小鼠胎盘组织TLR4、MD2、MyD88、NF-κB蛋白表达免疫组化图(×200)Fig 1 The immunohistochemical pictures of TLR4,MD2,MyD88 and NF-κB protein expression in placental tissue of mice in each group(×200)
本研究结果表明,在正常妊娠小鼠母胎界面TLR4、MD2、MyD88、NF-κB mRNA及其蛋白表达水平均较低,这提示在正常妊娠状态下TLR4/MyD88/NF-κB信号可能处于警备状态,当母胎界面受到病原体感染时信号可迅速激活,启动免疫保护。采用人β2-糖蛋白Ⅰ诱导造模后发现,母胎界面TLR4、MD2、MyD88、NF-κB mRNA及其蛋白表达水平均显著升高,这证实了在APA阳性流产病理过程中TLR4/MyD88/NF-κB信号通路被激活,可能引起了母胎界面免疫炎症反应、血栓形成、胎盘组织坏死等,从而导致早孕丢失和晚期妊娠并发症发生的推断[12-13]。阿司匹林为水杨酸类解热镇痛抗炎药,是目前临床治疗抗磷脂抗体综合征复发性流产的常用药[14-15],故本文以其为阳性对照。安子合剂给药后能显著下调母胎界面TLR4、MD2、MyD88、NF-κB mRNA和蛋白的表达,这提示其能抑制TLR4/MyD88/NF-κB信号通路转导,且低剂量安子合剂的作用较阿司匹林更为明显;中、高剂量安子合剂下调小鼠胎盘组织TLR4、MD2、MyD88、NF-κB mRNA及其蛋白表达的作用不及低剂量,这表明安子合剂低剂量作为等效人临床常用剂量具有一定的科学性,同时研究数据也提示患者应按临床用药指导用药,以获得较好临床疗效和用药经济性。
综上所述,安子合剂可抑制APA阳性流产小鼠TLR4/MyD88/NF-κB信号通路转导,这可能是其抗APA阳性流产的作用机制之一。本研究为中医药靶向治疗免疫性、复发性流产提供了新的科学依据。
[1] Chou AK,Hsieh SC,Su YN,et al.Neonatal and pregnancy outcome in primary antiphospholipid syndrome:a 10-year experience in one medical center[J].Pediatr Neonatol,2009,50(4):143-146.
[2] Zhou H,Sheng L,Wang H,et al.Anti-β2GPⅠ/β2GPⅠstimulates activation of THP-1 cells through TLR4/MD-2/ MyD88 and NF-κB signaling pathways[J].Thromb Res,2013,132(6):742-749.
[3] 陆启滨,任青玲.安子合剂治疗抗心磷脂抗体阳性致先兆流产191例临床研究[J].中华临床医学杂志,2006,7(11):25-27.
[4] 朱姝,陆启滨.抗心磷脂抗体导致妊娠丢失的免疫病理机制及安子合剂的干预作用[J].中国实验方剂学杂志,2012,18(11):177-181.
[5] 丁超,陆启滨.安子合剂对构建抗心磷脂抗体阳性流产模型小鼠mmp2、mmp9表达的影响[J].天然产物研究与开发,2014,26(6):967-969.
[6] 许家莹,陆启滨,丁超.安子合剂对ACA阳性先兆流产母胎界面p-STAT3的影响[J].时珍国医国药,2015,26(8):1 823-1 826.
[7] 肖世金,赵爱民,鲍世民.COX-2及其信号转导通路的表达与自身免疫型复发性流产的关系[J].上海交通大学学报(医学版),2011,31(7):895-899.
[8] Tolomeo T,Rico De Souza A,Roter E,et al.T cells demonstrate a Th1-biased response to native beta2-glycoproteinⅠ in a murine model of anti-phospholipid antibody induction[J].Autoimmunity,2009,42(4):292-295.
[9] 李莎莎,张义军,李洪利,等.非小细胞癌中MTAP蛋白及基因表达水平的检测[J].中国肿瘤杂志,2011,14(2):151-155.
[10] 梅珊珊,屈艳霞,张广兰,等.URSA患者蜕膜调节性T细胞Toll受体表达变化的临床意义[J].中山大学学报(医学科学版),2014,35(4):559-564.
[11] 杜久伟,朱瑞,王飞,等.原因不明反复自然流产患者外周血TLR2、TLR4表达及CD4+CD25+Treg细胞的变化[J].
临床检验杂志,2013,31(5):360-362.
[12] Mulla MJ,Salmon JE,Chamley LW,et al.A role for uric acid and the Nalp3 inflammasome in antiphospholipid antibody-induced IL-1β production by human first trimester trophoblast[J].PLoS One,2013,8(6):e65237.
[13] Oku K,Amengual O,Atsumi T.Pathophysiology of thrombosis and pregnancy morbidity in the antiphospholipid syndrome[J].Eur J Clin Invest,2012,42(10):1126-1135.
[14] 宋钰,王海燕.复发性流产合并抗磷脂抗体综合征诊疗进展[J].中国优生与遗传杂志,2016,24(5):9-13.
[15] 林芸竹,申向黎,黄亮,等.妊娠早期保胎药的新剂型研发进展[J].中国药房,2008,19(1):63-65.
Effects of Anzi Mixture on TLR4/MyD88/NF-κB Signaling Pathway of Antiphospholipid Antibodies Positive Abortive Mice
LIU Jing,LU Qibin(Dept.of Gynaecology,the Affiliated Hospital of Nanjing University of TCM,Nanjing 210029,China)
OBJECTIVE:To study the effects of Anzi mixture on Toll like receptor 4(TLR4)/myeloid differentiation factor 88(MyD88)/nuclear facter-κB(NF-κB)signaling pathway of antiphospholipid antibodies(APA)positive abortive mice,and to investigate the mechanism of anti-APA positive abortion.METHODS:BALB/c mice(female)were randomly divided into blank control group,model group,aspirin group(positive control,0.019 5 g/kg)and Anzi mixture low-dose,medium-dose and high-dose groups(37.7,75.4,150.8 g/kg,calculated by crude drug),with 10 mice in each group.Except for blank control group,other groups were given human β2-glycoproteinⅠas derivant to establish APA positive abortion model.From the first day of pregnancy,treatment groups were given relevant medicine intragastrically,and blank control group and model group were given constant volume of normal saline intragastrically,once a day,for consecutive 9 d.mRNA and protein levels of TLR4,myeloid differentiation 2(MD2),MyD88 and NF-κB in placental tissue of mice were determined by RT-PCR and immunohistochemical method.RESULTS:Compared with blank control group,mRNA and protein expression of TLR4,MD2,MyD88 and NF-κB in placental tissue were increased markedly in the model group(P<0.01).Compared with model group,mRNA and protein expression of TLR4,MD2 and MyD88 in aspirin group and Anzi mixture low-dose and medium-dose groups were decreased significantly as well as the protein expression of TLR4 in Anzi mixture high-dose group and the protein expression of NF-κB in all medicine groups(P<0.05 or P<0.01).mRNA expression of TLR4 and MD2 and the protein expression of MD2 and MyD88 in Anzi mixture low-dose groups were lower than those in aspirin group(P<0.05 or P<0.01).CONCLUSIONS:Anzi mixture can inhibit TLR4/MyD88/ NF-κB signaling pathway of APA positive abortive mice,which may be one of anti-APA positive abortion mechanisms.
Anzi mixture;Antiphospholipid antibody;TLR4/MyD88/NF-κB signaling pathway;Abortive mice;Placental tissue
R285.5
A
1001-0408(2017)01-0031-05
2016-08-18
2016-10-29)
(编辑:林 静)
江苏省中医药局国家中医临床研究基地开放课题(No.JD201507);江苏省中医药局中医药领军人才课题(No. LJ200910);江苏省中医院2014年度院级课题博士项目(No.Y14019)
*副主任中医师,博士研究生。研究方向:流产类疾病、绝经综合征。E-mail:13813824496@126.com
#通信作者:主任中医师,硕士。研究方向:流产类疾病、绝经综合征。电话:025-86617141-91403。E-mail:wenwd@nuaa.edu.cn
DOI10.6039/j.issn.1001-0408.2017.01.08
