替格瑞洛原料药粒径对其片剂体外溶出行为的影响
2017-02-18刘金凤吕慧敏南京师范大学泰州学院化学与生物工程学院江苏泰州5300扬子江药业集团有限公司药物研究院江苏泰州5300
王 燕,牟 聪,刘金凤,吕慧敏(1.南京师范大学泰州学院化学与生物工程学院,江苏泰州 5300;.扬子江药业集团有限公司药物研究院,江苏泰州 5300)
替格瑞洛原料药粒径对其片剂体外溶出行为的影响
王 燕1*,牟 聪2#,刘金凤2,吕慧敏2(1.南京师范大学泰州学院化学与生物工程学院,江苏泰州 225300;2.扬子江药业集团有限公司药物研究院,江苏泰州 225300)
目的:研究替格瑞洛原料药粒径对其片剂体外溶出行为的影响。方法:取替格瑞洛原料药及其经粉碎不同时间(15、30、40、60 s)后得到的不同粒径的粉末A、B、C、D、E,以湿法制粒法制备成片剂;采用紫外分光光度法在300 nm波长处测定上述各自制片在60 min内的体外累积溶出度(以0.2%聚山梨酯溶液为溶出介质,桨法),并以原研片为参比制剂,用相似因子(f2)法比较5种自制片与原研片体外溶出行为的相似性。结果:粉末A、B、C、D、E的d(0.9)分别为69.181、40.778、24.805、12.611、3.083 μm,f2值分别为27.77、36.79、50.06、67.68、79.99。结论:替格瑞洛原料药粒径越小,所制片剂溶出行为越接近原研片。原料药经粉碎后可显著提高替格瑞洛片的体外溶出度。为获得与原研片生物等效的制剂,建议替格瑞洛原料药粉末粒径分布宜控制在d(0.9)≤20 μm。
替格瑞洛;原料药;粒径分布;相似因子;紫外分光光度法;体外溶出度
替格瑞洛(Ticagrelor)是一种新型环戊基三唑嘧啶类抗血小板聚集药物[1],2010年在欧洲上市,2012年11月替格瑞洛片(商品名:倍林达)在我国上市,同年我国《经皮冠状动脉介入治疗(PCI)指南》也将其列为抗血小板治疗药物之一,目前已成为国外许多急性冠脉综合征(ACS)治疗指南推荐的抗血小板治疗用药[2-4]。由于替格瑞洛为生物药剂学分类系统(BCS)Ⅳ类化合物,为难溶性药物,其粒径分布会影响替格瑞洛片的体外溶出行为。笔者通过对原料药进行不同时间的粉碎得到不同粒径分布的粉末,再通过相同的制备工艺制成不同批次的自制片,与原研参比制剂进行体外溶出行为的对比研究,以期优选出原料药粉末的最适粒径分布,制备出与原研参比制剂生物利用度一致的产品[5]。
1 材料
1.1 仪器
DFT-50型手提式高速万能粉碎机(温岭市林大机械有限公司);GSL-101BII型激光颗粒分布测量仪(辽宁仪表研究所有限责任公司);XP205型电子天平、HX204型快速水分测定仪(瑞士Mettler Toledo公司);G20湿法制粒机(深圳信宜特科技有限公司);YD-3型硬度测定仪(天津市国铭医药设备有限公司);Y-160型摇摆式颗粒机(江苏省泰州市第三制药机械厂);C&C800型旋转式压片机(北京创博佳维科技有限公司);RCZ-8M型智能药物溶出仪、ZKT-18F型真空脱气仪(天津天大天发有限公司);Cary50 Bio型紫外-可见分光光度仪(美国Varian公司)。
1.2 药品与试剂
替格瑞洛片(原研片,阿斯利康制药有限公司,批号:TDBH1312084,规格:90 mg/片);替格瑞洛原料药(批号:TGRLYL-15001,纯度:99.5%)、替格瑞洛对照品(批号:TGRL-1404,纯度:99.9%)均来源于扬子江药业集团有限公司;甘露醇(青岛明月海藻集团有限公司,批号:3601309023);磷酸氢钙(湖州展望药业股份有限公司,批号:20120815);羟丙基纤维素[日本曹达贸易(上海)有限公司,批号:121110];羧甲基淀粉钠(湖州药业股份有限公司,批号:20130716);硬脂酸镁(浙江中维药业有限公司,批号:130201);95%乙醇(批号:20131114)、聚山梨酯80(批号:20131016)均来源于国药集团化学制剂有限公司。
2 方法与结果
2.1 不同粒径分布原料的制备
取适量替格瑞洛原料药并过80目筛,得样品A;取适量样品A倒入粉粹机中,依次粉碎15、30、40、60 s,分别取各个时间点粉碎后的原料药作为样品B、C、D、E[6]。
2.2 样品粒径分布的测定
按2015年版《中国药典》(四部)通则测定粒度方法中的第三法[7],各取样品A、B、C、D、E适量,分别加入分散剂0.5%聚山梨酯80中,超声5 min(频率:40 kHz,功率:240 W),制成稳定的分散体,测定粒径分布,结果见表1。
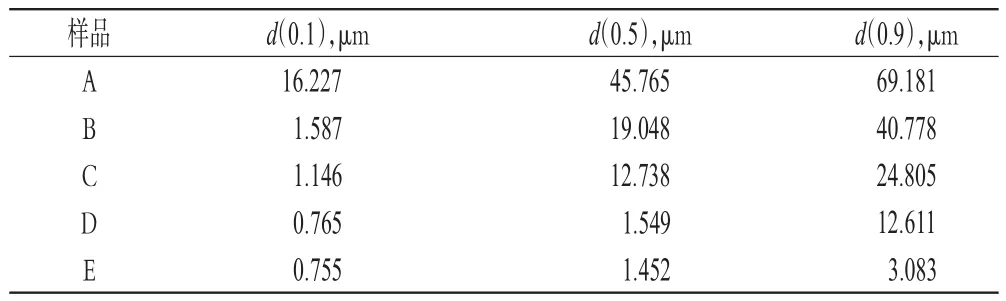
表1 样品粒径分布测定结果Tab 1 Distribution of particle size of samples
由表1可见,与样品A比较,其余4种样品的粒径均减小,表明对原料药进行粉碎后,可减小其粒径,且随着粉碎时间的延长,原料药的粒径逐渐减小。
2.3 替格瑞洛片的制备
片芯辅料选用甘露醇、磷酸氢钙、羟丙基纤维素、羧甲淀粉钠和硬脂酸镁,制备工艺采用湿法制粒。称取样品A、B、C、D、E各90.0 g,甘露醇136 g,磷酸氢钙44 g,羟丙基纤维素9 g,羧甲基淀粉钠9 g,适量95%乙醇,混匀,湿法制粒,加入硬脂酸镁3.0 g,混匀,压片,即得不同的自制替格瑞洛片,依次编批号为TGRLP-15001、TGRLP-15002、TGRLP-15003、TGRLP-15004、TGRLP-15005。
2.4 溶出度测定方法的建立
参照片剂溶出度测定的一般方法。本品选用2015年版《中国药典》(四部)通则0931中的第二法即桨法进行操作[7-8]。
2.4.1 溶出介质的选择 参考替格瑞洛片进口药品注册标准(标准号:JX20110193)[9]的溶出方法,选取0.2%聚山梨酯80溶液为溶出介质。
2.4.2 测定波长的确定 分别取替格瑞洛对照品、自制片(批号:TGRLP-15005)、原研片,用0.2%聚山梨酯80溶液制备成每1 mL约含替格瑞洛20 μg的溶液。另取空白辅料适量,用0.2%聚山梨酯80溶液超声提取,得空白溶液。取上述4种溶液冷却至室温,参考2015年版《中国药典》(四部)通则0401方法[7]进行紫外扫描。结果,对照品和2种片剂溶液均在300 nm波长处有最大吸收。空白辅料及自制片的紫外扫描结果见图1。
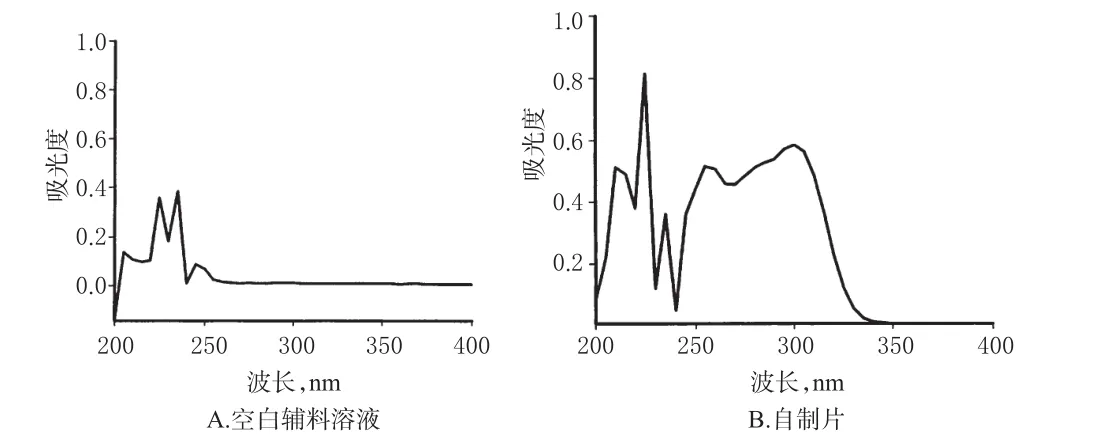
图1 紫外扫描图谱Fig 1 UV scanning spectrum
由图1可知,空白辅料对主药替格瑞洛检测无干扰。故确定检测波长为300 nm。
2.4.3 线性关系考察 精密称取替格瑞洛对照品25.76 mg,置于250 mL量瓶中,加0.2%聚山梨酯80溶液稀释至刻度,摇匀,作为线性贮备溶液。精密量取上述贮备溶液适量至相应量瓶中,用0.2%聚山梨酯80溶液稀释至刻度,摇匀,制备质量浓度分别为1.03、2.06、5.14、10.29、20.57、25.71µg/mL的对照品溶液。分别取上述溶液适量,在300 nm波长处分别测定吸光度(A)。将A与对应质量浓度(c)进行线性回归,结果线性方程为A=0.030 8c-0.004 5(R2=0.999 9)。结果表明,替格瑞洛检测质量浓度线性范围为1.03~25.71 μg/mL。
2.4.4 重复性和中间精密度试验 取自制片(批号:TGRLP-15005)6片,照“2.4.2”项下方法制备溶液,在300 nm波长处分别测定吸光度,进行方法的重复性试验,结果吸光度的RSD=1.0%(n=6)。另取本品6片,由不同的试验人员在不同日期采用不同的溶出仪和紫外-可见分光光度仪进行溶出度测定,进行方法中间精密度试验,结果溶出度的RSD=0.80%(n=6)。
2.4.5 回收率试验 分别取替格瑞洛对照品约45、72、90 mg(分别为处方量的50%、80%、100%)及相应处方比例的空白辅料210 mg(此为1片的空白辅料量),精密称定,置于同一溶出杯中,依法进行溶出度测定。于45 min时,取溶出液适量,过滤;精密量取续滤液2 mL,置于10 mL量瓶中,加0.2%聚山梨酯80溶液稀释至刻度,摇匀,作为供试品溶液。每个浓度各平行制备3份。在300 nm波长处分别测定吸光度,计算回收率,结果见表2。

表2 回收率试验结果Tab 2 Results of recovery tests
结果表明,低、中、高3个浓度水平的回收率在98.12%~101.45%,平均回收率为100.50%(RSD=1.17%,n=3),表明该方法准确度良好。
2.5 溶出行为的比较
分别取自制片和原研片各6片,分别于0、5、10、15、30、45、60 min取样后照溶出度测定法测定,溶出介质选用0.2%聚山梨酯溶液。同时,以原研片为参比制剂,用相似因子(f2)法[10]比较各样品的累积溶出度,绘制溶出曲线,结果见表3、图2。
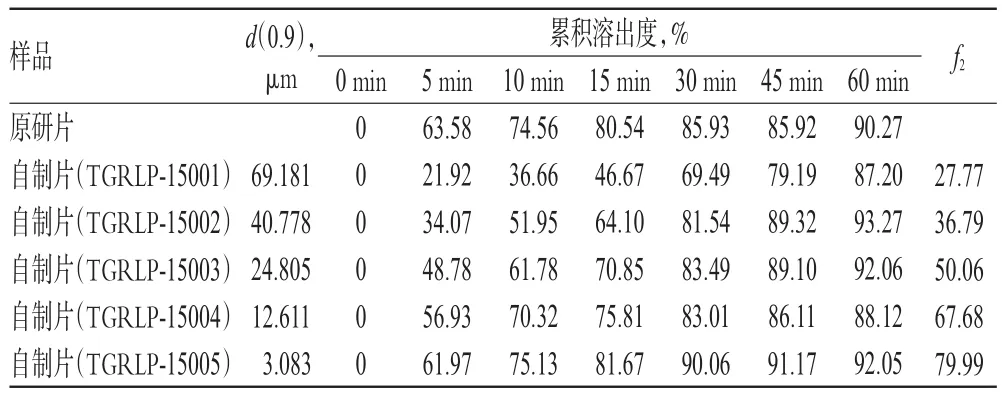
表3 自制片与原研片的累积溶出度比较Tab 3 Comparison of accumulative dissolution rate between prepared tablet and original tablet
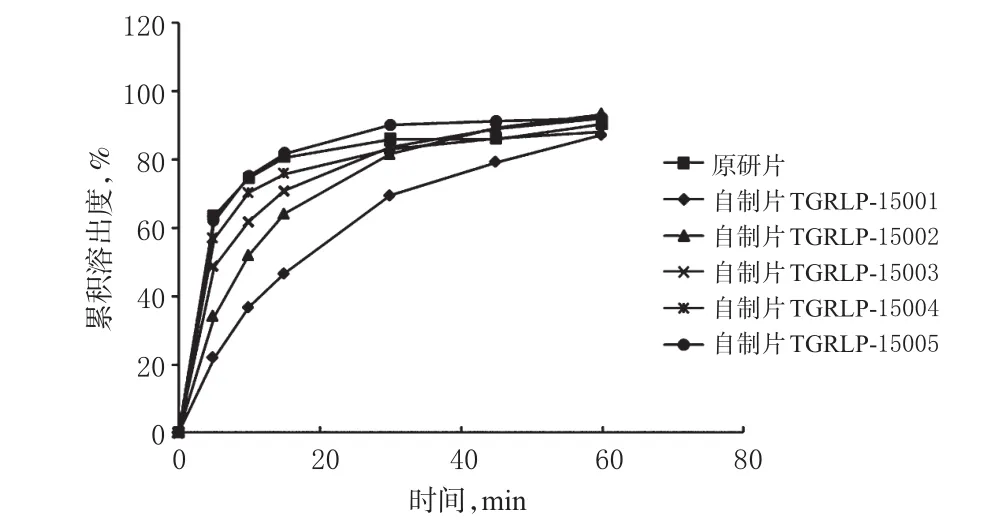
图2 自制片与原研片溶出曲线比较Fig 2 Comparison of dissolution curve between prepared tablet and original tablet
由表3及图2可见,在以0.2%聚山梨酯溶液为溶出介质时,有2个批号的自制品(批号:TGRLP-15004、TGRLP-15005)与原研片比较f2值较大(>50),表明其与原研片的溶出行为更相似。这2个批号自制品对应的原料药粉末粒径d(0.9)分别为12.611、3.083 μm。
3 讨论
本试验采用紫外-可见分光光度法测定替格瑞洛含量,不但方法操作简便,且线性关系较好,方法学考察均符合要求。
由于替格瑞洛在纯水、0.1 mol/L盐酸、pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液4种介质中累积溶出度均小于10%,没有临床指导意义。故在选用本试验的溶出介质时未考察其在上述4种常见溶出介质中的溶出行为,而选用0.2%聚山梨酯80溶液为溶出介质。
经试验发现,制备替格瑞洛片的原料药在未经粉粹处理时,所制片与原研片比较,f2仅为27.77,表明其与原研片溶出行为极不相似;原料药经粉碎后所制片剂,随着d(0.9)的减小,与原研片比较后的f2值逐渐增大,在当d(0.9)≤24.805 μm时,f2≥50,表明自制品与原研片在0.2%聚山梨酯80溶出介质中溶出行为相似。因此为了降低临床试验风险,获得与原研片生物等效的制剂,建议制备替格瑞洛片时,其原料药的粒径分布应控制 d(0.9)≤20 μm。
[1] Teng R,Oliver S,Hayes MA,et al.Absorption,distribution,metabolism,and exeretion of ticagrelor in healthy subjects[J].Drug Metab Dispos,2010,38(9):1514-1521.
[2] 孙秀波,付春毅,张亚同,等.新型抗血小板聚集药物:替格瑞洛的研究进展[J].中国药房,2015,26(4):2010-2013.
[3] Zeneca.Brilinta,Brilique(ticagrelor)[EB/OL].[2016-03-10].http://www.astrazeneca.com.cn/en/medicines/en-cardiovascular/en-brilinta.
[4] 中国网.治疗ASC患者的新选择:倍林达中国上市获批准[EB/OL].(2012-11-30)[2016-03-10].http://www.Chinadaily.com.cn/hqcj/2012-11/30/content_15975879.htm.
[5] 张庆刚,程刚.盐酸厄洛替尼不同粒径分布对其片剂溶出行为的影响[J].食品与药品,2015,17(2):83-86.
[6] 肖亚宝,文君,崔生法.格列美脲微粉的制备及其对溶出度的影响[J].中国粉体技术,2014,20(2):31-34.
[7] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:38-40、121-124、374-378.
[8] 国家食品药品监督管理总局.普通口服固体制剂溶出度试验技术指导原则[S].2015-02-05.
[9] 国家食品药品监督管理总局.替格瑞洛片进口药品注册标准 JX20110193[S].2011.
[10] 谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308-310.
(编辑:刘 萍)
Effects of Particle Size of Ticagrelor Crude Drug on in vitro Dissolution Behavior of Ticagrelor Tablets
WANG Yan1,MU Cong2,LIU Jinfeng2,LYU Huimin2(1.College of Chemistry and Biological Engineering,Taizhou College,Nanjing Normal University,Jiangsu Taizhou 225300,China;2.Drug Research Institute,Yangtze River Pharmaceutical Group Co.Ltd.,Jiangsu Taizhou 225300,China)
OBJECTIVE:To study the effects of particle size of ticagrelor crude drug on in vitro dissolution behavior of Ticagrelor tablets.METHODS:Ticagrelor crude drug and different particle size of ticagrelor powder A,B,C,D,E after smashing for different time(15,30,40,60 s)were used to prepare the tablet by wet granulation method.Accumulative in vitro dissolution rate of prepared tablets within 60 min were determined by UV spectrophotometry at 300 nm(using 0.2%tween as medium,paddle method).Using original tablet as reference preparation,the similarity factor(f2)method was used to compare the similarity of dissolution behavior between 5 prepared tablets and original tablet.RESULTS:d(0.9)of powder A,B,C,D,E were 69.181,40.778,24.805,12.611,3.083 μm,respectively.The corresponding f2were 27.77,36.79,50.06,67.68,79.99.CONCLUSIONS:The particle size of ticagrelor crude drug is much smaller,and the dissolution behavior of prepared tablet is closer to that of original tablet. The in vitro dissolution rate of Ticagrelor tablets is improved remarkably by micronization technology.In order to produce Ticagrelor tablets with the same bioavailability as original tablet,particle size of ticagrelor crude drug powder should be controlled with d(0.9)≤20 μm.
Ticagrelor;Crude drug;Particle size distribution;Similarity factor;UV spectrophotometry;in vitro dissolution
R943
A
1001-0408(2017)01-0119-03DOI10.6039/j.issn.1001-0408.2017.01.31
2016-03-04
2016-05-04)
*助教,硕士。研究方向:药物多晶型、药物新剂型与新技术。电话:0523-86152059。E-mail:806503228@qq.com
#通信作者:助理工程师。研究方向:药物新剂型与新技术。电话:0523-86975063。E-mail:542671045@qq.com
