重组融合蛋白大肠杆菌不对称合成(R)-2-羟基-3-苯基丙酸
2017-02-15朱益波蒋卓越郭倩郑青云林容天钱志浩齐斌王立梅
朱益波,蒋卓越,2,郭倩,郑青云,林容天,钱志浩,齐斌,王立梅*
1(常熟理工学院 生物与食品工程学院,苏州市食品生物技术重点实验室,江苏 常熟,215500)2 (苏州大学 基础医学与生物科学学院,江苏 苏州,215000)
重组融合蛋白大肠杆菌不对称合成(R)-2-羟基-3-苯基丙酸
朱益波1,蒋卓越1,2,郭倩1,郑青云1,林容天1,钱志浩1,齐斌1,王立梅1*
1(常熟理工学院 生物与食品工程学院,苏州市食品生物技术重点实验室,江苏 常熟,215500)2 (苏州大学 基础医学与生物科学学院,江苏 苏州,215000)
将来自于Lactobacillusplantarum的突变D-乳酸脱氢酶(D-LDHY52V)和Candidaboidinii的甲酸脱氢酶(FDH)进行融合,重组成双功能融合蛋白,为生物法合成(R)-2-羟基-3-苯基丙酸(D-PLA)提供新的方法。利用重叠延伸PCR技术,将对底物苯丙酮酸(PPA)亲合力更高的突变蛋白D-LDHY52V与FDH通过连接肽(Gly4Ser)3融合,将融合基因克隆至表达载体pET-28a(+),并转化EscherichiacoliBL21(DE3),经IPTG诱导得到高效表达。SDS-PAGE电泳分析结果表明,融合蛋白分子质量为79.7 kDa,在重组菌中获得了正确表达;酶活性测定结果表明,融合蛋白具有D-LDH和FDH的双重生物学活性。在不对称转化PPA合成(R)-2-羟基-3-苯基丙酸(D-PLA)的应用中,融合蛋白体系比D-LDHY52V单独表达体系的D-PLA产量提高了40.71%。通过5 h底物分批补加发酵,D-PLA产量为17.34 g/L,底物转化率为77.64%,生产强度3.47 g/(L·h)。双功能融合蛋白增强了辅酶再生的效率,有效促进了 (R)-2-羟基-3-苯基丙酸的不对称合成。
D-LDHY52V;甲酸脱氢酶;融合蛋白;D-3-苯基乳酸;辅酶再生
在食品工业中,乳酸菌一般被认为是安全菌株[1],它们代谢产生的抗菌物质可作为天然的食品防腐剂直接应用于食品工业[2]。2-羟基-3-苯基丙酸,即苯基乳酸(Phenyllactic acid, PLA)作为乳酸菌的代谢产物之一,广泛存在于乳酸菌发酵产品中[3]。大量研究表明,苯基乳酸是一种广谱的抗菌物质,对大多数革兰氏阳性菌、阴性菌和真菌都有很好的抑制效果[4],抑菌活性强于一些常用的食品防腐剂,如苯甲酸钠、山梨酸钾等[5]。因此苯基乳酸的开发和利用具有广泛的应用前景。
在乳酸菌的代谢过程中,苯丙氨酸(Phe)经过转氨反应转化成为苯丙酮酸(PPA),然后苯丙酮酸通过乳酸脱氢酶(LDH)还原生成苯基乳酸[6-7]。乳酸菌细胞内的乳酸脱氢酶被认为是将苯丙酮酸还原成苯基乳酸的关键酶[8-9],在微生物体内的表达受到严格调控而导致胞内乳酸脱氢酶含量较低,限制了苯基乳酸产量的提高。因此,利用基因工程技术构建高效表达乳酸脱氢酶的工程菌来提高苯基乳酸产量是极具发展潜力的一种方法。ZHU等[10]将来自Lactobacilluspentosus的乳酸脱氢酶第52位氨基酸替换成小分子疏水氨基酸后转化大肠杆菌高效表达,有效提升了乳酸脱氢酶对非天然底物苯丙酮酸的催化效率和D-PLA的产量。ZHENG等[11]和王颖等[12]分别将来自于BacilluscoagulansNL01和BacillusmegateriumZ2013513的L-乳酸脱氢酶在大肠杆菌中表达,均获得了高光学纯度的L-PLA。
乳酸脱氢酶是NADH依赖型氧还原酶。催化过程中需要不断消耗体系中的还原型辅酶(NADH)[13],转化反应也会因为还原型辅酶的不足而终止,但是还原型辅酶的额外添加会显著增加生产成本。因此开发系统中还原型辅酶再生的方法亦是研究的关键。酶偶联法是常用的辅酶再生的方法,在反应体系中共表达底物催化酶和辅酶再生酶,但辅酶在两个酶分子间传递,游离酶之间的空间距离有可能造成辅酶再生效率不高[14]。利用基因融合技术构建双功能酶有可能使两个酶的活性位点接近,使辅酶在分子内高效传递从而提高催化效率[15-16]。SÜHRER等[17]通过构建酮还原酶与甲酸脱氢酶的融合蛋白体系,在一个融合蛋白内实现NADH的再生。到目前为止,尚未有将乳酸脱氢酶与甲酸脱氢酶进行融合表达并实现辅酶再生用于生产苯基乳酸研究的报道。
研究将来自于Lactobacillusplantarum的D-乳酸脱氢酶(D-LDHY52V)与来自博伊丁假丝酵母(Candida
boidinii)的甲酸脱氢酶(FDH)进行融合表达,构建了D-LDHY52V-FDH双功能融合蛋白,在以苯丙酮酸为底物不对称合成(R)-2-羟基-3-苯基丙酸的反应中,实现辅酶因子的原位再生,维持反应的持续进行,获得更高产量的(R)-2-羟基-3-苯基丙酸。
1 材料与方法
1.1 材料
1.1.1 主要试剂
(R)-2-羟基-3-苯基丙酸和苯丙酮酸标品购自国药集团;酵母提取物,胰蛋白胨购自Oxoid公司(英国);PrimeSTAR HS DNA 聚合酶,限制性内切酶,T4DNA连接酶购自大连宝生物公司(TaKaRa);DNA分子量标准,蛋白质分子量标准,异丙基-β-D-硫代吡喃半乳糖苷(IPTG),硫酸卡那和相关分子试剂盒购自上海生工。所有实验试剂如果无特殊说明均为分析纯。
1.1.2 菌种和质粒
pMD19-T Simple Vector购自宝生物公司(大连);E.coliDH5α,E.coliBL21(DE3),Candidaboidinii,E.coliBL21(DE3)/pET-28a(+)-d-ldhY52V,pET-28a(+)均为实验室保藏。菌株E.coliBL21(DE3)/pET-28a(+)-d-ldhY52V的构建参考文献[10]。
1.1.3 主要仪器
PCR扩增仪、水平电泳系统、垂直电泳系统、凝胶成像系统美国Bio-RAD公司;高速台式离心机德国Thermo公司;恒温金属浴德国Eppendorf公司;高效液相色谱仪日本岛津公司;恒温振荡培养箱太仓市华美生化仪器厂。
1.2 方法
1.2.1 表达质粒的构建
1.2.1.1 pET-28a-d-ldhY52V-fdh的构建
构建示意图如图1所示。主要过程如下:通过2轮PCR,利用特异引物序列(表1)将编码乳酸脱氢酶的基因以及甲酸脱氢酶基因通过柔性Linker (GGGGS)3的核苷酸序列连接,并在引物P1F和P4R中分别加入BamH I和XhoI限制性酶切位点。第1次PCR,分别以质粒pET-28a(+)-d-ldhY52V和Candidaboidinii基因组为模板,扩增出D-LDH和FDH目的片段。PCR 程序为:98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸30 s,30~35个循环后在72 ℃延伸7~10 min。第2次PCR以经凝胶回收的第1次PCR产物作为模板,应用Gene-SOEing技术构建d-ldhY52V-fdh融合基因,具体方法如下:由于d-ldhY52V的3’端和fdh的5’端形成了部分重叠链,在随后的扩增反应中通过重叠链的延伸从而将两段基因拼接起来,合成全长的融合蛋白基因。PCR反应条件:98 ℃预变性3 min,前5个循环为98 ℃变性10 s,45 ℃退火15 s,72 ℃延伸1 min;后30个循环为98 ℃变性10 s,60 ℃退火15 s,72 ℃延伸2 min;最后72 ℃延伸10 min,共35个循环。在前5个循环结束后加入P1F,P4R。目的片段经凝胶回收后通过双酶切插入至pET-28a(+)载体的BamH I和XhoI位点之间。转化E.coliBL21(DE3)后经菌落PCR、酶切等方法筛选出符合要求的阳性克隆,进行DNA测序验证。

图1 pET-28a-d- ldhY52V-fdh构建示意图Fig.1 Scheme of the construction of pET-28a-d- ldhY52V-fdh

引物名称引物序列(5’-3’)所含特殊序列P1FCGCGGATCCATGAAAATTATTG-CATATGCBamHI酶切位点P2RGTCAAACTTAACTTGTGTG无P3FCACACAAGTTAAGTTTGACGGCGGTG-GCGGCAGCGGCGGAGGCGGAAGCG-GAGGCG-GAGGAAGCATGAAGATCGTTTTAGTC连接肽序列P4RCCGCTCGAGTTTaTTTCTTATCGTGTT-TACCGXhoI酶切位点P5CGCGGATCCATGAAGATCGTTTTAGTCBamHI酶切位点
1.2.1.2 pET-28a-fdh构建
以Candidaboidinii基因组为模板,P5和P4R为引物PCR扩增fdh。扩增产物经凝胶回收纯化,16 ℃过夜连接至pMD19-T,获得重组质粒pMD19-fdh。该质粒转化至E.coliDH5α,经测序验证无误后,克隆、提取质粒、BamH I和XhoI双酶切。目的片段经凝胶回收后插入pET-28a(+)载体的BamH I和XhoI位点之间。转化E.coliBL21(DE3)获得E.coli BL21(DE3)/pET-28a-fdh。
1.2.2D-LDHY52V-FDH融合蛋白的诱导表达及活性鉴定
E.coliBL21(DE3)/pET-28a-d-ldhY52V-fdh单菌落接种于含有50 mg/L卡那霉素的LB液体培养基中,37 ℃、200 r/min过夜培养(约9 h),按照1%接种于含有相同浓度卡那霉素的新鲜LB培养基中,37 ℃、200 r/min 培养至OD600约0.6时,添加IPTG浓度至0.6 mmol/L,诱导温度25 ℃,200 r/min条件下诱导10 h后离心收集菌体,用磷酸缓冲液(pH为7.0)重悬,将菌体沉淀冰浴超声破碎(超声3 s,停3 s,持续10 min)后12 000 r/min离心2 min,取适当量上清液进行乳酸脱氢酶和甲酸脱氢酶酶活测定。另取适量上清进行SDS-PAGE电泳分析。
乳酸脱氢酶和甲酸脱氢酶酶活测定基本原理是NADH在340 nm处有最大吸收峰,通过光吸峰值的改变定量测定酶的含量。乳酸脱氢酶检测的标准液为:0.1 mol/L磷酸缓冲液(pH为7.0),10 mmol/L苯丙酮酸钠,0.4 mmol/L的NADH。甲酸脱氢酶检测标准液:100 mmol/L磷酸钾缓冲液(pH=6.0),167 mmol/L甲酸钠,1.67 mmol/L NAD+。反应在30 ℃条件下,连续测定反应液3 min,在340 nm吸收值的变化。酶活定义为:在30 ℃、pH 7.0的条件下,每分钟消耗或生成1 μmol NADH所需的酶量为1个酶活单位(1 μmol/min=1U)。比活力定义为:1 mg粗酶蛋白中酶活力(U/mg)。蛋白质质量分数的检测参照Bradford的标准方法。
1.2.3 单批次全细胞转化生成D-PLA
将经过诱导的菌体离心后,用pH 7.0磷酸缓冲液洗涤2次,重悬于10 mL转化培养基中(pH 7.0的100 mmol/L的磷酸钾溶液含有10 g/L PPA,0.2 g葡萄糖,0.07 g甲酸钠 ),37 ℃,200 r/min转化2 h,定时取一定量转化液于4 ℃、12 000 r/min离心2 min,将上清液稀释适当倍数,用0.22 μm滤膜过滤,然后用高效液相测定。色谱条件参考ZHU[10]的方法。同样条件测定E.coliBL21(DE3)/p28a-d-ldhY52V菌株对苯丙酮酸的转化。
1.2.4 底物分批补加合成D-PLA
将诱导后菌体悬浮于50 mL转化液,菌体干重20 g/L,PPA、葡萄糖和甲酸钠起始浓度分别为7 g/L,20 g/L和7 g/L。分别在0.5 h添加0.35 g苯丙酮酸,1 h、1.5 h添加0.2 g苯丙酮酸,在2 h、3 h添加0.1 g的苯丙酮酸,使溶液中底物浓度大致维持在8 g/L左右,定时取样检测,测定方法如1.2.3所述。
2 结果与讨论
2.1D-ldhY52V-fdh融合基因及表达质粒的构建与鉴定
用Over-lap extension PCR法成功构建d-ldhY52V-fdh融合基因(图2a),测序结果表明,融合基因序列与设计一致,其中d-ldhY52V基因片段长996 bp,编码332个氨基酸;连接肽(Linker)基因长45 bp,编码15个氨基酸(GGGGS)3,fdh基因长1 122 bp,编码374个氨基酸。融合基因片段定向插入pET-28a(+)表达载体后提取质粒进行BamH I/XhoI双酶切验证(图2b)。双酶切的目的DNA片段大小正确,验证正确的质粒经DNA测序分析,无碱基错配,最终确定重组表达质粒pET-28a-d-ldhY52V-fdh构建成功。

图2 凝胶电泳验证Fig.2 Validation by agarosegel electrophoresis(a)Analysis of PCR products by agarosegel electrophoresis. M-DNA marker; 1-PCR product of d-ldhY52V; 2-PCR product of fdh 3-PCR product of d-ldhY52V-fdh (b) Identification of recombinant expression vector pET-28a-d-ldhY52V-fdh. M-DNA Marker; 1-pET-28a-d-ldhY52V-fdh digested with BamH I and Xho I
2.2 融合蛋白的诱导表达及活性检测
将重组菌E.coliBL21(DE3)/pET-28a-d-ldhY52V,E.coliBL21(DE3)/pET-28a-fdh,E.coliBL21(DE3)/pET-28a-d-ldhY52V-fdh分别进行培养,破碎菌体得到粗蛋白溶液样品。对表达的重组蛋白d-ldhY52V,FDH,D-LDHY52V-FDH进行电泳分析,结果如图3所示。D-LDHY52V的理论值为37 kDa,FDH的理论值为41 kDa,目标蛋白为79.7 kDa。由图3可以看出,重组菌在近80 kDa处有明显蛋白条带(图3,泳道3),相对分子质量和预期的大小一致,表明融合蛋白在大肠杆菌中表达成功。表2列出了从重组菌内得到的融合蛋白D-LDH和FDH活性的检测结果。融合蛋白的D-LDH活性只有单独表达的D-LDH的42.97%,融合表达的FDH的活性和单独表达的FDH活性相近。这些结果表明,融合蛋白具有D-LDH和FDH双重生物学活性,在构建的重组菌中得到了成功表达,并对苯丙酮酸显示出催化活力。

M-Maker; 1-crude extract of E. coli BL21(DE3)/pET-28a-d-ldhY52V with induction;2-crude extract of E. coli BL21(DE3)/pET-28a-fdh with induction;3-crude extract of E. coli BL21(DE3)/pET-28a-d-ldhY52V-fdh with induction图3 重组工程菌诱导表达检测Fig.3 The analysis of recombinant protein by SDS-PAGE

VariantD-LDHactivity(U/mg)FDHactivity(U/mg)D-LDHY52V104.84±4.19NDFDHND0.38±0.03D-LDHY52V-FDH49.77±5.950.41±0.07
2.3 重组菌批式全细胞合成D-PLA
对菌株E.coliBL21(DE3)/pET28a-d-ldhY52V和E.coliBL21(DE3)/pET28a-d-ldhY52V-fdh进行单批次转化实验,在反应过程中定时取样,考察苯基乳酸生产速率的情况。如图4所示,表达融合蛋白的重组菌在转化反应初期就具有较强的转化活力,前10 min内累积的D-PLA产量是菌株E.coliBL21(DE3)/pET28a-d-ldhY52V的1.6倍。由此可以看出,具有辅酶NADH再生的转化反应体系,因为反应过程中辅酶NADH的及时补充,使合成苯基乳酸的反应速率加快。KATHRIN等[18]将3-酮乙基酰基载体蛋白还原酶与突变型甲酸脱氢酶进行融合后全细胞生物转化五氟苯乙酮生成五氟苯基乙醇的过程中,也观察到类似现象。此外,可以看出单独表达D-LDHY52V的体系在反应进行到40 min时,D-PLA的产量基本不再增高,而具有辅因子再生的融合表达体系因为辅酶NADH的持续供给,转化反应能够维持较长的时间,D-PLA单批次产量累积达到7.13 g/L,较D-LDHY52V的单独表达体系提高40.71%。
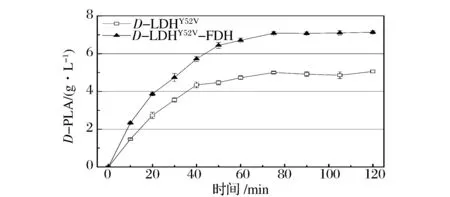
图4 E. coli BL21(DE3)/pET-28a-d-ldhY52V 和 E. coli BL21(DE3)/pET-28a-d-ldhY52V-fdh合成D-PLA时间曲线Fig.4 Time course of batch production of D-PLA by the recombinant E. coli BL21(DE3)/pET-28a-d-ldhY52Vand E. coli BL21(DE3)/pET-28a-d-ldhY52V-fdh
2.4 分批补加底物合成D-PLA
对于生物催化反应而言,底物浓度的高低会显著影响反应的速度,底物浓度太低时,酶的活性中心没有被完全饱和,导致反应速度慢;而过高的底物浓度会对酶和菌体活性有较大的抑制[19]。为了避免转化过程中的底物抑制作用,本研究利用分批添加底物方式来提高D-PLA的产量。转化过程中各参数变化如图5所示,在转化反应的初期,PPA快速转化合成D-PLA,反应前2 h内,菌体保持较高的转化活力,转化率维持在80%以上,D-PLA产量累计达到15.14 g/L。2 h以后菌体转化活力下降,D-PLA产量上升缓慢,转化至4 h,D-PLA产量为17.20 g/L。最终,经5 h全细胞转化,D-PLA产量达到最大值17.34 g/L,转化率为77.64%,生产强度3.47 g/(L·h)。相比ZHU等[10]报道的D-LDHY52V的重组菌转化4 h,合成D-PLA产量结果(15.6 g/L)相比,本研究产量提高了10.12%。和MU等[6]报道利用菌株Lactobacillussp.SK007底物流加发酵72 h生产D-PLA(产量17.38 g/L,转化率51.1%,生产强度0.241 g/(L·h)相比,本研究生产强度与转化率都显著提高。ZHENG等[20]利用1株嗜热芽孢杆菌BacilluscoagulansSDM全细胞转化生产苯基乳酸,获得产量37.3 g/L,这是此前报道的生物法生产苯基乳酸的最高产量,但其发酵周期长达16 h,生产强度为2.3 g/(L·h)。与其相比,本研究在产量上仍有待进一步提高,但在生产强度方面具有非常明显的优势。

图5 分批补料添加苯丙酮酸钠生产D-PLA时间曲线Fig.5 Time course of D-PLA production in fed-batch fermentation with intermittent PPA feeding
3 结论
本研究成功构建D-LDHY52V-FDH融合蛋白,经过体外生物学活性分析,该融合蛋白具有催化苯丙酮酸还原和再生辅因子的双重生物学功能。在利用重组菌合成D-PLA时,融合蛋白体系较D-LDHY52V单独表达体系具有明显的优势,通过批次添加底物策略,获得D-PLA最高产量17.34 g/L,转化率77.64%,生产强度3.47 g/(L·h)。本研究构建的双功能融合蛋白为解决酶偶联法反应体系复杂、不稳定的弊端提供了一个替代方案,为生物催化法不对称合成(R)-2-羟基-3-苯基丙酸提供了基础性数据。
[1] FAVARO L, PENNA A L B, TODOROV S D. Bacteriocinogenic LAB from cheeses-Application in biopreservation[J]. Trends in Food Science & Technology, 2014, 41(1):37-48.
[3] MU WM, YU SH, ZHU LJ, et al. Recent research on 3-phenyllactic acid, a broad-spectrum antimicrobial compound[J]. Applied Microbiology & Biotechnology, 2012, 95(5):1 155-1 163.
[4] DIEULEVEUX V, LEMARINIER S, Gueguen M. Antimicrobial spectrum and target site ofD-3- phenyllactic acid[J]. International Journal of Food Microbiology, 1998 ,40(3):177-183.
[5] 李德茂, 李从发, 刘四新, 等.3-苯基乳酸的研究进展[J].药物生物技术, 2004,11(5):344-347.
[6] MU WM, CHAN C, LI XF, et al. 3-Phenyllactic acid production by substrate feeding and pH-control in fed-batch fermentation ofLactobacillussp.SK007 [J]. Bioresource Technology, 2009, 100(21): 5 226-5 229.
[7] MCSWEENEY PLH, SOUSA MJ. Biochemical pathways for the production of flavour compounds in cheeses during ripening: A review[J]. Le Lait,2000,80:293-324.
[8] LI XF, JIANG B, PAN BL, et al. Purification and partial characterization ofLactobacillusspecies SK007 lactate dehydrogenase (LDH) catalyzing phenylpyruvic acid (PPA) conversion into phenyllactic acid (PLA)[J]. Journal of Agricultural & Food Chemistry, 2008,56(7):2 392-2 399.
[9] JIA JH, MU WM, TAO Z, et al. Bioconversion of phenylpyruvate to phenyllactate: gene cloning, expression, and enzymatic characterization of d-and l -Lactate dehydrogenases fromLactobacillusplantarumSK002[J]. Applied Biochemistry & Biotechnology, 2009,162(1):242-251.
[10] ZHU YB, HU FG, ZHU YY, et al. Enhancement of phenyllactic acid biosynthesis by recognition site replacement ofD-lactate dehydrogenase fromLactobacilluspentosus[J]. Biotechnology Letters, 2015, 37(6):1-9.
[11] ZHENG ZJ, ZHAO MY, YING Z, et al. Production of optically pure l-phenyllactic acid by using engineeredEscherichiacolicoexpressing l-lactate dehydrogenase and formate dehydrogenase[J]. Journal of Biotechnology, 2015(207):47-51.
[12] 王颖, 范铭, 薛素妹,等. 全细胞催化合成L-苯基乳酸重组大肠杆菌的构建[J]. 食品与发酵工业, 2015,41(12):13-17.
[13] YOSHIROU I, SHINO T, TAKAHASHI O, et al. Recognition site for the side chain of 2-ketoacid substrate in d-lactate dehydrogenase [J]. Journal of Biochemistry, 2005, 138(6): 741-749.
[14] 黄志华, 刘铭, 王宝光,等. 甲酸脱氢酶用于辅酶NADH再生的研究进展[J]. 过程工程学报, 2006, 6(6):1 011-1 016.
[15] YU SH, ZHU LJ, ZHOU C, et al. Enzymatic production ofD-3-phenyllactic acid byPediococcuspentosaceusD-lactate dehydrogenase with NADH regeneration by Ogataea parapolymorpha formate dehydrogenase.[J]. Biotechnology Letters, 2014, 36(3):627-631.
[16] WANG R, XUE Y, WU X, et al. Enhancement of engineered trifunctional enzyme by optimizing linker peptides for degradation of agricultural by-products[J]. Enzyme & Microbial Technology, 2010, 47(5):194-199.
[17] SÜHRER I, HASLBECK M, CASTIGLIONE K. Asymmetric synthesis of a fluoxetine precursor with an artificial fusion protein of a ketoreductase and a formate dehydrogenase[J]. Process Biochemistry, 2014, 49(9):1 527-1 532.
[18] HÖLSCH K, WEUSTER-BOTZ D. Enantioselective reduction of prochiral ketones by engineered bifunctional fusion proteins[J]. Biotechnology & Applied Biochemistry, 2010, 56(4):131-140.
[19] 施巧琴. 酶工程[M]. 北京:科学出版社; 2005:27-31.
[20] ZHENG ZJ, MA CQ,GAO C,et al. Efficient conversion of phenylpyruvic acid to phenyllactic acid by using whole cells ofBacilluscoagulansSDM[J]. Plos One,2011,6(4):0019030.
Construction of fusion protein for asymmetric synthesis of (R)-2-hydroxy-3-phenylpropionic acid
ZHU Yi-bo1, JIANG Zhuo-yue1,2, GUO Qian1, ZHENG Qing-yun1,LIN Rong-tian1, QIAN Zhi-hao1, QI Bin1, WANG Li-mei1*
1(Key Laboratory of Food and Biotechnology of Suzhou, Changshu Institute of Technology, Changshu 215500, China) 2(Institute of Basic Medical and Biological Sciences,Soochow University, Suzhou 215000,China)
The bifunctional fusion protein system consisting of a mutantD-lactic dehydrogenase (D-LDHY52V) and formate dehydrogenase (FDH) was constructed for asymmetric synthesis of (R)-2-hydroxy-3-phenylpropionic acid and cofactor regeneration. Thed-ldhY52V-fdhgene was constructed with the flexible 15 amino acids linker (Gly4Ser)3by overlap extension PCR, and the final full length product was cloned into the pET-28a(+) vector for protein expression inEscherichiacoliBL21(DE3), wherein protein expression was induced by IPTG. The expression of fusion protein was analyzed through SDS-PAGE. The result showed a specific band of about 79.7 kDa after expression ofE.coliBL21 (DE3) containing plasmid pET28a-d-ldhY52V-fdh, its size was identical with the expected molecular weight of the fusion protein. The specific activity of crude recombinant protein extracts was then found to exhibit bothD-LDH and FDH activity. In asymmetric reductions of phenylpyruvic acid (PPA), cells expressing fusion protein generated 40.71% more of theD-PLA in the batch fermentation compared with cells expressingD-LDHY52V. Fed-batch fermentation was conducted by intermittent feed PPA, after 5 h transformation, the finalD-PLA concentration reached 17.34 g/L with the conversion ratio of 77.64%. Results showed that the fusion proteinD-LDHY52V-FDH was successfully constructed, and it could provide foundation for further study of asymmetric synthesis of (R)-(+)-2-hydroxy-3-phenylpropionic acid with simultaneous cofactor regeneration.
D-LDHY52V; formate dehydrogenase; fusion protein;D-3-phenyllactic acid; cofactor regeneration
10.13995/j.cnki.11-1802/ts.201701009
博士,副教授(王立梅教授为通讯作者,E-mail:wlmqb@126.com)。
国家自然科学青年基金(31501459);国家自然科学基金面上项目(31470092);江苏省自然科学青年基金项目(BK20130380);江苏省“六大高峰人才”资助计划项目(NY-021);常熟市科技计划项目(CN201412)
2016-06-24,改回日期:2016-08-08
