高脂饮食对AOM/DSS诱导的小鼠不同周期溃疡性结肠炎的影响及白细胞介素6的改变
2017-02-11周凤刘维新于艳红邢俊伟杨慧珊李虹兰雨桐
周凤,刘维新,于艳红,邢俊伟,杨慧珊,李虹,兰雨桐
(1.中国医科大学附属第一医院消化内科,沈阳 110001;2.宁波市医疗中心李惠利东部医院感染科,浙江 宁波 315000)
高脂饮食对AOM/DSS诱导的小鼠不同周期溃疡性结肠炎的影响及白细胞介素6的改变
周凤1,2,刘维新1,于艳红1,邢俊伟1,杨慧珊1,李虹1,兰雨桐1
(1.中国医科大学附属第一医院消化内科,沈阳 110001;2.宁波市医疗中心李惠利东部医院感染科,浙江 宁波 315000)
目的 观察高脂饮食对氧化偶氮甲烷(AOM)/葡聚糖硫酸钠(DSS)诱导的小鼠不同周期溃疡性结肠炎(UC)及其不典型增生的影响以及血液中白细胞介素6(IL⁃6)的改变。方法 DSS组、DSS+AOM组、DSS+高脂组、DSS+AOM+高脂组小鼠以DSS水3 d+灭菌水4 d为1个循环周期全程交替口服,并设立正常对照组,每组12只。前3周每周第1天DSS+AOM组及DSS+AOM+高脂组小鼠腹腔注射AOM(10 mg/kg)。分段处死小鼠,采用疾病活动指数、病理组织学评分判断炎症程度,ELISA法检测血清中IL⁃6水平。结果 单纯使用DSS可建立UC模型。在第9个循环周期末处死的小鼠中,正常对照组与DSS组无不典型增生发生,DSS+高脂组不典型增生率为25%(1/4),而DSS+AOM组为50%(2/4),DSS+AOM+高脂组为75%(3/4),但DSS组与DSS+高脂组、DSS+AOM组与DSS+AOM+高脂组、DSS组与DSS+AOM组、DSS+高脂组与DSS+AOM+高脂组比较,不典型增生率均无统计学差异(均P>0.05)。DSS+高脂组和DSS+AOM+高脂组的疾病活动指数、病理组织学评分分别大于对应的DSS组和DSS+AOM组(P<0.05)。DSS+高脂组和DSS+AOM+高脂组血清IL⁃6水平虽高于对应的DSS组和DSS+AOM组,但差异无统计学意义(P>0.05)。结论 高脂饮食可能是UC及其不典型增生的一种致病因素。
高脂饮食;溃疡性结肠炎;不典型增生;白细胞介素6
炎症性肠病是一种病因尚不明确的慢性肠道炎症性疾病,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病。炎症性肠病是结直肠癌的高危因素之一[1],长期反复的炎症会导致结肠黏膜不典型增生甚至癌变的发生[2]。有研究[3]表明,UC相关性结直肠癌的发生过程不再依照“腺瘤→癌变”的经典模式,而是遵循炎症→不典型增生(低度、高度)→癌的演变过程。白细胞介素6(interleukin⁃6,IL⁃6)是白细胞介素家族中的多功能细胞因子,具有调节免疫应答、诱导急性期蛋白及调节肿瘤生长等作用。炎症性肠病中,维持大肠慢性炎症的CD4+T细胞主要依赖IL⁃6的抗凋亡作用。大量研究[4⁃6]显示,IL⁃6在UC的炎症发生及癌变过程中具有重要作用,它不但能维持炎症的慢性过程,还能促进异常细胞的发生,对T细胞和肿瘤细胞起抗凋亡作用。流行病学研究[7⁃8]证实,高脂饮食可能增加炎症性肠病和结直肠癌的发病率,但尚缺少高脂饮食对炎症性肠病向癌症进展影响的研究。OKAYASU等[9]利用致癌剂氧化偶氮甲烷(azoxymethane,AOM)与致炎剂葡聚糖硫酸钠(dextran sodium sulfate,DSS),在实验动物中首次验证反复黏膜坏死和再生对肿瘤形成的促进作用,较单纯使用AOM或DSS的实验周期大为缩短。该方法已被逐步优化,目前已成为常用的肠炎相关结直肠癌动物模型之一。本研究拟通过建立AOM/DSS诱导的UC及其不典型增生模型,并给予高脂饮食干预,检测IL⁃6的变化,进一步探讨高脂饮食对炎症及其癌变进展的影响,为临床治疗和预防提供新的思路。
1 材料与方法
1.1 实验动物
选用雄性6周龄Balb/c小鼠60只,由北京维通利华实验动物技术有限公司提供。适应性喂养1周,恒温(23±2)℃,恒湿50%±10%,昼夜循环。
1.2 实验材料
分子量为36 000~50 000的DSS,购自美国MP⁃BIO公司;AOM(A5486⁃25MG),购自美国Sigma公司;小鼠IL⁃6 ELISA试剂盒,购自北京方程生物科技有限公司。高脂饲料:猪油(21%)、胆固醇(0.15%)、基础饲料(78.85%),购自北京科奥协力饲料有限公司。其余材料均为实验室自备。
1.3 实验方法
1.3.1 造模及分组:配制DSS饮用水,将分子量为36 000~50 000的DSS溶于灭菌水中,配置成3%的DSS溶液。随机将小鼠平均分为5组,分别为正常对照组和4个实验组,每组12只。实验组包括正常饮食的DSS组(DSS诱导UC)、DSS+AOM组(AOM/ DSS联合诱导UC癌变)以及高脂饮食的DSS+高脂组、DSS+AOM+高脂组。正常对照组予以灭菌水自由饮用,不作任何处理。除正常对照组外,4个实验组均以自由饮用3%的DSS水3 d+自由饮用灭菌水4 d为1个循环周期,重复9个周期。DSS+AOM组及DSS+AOM+高脂组小鼠在前3个循环周期的每周第1天,腹腔注射AOM(10 mg/kg)。
1.3.2 标本采集:于第1、3、5、7个循环周期末各组处死2只小鼠,第9个循环周期末处死各组剩余小鼠。处死前采用摘眼球法取血,放于EP管中。将每只小鼠整段结肠取出,沿纵轴切开,用生理盐水冲净后明确炎症部位,截取1cm组织固定于10%甲醛溶液中,常规石蜡包埋、制作组织切片、常规HE染色后封片,光镜下观察结肠组织病理改变的情况。采用ELISA法检测各组小鼠血清中IL⁃6的水平。
1.3.3 疾病活动指数的评估:每日记录小鼠的体质量、大便性状和便血情况。评分方法[10]:体质量无下降,大便性状、颜色正常各计0分;体质量下降<5%,大便松散、颜色正常各计1分;体质量下降5%~<10%,大便松散、黑便各计2分;体质量下降10%~<15%,大便稀便、黑便各计3分;体质量下降≥15%,大便稀便、肉眼血便各计4分。计算总评分,作为每只小鼠的疾病活动指数,以评估疾病活动情况。
1.3.4 不同喂养方式下小鼠体质量差值比较:记录小鼠的体质量,计算第1、3、5、7、9循环周期末小鼠体质量与初始体质量的差值,采用方差分析方法比较各组体质量变化是否相同。
1.3.5 病理组织学损伤评分:在光镜下观察结肠组织切片。评分方法[10]:无溃疡、无炎症、无肉芽肿、无纤维化、无病变各计0分;小溃疡<3 mm、轻度炎症、有肉芽肿、病变局限于黏膜下层各计1分;大溃疡≥3 mm、重度炎症、病变深度达肌层、重度纤维化各计2分。合计总分,评估组织损伤情况。癌变标准[11]包括不典型增生和癌变。
1.3.6 ELISA法检测血清IL⁃6水平:选取第1、5、7、9循环周期末小鼠,采用摘眼球法取血,存于-80℃冰箱,待ELISA检测时解冻分离血清血浆,选用血清。严格参照ELISA试剂盒说明进行操作。
1.4 统计学分析
采用SPSS 19.0软件进行分析,数据以x±s表示。各样本均数的比较采用单因素方差分析,两两比较采用LSD检验。多个样本表达率的比较及多重比较采用χ2检验,相关性采用Spearman等级相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况及疾病活动指数
4个实验组小鼠在第1个循环周期症状不明显。第3个循环周期开始后第3天小鼠出现精神萎靡、懒动等症状,DSS+高脂组和DSS+AOM+高脂组小鼠体毛凌乱明显,大便次数增多、质稀,出现黑便,改正常饮水第2天症状改善,大便松散,仍有黑便,体质量下降。第5个循环周期开始后第3天4个实验组每组分别有3~6只小鼠出现大便颜色变深、黑便或血便,改正常饮水后第3天血便消失,但仍有黑便,DSS+AOM+高脂组有1只小鼠稀便。第7个循环周期开始后第2天4个实验组小鼠出现稀便、黑便,第3天出现血便,改正常饮水后第3天血便消失,有稀便、黑便,DSS+高脂组和DSS+AOM+高脂组尤为明显。第9个循环周期开始后第2天4个实验组所有小鼠均出现稀便,部分小鼠有肉眼血便,第3天全部可见肉眼血便,改正常饮水第4天部分小鼠仍有腹泻及便血症状,DSS+高脂组和DSS+AOM+高脂组较明显。正常对照组小鼠精神、活动、食量、大便性状正常,体毛柔顺。总体可见,DSS+高脂组和DSS+AOM+高脂组的疾病活动指数大于对应的DSS组和DSS+AOM组(P<0.05),但DSS+AOM组与DSS组、DSS+AOM+高脂组与DSS+高脂组比较,疾病活动指数的差异无统计学意义(P>0.05)。4个实验组的疾病活动指数均大于正常对照组(P<0.05)。见表1。
2.2 不同喂养方式下小鼠体质量差值
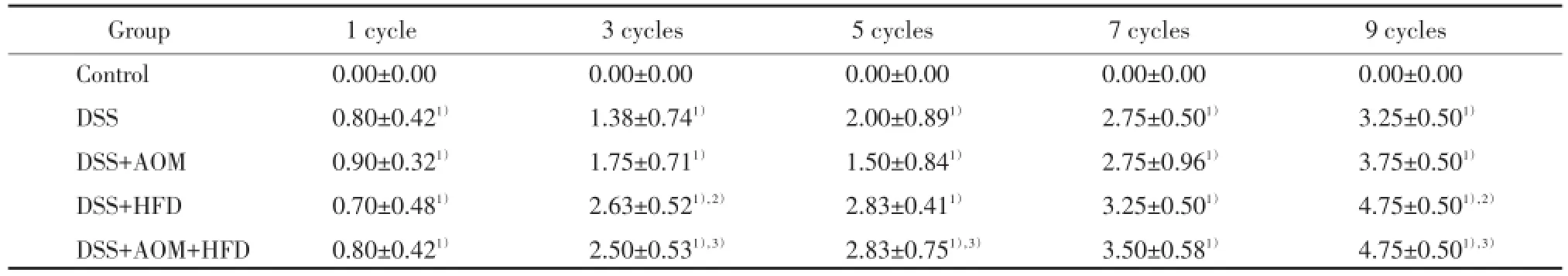
表1 第1、3、5、7、9循环周期末各组小鼠疾病活动指数Tab.1 Disease activity index of 5 groups of mice at the end of 1,3,5,7,and 9 cycles
4个实验组中9个循环周期小鼠体质量差值变化总体呈缓慢增长或不增长趋势,期间有体质量下降。起初DSS+高脂组和DSS+AOM+高脂组小鼠体质量增长高于对应的DSS组和DSS+AOM组,第3个循环周期末开始,DSS+高脂组和DSS+AOM+高脂组小鼠体质量下降,在第5、9个循环周期末,DSS+高脂组、DSS+AOM+高脂组体质量差值分别小于DSS组、DSS+AOM组,差异有统计学意义(P<0.05);第5个循环周期开始,DSS+AOM组、DSS+AOM+高脂组体质量增长分别小于DSS组及DSS+高脂组,差异有统计学意义(P<0.05)。见表2。
2.3 光镜下结肠病理组织学评估
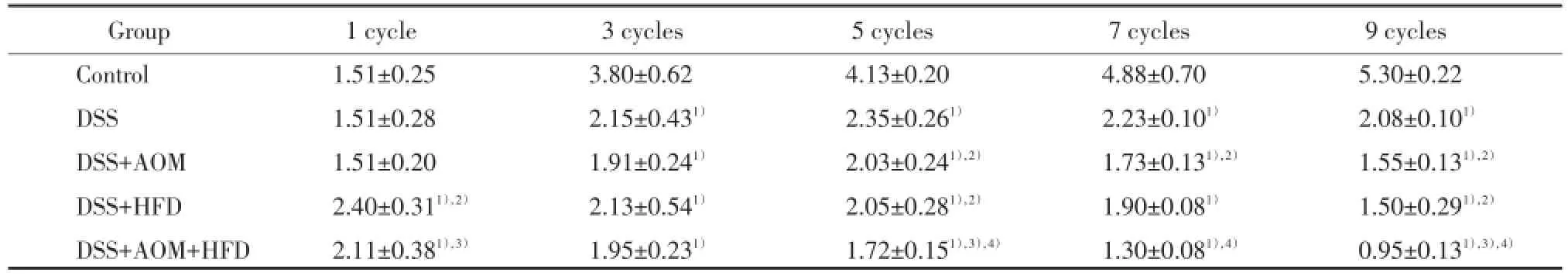
表2 第1、3、5、7、9循环周期末各组小鼠实验前后体质量差值(g)Tab.2 Body weight growth of 5 groups of mice at the end of 1,3,5,7,and 9 cycles(g)
4个实验组在第1个循环周期末处死的小鼠中结肠组织轻度水肿,炎症细胞浸润不明显;第3个循环周期末处死的小鼠中结肠组织明显充血水肿,部分黏膜上皮损伤脱落,伴有不同程度的腺体结构消失;第5个循环周期末处死的小鼠中发现小溃疡病灶,炎症细胞浸润多在黏膜下层,固有腺体萎缩;第7个循环周期末可见多发小溃疡灶,黏膜坏死、糜烂,炎症细胞较前增多,黏膜下层可见淋巴结节,伴有纤维化出现。第9个循环周期末DSS+AOM组、DSS+高脂组及DSS+AOM+高脂组有不典型增生的表现,如细胞核大深染、核型不规则、核分裂像增多、核质比例增多等。DSS组未见不典型增生表现。正常对照组小鼠结肠黏膜上皮完整,腺体排列规整,无充血水肿及糜烂溃疡。第7个循环周期末,病理组织学评分DSS组小于DSS+AOM组、DSS组小于DSS+高脂组,差异均有统计学意义(P<0.05);第9个循环周期末,病理组织学评分DSS组小于DSS+ AOM组、DSS+高脂组小于DSS+AOM+高脂组、DSS组小于DSS+高脂组、DSS+AOM组小于DSS+AOM+高脂组,差异均有统计学意义(P<0.05)。4个实验组病理组织学评分均大于正常对照组(P<0.05)。见表3。第9个循环周期末处死的小鼠中,正常对照组与DSS组无不典型增生发生,DSS+高脂组不典型增生率为25%(1/4),DSS+AOM组为50%(2/4),DSS+AOM+高脂组为75%(3/4),DSS+AOM+高脂组小鼠结直肠不典型增生率大于正常对照组(P<0.05),但DSS组与DSS+高脂组、DSS+AOM组与DSS+AOM+高脂组、DSS组与DSS+AOM组、DSS+高脂组与DSS+AOM+高脂组比较,不典型增生率均无统计学差异(均P>0.05)。第9个循环周期末各组小鼠结肠病理图片见图1。
2.4 ELISA法检测血清IL⁃6水平

表3 第1、3、5、7、9循环周期末各组小鼠病理组织学评分Tab.3 Pathohistological index of 5 groups of mice at the end of 1,3,5,7,and 9 cycles

图1 第9个循环周期末各组小鼠结肠病理图片Fig.1 Pathological pictures of colon of 5 groups of mice at the end of 9 cycles
4个实验组中血清IL⁃6水平随循环周期的增加而逐渐升高,明显高于正常对照组,差异有统计学意义(P<0.05)。DSS+高脂组、DSS+AOM+高脂组小鼠血清IL⁃6水平大于对应的DSS组、DSS+AOM组,但差异无统计学意义(P>0.05)。在第9个循环周期末,小鼠血清IL⁃6水平DSS组小于DSS+AOM组、DSS+高脂组小于DSS+AOM+高脂组,差异均有统计学意义(P<0.05)。见表4。
3 讨论
近年来,随着生活方式及饮食习惯的改变,UC的发病率在世界各地呈逐渐增高趋势,且与结直肠癌的发病关系密切。有研究[12]发现,UC相关性结直肠癌仅占所有结直肠癌的1%~2%,但在导致UC患者死亡的因素中占了15%,可认为UC癌变是造成UC患者死亡的主要原因之一。其病因和发病机制尚不明确,目前认为生活环境、饮食习惯、免疫系统、遗传等多因素的改变均可能在UC癌变过程中发挥重要的作用[13]。
高脂饮食与结肠炎、结直肠癌的发病密切相关。研究[14]证明高脂饮食可能增加小鼠UC的患病率,徐德魁等[15]发现结肠炎小鼠给予高脂饮食后结肠局部炎症加重,表明高脂饮食可能是UC的一个致病因素。其机制可能为脂类在消化道代谢分解的产物,如次级胆酸、硫化氢等,损害肠道微环境,诱发结肠黏膜炎症。炎症的不断累积可导致不典型增生的发生,甚至发生癌变。高脂饮食是肥胖的主要原因,而肥胖被大多数研究者认为是一种“低度炎症状态”。肥胖相关的炎症在癌症发生发展中起到重要的作用[16]。目前缺少高脂饮食对UC癌变的相关实验及临床研究。

表4 第1、5、7、9循环周期末各组小鼠血清IL⁃6水平(pg/mL)Tab.4 Level of serum IL⁃6 at the end of 1,5,7,and 9 cycles(pg/mL)
IL⁃6是一种多效能细胞因子,其与受体结合形成IL⁃6/IL⁃6R/gpl30复合物进行信号传导,诱导转录激活子3活化,进而发挥其生物学功能。它的主要生物学作用包括调节免疫应答和造血系统、诱导急性期蛋白及调节肿瘤生长等。炎症性肠病中,不论是克罗恩病还是UC,维持大肠慢性炎症的CD4+T细胞主要依赖IL⁃6的抗凋亡作用,IL⁃6是炎症性肠病发展过程中的一种核心细胞因子。在炎症性肠病逐渐进展并最终发生肿瘤的演变过程中,IL⁃6不仅协同帮助肿瘤因子,促进异常细胞的发生,还对T细胞和肿瘤细胞有抗凋亡作用[17]。有研究[18]证实,阻滞抗体介导的IL⁃6信号传递,可延迟化学致癌物质诱导的UC相关性结直肠癌形成。
UC是一个反复发作的疾病,发作期及缓解期长短不一,反复发作的炎症导致肠道黏膜不典型增生,甚至发生癌变,在临床上收集多个周期病例难度大,主要的研究手段是建立相应的动物模型。本研究采用DSS诱导建立不同周期的UC小鼠模型,加用AOM联合建立UC不典型增生及癌变模型,结果显示单纯使用DSS可建立UC小鼠模型。第9个循环周期末处死的小鼠中,DSS组无不典型增生发生,DSS+高脂组不典型增生率为25%,而加用AOM的DSS+AOM组不典型增生率为50%,DSS+AOM+高脂组不典型增生率为75%。由于样本量太小,DSS组与DSS+高脂组、DSS+AOM组与DSS+AOM+高脂组、DSS组与DSS+AOM组、DSS+高脂组与DSS+AOM+高脂组比较,差异均无统计学意义(P>0.05),各组均无癌变发生,考虑可能为诱导周期太短,可增加实验周期来完善进一步研究。DSS+高脂组、DSS+ AOM+高脂组的小鼠病理组织学评分、疾病活动指数高于对应正常饮食的DSS组、DSS+AOM组小鼠(P<0.05),DSS组与DSS+AOM组、DSS+高脂组及DSS+AOM+高脂组比较,病理组织学评分的差异也有统计学意义(P<0.05)。而且随着循环周期的增多,高脂饮食的DSS+高脂组、DSS+AOM+高脂组的小鼠体质量增长小于正常饮食的DSS组、DSS+AOM组小鼠(P<0.05),DSS+AOM组、DSS+AOM+高脂组小鼠体质量增长分别小于DSS组及DSS+高脂组,差异有统计学意义(P<0.05)。这说明高脂饮食、AOM可加重小鼠结肠炎症,诱导不典型增生的发生,并影响着小鼠的正常生长。4个实验组的血清IL⁃6水平逐渐升高,明显高于正常对照组(P<0.05),DSS+高脂组、DSS+AOM+高脂组的IL⁃6水平比对应的DSS组、DSS+AOM组增高,但是差异无统计学意义(P>0.05),可能与高脂负荷量不足有关。在第9个循环周期末,DSS组与DSS+AOM组、DSS+高脂组与DSS+AOM+高脂组血清IL⁃6水平的差异有统计学意义(P<0.05)。高脂饮食可能可加重UC,增加其不典型增生的发生率,为其治疗和预防提供了临床参考。
综上所述,高脂饮食可以加重AOM/DSS诱导的小鼠UC及其不典型增生。IL⁃6水平在DSS+AOM+高脂组、DSS+AOM组最高,其次是DSS+高脂组、DSS组,在正常对照组最低。高脂饮食可能是UC及其不典型增生的一种致病因素。
[1]GUINA T,BIASI F,CALFAPIETRA S,et al.Inflammatory and re⁃dox reactions in colorectal carcinogenesis[J].Ann N Y Acad Sci,2015,1340(1):95-103.DOI:10.1111/nyas.12734.
[2]TAN YG,ZHANG YF,GUO CJ,et al.Screening of differentially ex⁃pressed microRNA in ulcerative colitis related colorectal cancer[J].Asian Pac J Tro Med,2013,6(12):972-976.DOI:10.1016/ S1995⁃7645(13)60174⁃1.
[3]TRIANTAFILLIDIS JK,NASIOULAS G,KOSMIDIS PA.Colorectal cancer and inflammatory bowel disease:epidemiology,risk factors,mechanisms of carcinogenesis and prevention strategies[J].Anti⁃cancer Res,2009,29(7):2727-2737.
[4]LEE MJ,LEE JK,CHOI JW,et al.Interleukin⁃6 induces S100A9 expression in colonic epithelial cells through STAT3 activation in experimental ulcerative colitis[J].PLoS One,2012,7(9):e38801. DOI:10.1371/journal.pone.0038801.
[5]MORIASI C,SUBRAMANIAM D,AWASTHI S,et al.Prevention of colitis⁃associated cancer:natural compounds that target the IL⁃6 sol⁃uble receptor[J].Anticancer Agents Med Chem,2012,12(10):1221-1238.
[6]ROSS R.Atherosclerosis⁃an inflammatory disease[J].N Engl J Med,1999,340(2):115-126.DOI:10.1056/NEJM199901143400 207.
[7]VARGAS AJ,THOMPSON PA.Diet and nutrient factors in colorec⁃tal cancer risk[J].Nutr Cli Pract,2012,27(5):613-623.DOI:10.1177/0884533612454885.
[8]LI H,YANG G,XIANG YB,et al.Body weight,fat distribution and colorectal cancer risk:a report from cohort studies of 134255 Chi⁃nese men and women[J].Int J Obes,2012,37(6):783-789.DOI:10.1038/ijo.2012.152.
[9]OKAYASU I,OHKUSA T,KAJIURA K,et al.Promotion of colorec⁃tal neoplasia in experimental murine ulcerative[J].Gut,1996,39(1):87-92.
[10]刘维新,张绅,任益,等.溃疡性结肠炎及溃疡性结肠炎相关性结直肠癌小鼠模型中血管生成因子的表达及其与血管新生的关系[J].中国医科大学学报,2013,42(3):231-234.DOI:10.3969/j.issn.0258⁃4646.2013.03.011.
[11]MORSON BC,SOBIN L,GRUNDMANN E,et al.Precancerous conditions and epithelial dysplasia in the stomach[J].J Clin Pathol,1980,33(8):711-721.
[12]JEMAL A,BRAY F,CENTER MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.DOI:10.3322/caac. 20107.
[13]贾丹丹,戚文娟,程莉,等.溃疡性结肠炎相关性结直肠癌的危险因素及癌变机制[J].现代肿瘤医学,2014,22(3):720-722. DOI:10.3969/j.issn.1672⁃4992.2014.03.75.
[14]VAN DER LOGT EM,BLOKZIJL T,VAN DER MEER R,et al. Westernized high⁃fat diet accelerates weight loss indextran sulfate sodiuminduced colitis in mice,which is further aggravated by sup⁃plementation of heme[J].J Nutr Biochem,2013,24(6):1159-1165.DOI:10.1016/j.jnutbio.2012.09.001.
[15]徐德魁,郎绪龙,于庆功,等.高脂饮食对结肠炎小鼠肿瘤坏死因子⁃α表达的影响[J].中华实用诊断与治疗杂志,2014,28(11):1075-1076.DOI:10.13507/j.issn.1674⁃3474.2014.11.013.
[16]KARAGOZIAN R,DERDAK Z,BAFFY G.Obesity associated mechanisms of hepatocarcinogenesis[J].Metabolism,2014,63(5):607-617.DOI:10.1016/j.metabol.2014.01.011.
[17]潘宏,金志明,王天翔.白介素⁃6信号传递途径及其与大肠癌的关系[J].外科理论与实践,2008,3(1):273-275.DOI:10.16139/j.1007⁃9610.2008.03.029.
[18]BECKER C,FANTINI MC,SCHRAMM C,et al.TGF⁃beta sup⁃presses tumor progression in colon cancer by inhibition of IL⁃6 trans⁃signaling[J].Immunity,2004,21(4):491-501.DOI:10. 1016/j.immuni.2004.07.020.
(编辑 陈 姜)
Effects of High Fat Diet on Ulcerative Colitis in Different Periods Induced by AOM/DSS and the Changes of Interleukin⁃6 Level in Mice
ZHOU Feng1,2,LIU Weixin1,YU Yanhong1,XING Junwei1,YANG Huishan1,LI Hong1,LAN Yutong1
(1.Department of Digestive Diseases,The First Hospital,China Medical University,Shenyang 110001,China;2.Department of Infectious Diseases,Ningbo Medical Center Lihuili Eastern Hospital,Ningbo 315000,China)
Objective To observe the effects of high fat diet on ulcerative colitis(UC)and atypical hyperplasia in different periods induced by azoxymethane(AOM)/dextran sodium sulfate(DSS)and the changes of interleukin⁃6(IL⁃6)level in blood.Methods The mice in DSS,DSS+ AOM,DSS+high fat diet,and DSS+AOM+high fat diet groups were given DSS for 3 days and sterilization water for 4 days as one cycle for 9 cycles,and the mice in normal control group were given sterilization water(n=12 in each group).The mice in DSS+AOM and DSS+AOM+high fat diet groups received intraperitoneal injection of AOM(10 mg/kg)in the every first day of the first 3 cycles.The mice in each group were sacrificed at different time points,and the disease activity index and pathohistological index were used to determine the degree of inflammation.ELISA method was used for the detection of serum IL⁃6 level.Results Simple administration of DSS could induce UC in the mouse model.After 9 circles of treatment,atypical hyperplasia was not found in normal control and DSS groups,and the rate of atypical hyperplasia was 25%(1/4)in DSS+high fat diet group,50%(2/4)in DSS+AOM group,and 75%(3/4)in DSS+AOM+high fat diet group.However,there were no significant differences in the rate of atypical hyperplasia between DSS and DSS+AOM groups,DSS+high fat diet and DSS+AOM+high fat diet groups,DSS and DSS+high fat diet groups,and DSS+AOM and DSS+AOM+high fat diet groups(allP>0.05).The histopathological score and the disease activity index in DSS+high fat diet and DSS+AOM+high fat diet groups were higher than those in DSS and DSS+AOM groups(P<0.05).The IL⁃6 level in DSS+ high fat diet and DSS+AOM+high fat diet groups was higher than that in DSS and DSS+AOM groups,but the difference was not statistically signifi⁃cant(P>0.05).Conclusion High fat diet may be one of the stimulating factors of UC and atypical hyperplasia.
high fat diet;ulcerative colitis;atypical hyperplasia;interleukin⁃6
R574.62
A
0258-4646(2017)03-0232-06
10.12007/j.issn.0258⁃4646.2017.03.010
沈阳市科技计划(F13⁃316⁃1⁃40)
周凤(1991-),女,医师,硕士.
刘维新,E-mail:weixinliu@yahoo.com
2016-07-05
网络出版时间:
