苜蓿黄酮对奶牛乳腺上皮细胞乳蛋白、乳脂和乳糖合成的影响
2017-02-10占今舜刘明美赵国琦
占今舜,刘明美,2,詹 康,赵国琦*
(1.扬州大学动物科学与技术学院,江苏扬州 225009;2.江苏联合职业技术学院淮安生物工程分院,江苏淮安 223200)
苜蓿黄酮对奶牛乳腺上皮细胞乳蛋白、乳脂和乳糖合成的影响
占今舜1,刘明美1,2,詹 康1,赵国琦1*
(1.扬州大学动物科学与技术学院,江苏扬州 225009;2.江苏联合职业技术学院淮安生物工程分院,江苏淮安 223200)
本试验旨在研究苜蓿黄酮对体外培养奶牛乳腺上皮细胞乳蛋白、乳脂和乳糖合成相关基因表达的影响。将乳腺上皮细胞分成5组,每组培养基中分别含有0、25、50、75、100 μg/mL苜蓿黄酮,细胞在37℃,5% CO2培养箱中培养72 h,然后检测相关基因的表达。结果表明:添加苜蓿黄酮具有降低乳腺上皮细胞的mTOR相对表达量的趋势(P=0.09),25 μ g/mL组的S6K1和eIF4E相对表达量显著低于50 μ g/mL组(P<0.05),而对氨基酸转运蛋白无影响;苜蓿黄酮具有降低FATP1相对表达量的趋势(P=0.06),50 μ g/mL组PPAR-γ 、SCD1和FASN相对表达量最高均显著高于0 μg/mL(P<0.05)组;50 μg/mL组的Glut1和Glut4相对表达量显著高于25 μg/mL组(P<0.05),0 μg/mL组的Glut8相对表达量显著低于50~100 μg/mL组(P<0.05),而β-1,4-Gal T相对表达量显著高于其他各组(P<0.05),25 μg/mL组的HK2相对表达量显著低于0 μg/mL组(P<0.05)。结果提示,苜蓿黄酮能够调节乳蛋白、乳脂和乳糖的合成。
苜蓿;黄酮类化合物;奶牛;奶牛乳腺上皮细胞
黄酮类化合物(Flavonoids)是以2-苯基色原酮为母核而衍生的,以C6-C3-C6为碳架的一类化合物,其广泛存在于植物中,是植物一种主要的次生代谢产物。研究表明,黄酮类化合物具有抗氧化、改善血液循环、抑制炎症等作用,添加在饲料中可促进动物生长和改善繁殖性能等[1]。紫花苜蓿(Medicagosativa)由于营养价值高,含有丰富的蛋白质、粗纤维、维生素以及微量元素,被称为“牧草之王”,是我国最重要的栽培牧草之一[2]。苜蓿中黄酮含量较高,据报道,45个紫花苜蓿品种中有70%以上品种的总黄酮含量为0.6%~0.9%。研究发现,苜蓿黄酮能够提高麻鸡的生产性能,提高小鼠的生长性能和改善其特异性和非特异性免疫功能以及过影响下丘脑-垂体-卵巢性腺轴来改善妊娠期间雌鼠的繁殖性能[3-5]。日粮中添加大豆黄酮能够提高奶牛乳脂率、乳蛋白和乳糖的含量;添加染料木黄酮能显著提高牛奶的乳脂率和乳蛋白率,而添加芦丁不会影响乳脂率、乳蛋白和乳糖的含量[6-8]。说明黄酮类化合物对奶牛乳品质有一定的影响作用,且不同结构的黄酮类化合物作用不同。细胞培养技术是通过体外模拟体内生理环境,在建立无菌、适温和一定的营养条件,使活体内取出与试验相关组织或细胞生长和生存并维持其结构与功能的一种方法。该方法具有易于提供性状相似的试验对象、耗资少、对于大型经济动物来讲比较经济等特点。目前,苜蓿黄酮对奶牛乳品质的影响尚未有报道。因此,本试验通过细胞培养技术来研究苜蓿黄酮对乳脂、乳蛋白和乳糖相关合成相关基因表达的影响,从而了解苜蓿黄酮调节奶牛乳品质的可能机制。
1 材料与方法
1.1 材料 苜蓿黄酮提取和纯化均由陕西绿清生物工程有限公司完成。奶牛乳腺上皮细胞由本试验室通过组织块培养法获得,纯化后通过共聚焦显微镜观察细胞角蛋白18来证明所培养的细胞为上皮型细胞[9]。
1.2 试验方法
1.2.1 细胞培养 试验于2015年3月开始进行,取密度为5×105个/mL细胞接种到6孔板,将细胞置于DMEM/F12(Gibco,美国)培养基在37℃,5% CO2的培养箱中培养,培养基中含有10%的胎牛血清(Gibco,美国)、2 mmol/L谷氨酰胺、100 U/mL青霉素和100 μg/mL链霉素(Sigma,美国)。试验分为5组,即基础培养基中分别加0、25、50、75、100 μg/mL苜蓿黄酮,每组5个重复,其中苜蓿黄酮用DMSO(索莱宝,北京)完全溶解,各处理组中的二甲基亚砜(DMSO)含量为2%。培养72 h后进行细胞RNA提取。
1.2.2 细胞RNA提取和cDNA的合成 去除细胞培养液,在6孔板中每个孔中直接加入1 mL的Trizol,混匀静置5 min。然后根据天根生化科技有限公司RNA提取试剂盒中的说明书进行总RNA的提取,采用One Drop仪器进行总RNA的浓度和纯度的测定。采用Roche反转录试剂盒进行cDNA的合成,操作在冰上进行。反应体系为20 μL:Total RNA 1μ L,Anchored-oligo(dT)18 primer 1μ L,Random hexamer primer 2 μ L,Water(PCR-grade)9 μ L,Transcriptor Reverse Transcriptase Reaction Buffer 4 μ L,protector RNase Inhibitor 0.5 μL,Deoxynucleotide Mix 2 μ L,Transcriptor Reverse Transcriptase 0.5 μ L。反应条件:25℃ 10 min,55℃30 min。所得cDNA保存于-20℃待测。
1.2.3 引物设计 根据GenBank中的基因序列,采用primer 5.0软件设计引物,引物由Invitrogen公司合成(表1)。
1.2.4 荧光定量PCR条件 根据Roche试剂盒说明书配制PCR反应液,操作在冰上进行。反应液组成:Master Mix 10 μ L,上、下游引物各1 μ L,PCR级水3 μL,cDNA 5μ L。将反应液置入罗氏96孔PCR反应板中,然后在罗氏Light Cycler 96 PCR仪上进行检测。PCR反应条件为95℃预变性600 s;PCR反应为95℃ 10 s,退火60℃和72℃延伸各10 s,循环45次;熔解曲线分析65℃ 60 s。
1.3 统计分析 基因相对表达量采用2-△△Ct方法进行计算,试验数据先用Excel 2007进行预处理,数据采用IBMSPSSstatistics 21.0单因素方差分析(ANOVA),LSD法多重比较, P<0.05表示差异显著。
2 结果与分析
2.1 苜蓿黄酮对乳蛋白合成基因表达的影响 从表2中可知,苜蓿黄酮对奶牛乳腺上皮细胞的氨基酸转运蛋白基因(LAT1和CAT1)表达没有显著影响。添加苜蓿黄酮具有降低乳腺上皮细胞的mTOR相对表达量的趋势(P=0.09),降低4EBPI的相对表达量,但各组未达显著性。25 μg/mL组的S6K1相对表达量显著低于0、50、75 μg/mL组(P<0.05);eIF4E相对表达量显著低于50 μg/mL组(P<0.05)。说明苜蓿黄酮能够影响奶牛乳蛋白合成。
2.2 苜蓿黄酮对乳脂合成基因表达的影响 从表3中可知,苜蓿黄酮具有降低FATP1相对表达量的趋势(P=0.06),但各组SREBP1相对表达量之间无显著性差异。添加50 μg/mL组的PPAR-γ 、SCD1和FASN相对表达量均显著高于0、25 μg/mL组(P<0.05)。结果表明,苜蓿黄酮对乳脂合成具有调节作用。
2.3 苜蓿黄酮对乳糖合成基因表达的影响 由表4可知,50 μg/mL组的Glut1和 Glut4相对表达量显著高于25 μg/mL组(P<0.05);0 μg/mL组的Glut8相对表达量显著低于其他组(P<0.05),而β-1,4-Gal T相对表达量显著高于其他各组(P<0.05);25 μg/mL组的HK2相对表达量显著低于0 μg/mL组(P<0.05),其他各组之间无显著差异。结果表明,苜蓿黄酮对乳糖合成具有一定的影响作用。
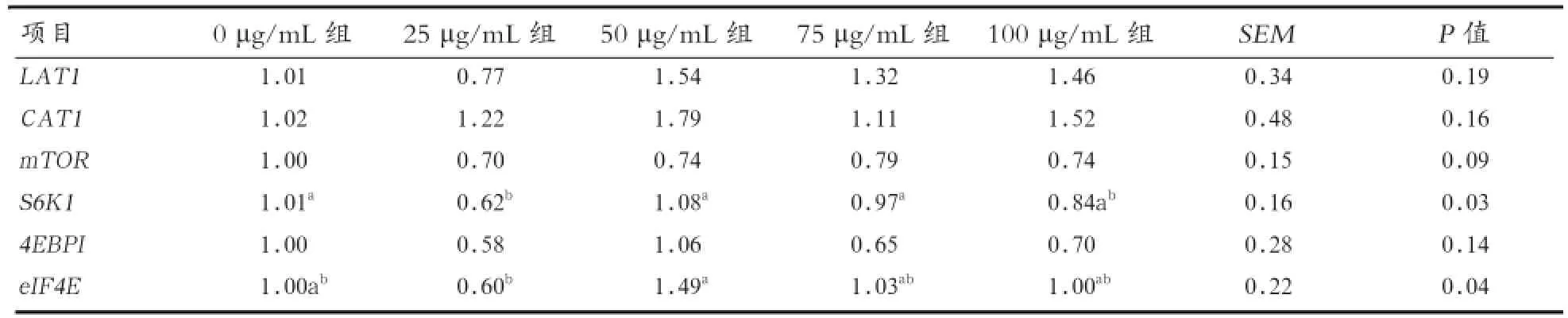
表2 苜蓿黄酮对乳蛋白合成基因表达的影响
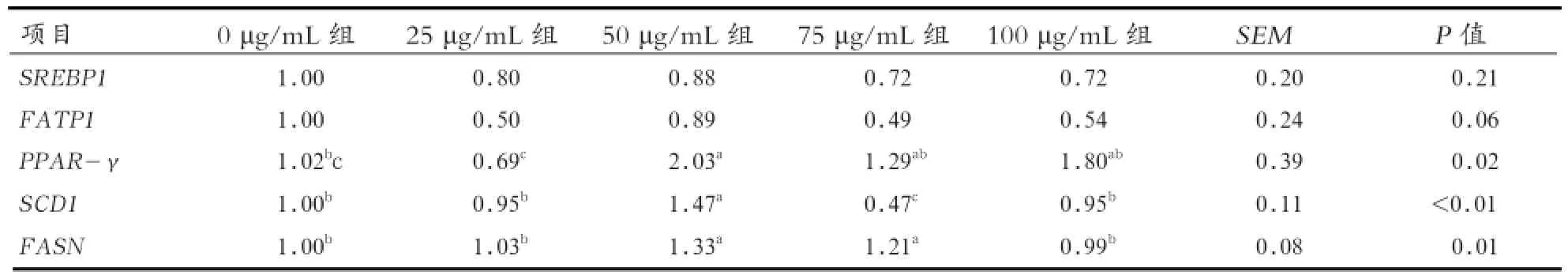
表3 苜蓿黄酮对乳脂合成基因表达的影响
3 讨论与结论
乳蛋白合成受到氨基酸转运系统、蛋白酪氨酸激酶-2信号转导子和转录激活子-5信号转导途径(Jak2-Stat5)和雷帕霉素靶蛋白(mTOR)信号通路的调控[10]。乳腺是奶牛合成乳蛋白的重要器官,乳中的大部分乳蛋白是以氨基酸为原料合成的。乳腺上皮细胞通过氨基酸转运载体将血液中游离氨基酸转进乳腺来合成乳蛋白。氨基酸转运载体CAT1(SLC7A1)能特异的转运碱性氨基酸(赖氨酸、精氨酸和组氨酸),而LAT1(SlC7A5)能够转运大分子的支链氨基酸、中性氨基酸和一些必需氨基酸,其对蛋白质的合成有促进作用[11]。从本试验结果来看,苜蓿黄酮不会影响乳腺上皮细胞对氨基酸的吸收。4EBPl和S6K1是蛋白翻译的关键调节因子,4EBPl能够与eIF4E相结合会抑制蛋白质的翻译。而mTOR能够抑制4EBPl发生磷酸化,促使eIF4E与4EBPl分离,导致eIF4E的表达增高,从而促进关键蛋白质的翻译。另外,mTOR能够使S6K1蛋白磷酸化,增强含嘧啶基因mRNA的翻译功能,调节蛋白质的合成[12]。从本试验结果来看25 μg/mL苜蓿黄酮组的mTOR、S6K1和eIF4E相对表达最低,说明添加低剂量苜蓿黄酮可能会通过降低mTOR表达,降低S6K1磷酸化和降低eIF4E表达,降低mRNA的翻译,进而降低乳蛋白的合成。但随着苜蓿黄酮剂量的升高,可能对乳蛋白的合成会有所升高。
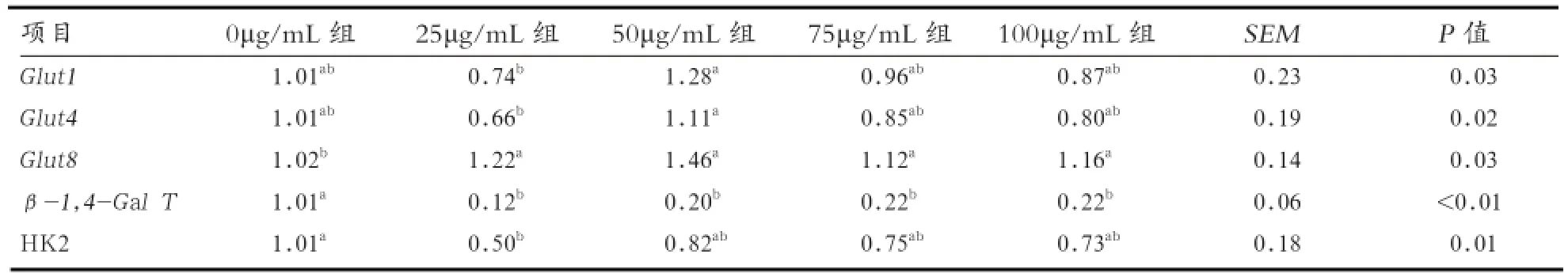
表4 苜蓿黄酮对乳糖合成基因表达的影响
一部分乳脂是由乳腺上皮细胞利用乙酸、β-羟丁酸等物质在各种酶的作用下从头合成,另一部分是从血液中获取。脂肪酸合成酶(FAS)是脂肪合成的一个关键酶,其能够催化乙酰辅酶A和丙二酰辅酶A生成长链脂肪酸。当FAS酶活性提高,丙二酰辅酶A能不断催化合成长链脂肪酸,进而导致脂肪的沉积。硬脂酰辅酶A去饱和酶(SCD)是催化饱和脂肪酸形成单不饱和脂肪酸的关键酶。通过敲除SCD基因的小鼠,虽增加采食高能饲粮,但其体脂的沉积却大大减少。说明SCD能够促进脂肪的合成。脂肪酸转运蛋白(FATPs)参与机体内细胞的脂肪酸跨膜转运和脂质代谢。FATP1可以促进细胞对长链脂肪酸的吸收并促进甘油三酯的储存[13]。固醇调节元件结合蛋白(SREBP)是转录调节脂肪合成基因的重要因子,能够调控胆固醇和脂肪酸合成基因的表达。SREBP1是脂肪合成有关基因转录的决定子,能够参与调控多种脂肪合成相关酶基因的转录激活过程。过氧化物酶体增殖物激活受体(PPAR)是脂质代谢的主要调控因子,PPAR-γ能够调节脂质蛋白酶、脂肪酸转运酶和脂肪酸转运蛋白的表达来调节脂肪酸和胆固醇的摄入。研究发现,使用PPAR-γ激动剂后能够上调SCD、FAS等表达[14]。从本试验结果看,苜蓿黄酮可能会通过促进PPAR-γ表达来上调FATP1、SCD和FAS表达,进而提高乳脂的合成。
乳糖主要由乳腺上皮细胞通过葡萄糖转运蛋白( Glut)吸收乳腺组织的血糖进入细胞内合成。对于奶牛, Glut1是最主要的葡萄糖转运蛋白,但泌乳期乳腺也能表达 Glut 4和 Glut8[15]。催化乳糖合成的酶类包括己糖激酶和乳糖合成酶。己糖激酶(HK)能使葡萄糖磷酸化为葡萄糖-6-磷酸,然后在变位酶和UTP 的作用下生成UDP-半乳糖。乳糖合成酶由 β-1,4-半乳糖基转移酶(β-1,4-GT)及必需辅助因子 α-乳白蛋白(α-lA)组成,是乳糖合成与分泌过程的主要限速酶,能够催化葡萄糖和 UDP-半乳糖合成乳糖。从本试验结果来看,苜蓿黄酮能够提高 Glut8的表达,但对 Glut1和 Glut4表达的影响不大;能够降低β-1,4- GT和HK2表达。结果表明,苜蓿黄酮可能会通过调节催化乳糖合成酶和葡萄糖转运蛋白来调节乳糖的合成。
以上结果说明,苜蓿黄酮能够调节乳腺上皮细胞乳蛋白、乳脂和乳糖合成相关基因的表达来调控乳蛋白、乳脂和乳糖的合成。然而通过体外细胞培养相对于机体这个系统来讲,会存在很大的差异,因此试验的结果可能会与在体内研究的结果存在差异。
[1] 占今舜,赵越,张彬. 大豆黄酮在禽类生产中的应用研究进展[J]. 家禽科学, 2012, (4):49- 52.
[2] 占今舜, 魏明吉, 苏效双,等. 苜蓿黄酮对热应激下体外培养奶牛乳腺上皮细胞凋亡的影响[J]. 草业学报, 2016, 25(4):159- 165.
[3] 欧阳克蕙,熊小文,王文君,等. 苜蓿黄酮对崇仁麻鸡生长性能及肌肉化学成分的影响[J]. 草业学报, 2013, 22(4):340- 345.
[4] 朱宇旌,张勇,宁自利,等. 苜蓿异黄酮提取物对小鼠生长和免疫功能的影响[J]. 营养学报, 2008, 30(6):615-618.
[5] 王伟,田苗苗,梁新平,等. 苜蓿总黄酮对妊娠雌鼠繁殖性能及相关基因表达量的影响[J].草业学报, 2013, 22(6):249- 256.
[6] 杨建英. 大豆黄酮对不同泌乳期奶牛产奶量,乳成分的影响及相关作用机制的研究[D]. 郑州:河南农业大学, 2003.
[7] 李晶晶. 日粮中添加染料木黄酮对荷斯坦奶牛生产性能和血液生化指标的影响[D]. 保定:河北农业大学, 2008.
[8] 郭旭东. 芦丁对奶牛泌乳性能,瘤胃消化代谢和对大鼠乳腺发育的影响[D] .北京:中国农业科学院, 2011.
[9] 詹康,贡笑笑,左晓昕,等.奶牛乳腺上皮细胞系的培养与鉴定[J]. 动物营养学报, 2015, 27(8):2544- 2550.
[10] 林忠荔,江明锋,任洪辉.牛乳蛋白合成的分子调控机制[J] .中国畜牧兽医, 2014, 41(5):158- 162.
[11] 熊霞,阳成波,印遇龙. 肠道氨基酸及氨基酸转运载体研究进展[J] . 生理科学进展, 2012, 43(3):202- 206.
[12] Ⅰnoki K, Ouyang H, Li Y, et a1. Signaling by target of rapamycin proteins in cell growth control[J]. Microbiol Mol Biol Rev , 2005, 69(1):79-100.
[13] Lobo S, Wiczer B M, Smith A J, et al. Fatty acid metabolism in adipocytes: functional analysis of fatty acid transport proteins 1 and 4[J]. J Lipid Res, 2007, 48: 609- 620.
Efects of Alfalfa Flavonoids on Lactoprotein, Milk Fat and Lactose Synthesis in Bovine Mammary Epithelial Cells
ZHAN Jin-shun1, LⅠU Ming-mei1,2, ZHAN Kang1, ZHAO Guo-qi1*
(1. College of Animal Science and Technology, Yangzhou University, Jiangsu Yangzhou 225009, China; 2. Jiangsu Joint Ⅰnstitute of Technology of Profession of Huai’an Bio-engineering Branch, Jiangsu Huai’an 223200, China)
To study the effects of alfalfa flavonoids on gene expression of the lactoprotein, fat and lactose synthesis in bovine mammary epithelial cells. The bovine mammary epithelial cells were divided into 5 groups which had the concentrations of alfalfa favonoids 0, 25, 50, 75 and 100μg/mL, respectively. The cells of each groups were cultured at the condition of 37 ℃,5 % CO2in the cell incubator. The cells were cultured at 72 h and then collected to detect the gene expression. The results showed as follow: the relative expression of mTOR showed a tendency of decrease by alfalfa favonoids supplementation (P=0.09). The relative expression of S6K1 and eⅠF4E were signifcantly lower in 25 μg/mL group than that in 50 μg/mL group (P<0.05). However, the relative expression of amino acid transporter was unafected by alfalfa favonoids. The relative expression of FATP1 had a tendency of decrease by supplementing alfalfa favonoids (P=0.06). Compared with 0 μg/mL group, the relative expression of PPAR-y ,SCD1 and FASN in 50 μg/mL group were signifcantly increased (P<0.05). Compared with 25 μg/mL group, the relative expression of Glut1 and Glut4 in 50 μg/mL group and the relative expression of HK2 in 0 μg/mL group were signifcantly increased (P<0.05). Compared with 0 μg/mL group, the relative expression of Glut8 in 50 to 100 μg/mL group were signifcantly increased (P<0.05), whereas the relative expression of β-1,4-Gal T in other group were signifcantly decreased (P<0.05). Ⅰn conclusion, alfalfa favonoids could regulate the synthesis of lactoprotein, milk fat and lactose.
Alfalfa; Flavonoids; Dairy cow; Bovine mammary epithelial cells
S823.5
A
10.19556/j.0258-7033.2017-01-091
2016-06-30;
2016-07-21
江苏省高校优势学科建设工程项目(PAPD);长三角地区生鲜乳质量安全追溯体系关键技术研究应用项目(14395810100);江苏省高校研究生科研创新计划项目(KYZZ_0367))
占今舜(1985-),男,江西玉山人,博士研究生,主要从事动物营养与饲料科学研究,E-mail:zhanjinshun@sohu.com
*通讯作者:赵国琦,教授,博士生导师,E-mail:gqzhao@yzu.edu.cn
