不同浓度EPA和DHA对C2C12成肌细胞增殖及凋亡的影响
2017-02-10刘玉兰武汉轻工大学动物营养与饲料科学湖北省重点实验室湖北武汉430023中南民族大学生命科学学院湖北武汉430074
张 琳,刘 妍,2,刘玉兰,张 晶*(.武汉轻工大学,动物营养与饲料科学湖北省重点实验室,湖北武汉 430023;2.中南民族大学生命科学学院,湖北武汉 430074)
不同浓度EPA和DHA对C2C12成肌细胞增殖及凋亡的影响
张 琳1,刘 妍1,2,刘玉兰1,张 晶1*(1.武汉轻工大学,动物营养与饲料科学湖北省重点实验室,湖北武汉 430023;2.中南民族大学生命科学学院,湖北武汉 430074)
本试验旨在研究二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)对体外培养的C2C12成肌细胞增殖和凋亡的影响。用不同终浓度DHA和EPA(0、6.25、12.5、25、50、100 μmol/L)分别作用C2C12细胞12、24、48 h后,用CCK-8法检测细胞的增殖情况;用不同终浓度DHA和EPA(0、50、100 μmol/L)分别作用C2C12细胞48 h后,用TUNEL法检测细胞凋亡情况。结果表明:终浓度为50、100 μmol/L的EPA处理细胞48 h,C2C12细胞增殖能力受到显著抑制,但不同浓度DHA处理组细胞的增殖能力无明显变化。此外,EPA处理C2C12细胞后,TUNEL法显示凋亡细胞数增加,且100 μmol/L的EPA处理组细胞凋亡最明显。然而,与对照相比,DHA处理组细胞无明显凋亡。上述结果表明,EPA能抑制C2C12成肌细胞增殖并促进其凋亡,而DHA对细胞增殖和凋亡无明显影响。
二十碳五烯酸;二十二碳六烯酸;成肌细胞;细胞增殖;细胞凋亡
ω-3多不饱和脂肪酸(PUFA)主要包括二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),它们属于人体必需脂肪酸,常被作为特殊的营养素,因具有独特的生理活性而受到广泛关注[1]。研究表明,EPA、DHA具有预防心脑血管疾病、促进视觉系统及神经系统发育、调节免疫、抗癌、抗炎等多种作用[2]。
成肌细胞是骨骼肌的前体细胞。骨骼肌发育的过程主要包括成肌细胞增殖、退出细胞周期、迁移并融合为多核肌管,最后形成肌纤维[3]。此外,成肌细胞也具有成脂分化的能力[4]。目前研究发现,ω-3 PUFA影响成肌细胞的脂质代谢、抗氧化、蛋白合成以及成脂分化等一系列过程。Pinel等[5]研究发现,EPA、DHA均明显改善C2C12成肌细胞膜的流动性,并影响棕榈酸酯在成肌细胞中的代谢,从而减缓其脂质毒性作用。Silva等[6]研究发现,在C2C12成肌细胞中添加EPA后过氧化氢酶活性增强,而DHA抑制超氧化物歧化酶活性。此外,DHA、EPA均能促进成肌细胞脂肪分化相关基因的表达[7-8]。然而,ω-3 PUFA对成肌细胞增殖、凋亡、分化影响的研究较少。因此,本研究将C2C12成肌细胞作为研究模型,采用CCK-8和TUNEL法检测EPA、DHA添加对细胞增殖和凋亡的影响,从而探讨ω-3 PUFA对骨骼肌发育的影响。
1 材料与方法
1.1 主要试剂 C2C12细胞(小鼠成肌细胞)由华中农业大学赵书红教授惠赠;CCK-8试剂盒购自日本同仁化学研究所;一步法TUNEL细胞凋亡检测试剂盒购自碧云天生物技术有限公司;DMEM高糖培养基、胎牛血清、谷氨酰胺、双抗、磷酸盐缓冲液均购自Invitrogen公司;DHA和EPA均购自Sigma公司,用无水乙醇溶解配制成储存液。
1.2 主要仪器设备 SW-CJ-2FD型双人单面净化工作台;CO2培养箱(上海启前电子科技有限公司);DK-S12型电热恒温水浴锅(上海森信试验仪器有限公司);BIO-RAD酶标仪;倒置式荧光显微镜(OlYMPUS)。
1.3 C2C12成肌细胞培养 C2C12成肌细胞株常规复苏后,用DMEM高糖培养基(含10%的胎牛血清,1%谷氨酰胺,1%双抗),在体积分数5% CO2,37℃的培养箱中培养。
1.4 CCK-8试剂盒检测细胞增殖 在96孔板中加入细胞浓度为2×104个/mL的细胞悬液100 μL,将培养板在培养箱预培养24 h后,处理组分别添加终浓度为6.25、12.5、25、50、100 μmol/L的DHA和EPA,同时设置对照组,每组4个重复,在培养箱中分别孵育12、24、48 h。孵育完成后,将孔板中的培养液弃掉,换成新鲜培养液100 μL/孔,然后每孔加入10 μL CCK-8溶液,在培养箱内孵育1 h后,用酶标仪测定450 nm处的吸光度。
1.5 一步法TUNEL细胞凋亡检测 处理组分别添加终浓度为50 μmol/L和100 μmol/L的DHA和EPA培养细胞48 h,同时设置对照组,PBS洗涤3次后,用免疫染色固定液固定细胞40 min。固定后再用PBS洗涤1次,加入免疫染色洗涤液,冰浴孵育2 min。根据一步法TUNEL细胞凋亡检测试剂盒配制适当量的TUNEL检测液,充分混匀。冰浴孵育完成后,用PBS洗涤2次,在样品上加50 μL TUNEL检测液,37℃避光孵育1 h。冲洗,加入少量DAPI染色液,覆盖住样品,室温放置3~5 min。吸除DAPI染色液,用PBS洗涤3次,每次5 min,洗涤完成后在荧光显微镜下观察拍照。
1.6 C2C12成肌细胞凋亡形态观察 选用添加终浓度为100 μmol/L的DHA和EPA的培养液培养C2C12成肌细胞48 h后,用显微镜在20×倍镜下观察细胞形态变化,并白光拍照。
2 结 果
2.1 不同浓度DHA和EPA对C2C12细胞增殖的影响 由图1可见,在本试验中培养时间分别为12、24、48 h,随着培养时间的延长,不同浓度DHA和EPA处理组中细胞的OD值均呈上升趋势,在48 h时达到最大。图1A显示,与对照组相比,不同浓度DHA处理组细胞的OD值在同一时间点的差异不明显;图1B显示,在48 h时,50 μmol/L和100 μmol/L EPA处理组细胞的OD值明显低于其他各浓度处理组及对照组,表明浓度为50 μmol/ L和100 μmol/L的EPA对C2C12细胞增殖有一定抑制作用。为了分析50 μmol/L和100 μmol/L的EPA处理组细胞的OD值降低是否与细胞凋亡相关,分别选取终浓度为50 μmol/L和100 μmol/L的DHA和EPA处理C2C12细胞48 h后,用一步法TUNEL细胞凋亡检测试剂盒检测细胞凋亡情况。
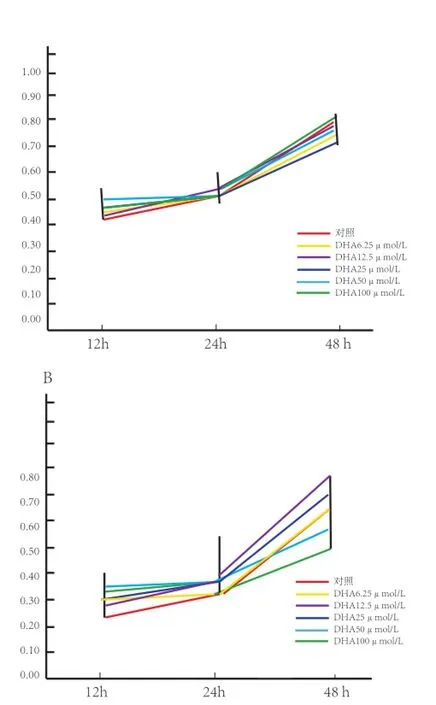
图1 CCK-8检测不同添加浓度DHA和EPA对C2C12细胞增殖的影响
2.2 不同浓度DHA和EPA对C2C12细胞凋亡的影响 图2显示,50 μmol/L的DHA处理组C2C12细胞未见明显红色荧光阳性信号,100 μmol/L的DHA处理组C2C12细胞仅见部分红色荧光,表明DHA对C2C12细胞凋亡无明显影响;图3显示,浓度为50 μmol/L EPA处理C2C12细胞48 h,可检测到部分凋亡细胞,而100 μmol/L的EPA处理组可见明显的凋亡细胞,表明50 μmol/L和100 μmol/L的EPA均可诱导C2C12细胞发生凋亡。
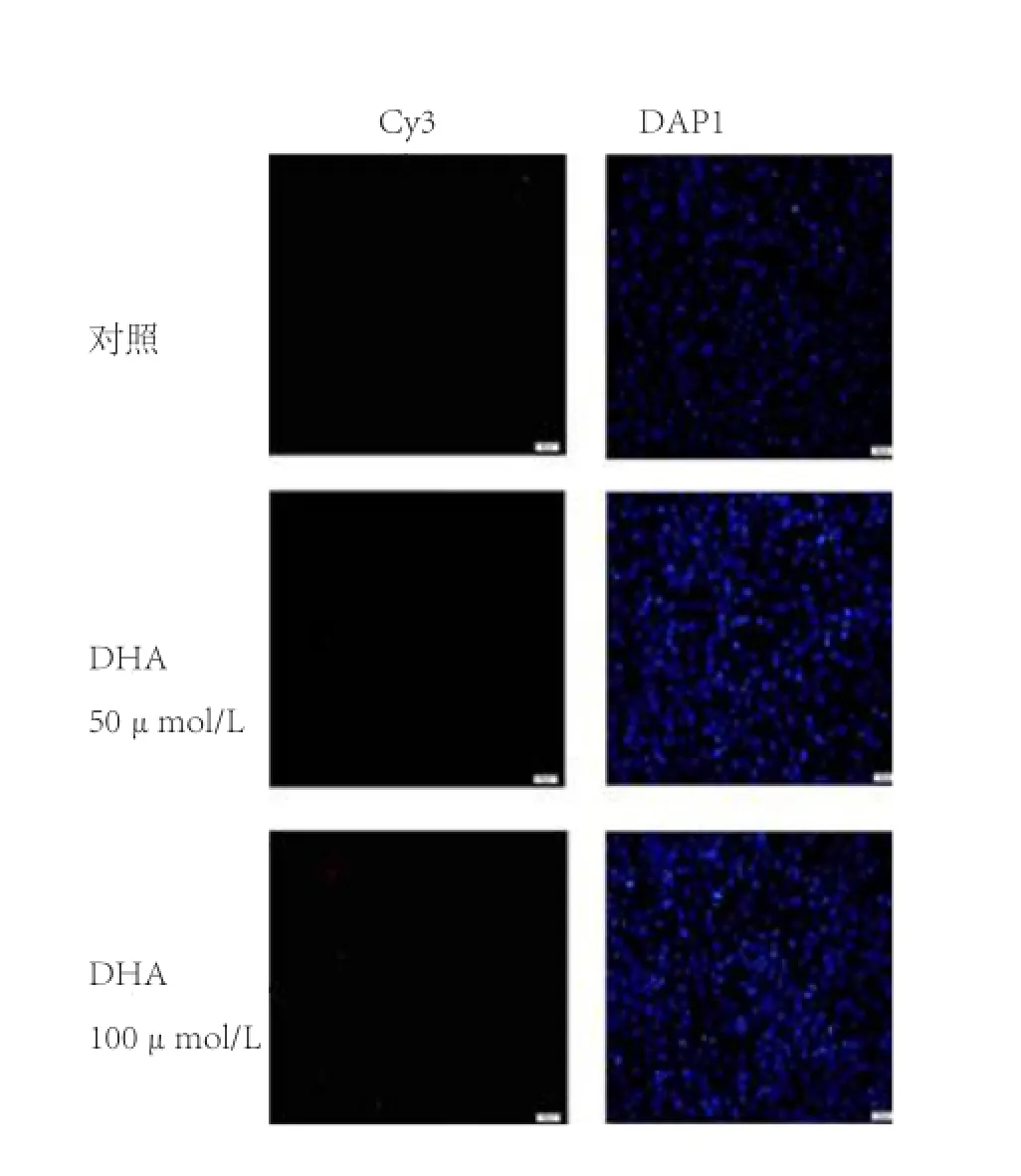
图2 一步法TUNEL检测不同添加浓度DHA对C2C12成肌细胞凋亡的影响
2.3 DHA和EPA对C2C12细胞形态的影响 培养液中分别添加终浓度为100 μmol/L的DHA和EPA,培养C2C12细胞48 h后,用显微镜在20×倍镜下观察细胞形态。由图4可见,对照组细胞形态完整、排列有序,未见明显凋亡现象;相对于对照组,100 μmol/L的DHA和EPA处理组C2C12细胞发生皱缩、碎裂,杂乱不清,凋亡细胞增多,尤以EPA处理组的细胞凋亡更为明显。
3 讨 论
骨骼肌的生长发育是一个极其复杂的过程,主要包括胚胎期肌纤维的形成以及出生后肌纤维体积的增大。胚胎期骨骼肌发育是成肌细胞增殖、分化、融合成肌管并形成肌纤维的过程。出生后肌纤维的数量不再增加,只是肌纤维增粗、增长,而这一过程主要依靠肌肉蛋白质的合成[9]。目前研究表明,多种营养因素对调控动物的肌肉生长发育及改善肉的品质具有重要作用[10-11]。
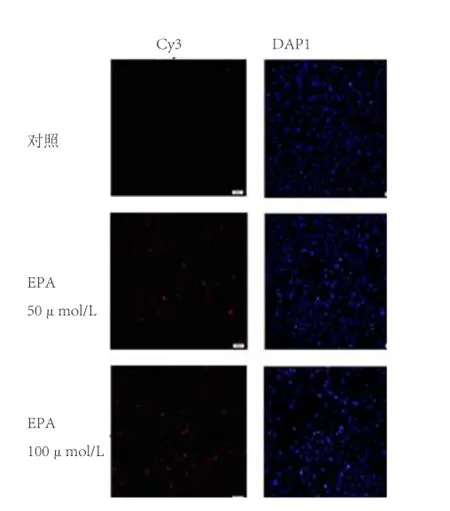
图3 一步法TUNEL检测不同添加浓度EPA对C2C12成肌细胞凋亡的影响
鱼油富含ω-3多不饱和脂肪酸(DHA和EPA),在抗炎、调节血脂、调节免疫系统等方面具有重要功能。一些研究表明,在母猪妊娠期和泌乳期日粮中添加鱼油,可影响仔猪初生重、平均断奶重、育成率和后期生长[12-14]。然而,Rooke等[15]研究发现,在母猪妊娠期第91天添加3%鱼油,仔猪组织中脂肪酸含量发生改变,但对仔猪增重无影响。lauridsen等[16]研究也发现,在母猪产前一周和泌乳期添加8%不同来源脂肪酸,鱼油组和对照组的仔猪窝增重显著低于其他几组。ω-3多不饱和脂肪酸是幼龄动物生长发育所必需的脂肪酸,对大脑发育及视觉系统的发育尤为重要,但对骨骼肌生长发育的作用尚无明确的结论。目前,大量研究主要利用C2C12肌管细胞为模型,证实EPA和DHA具有促进骨骼肌蛋白合成、抑制炎性因子表达、调节脂类代谢和改善胰岛素耐受等作用[17-19]。肌管细胞由成肌细胞分化而来,但EPA和DHA对成肌细胞增殖和分化过程有何影响,相关的研究较少。

图4 添加终浓度100 μmol/L的DHA和EPA对C2C12细胞形态的影响
母体在妊娠期间补充EPA和DHA,胎儿组织EPA和DHA的含量会不断增加[20]。因此,认为在妊娠期间补充EPA和DHA,会对胚胎骨骼肌的发育产生长效的影响。Peng等[21]选取不同终浓度 EPA和 DHA(10、20、50、100 μmol/L) 处理C2C12细胞24 h后,用MTT法检测发现50、100 μmol/L的EPA和DHA均能抑制细胞增殖。然而,本研究结果表明,不同浓度EPA和DHA处理C2C12细胞24 h,对细胞增殖均无明显影响。随后,将处理时间延长至48 h,结果表明低浓度的EPA(6.25、12.5、25 μmol/L)对C2C12细胞增殖仍无明显影响,但高浓度的EPA(50、100 μmol/L)随着处理时间的延长,其对细胞增殖的抑制作用逐渐增强,提示EPA抑制C2C12细胞增殖依赖于浓度和作用时间。但在相同的作用时间下,不同浓度的DHA对C2C12细胞的增殖均无明显影响。
此外,本研究结果显示50、100 μmol/L的EPA处理C2C12细胞48 h,可诱导细胞发生凋亡,且随着浓度的增加,细胞凋亡越显著,提示高浓度EPA抑制细胞增殖可能与其促进细胞凋亡密切相关。然而,50、100 μmol/L的DHA对细胞凋亡无明显影响。本研究推测DHA处理C2C12细胞48 h,未对细胞增殖和凋亡产生影响,可能与处理时间有关。
目前,有研究表明EPA和DHA的作用涉及细胞增殖和细胞凋亡过程中的多个基因和信号通路。Erk1/2 MApK信号通路促进成肌细胞的增殖并抑制分化[22]。Peng等[21]研究发现,EPA和DHA能抑制C2C12细胞内Erk1/2蛋白磷酸化水平,并且下调细胞周期相关蛋白cyclin E和CDK2的表达。EPA和DHA具有抗癌作用,可通过抑制Bcl-2表达、激活Caspases、改变膜的结构等途径促进细胞凋亡[23-24]。但EPA和DHA对成肌细胞增殖和凋亡的作用机制仍不清楚,有待进一步研究。
4 结 论
骨骼肌的胚胎发育决定了出生后肌纤维的数量和性状。母体在妊娠期间补充EPA和DHA,胎儿组织中EPA和DHA的含量会不断增加。虽然EPA和DHA能促进胎儿大脑发育及视觉系统的发育,但本研究结果提示随着EPA和DHA浓度的不断增加和作用时间的延长,可能会对胚胎骨骼肌的发育产生不利影响,这为妊娠时期母体合理补充营养素EPA和DHA提供了一定的理论依据。
[1] Smith G Ⅰ, Julliand S, Reeds D N, et al. Fish oil-derived n-3 PUFA therapy increases muscle mass and function in healthy older adults[J]. Am J Clin Nutr, 2015, 102(1): 115-122.
[2] Swanson D, Block R, Mousa S A. Omega-3 fatty acids EPA and DHA: health benefits throughout life[J]. Adv Nutr, 2012, 3(1): 1-7.
[3] Schiaffino S, Dyar K A, Ciciliot S, et al. Mechanisms regulating skeletal muscle growth and atrophy[J]. FEBS J, 2013, 280(17): 4294-4314.
[4] Singh N K, Chae H S, Hwang Ⅰ H, et al. Transdifferentiation of porcine satellite cells to adipoblasts with ciglitizone[J]. J Anim Sci, 2007, 85(5): 1126-1135.
[5] Pinel A, Rigaudière J P, Laillet B, et al. N-3PUFA differentially modulate palmitate-induced lipotoxicity through alterations of its metabolism in C2C12 muscle cells[J]. Biochim Biophys Acta, 2015, 1861(1).
[6] Silva E P D, Nachbar R T, Levada-Pires A C, et al. Omega-3 fatty acids differentially modulate enzymatic anti-oxidant systems in skeletal muscle cells[J]. Cell Stress Chaperones, 2016, 21(1): 1-9.
[7] 陈小玲, 黄志清, 刘光芒, 等. DHA对C2C12细胞成脂分化过程中相关基因表达的影响[J]. 湖北农业科学, 2013, 52(16): 3987-3990.
[8] 罗何峰, 胡小明, 蒋思文, 等. EPA诱导成肌细胞转分化成脂肪细胞的分子机理研究[C].动物营养研究进展, 2012.
[9] Takagaki Y, Yamagishi H, Matsuoka R. Factors involved in signal transduction during vertebrate myogenesis[J].Ⅰnt Rev Cell Mol Biol, 2012, 296: 187-272.
[10] 刘秀娟, 李晓, 赵茹茜. 母体营养对后代肌肉生长发育的影响[J]. 畜牧与兽医, 2008, 40(7): 98-100.
[11] 苏国旗, 王军, 曹猛, 等. 母猪妊娠期营养水平对后代仔猪肌肉生长和发育的影响[J].动物营养学报, 2016,28(4): 1050-1059.
[12] 肖成林, 田春庄, 黄飞若, 等. 母猪日粮中的鱼油对乳中脂肪酸和仔猪生长性能的影响[J].动物营养学报, 2008, 20(1): 8-15.
[13] Rooke J A, Sinclair A G, Ewen M. Changes in piglet tissue composition at birth in response to increasing maternal intake of long-chain, n-3 polyunsaturated fatty acids are non-linear[J]. Br J Nutr, 2001, 86(4): 461-470.
[14] Rooke J A. Feeding tuna oil to the sow at different times during pregnancy has different effects on piglet longchain polyunsaturated fatty acid composition at birth and subsequent growth[J]. Br J Nutr, 2001, 86(1): 21-30.
[15] Rooke J A, Bland Ⅰ M, Edwards S A. Effect of feeding tuna oil or soyabean oil as supplements to sows in late pregnancy on piglet tissue composition and viability[J]. Brit J Nutr, 1998, 80(3): 273-280.
[16] Lauridsen C, Danielsen V. Lactational dietary fat levels and sources infuence milk composition and performance of sows and their progeny[J]. Livest Prod Sci, 2004, 91(1-2): 95-105.
[17] Kamolrat T, Gray S R. The effect of eicosapentaenoic and docosahexaenoic acid on protein synthesis and breakdown in murine C2C12 myotubes[J]. Biochem Biophys Res Commun, 2013, 432(4): 593-598.
[18] Chen S C, Chen P Y, Wu Y L, et al. Long-chain polyunsaturated fatty acids amend palmitate-induced infammation and insulin resistance in mouse C2C12 myotubes[J]. Food Funct, 2016, 7(1): 270-278.
[19] Figueras M, Olivan M, Busquets S, et al. Effects of eicosapentaenoic acid (EPA) treatment on insulin sensitivity in an animal model of diabetes: improvement of the infammatory status[J]. Obesity, 2011, 19(2): 362-369.
[20] Olsen S F, Østerdal M L, Salvig J D, et al. Fish oil intake compared with olive oil intake in late pregnancy and asthma in the offspring: 16 y of registry-based follow-up from a randomized controlled trial[J]. Am J Clin Nutr, 2008, 88(1): 167-175.
[21] Peng Y, Zheng Y, Zhang Y, et al. Different effects of omega-3 fatty acids on the cell cycle in C2C12 myoblast proliferation[J]. Mol Cell Biochem, 2012, 367(1-2): 165-173.
[22] Jones N C, Fedorov Y V, Rosenthal R S, et al. ERK1/2 is required for myoblast proliferation but is dispensable for muscle gene expression and cell fusion[J]. J Cell Physiol, 2001, 186(1): 104-115.
[23] Narayanan B A, Narayanan N K, Reddy B S. Docosahexa -enoic acid regulated genes and transcription factors inducing apoptosis in human colon cancer cells[J]. Ⅰnt J Oncol, 2001, 19(6): 1255-1262.
[24] Chapkin R S, Hong M Y, Fan Y Y, et al. Dietary n-3 PUFA alter colonocyte mitochondrial membrane composition and function[J]. Lipids, 2002, 37(2): 193-199.
Efects of Diferent Concentrations of EPA and DHA on Proliferation and Apoptosis of C2C12 Myoblast
ZHANG lin1, LⅠU Yan1,2, LⅠU Yu-Lan1, ZHANG Jing1*
(1. Hubei Key Laboratory of Animal Nutrition and Feedscience, Wuhan Polytechnic University, Hubei Wuhan 430023, China; 2. College of life Sciences,South-Central University for Nationalities, Hubei Wuhan 430074, China)
This experiment was conducted to investigate the efects of eicosapentaenoic acid (EPA) and docosahexaenoic acid (DHA) on cell proliferation and apoptosis of C2C12 myoblasts. We treated C2C12 myoblasts with different concentrations of DHA and EPA (0, 6.25, 12.5, 25, 50 and 100 μ mol/L, respectively) for 12 h, 24 h and 48 h, and monitored the cell lines for alterations in proliferation with the Cell Counting Kit-8. Ⅰn addition, we detected the C2C12 apoptosis under treatment with diferent concentrations of DHA and EPA (0, 50 and 100 μ mol/L) for 48 h by using the TUNEL assay. The results showed that the C2C12 proliferation was signifcantly inhibited after the treatment with 50 and 100 μ mol/L EPA for 48 h. However, there was no obvious diference in the proliferation of the C2C12 treated with various concentrations of DHA. Ⅰn addition, the TUNEL assay showed that treatment with EPA increased the number of apoptotic cells, and the cellular apoptosis was more obvious under treatment with 100 μ mol/L EPA. Compared with the control group, no obvious cellular apoptosis was observed under treatment with DHA. These results indicate that, EPA can inhibit C2C12 myoblast proliferation and promote its apoptosis, while DHA have no obvious effects on cell proliferation and apoptosis.
Eicosapentaenoic acid; Docosahexaenoic acid; Myoblasts; Cell proliferation; Apoptosis
S865.5
A
10.19556/j.0258-7033.2017-01-061
2016-07-27;
2016-09-02
湖北省自然科学资助项目(2015CFB514);湖北省高等学校优秀中青年科技创新团队计划项目(T201508)
张琳(1991-),女,湖北枣阳人,硕士生,研究方向为动物营养与饲料科学,E-mail:2223102573@qq.com
*通讯作者:张晶(1985-),女,湖北武汉人,博士,讲师,研究方向为骨骼肌发育和肌肉损伤的机制,E-mail:judyzhang 1103@163.com
