洪湖碘泡虫PCR检测方法的建立与初步应用
2017-02-09翟艳花顾泽茂
李 丹,柳 阳,翟艳花,顾泽茂
(1.华中农业大学水产学院,武汉 430070;2.淡水水产健康养殖湖北省协同创新中心,武汉 430070;3.农业部淡水生物繁育重点实验室, 武汉 430070)
洪湖碘泡虫PCR检测方法的建立与初步应用
李 丹1, 2, 3,柳 阳1, 2, 3,翟艳花1, 2, 3,顾泽茂1, 2, 3
(1.华中农业大学水产学院,武汉 430070;2.淡水水产健康养殖湖北省协同创新中心,武汉 430070;3.农业部淡水生物繁育重点实验室, 武汉 430070)
为建立一种灵敏、特异的快速检测异育银鲫寄生洪湖碘泡虫(Myxobolushonghuensis)的方法,本研究根据洪湖碘泡虫ITS-5.8S rDNA基因序列筛选出一对特异性引物MhF/R,建立PCR检测方法,对反应条件进行优化,并通过特异性试验、灵敏性试验与临床检测验证其可行性。结果显示,建立的PCR检测方法能特异性扩增洪湖碘泡虫相应的基因片段,长度为479 bp,而对试验中其他9种粘孢子虫的扩增结果均为阴性;最低能检测0.1 pg的虫体基因组DNA。通过临床样品检测,PCR方法比显微镜检测的检出率提高了19.5%。结果表明,该PCR方法特异、灵敏,适用于洪湖碘泡虫的快速检测。
洪湖碘泡虫(Myxobolushonghuensis);ITS-5.8S rDNA;PCR检测;显微镜检测
异育银鲫(CarassiusauratusgibelioBloch)自上世纪80年代被成功筛选培育,具有生长快、易饲养、抗逆性强等特点,是我国重要的鲫鱼养殖品种。随着异育银鲫养殖规模的不断扩大,病害问题日趋严重,尤其是粘孢子虫病,严重威胁着异育银鲫的苗种培育和成鱼养殖,已成为制约异育银鲫产业健康发展的瓶颈因素[1-2]。目前,超过50种粘孢子虫种类寄生于异育银鲫[3-7],危害最严重的为异育银鲫“喉孢子虫病”的病原体—洪湖碘泡虫(Myxobolushonghuensis)[5]。患病鱼体主要表现为喉部红肿发炎,不食而消瘦,游动迟缓,眼球外凸,鳃丝肿胀,鳃盖外鼓而无法闭合,易缺氧等。洪湖碘泡虫病的流行季节为每年5-10月,5-7月为病害高发期,主要流行于湖北、江苏、沈阳等多个地区,感染率可达60%,死亡率最高可达100%。目前洪湖碘泡虫的检测主要以显微镜下可见成熟孢子、肉眼可见孢囊为依据,而一旦粘孢子虫在鱼体内形成成熟的孢子或孢囊,药物很难渗入成熟孢子坚硬的几丁质外壳。因此,有必要建立一种简单快速的早期检测方法,在其营养体阶段进行药物防治,为诊断和预防洪湖碘泡虫病提供技术支持。
目前,洪湖碘泡虫的检测方法主要有三种:(1)以显微镜观察成熟孢子为基础的形态学检测方法,虽然操作简便,但存在检测滞后、费时费力、效率低、易于漏检等问题[8];(2)以抗原与抗体反应为基础的免疫学检测方法,虽然具有灵敏性高、能进行早期检测的特点,但由于粘孢子虫生活史中存在期、属特异性抗原以及共同抗原,交叉反应严重,增加了种特异性检测的难度[9-12];(3)以PCR技术为基础的分子生物学检测方法具有较高的特异性与灵敏性,运用最为广泛[13-16]。贾洛[17]以洪湖碘泡虫为抗原制备的抗体能与多种粘孢子虫发生交叉反应;顾伟[18]根据洪湖碘泡虫的18S rDNA基因建立了巢式PCR方法,灵敏性较高,然而该方法的特异性还有待检验。因此,亟需建立一种快速准确、灵敏性高、特异性强的检测方法。核糖体DNA(rDNA)中的内转录间隔区ITS(包括ITS1与ITS2)属于非编码序列,所受的选择压力较小,进化速度快,具有可变性[19],常与保守度较高的编码序列5.8S rDNA共同作为靶标应用于相似物种的区别与鉴定中。本研究以洪湖碘泡虫的ITS-5.8S rDNA为靶基因筛选了一对特异性引物,建立了针对洪湖碘泡虫的特异性检测方法,并初步应用于临床检测。
1 材料与方法
1.1 样品采集与保存
本试验中使用的洪湖碘泡虫(M.honghuensis)、吴李碘泡虫(M.wulii)、丑陋圆形碘泡虫(M.turpisrotundus)、倪李碘泡虫(M.nielii)、武汉单极虫(Thelohanelluswuhanensis)、龟壳单极虫(T.testudines)、多涅茨尾孢虫(Henneguyadoneci)、吉陶单极虫(T.kitauei)、山东碘泡虫(M.shantungensis)、野鲤碘泡虫(M.koi)等粘孢子虫样本均由本实验室自行采集与保存。2015年7月从湖北省武汉市东西湖区养殖池塘随机采集36尾异育银鲫,体长为3.0~12.4 cm,实验鱼用撒网捕捞,将鱼体放入充氧袋运回实验室,暂养于水族箱中。
1.2 主要试剂
Marker DL2000、Loading Buffer 与PCR体系试剂(10×PCR Buffer(Mg2+free)、Mg2+、dNTP Mixture、Taq DNA聚合酶)均购于宝生物工程有限公司;动物组织基因组DNA提取试剂盒购自康为世纪生物科技有限公司;DNA回收试剂盒购自Omega公司;TA克隆试剂盒(载体pMD19-T)购自宝生物工程有限公司。
1.3 基因组DNA的提取
虫体基因组DNA的提取:将实验室保存于乙醇中的带有粘孢子虫孢囊样品取出,剪取小块置于干净的载玻片中,去除多余的宿主组织,室温放置15-20 min或放入烘箱3-5 min,使乙醇挥发。将组织样品或孢囊剪碎移入EP管中,充分研磨,再用蒸馏水冲洗、离心,反复几次得到均匀组织或孢囊溶液备用。将待检测的样品移入500 μL细胞裂解液中(100 mol/L氯化钠,10 mol/L Tris,10 mol/L EDTA,0.2% SDS,1 mg·mL-1蛋白酶K),55 ℃水浴过夜,使用通用型动物组织DNA提取试剂盒提取虫体的基因组DNA,具体步骤按照试剂盒的说明书进行,提取后的DNA置于-20 ℃冰箱保存备用。
检测样品基因组DNA的提取:分别剪取每尾异育银鲫的皮肤、鳃、咽及肝胰脏的部分组织,共约50 mg,混合在一起,置于研钵中,剪碎并加入液氮充分研磨,然后采用动物组织基因组DNA提取试剂盒提取样品的总DNA,提取后的DNA置于-20 ℃冰箱保存备用。
1.4 引物筛选
通过比对与分析各粘孢子虫的ITS1-5.8S-ITS2基因序列,利用Primer 5.0软件根据洪湖碘泡虫的ITS1与ITS2基因的差异序列分别设计上游与下游引物,其中,上游引物MhF:5’-TGATCATTGTGTGTTCATCAAGTC-3’,下游引物MhR:5’-TCGTAAAAATGACCTCTACTTTATAC-3’,扩增目的片段长度为479 bp。引物由武汉奥科鼎盛生物科技有限公司合成。
1.5 PCR反应条件优化
1.5.1 退火温度的优化
以洪湖碘泡虫虫体基因组DNA为模板进行温度梯度试验,设定温度梯度为:55 ℃、56 ℃、57 ℃、58 ℃、59 ℃、60 ℃,分别进行PCR扩增,确定引物的最佳退火温度。
1.5.2 Mg2+浓度的优化
以洪湖碘泡虫虫体基因组DNA为模板进行Mg2+浓度梯度试验,设定Mg2+终浓度为:0.5 mol/L、1.0 mol/L、1.5 mol/L、2.0 mol/L、2.5 mol/L、3.0 mol/L、3.5 mol/L、4.0 mol/L,分别进行PCR扩增,确定Mg2+的最佳浓度。
1.5.3 循环数的优化
以洪湖碘泡虫虫体基因组DNA为模板进行PCR循环数梯度试验,设定PCR循环数为:25循环、30循环、35循环、40循环,分别进行PCR扩增,确定反应最佳循环数。
1.6 特异性试验
根据优化后的反应体系与条件,以洪湖碘泡虫、吴李碘泡虫、丑陋圆形碘泡虫、倪李碘泡虫、武汉单极虫、龟壳单极虫、多涅茨尾孢虫、吉陶单极虫、山东碘泡虫、野鲤碘泡虫及健康异育银鲫的DNA作为模板,同时以灭菌ddH2O为模板作为空白对照进行PCR扩增,检测该方法的特异性。
1.7 灵敏性试验
将洪湖碘泡虫的虫体DNA经10倍倍比稀释,分别得到8个不同浓度的DNA(10、1、10-1、10-2、10-3、10-4、10-5、10-6ng/μL),每个反应同时加入100 ng宿主DNA,以稀释后的不同浓度的粘孢子虫DNA与宿主DNA的混合物作为模板,以灭菌ddH2O为模板作为空白对照,用筛选的引物进行PCR扩增,检测该方法的灵敏性。
1.8 临床样品检测
利用显微镜镜检法与PCR方法同时对36份样品进行洪湖碘泡虫的检测。显微镜检测:刮取鱼体皮肤粘液,提取鱼体鳃、咽、肝脏部分组织进行压片观察,计算洪湖碘泡虫成熟孢子的检出率。PCR检测:按照优化后的PCR反应体系与条件对样品进行PCR检测,根据目的条带大小判定结果;扩增之后,随机抽取三个阳性样品,切胶回收,纯化PCR产物,参照pMD19-T克隆试剂盒的操作步骤对目的DNA片段进行连接与转化。经过PCR筛选得到阳性克隆,将阳性克隆菌液送往武汉奥科鼎盛生物科技有限公司进行测序。测定的序列经人工校对、拼接并确认无误之后,在NCBI网站中进行序列比对,进一步验证检测结果。
2 结果与分析
2.1 PCR反应优化结果
PCR反应的优化结果见图1。退火温度在55~60 ℃范围内,PCR扩增产物的条带都比较亮,无明显差异,而引物的退火温度为57 ℃,因此选择57 ℃为最佳退火温度(图1)。Mg2+浓度在1.0~2.5 mol/L范围内,扩增条带较亮,综合考虑扩增效果与试剂成本,最终选择1.5 mol/L为最佳Mg2+浓度(图2)。循环数为30、35、40时,扩增条带清晰明亮,综合考虑扩增效果与试验时间,最终选择35次作为最佳循环数(图3)。综上,优化后的PCR反应体系为:DNA扩增模板50 ng,10×PCR Buffer 2.5 μL,Mg2+1.5 mol/L,dNTPs 1.0 mol/L,TaqDNA聚合酶1 U,Mh F/R各200 nM,灭菌ddH2O补足至25 μL;反应条件为:95 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸45 s,35个循环;72 ℃延伸7 min,4 ℃保存。
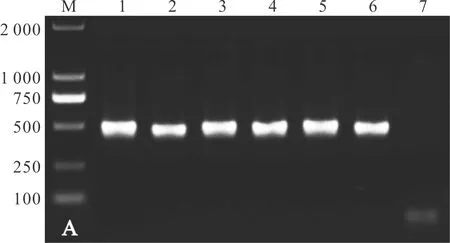
图1 退火温度优化Fig.1 Optimization of annealing temperatureM: DNA分子质量标准; 1~6: 退火温度依次为55 ℃, 56 ℃, 57 ℃, 58 ℃, 59 ℃, 60 ℃; 7: 空白对照.

图2 镁离子浓度优化Fig.2 Optimization of MgCl2 concentrationM: DNA分子质量标准; 1~8: 镁离子浓度依次为0.5 mol/L,1.0 mol/L, 1.5 mol/L, 2.0 mol/L, 2.5 mol/L, 3.0 mol/L, 3.5 mol/L, 4.0 mol/L; 9: 空白对照.

图3 循环数优化Fig.3 Optimization of cycle numberM:DNA分子质量标准;1~5:循环数依次为20, 25, 30, 35, 40次;6:空白对照.
2.2 特异性试验
琼脂糖凝胶电泳结果显示,只有以洪湖碘泡虫DNA为模板才能扩增出单一的目的条带,而其他的粘孢子虫均无条带扩增(图4),说明建立的洪湖碘泡虫PCR检测方法特异性良好。

图4 PCR特异性试验Fig.4 The specificity test of PCRM: DNA分子质量标准;1: 洪湖碘泡虫;2: 吴李碘泡虫;3: 丑陋圆形碘泡虫;4: 倪李碘泡虫;5: 武汉单极虫;6: 龟壳单极虫;7: 多涅茨尾孢虫;8: 吉陶单极虫;9: 山东碘泡虫;10: 野李碘泡虫;11: 健康鲫鱼;12: 空白对照.
2.3 试验的灵敏性
琼脂糖凝胶电泳结果显示,在宿主DNA干扰的情况下,洪湖碘泡虫模板浓度为10-4ng(0.1 pg)时仍能扩增出条带,因此,确定建立的PCR方法对洪湖碘泡虫最低检测限为0.1 pg,灵敏性试验结果见图5。

图5 PCR灵敏性试验Fig.5 The sensitivity test of PCRM: DNA分子质量标准; 1~8分别为10, 1, 10-1, 10-2, 10-3, 10-4, 10-5, 10-6 ng洪湖碘泡虫DNA + 100 ng宿主DNA; 9: 空白对照.
2.4 临床初步应用
利用显微镜镜检法与PCR方法同时对采集的36份样品进行洪湖碘泡虫的临床检测,结果显示显微镜镜检法检测洪湖碘泡虫成熟孢子(图6)的阳性检出率为22.2 %(8/36),PCR方法检测洪湖碘泡虫的阳性检出率为41.7%(15/36),比镜检法的高19.5个百分点。随机抽取的三个阳性扩增产物与洪湖碘泡虫的ITS-5.8S rDNA基因序列的相似度为99.6%~99.9%,表明建立的PCR检测方法实用性强,可用于异育银鲫寄生洪湖碘泡虫的临床检测。

图6 洪湖碘泡虫成熟孢子, 标尺=10 μm.Fig.6 Photomicrograph of mature spores of M. honghuensis, scale bar =10 μm.
3 讨论
在粘孢子虫的早期分子检测中,18S rDNA是运用最为广泛的分子标记[20-23],然而,18S rDNA序列比较保守,在同属近缘种类间相似度较高,难以区分。其中,洪湖碘泡虫与吴李碘泡虫的18S rDNA相似度就高达93%,差异碱基分布分散,难以根据其18S rDNA基因进行区别鉴定,因此迫切需要寻找其他合适的分子靶标。ITS是介于核糖体DNA上18S、5.8S、28S 基因之间的一段高度可变区域,具有种间变异与种内稳定的特点[24],已作为一种有效的分子标记被广泛运用于寄生虫近缘物种的分子检测中,但在粘孢子虫检测方面运用较少,目前只有Woo 等[25]利用ITS基因对感染鲤肠道的单极虫T.kitauei与T.hovorkai进行了有效的区别与鉴定。通过序列比对与分析,发现洪湖碘泡虫的ITS包含较多的差异序列,因此,本研究选择洪湖碘泡虫的ITS为靶基因建立了PCR检测方法。
在建立PCR检测方法的过程中,引物的筛选至关重要。特异性试验中只有洪湖碘泡虫扩增出单一目的条带,而其他粘孢子虫种类的扩增结果呈阴性,证明筛选的引物特异性良好。灵敏性试验中,在宿主DNA的干扰下,检测灵敏度仍达到了pg级检测水平,说明该方法的灵敏性较高。一般PCR方法的灵敏性试验仅仅用寄生虫的虫体基因组DNA为模板检测,而忽略了宿主DNA的干扰,是一种分析灵敏性试验,而本研究在每个反应中加入一定量的宿主DNA,结果更接近实际的诊断灵敏性。许多研究表明,PCR检测方法比传统显微镜镜检方法的灵敏性更高[13, 14],本研究以这两种方法对实际样品进行检测与比较,结果发现PCR方法的阳性检出率比镜检高19.5百分点,表明PCR的灵敏性更高。由于粘孢子虫的营养体形态多种多样,且易与鱼体组织结构相混淆[11],因此本研究以观察到成熟孢子为标准计算检出率,但检测结果会低于实际的感染率。在显微镜检测中,有1个样品的检测结果为阳性,能观察到成熟的孢子,但数量较少,而对应的PCR检测呈阴性,类似的现象在国外粘孢子虫的检测中也有过相关的报道[22]。另外,三个随机样品的测序结果表明该方法的准确性高,适用于洪湖碘泡虫的临床诊断。
[1]陈昌福,曹丽萍,方 苹.异育银鲫几种黏孢子虫病及其防控技术研究概况[J].当代水产,2014,39(7):72-74.
[2]李林思,黄丽萍,邵汝强.异育银鲫粘孢子虫病调查[J].水产养殖,2008,(5):40-42.
[3]陈启鎏,马成伦.中国动物志.粘体动物门,粘孢子虫纲[M].北京:科学出版社,1998.
[4]叶灵通,李文祥,邹 红,等.池塘养殖异育银鲫寄生黏孢子虫的种群动态[J].水生生物学报,2014,38(6):1092-1097.
[5] Liu Y, Whipps C M, Gu Z M, et al.Myxobolushonghuensisn. sp. (Myxosporea: Bivalvulida) parasitizing the pharynx of allogynogenetic gibel carpCarassiusauratusgibelio(Bloch) from Honghu Lake, China [J]. Parasitol Res, 2012, 110: 1331-1336.
[6] Liu Y, Jia L, Huang M J,etal.Thelohanellustestudineusn. sp. (Myxosporea: Bivalvulida) infecting the skin of allogynogenetic gibel carpCarassiusauratusgibelio(Bloch) in China [J]. J Fish Dis, 2014, 37: 535-542.
[7] Zhang J Y, Wang J G, Li A H, et al. Infection ofMyxobolusturpisrotundussp.n.in allogynogenetic gibel carp,Carassiusauratusgibelio(Bloch), with revision ofMyxobolusrotundus(s. l.) Nemeczek reported fromC.auratusauratus(L.) [J]. J Fish Dis, 2010, 33: 635-638.
[8]鲁义善.圆形碘泡虫病和我国粘孢子虫部分种属的系统分类[D].武汉:中国科学院水生生物研究所,2003.
[9]吴英松,汪建国.圆形碘泡虫免疫原性的研究[J].水生生物学报,2000,24(3):246-251.
[10] Bartholomew J L, Rohovec J S, Fryer J L. Development, characterization and use of monoclonal and polyclonal antibodies against the myxosporean,Ceratomyxashasta[J]. J Protozool, 1989, 36: 397-401.
[11] Jia L, Li D, Gu Z M, et al. Development of monoclonal antibodies against polar filaments and spore valves ofMyxobolushonghuensis(Myxosporea: Bivalvulida) [J]. Dis Aquat Org, 2016, 117: 197-204.
[12] Morris D, Adams A, Richards R. In situ hybridisation identifies the gill as a portal of entry for PKX (Phylum Myxozoa), the causative agent of proliferative kidney disease in salmonids [J]. Parasitol Res, 2000, 86: 950-956.
[13] Clark T G. Molecular approaches and techniques//Woo P T K.Fish Diseases and Disorders [M].CABI,2006: 725-752.
[14] Grabner D S, Yokoyama H, Shirakashi S, et al. Diagnostic PCR assays to detect and differentiateKudoaseptempunctata,K.thyrsitesandK.lateolabracis(Myxozoa, Multivalvulida) in muscle tissue of olive flounder (Paralichthysolivaceus) [J]. Aquaculture, 2012, 338: 36-40.
[15] Grossel G, Handlinger J, Battaglene S, et al. Diagnostic polymerase chain reaction assay to detectKudoaneurophila(Myxozoa: Multivalvulida) in a marine finfish hatchery [J]. Dis Aquat Org, 2005, 64: 141-149.
[16] Kelley G O, Zagmutt-Vergara F J, Leutenegger C M, et al. Evaluation of five diagnostic methods for the detection and quantification ofMyxoboluscerebralis[J]. J Vet Diagn Invest, 2004, 16: 202-211.
[17]贾 洛.洪湖碘泡虫抗体的制备及其特异性研究[D].武汉:华中农业大学,2015.
[18]顾 伟.江苏地区鲫鱼寄生粘孢子虫种类调查与分类研究[D].南京:南京农业大学,2012.
[19]白树猛,田 黎.ITS序列分析在真菌分类鉴定和分子检测中的应用[J].畜牧与饲料科学,2009,30(1):52-53.
[20] Andree K B, MacConnell E, Hedrick R P. A nested polymerase chain reaction for the detection of genomic DNA ofMyxoboluscerebralisin rainbow troutOncorhynchusmykiss[J]. Dis Aquat Org, 1998, 34: 145-154.
[21] Baldwin T J, Myklebust K A. Validation of a single round polymerase chain reaction assay for identification ofMyxoboluscerebralismyxospores[J]. Dis Aquat Org, 2002, 49: 185-190.
[22] Mahony A, Fraser S, Groman D B, et al. Specific PCR forMyxobolusarcticusSSU rDNA in juvenile sockeye salmonOncorhynchusnerkafrom British Columbia, Canada [J]. Dis Aquat Org, 2015, 115: 87-92.
[23] Meng G T, Li-Chan E C Y. Polymerase chain reaction assay for the detection ofKudoapaniformisandKudoathyrsitesin Pacific Hake (Merluccius productus) [J]. J Agric Food Chem, 2007, 55: 3298-3303.
[24]肖淑敏,李国清,周荣琼,等.以ITS-1序列鉴定牛源环孢子虫[J].中国兽医学报,2007,27(1):59-61.
[25] Woo S H, Seo J S, Lee E H. Discrimination and simultaneous detection of two myxozoan parasites belonging to genusThelohanellusby multiplex polymerase chain reaction [J]. Vet Parasitol, 2014, 203: 212-216.
(责任编辑:张潇峮)
Development and preliminary application of PCR method for the detection of Myxobolus honghuensis (Myxosporea: Bivalvulida)
LI Dan1,2,3, LIU Yang1,2,3, ZHAI Yan-hua1,2,3, GU Ze-mao1,2,3
( 1.DepartmentofAquaticAnimalMedicine,CollegeofFisheries,HuazhongAgriculturalUniversity,Wuhan430070,China;2.FreshwaterAquacultureCollaborativeInnovationCenterofHubeiProvince,Wuhan430070,China; 3.KeyLabofFreshwaterAnimalBreeding,MinistryofAgriculture,Wuhan430070,China)
To establish a sensitive, specific and rapid method for detection ofMyxobolushonghuensisinfecting allogynogenetic gibel carpCarassiusauratusgibelio(Bloch), a single PCR method was developed with primers MhF/R targeting on its ITS-5.8S rDNA gene. After optimizating the reaction condition and system, a series of experiments on specificity and sensitivity were conducted. Additionally, 36 field samples were tested by the established PCR and microscopic examination. The results showed that the developed PCR method was specific to amplify a 479 bp fragment using genomic DNA fromM.honghuensiswith a detection limit of 0.1 pg, and no cross-reactions with other 9 myxosporean species tested. The clinical detection rate was 19.5% higher than that of microscopic examination. The results suggest that the present PCR method is an efficient approach for molecular detection ofM.honghuensisbecause of its specificity and sensitivity.
Myxobolushonghuensis; ITS-5.8S rDNA; PCR detection; microscopic examination
2016-05-22;
2016-09-21
国家自然科学基金项目(31572233)
李 丹(1991- ),女,硕士,专业方向为水生动物医学。E-mail: liyidan1991@163.com
顾泽茂。E-mail: guzemao@mail.hzau.edu.cn
S917
A
1000-6907-(2017)01-0012-05
