氮肥添加对高寒藏嵩草(Kobresiatibetica)沼泽化草甸和土壤微生物群落的影响
2017-02-08王长庭王根绪李香真字洪标阿的鲁骥
王长庭,王根绪,李香真,王 永,字洪标,阿的鲁骥
1 西南民族大学生命科学与技术学院, 成都 610041 2 中国科学院水利部成都山地灾害与环境研究所, 成都 610041 3 中国科学院成都生物所, 成都 610041
氮肥添加对高寒藏嵩草(Kobresiatibetica)沼泽化草甸和土壤微生物群落的影响
王长庭1,*,王根绪2,李香真3,王 永1,字洪标1,阿的鲁骥1
1 西南民族大学生命科学与技术学院, 成都 610041 2 中国科学院水利部成都山地灾害与环境研究所, 成都 610041 3 中国科学院成都生物所, 成都 610041
以藏嵩草沼泽化草甸为研究对象,利用磷脂脂肪酸(PLFA)技术,研究连续6年N素添加对地上植被群落数量特征、土壤微生物群落结构的影响。结果表明:① 藏嵩草沼泽化草甸群落生物量、枯枝落叶对施肥处理无明显响应,且莎草科植物对土壤氮素的吸收和利用率较低。② 施肥增加了0—10 cm土壤微生物类群PLFAs丰富度,尤其细菌和革兰氏阳性菌PLFAs,降低了10—20 cm PLFAs丰富度;③ 磷脂脂肪酸饱和脂肪酸/单烯不饱和脂肪酸、细菌 PLFAs/真菌 PLFAs的比值随土壤层次增加而增加;④ 0—10 cm土层,革兰氏阳性菌、真菌 PLFAs含量与pH、土壤速效磷、速效氮、土壤有机质显著正相关 (P<0.05或P<0.01);10—20 cm土层,细菌、革兰氏阳性菌、真菌和总PLFAs含量与土壤有机质含量显著正相关 (P<0.05或P<0.01)。表明藏嵩草沼泽化草甸微生物PLFAs含量和丰富度对施肥的响应存在明显的土层梯度效应,土壤微生物PLFAs含量和丰富度主要受表层土壤初始养分含量的影响。
藏嵩草草甸;磷脂脂肪酸(PLFA);微生物群落;氮添加
草地施肥是一种维持草地生态系统养分平衡的重要管理措施。一方面,草地施肥能够补充土壤营养物质,提高植物群落初级生产力,降低物种丰富度和群落多样性[1-6]。另一方面,由于微生物参与凋落物分解、硝化与反硝化作用等地下生态过程,同时其数量、活性和群落结构受到氮输入剧增的影响[7],但施N对草地土壤微生物特性的影响效应仍存在很大的不确定性[8],如施N降低了土壤微生物量[9-10];施N增加了放线菌的磷脂脂肪酸(PLFA),但真菌的PLFA不受施N影响[11]。因此,外源性N的输入不仅影响草地群落初级生产力、草地生态系统土壤可利用N素的状况,更重要的是影响土壤微生物组成和多样性及其与植物之间的关系。
有关植物吸收土壤有机N的研究,人们从土壤有机N的可利用性、植物吸收有机N能力以及根系对有机N吸收的机理等进行了探讨和总结[12-15]。研究发现:在高寒草甸、极地苔原,土壤有机N的矿化速率低,可利用无机N的供应不足,而土壤中却富含大量的自由态氨基酸[16-18],且植物每年摄取的N量远高于土壤N净矿化量[19-21]。特别是高寒沼泽湿地生态系统中,不同植物种对土壤N素的吸收存在差异和多元化的特点[22]。因此,植物在获取N素营养中的多元化是对目前陆地N循环理解的一种挑战[23-24]。
N输入对土壤微生物的影响更多地反映在微生物群落的结构和功能上,而土壤微生物量、微生物活动和群落结构的变化又会通过改变凋落物分解、养分利用和C、N 循环等重要的土壤生态系统功能和过程做出响应[25]。近年来,基于生物化学 (phospholipid fatty acid PLFA) 、生理学 (Biolog) 和分子生物学(PCR-RFLP、T-RFLP、RISA等)方法的发展,弥补了传统培养方法的不足,可以比较全面了解在各种条件下微生物群落结构变化情况[26-30]。磷脂脂肪酸(PLFA) 法是一种快速、可靠并可重现的分析土壤微生物群落结构的方法,可用于表征在数量上占优势的土壤微生物群落[31]。因此,本论文以高寒藏嵩草草甸为研究对象,利用PLFA技术通过分析土壤PLFA含量及其组成,试图了解外源性N素添加对地上植被、土壤微生物的影响,植物与土壤微生物之间对氮素养分存在竞争关系?土壤微生物群落空间分布格局?探索植物群落生物量、凋落物、微生物群落结构与土壤养分之间的关系,为明确高寒草地生态系统N吸收、利用提供理论依据。
1 研究地区概况
本研究于2005—2010 年8 月在中国科学院海北高寒草甸生态系统开放实验站乱海子进行。37°37′ N,101°18′ E,平均海拔为3 200 m,年平均气温-1.7℃,最高气温为23.7 ℃,最低气温为-37.1 ℃;年平均降雨量为560 mm,主要降水量集中在5—9 月份,约占年降水量的85%[32]。
藏嵩草沼泽化草甸(Kobresiatibeticaof swamp meadow),群落结构简单,仅有草本一层,群落平均高度10—25 cm,群落总覆盖度80%—95%,优势种主要是藏嵩草(Kobresiatibetica)、帕米尔苔草 (Carexpamirensis),次优势种和伴生种有华扁穗草(Blysmussinocompressus)、黑褐苔草(Carexatrofusca)、早熟禾(Poaspp.)、溚草(Koeleriacristata)等,伴生种有小金莲花(Trolliuspumilus)、甘青报春(Primulatangutica)、星状风毛菊(Saussureastella)等,土壤类型为有机寒冻潜育土[22-33]。藏嵩草草甸土壤中总N浓度为14.45 g/kg,铵态N浓度为31—39 mg/kg,硝态N浓度为69—114 mg/kg,土壤无机N占总N的0.7%—1.1%[22]。
2 材料与方法
2.1 试验设计及样品采集
选择2—3 hm2植被生长均匀、未退化的藏嵩草草甸(冬春草场)用围栏保护。2005 年4 月中旬在围栏内选择面积为50 m × 50 m 的地势平坦样区,分成2 个平行试验样区,试验样区间距为2 m;每个样区6个面积为4 m × 3 m 的小样区,小样区间距为2 m,各个小样区四角用木桩标记。每个小样区设置4个1 m × 1 m测定样方,样方间间距0.5 m,以双因素随机区组实验设计在每个样方中进行施肥处理(0 g/m2、20尿素(46.65% N) g/m2) 和凋落物处理 (凋落物剔除、凋落物不剔除),共24个施肥、24个凋落物处理样方。2005—2010年,每年5 月下旬施肥(尿素46.65% N)1 次。
2005—2010年,每年的11月从凋落物剔除样方中人工剔除枯枝落叶(现存量);凋落物不剔除样方中2005—2010年枯枝落叶现存量的累计数量表示其总量。
试验处理包括N 添加 (+N)+ 枯枝落叶剔除(litter removed (LR)): +N+LR;N 添加(+N)+枯枝落叶不剔除(litter left intact (LI)): +N+LI;N 不添加(-N)+枯枝落叶剔除(litter removed (LR)): LR+(-N);N 不添加(-N)+枯枝落叶不剔除(litter left intact (LI)): LI+(-N)[3]。
2.2 群落调查与样品采集2.2.1 群落调查、生物量
6个1 m × 1 m样方进行植物群落特征(所有植物种的分盖度、高度和频度,以及植物群落的总盖度)调查,然后齐地面分种剪草(收获法),剪去植物地上部分后在1 m × 1 m样方的中心区域划出50 cm ×50 cm样方,用手收取枯枝落叶,所有植物样品在65°C 烘箱48小时烘干至恒重,称取生物量(包括枯枝落叶)。
大直径塞规尺寸的测量所引入的误差还包括当被测塞规的温度与标准温度20℃不相等时,按照规程要求应进行等温,标准件与被测塞规之间的温度差≤0.3℃。假定被测塞规与标准件的线性膨胀系数为α=11.5×10-6℃-1,假定服从U形分布(b=0.7),最终被测塞规与标准件之间温度差引入的不确定度分量u3为:
2.2.2 土壤样品
2008—2010年,在测定过地上生物量的样方中,采用25 cm ×25 cm样方采集植物地下根系 (0—10 cm、10—20 cm) 的同时,沿土壤剖面分层采集0—10 cm、10—20 cm土层土壤样品,过2 mm筛,四分法选取3个500g 土样分成两份,一份冷藏带回实验室保存于-70 ℃ 超低温冰箱,用于测定土壤微生物PLFA分析;一份带回实验室风干,用于测定土壤有机质,总N、总磷、速效N和速效磷,土壤pH 用pHS-3酸度计测定(1∶2.5 土水比)[34]。
2.2.3 土壤PLFA测定
取相当于6.0 g 冷冻干燥的土壤样品,采用改进的Bligh-Dyer方法[35]通过氯仿-甲醇-柠檬酸缓冲液振荡提取总脂,经硅胶柱层析分离得到磷脂脂肪酸,将得到的磷脂脂肪酸甲脂化,然后采用HP7890-HP5975 型气相色谱质谱联用仪(GC-MS)分析磷脂脂肪酸的组成[36]。检测中升温程序如下:进样后在50 ℃保持1 min,之后以12 ℃/min 的速率升到180 ℃,保持2 min 后以6 ℃/min 的速率升到220 ℃,停留2 min 后以15 ℃/min 的速率升到240 ℃,保持1 min 后以15 ℃/min 的速率达到最终温度260 ℃,并保持15 min。
气相色谱与质谱之间的连接温度为280 ℃,用高纯氦气(1 mL/min)作载气。质谱仪采用电子电离(EI)方式,电子能量为70 eV。PLFA 的定性根据质谱标准图谱和已有的相关报道[37],以正十九烷脂肪酸甲酯内标物进行定量计算。
脂肪酸含量的计算公式如下:
PLFA(nmol/g)=1000×(PPLFA×S×V)/(POSTD×M×W)
式中,PPLFA和POSTD分别为样品和标准物质的峰面积,S为标准物质的浓度(μg/mL),V为样品的测定体积(mL),M为相应磷脂脂肪酸的摩尔质量(g/mol),W为干土的质量(g)。PLFA采用脂肪酸的常用命名方法[26]。PLFA可以作为微生物生物量和群落结构变化的生物标记分子。根据已有的研究结果,指示特定微生物的PLFA生物标记物如下表(表1)。

表1 藏嵩草草甸土壤PLFA生物标记物
2.3 数据分析
3 结果与分析
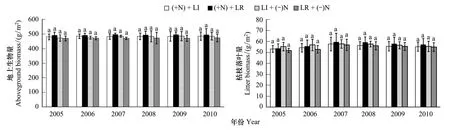
3.1 地上生物量和枯枝落叶
连续6年施肥、枯枝落叶处理对高寒藏嵩草草甸群落地上生物量、枯枝落叶量的影响如图1和表2。群落地上生物量在+N+LR、+N+LI、LR+(-N)、LI+(-N)处理,不同年份及其交互作用下有微弱变化(0.05 3.2 土壤微生物类群的变化 不同处理条件下高寒藏嵩草草甸各类群微生物PLFAs含量和PLFAs总量差异明显。在+N+LI、LR+(-N)处理中,0—10 cm土层微生物各类群PLFAs含量明显高于10—20 cm 土层,LI+(-N)处理中除G+PLFAs 外,其他菌群0—10 cm土层PLFAs 含量均高于10—20 cm 土层;但在+N+LR 中,0—10 cm土层总PLFAs、B PLFAs 含量低于10—20 cm 土层(图 1)。 不同处理中,一般饱和脂肪酸 /单烯不饱和脂肪酸(SAT/MONO)、F PLFAs与 B PLFAs(F PLFAs/B PLFAs)的比值均随土层增加而增加;施肥和枯枝落叶的积累提高了10—20 cm 土层G+PLFAs/G-PLFAs的比值(图 1)。高寒藏嵩草草甸土壤各类群PLFAs含量随土壤层次增加而增加,特别是B PLFAs,说明不同处理条件下不同土层微生物组成比例发生明显变化。 图1 高寒藏嵩草草甸不同土层微生物类群PLFAs含量的变化Fig.1 Changes of microbial group PLFAs contents at the 0—10 cm, 10—20 cm soil depth in the Kobresia tibetica meadowB PLFAs:细菌bacterial PLFAs;F PLFAs:真菌fungal PLFAs;G+ PLFAs:革兰氏阳性菌Gram-positive bacterial PLFAs;G- PLFAs:革兰氏阳性菌Gram-negative bacterial PLFAs;SAT:一般饱和脂肪酸normal saturated fatty acid;MONO:单烯不饱和脂肪酸monounsaturated fatty acid 3.3 PLFAs主成分分析(PCA) 为进一步分析不同处理土壤微生物群落结构差异,对不同处理、不同土层高寒藏嵩草草甸土壤微生物磷脂脂肪酸结构(PLFA)进行主成分分析(图 2)。结果发现:不同的处理条件下在PC轴上的分布存在明显差异。在0—10 cm 土层中,第一主成分(PC1)和第二主成分(PC2)的贡献率分别为53%和29.5%,累计贡献率为82.5(图2a)。在10—20 cm土层中,第一主成分(PC1)的贡献率为54.9%,第二主成分(PC2)的贡献率为24.0%,累计贡献率为78.9%。 在0—10 cm土层,LI和LR处理下,+N+LR和+N+LI分别位于LR+(-N)和LI+(-N)右侧,+N增加了C14:0、C19:0、a15:0、C11:0、a18:0、C17:0、i18:0、16:1ω7t和C15:0,因此+N能够增加土壤微生物丰富度,尤其是增加B PLFAs 和G+PLFAs含量。由于+N+LR与LR+(-N)在PC1轴上的水平距离显著小于+N+LI与LI+(-N),因此,LR在+N处理下,增加B PLFAs和G+PLFAs的效应显著低于LI。在-N处理下,LI位于LR左侧;在+N处理下,LI位于LR右侧,可见+N处理对土壤微生物群落结构的影响大于LR的影响。 在10—20 cm土层,+N和-N处理下,LI均位于LR右侧,说明凋落物的移除效应大于N肥效应对土壤微生物群落结构的影响,尤其是F PLFAs(18:1ω9t)的多样性。 图2 不同处理条件下高寒藏嵩草草甸土壤微生物(0—10 cm, 10—20 cm)PLFA主成分分析Fig.2 Principal component analysis (PCA) of soil microbial phospholipid fatty acid (PLFA) signatures detected in the 0—10 cm top and 10—20 cm soil layers in treatment plots with urea N addition and litter manipulations 3.4 土壤理化性质 由表2可知,除土壤全磷外,不同处理、土层作用对pH、全N、速效N、速效磷和土壤有机质含量有极显著影响(P<0.001),处理和土层交互作用极显著影响pH和土壤有机质(P<0.01),但对土壤全N、全磷、速效N和速效磷的交互作用不明显(P> 0.05)。 表2 不同处理条件下高寒藏嵩草草甸土壤理化性质(0—10 cm, 10—20 cm)方差分析 Table 2 ANOVA for Soil physical-chemical properties in the 0—10 and 10—20 cm soil layers under varying urea N addition and litter manipulations in aKobresiatibeticameadow (Data present mean±SE,n=3) 项目ItemspH土壤全NTN/(g/kg)土壤全磷TP/(g/kg)dfFPdfFPdfFP处理Treatment3,2415.354<0.0013,2433.139<0.0013,240.1870.904土层Depth1,244.1390.0591,2465.131<0.0011,2446.996<0.001处理×土层Treatment×Depth3,244.992<0.0133,240.7400.5443,240.3110.817项目Items土壤速效NAN/(mg/kg)土壤速效磷AP/(mg/kg)土壤有机质SOM/(g/kg)dfFPdfFPdfFP处理Treatment3,245.6330.0083,246.3530.0053,2410.861<0.001土层Depth1,2438.577<0.0011,2459.036<0.0011,24127.538<0.001处理×土层Treatment×Depth3,240.9740.4293,242.0520.1473,244.3830.020 3.5 群落生物量与各类群PLFA相关性分析 通过对各菌群 PLFAs 与土壤养分进行相关性分析(表 3)。结果表明:0—10 cm土层,G+PLFAs含量与pH (P=0.028)、AP (P=0.011)、SOM (P=0.008) 显著或极显著正相关(P<0.05或P<0.01);G-PLFAs含量与TN (P=0.011) 显著负相关;F PLFAs含量与TN(P=0.012)、AN (P=0.002)、AP (P=0.004)、SOM (P=0.011)显著或极显著正相关 (P<0.05或P<0.01)。 10—20 cm土层,F PLFAs含量与AP(P=0.045)显著正相关;除G-PLFAs (P=0.333)外,B PLFAs (P=0.015)、G+PLFAs (P=0.000)、F PLFAs (P=0.033)和总PLFAs含量(P=0.000)与SOM 含量显著或极显著正相关 (P<0.05或P<0.01)。 表3 不同处理条件下高寒藏嵩草草甸土壤养分与PLFAs 含量的相关性分析 Table 3 Correlation between soil nutrients and microbial PLFAs contents in the 0—10 and 10—20 cm soil layers with urea N addition and litter manipulations from 2008—2010 项目Items土壤深度Soildepth/cmpH土壤全NTN土壤全磷TP土壤速效NAN土壤速效磷AP土壤有机质SOM细菌BPLFAs0—10Pearsoncorrelation0.026-0.3690.090-0.0140.3730.279Sig.0.9360.2370.7800.9650.2330.381N121212121212革兰氏阳性菌Pearsoncorrelation0.630*0.414-0.1630.1810.699*0.723**G+PLFAsSig.0.0280.1800.6130.5740.0110.008N121212121212革兰氏阴性菌Pearsoncorrelation-0.143-0.582*0.147-0.1570.1730.069G-PLFAsSig.0.6580.0470.6490.6250.5920.832N121212121212真菌FPLFAsPearsoncorrelation0.3340.695*0.0010.785**0.755**0.704*Sig.0.2880.0120.9980.0020.0040.011N121212121212总量TotalPLFAsPearsoncorrelation0.204-0.1330.0360.1070.5420.467Sig.0.5250.6810.9120.7400.0690.126N121212121212细菌BPLFAs10—20Pearsoncorrelation-0.183-0.303-0.084-0.1390.0430.678*Sig.0.5690.3380.7960.6660.8940.015N121212121212革兰氏阳性菌Pearsoncorrelation0.1750.209-0.110-0.0740.5030.866**G+PLFAsSig.0.5870.5150.7340.8190.0960.000N121212121212革兰氏阴性菌Pearsoncorrelation0.4220.2390.1700.3190.0130.306G-PLFAsSig.0.1720.4550.5960.3130.9690.333N121212121212真菌FPLFAsPearsoncorrelation0.4390.517-0.0770.0710.586*0.616*Sig.0.1530.0850.8120.8260.0450.033N121212121212总量TotalPLFAsPearsoncorrelation0.1570.143-0.096-0.0570.4360.890**Sig.0.6270.6570.7670.8590.1570.000N121212121212 * * 相关性在0.01水平上显著; * 相关性在0.05水平上显著 为维持草地生态系统养分平衡、促进退化草地的恢复,施肥在国外一些畜牧业发达的国家已经是一项常规的草地管理措施[47]。因此,外源N的输入将可能在很大程度上改变草地生态系统可利用N素的状况,从而对草地生态系统初级生产力、土壤碳库产生重要影响。例如:N肥添加能够增加土壤中有效N含量,尤其是被植物能够利用的速效N含量,刺激植物的生长,增加植物-土壤中有机碳的积累。短期的N肥添加可以提高群落生产力,而过度施加N肥则会使土壤-植被中营养元素失衡,造成土壤酸化,对植被生产力的恢复和提高产生不利影响[3, 48-49],过量追加N肥不利于高寒草甸群落植被结构的改善和群落生产力的提高[50-51]。N添加对高寒草甸地下生物量、植物总生物量无显著影响[5]。这些相互矛盾的结果可能与高寒草甸群落物种组成、初始微生物类群、土壤 pH、有机质以及土壤养分含量的不同有关。研究发现,藏嵩草草甸以多年生莎草科植物为优势种,建群种为藏嵩草,且连续6a施肥对高寒藏嵩草草甸群落地上生物量、枯枝落叶的影响不明显。王文颖等[22]藏嵩草草甸 7 种植物对N的吸收的研究发现,莎草科植物如:藏嵩草、华扁穗草和黑褐苔草对3种N形态的吸收值均很低,且对不同形态N素的吸收差异不显著。植物群落组成、物种本身特征和外部环境资源对高寒草甸物种多样性和生产力有着重要的影响[33]。不同植物种由于其生长型、生长发育时期[52]以及N源的可利用性不同[53],植物对土壤N素的吸收和利用上可能存在差异。高寒草甸植物的生长很有可能受土壤中起始有机质、可利用N含量的限制。因此,高寒草甸植物群落地上生物量、枯枝落叶对外源性N添加的响应也不尽一致。 草地土壤微生物量对施N的响应,由于不同的施肥量、不同的肥料类型、施肥时间长短、草地初始N水平都会对土壤微生物量产生影响[8]。本研究显示:施肥与否,0—10 cm土层微生物各类群PLFAs含量明显高于10—20 cm 土层。施肥能增加0—10 cm土壤微生物PLFAs的丰富度,尤其B PLFAs 和G+PLFAs的丰富度,但降低了10—20 cm土壤微生物群落PLFAs丰富度。说明藏嵩草沼泽化草甸微生物PLFAs含量和丰富度对施肥的响应仅体现在不同土层梯度上。河岸地带等湿地莎草科物种分布广泛、群落结构单一且生产力水平高[54],其地下生物量影响地下生物地球化学过程、湿地土壤的发展[55]。在高寒草甸特别是藏嵩草沼泽化草甸群落,其地下根系大部分集中在 0—10 cm土层,土壤养分同样也分布在 0—10 cm[56, 33]。施肥可能刺激了植物根系的生长以及根系分泌物输出,为土壤输入大量新鲜碳源,有利于土壤微生物生长。而且植被根系扰动能显著改善深层土壤结构,降低土壤致密性,进而提高微生物数量[57]。藏嵩草沼泽草甸由于土壤水分含量高,土壤pH偏碱性,使土壤表层的好气和兼性厌气性细菌和放线菌大量繁殖,形成表层微生物生物量高,深层生物量相对低的格局[58]。 土壤磷脂脂肪酸SAT/MONO、B PLFAs/F PLFAs的比值往往与微生物群落所受到的养分胁迫及化学或物理干扰有关[59];微生物PLFA含量和类型的多样性作为监测土壤环境的指标,能及时有效地判别土壤养分的变化情况[60]。研究表明,藏嵩草沼泽化草甸SAT/MONO、B PLFAs/F PLFAs的比值随土壤层次增加而增加,特别是B PLFAs,说明施肥可以缓解0—10 cm土壤微生物群落的养分胁迫,而且0—10 cm 土层初始养分含量、根系生物量高,有利于对环境变化抗性较好,类群较稳定的G+PLFAs含量的提高[61],表层土壤系统可能越趋于稳定。另外,藏嵩草沼泽化草甸土壤全量和速效养分含量均高于矮嵩草草甸、小嵩草草甸等[34],对大多数的微生物种类都具有良好的刺激作用,有利于提高微生物量、稳定藏嵩草草甸群落地上生物量,从而维持土壤不同土层的生态功能,尤其是表层。 土壤表层,大部分增加的N被矿化了,N素可能影响了碳含量的改变[62];Hagedorn等[63]认为是N输入通过降低土壤中腐殖质的分解速度来增加土壤碳储量。土壤总PLFAs、F PLFAs、B PLFAs、G+PLFAs、G-PLFAs的含量以及土壤全量养分、速效养分含量随土层深度的增加呈降低趋势。本研究中,与土壤养分的相关分析表明:0—10 cm土层,G+PLFAs含量与pH、AP、SOM显著正相关;F PLFAs含量与TN、AN、AP、SOM显著正相关。10—20 cm土层,B PLFAs、G+PLFAs、F PLFAs和总PLFAs含量与SOM 含量显著正相关。说明随土层加深土壤微生物代谢活动很可能受到更强的限制,而表层土壤适宜的水热条件、充足的N源以及良好的通气状况更能满足微生物代谢与繁殖的需要,是促进土壤微生物累积的有利条件。 因此,对于藏嵩草沼泽化草甸,添加N素之所以具有高的土壤养分 (如: 0—10 cm),但群落生产力变化不明显,可能是基于以下几个方面的原因:1)适度施肥对有机质向土壤输入的促进作用比对有机质分解的促进作用大,有利于表层土壤养分吸存[64];2)短期施肥内,土壤微生物PLFAs含量和丰富度由表层土壤初始养分调控的程度大于施N的直接调控作用;3)高寒沼泽湿地生态系统中,莎草科植物对土壤N的利用较低[22],最终减少对群落地上生物量的影响;4)pH增大使微生物群落的胁迫压力有所缓解,提高了土壤系统的稳定性,为微生物量的形成提供了比较稳定的环境,从而增加了土壤微生物量[65]。此外,土壤微生物本身对时空格局变化的响应可能存在较大差异,短期的施肥实验也可能掩盖生态系统对实验处理的敏感性和滞后效应。因此,开展长期性的野外定位实验、多因子综合控制实验将有助于全面理解高寒草甸生态系统地上、地下部分的互作机制。 [1] Hillebrand H, Gruner D S, Borer E T, Bracken M E S, Cleland E E, Elser J J, Harpole W S, Ngai J T, Seabloom E W, Shurin J B, Smith J E. Consumer versus resource control of producer diversity depends on ecosystem type and producer community structure. Proceedings of the National Academy of Sciences, 2007, 104(26): 10904-10909. [2] 李禄军, 曾德慧, 于占源, 艾桂艳, 杨丹, 毛瑢. 氮素添加对科尔沁沙质草地物种多样性和生产力的影响. 应用生态学报, 2009, 20(8): 1838-1844. [3] Wang C T, Long R J, Wang Q L, Liu W, Jing Z C, Zhang L. Fertilization and litter effects on the functional group biomass, species diversity of plants, microbial biomass, and enzyme activity of two alpine meadow communities. Plant and Soil, 2010, 331(1/2): 377-389. [4] 杨中领. 青藏高原东部高寒草甸群落结构和功能对施肥和放牧的响应[D]. 兰州: 兰州大学, 2011. [5] 杨晓霞, 任飞, 周华坤, 贺金生. 青藏高原高寒草甸植物群落生物量对氮、磷添加的响应. 植物生态学报, 2014, 38(2): 159-166. [6] Printice I C, Farquhar G, Fasham M J R, Goulden M L, Heimann M, Jaramillo V J, Kheshgi H S, Le Quéré C, Scholes R J, Wallace D W R. The carbon cycle and atmospheric carbon dioxide // Houghton J, ed. IPCC Third Assessment Report. Cambridge: Cambridge University Press, 2001: 184-237. [7] 沈菊培, 贺纪正. 微生物介导的碳氮循环过程对全球气候变化的响应. 生态学报, 2011, 31(11): 2957-2967. [8] 何亚婷, 董云社, 齐玉春, 肖胜生, 刘欣超. 草地生态系统土壤微生物量及其影响因子研究进展. 地理科学进展, 2010, 29(11): 1350-1359. [9] Compton J E, Watrud L S, Porteous L A, Degrood S. Response of soil microbial biomass and community composition to chronic nitrogen additions at Harvard forest. Forest Ecology and Management, 2004, 196(1): 143-158. [10] Wallenstein M D, McNulty S, Fernandez I J, Boggs J, Schlesinger W H. Nitrogen fertilization decreases forest soil fungal and bacterial biomass in three long-term experiments. Forest Ecology and Management, 2006, 222(1/3): 459-468. [11] Clegg C D, Lovell R D L, Hobbs P J. The impact of grassland management regime on the community structure of selected bacterial groups in soils. FEMS Microbiology Ecology, 2003, 43(2): 263-270. [12] 莫良玉, 吴良欢, 陶勤南. 高等植物对有机氮吸收与利用研究进展. 生态学报, 2002, 22(1): 118-124. [13] Näsholm T, Kielland K, Ganeteg U. Uptake of organic nitrogen by plants. New Phytologist, 2009, 182(1): 31-48. [14] 王文颖, 刘俊英. 植物吸收利用有机氮营养研究进展. 应用生态学报, 2009, 20(5): 1223-1228. [15] 徐兴良, 白洁冰, 欧阳华. 植物吸收土壤有机氮的研究进展. 自然资源学报, 2011, 26(4): 715-724. [16] Xu X L, Ouyang H, Cao G M, Pei Z Y, Zhou C P. Uptake of organic nitrogen by eight dominant plant species inKobresiameadows. Nutrient Cycling in Agroecosystems, 2004, 69(1): 5-10. [17] Nordin A, Schmidt I K, Shaver G R. Nitrogen uptake by arctic soil microbes and plants in relation to soil nitrogen supply. Ecology, 2004, 85(4): 955-962. [18] Miller A E, Bowman W D, Suding K N. Plant uptake of inorganic and organic nitrogen: Neighbor identity matters. Ecology, 2007, 88(7): 1832-1840. [19] Henry H A L, Jefferies R L. Plant aminoacid, soluble N turnover and microbial N capture in soils of a grazed Arctic saltmarsh. Journal of Ecology, 2003, 91(4): 627-636. [20] 曹广民, 吴琴, 李东, 胡启武, 李月梅, 王溪. 土壤-牧草氮素供需状况变化对高寒草甸植被演替与草地退化的影响. 生态学杂志, 2004, 23(6): 25-28. [21] Miller A E, Bowman W D. Alpine plants show species-level differences in the uptake of organic and inorganic nitrogen. Plant and Soil, 2003, 250(2): 283-292. [22] 王文颖, 周华坤, 杨莉, 李锦萍, 汪新川. 高寒藏嵩草(Kobresiatibetica)草甸植物对土壤氮素利用的多元化特征. 自然资源学报, 2014, 29(2): 249-255. [23] Lipson D, Näsholm T. The unexpected versatility of plants: organic nitrogen use and availability in terrestrial ecosystems. Oecologia, 2001, 128(3): 305-316. [24] Jones D L, Healey J R, Willett V B, Farrarb J F, Hodge A. Dissolved organic nitrogen uptake by plants—An important N uptake pathway? Soil Biology and Biochemistry, 2005, 37(3): 413-423. [25] 张乃莉, 郭继勋, 王晓宇, 马克平. 土壤微生物对气候变暖和大气N沉降的响应. 植物生态学报, 2007, 31(2): 252-261. [26] Frostegård A, Bååth E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil. Biology and Fertility of Soils, 1996, 22(1/2): 59-65. [27] 张秋芳, 刘波, 林营志, 史怀, 杨述省, 周先冶. 土壤微生物群落磷脂脂肪酸PLFA生物标记多样性. 生态学报, 2009, 29(8): 4127-4137. [28] Feng X J, Simpson M J. Temperature and substrate controls on microbial phospholipid fatty acid composition during incubation of grassland soils contrasting in organic matter quality. Soil Biology and Biochemistry, 2009, 41(4): 804-812. [29] Castro H F, Classen A T, Austin E E, Norby R J, Schadt C W. Soil microbial community responses to multiple experimental climate change drivers. Applied and Environmental Microbiology, 2010, 76(4): 999-1007. [30] Hollister E B, Schadt C W, Palumbo A V, Ansley R J, Boutton T W. Structural and functional diversity of soil bacterial and fungal communities following woody plant encroachment in the southern Great Plains. Soil Biology and Biochemistry, 2010, 42(10): 1816-1824. [31] 颜慧, 蔡祖聪, 钟文辉. 磷脂脂肪酸分析方法及其在土壤微生物多样性研究中的应用. 土壤学报, 2006, 43(5): 851-859. [32] Wang W Y, Ma Y G, Xu J, Wang H C, Zhu J F, Zhou H K. The uptake diversity of soil nitrogen nutrients by main plant species inKobresiahumilisalpine meadow on the Qinghai-Tibet Plateau. Science China Earth Sciences, 2012, 55(10): 1688-1695. [33] Wang C T, Cao G M, Wang Q L, Jing Z C, Ding L M, Long R J. Changes in plant biomass and species composition of alpineKobresiameadows along altitudinal gradient on the Qinghai-Tibetan Plateau. Science in China Series C: Life Sciences, 2008, 51(1): 86-94. [34] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000: 13-169. [35] Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911-917. [36] White D C, Flemming C A, Leung K T, MacNaughton S J. In situ microbial ecology for quantitative appraisal, monitoring, and risk assessment of pollution remediation in soils, the subsurface, the rhizosphere and in biofilms. Journal of Microbiological Methods, 1998, 32(2): 93-105. [37] Frostegård Å, Tunlid A, Bååth E. Phospholipid fatty acid composition, biomass, and activity of microbial communities from two soil types experimentally exposed to different heavy metals. Applied and Environmental Microbiology, 1993, 59(11): 3605-3617. [38] Zelles L. Phospholipid fatty acid profiles in selected members of soil microbial communities. Chemosphere, 1997, 35(1/2): 275-294. [39] Zogg G P, Zak D R, Ringelberg D B, White D C, Macdonald N W, Pregitzer K S. Compositional and functional shifts in microbial communities due to soil warming. Soil Science Society of America Journal, 1997, 61(2): 475-481. [40] Zelles L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review. Biology and Fertility of Soils, 1999, 29(2): 111-129. [41] Knoblauch C, Zimmermann U, Blumenberg M, Michaelis W, Pfeiffer E M. Methane turnover and temperature response of methane-oxidizing bacteria in permafrost-affected soils of northeast Siberia. Soil Biology and Biochemistry, 2008, 40(12): 3004-3013. [42] Myers R T, Zak D R, White D C, Peacock A. Landscape-level patterns of microbial community composition and substrate use in upland forest ecosystems. Soil Science Society of America Journal, 2001, 65(2): 359-367. [43] Zechmeister-Boltenstern S, Michel K, Pfeffer M. Soil microbial community structure in European forests in relation to forest type and atmospheric nitrogen deposition. Plant and Soil, 2011, 343(1/2): 37-50. [44] 张焕军, 郁红艳, 丁维新. 长期施用有机无机肥对潮土微生物群落的影响. 生态学报, 2011, 31(12): 3308-3314. [45] Kimura M, Asakawa S. Comparison of community structures of microbiota at main habitats in rice field ecosystems based on phospholipid fatty acid analysis. Biology and Fertility of Soils, 2006, 43(1): 20-29. [46] Tunlid A, Hoitink H A J, Low C, White D C. Characterization of bacteria that SuppressRhizoctoniadamping off in bark compost media by analysis of fatty acid biomarkers. Applied and Environmental Microbiology, 1989, 55(6): 1368-1374. [47] Ünlü K, Özenirler G, Yurteri C. Nitrogen fertilizer leaching from cropped and irrigated sandy soil in central Turkey. European Journal of Soil Science, 1999, 50(4): 609-620. [49] Lieb A M, Darrouzet-Nardi A, Bowman W D. Nitrogen deposition decreases acid buffering capacity of alpine soils in the southern Rocky Mountains. Geoderma, 2011, 164(3/4): 220-224. [50] Wei C Z, Yu Q, Bai E, Lü X T, Li Q, Xia J Y, Kardol P, Liang W J, Wang Z W, Han X G. Nitrogen deposition weakens plant-microbe interactions in grassland ecosystems. Global Change Biology, 2013, 19(12): 3688-3697. [51] Chen D, Lan Z C, Bai X, Grace J B, Bai Y F. Evidence that acidification-induced declines in plant diversity and productivity are mediated by changes in below-ground communities and soil properties in a semi-arid steppe. Journal of Ecology, 2013, 101(5): 1322-1334. [52] Weintraub M N. Nutrient Dynamics in the Arctic Tundra of Alaska[D]. California: University of California, 2004. [53] Hodge A, Robinson D, Fitter A. Are microorganisms more effective than plants at competing for nitrogen? Trends in Plant Science, 2000, 5(7): 304-308. [54] Brinson M M, Lugo A E, Brown S. Primary production, decomposition and consumer activity in freshwater wetlands. Annual Review of Ecology and Systematics, 1981, 12(1): 123-161. [55] Schipper L A, Cooper A B, Harfoot C G, Dyck W J. Regulators of denitrification in an organic soil. Soil Biology and Biochemistry, 1993, 25(7): 925-933. [56] 周兴民. 中国嵩草草甸. 北京: 科学出版社, 2001 [57] Haynes R J. Size and activity of the soil microbial biomass under grass and arable management. Biology and Fertility of Soils, 1999, 30(3): 210-216. [58] 王启兰, 曹广民, 王长庭. 高寒草甸不同植被土壤微生物数量及微生物生物量的特征. 生态学杂志, 2007, 26(7): 1002-1008. [59] Moore-Kucera J, Dick R P. PLFA profiling of microbial community structure and seasonal shifts in soils of a douglas-fir chronosequence. Microbial Ecology, 2008, 55(3): 500-511. [60] 杨希智, 王长庭, 字洪标, 刘敏. 三江源区不同建植年限人工草地土壤微生物群落结构特征. 应用与环境生物学报, 2015, 21(2): 341-349. [62] Nadelhoffer K J, Emmett B A, Gundersen P, Kjønaas O J, Koopmans C J, Schleppi P, Tietema A, Wright R F. Nitrogen deposition makes a minor contribution to carbon sequestration in temperate forests. Nature, 1999, 398(6723): 145-148. [63] Hagedorn F, Spinnler D, Siegwolf R. Increased N deposition retards mineralization of old soil organic matter. Soil Biology and Biochemistry, 2003, 35(12): 1683-1692. [64] Soussana J F, Loiseau P, Vuichard N, Ceschia E, Balesdent J, Chevallier T, Arrouays D. Carbon cycling and sequestration opportunities in temperate grasslands. Soil Use and Management, 2004, 20(2): 219-230. [65] Wardle D A. Controls of temporal variability of the soil microbial biomass: A global-scale synthesis. Soil Biology and Biochemistry, 1998, 30(13): 1627-1637. 附图 高寒藏嵩草(Kobresia tibetica)草甸施肥、枯枝落叶处理条件下地上生物量、枯枝落叶的变化(Mean ± SE, n=6)Attached Fig. Aboveground biomass (a) and litter biomass (b) over six years in experimental treatment plots with urea N addition and litter manipulations (Error bars indicate ±1 SE. n=12 for each treatment) 相同字母表示在P=0.05 水平下差异不显著 Attached Table Results of the two-way ANOVA showing the effect of experimental treatments (Fertilization, litter), years (2005—2010), and their (interactions on the AGB) and litter biomass in aKobresiatibeticameadow over six years (2005—2010) SourceDependentVariabledfFSig.处理Treatment地上生物量AGB(g/m2)2,1442.7820.065枯枝落叶Litterbiomass(g/m2)2,1441.3990.250年份Year地上生物量AGB(g/m2)1,1442.0160.093枯枝落叶Litterbiomass(g/m2)1,1442.0020.095处理×年份Treatment×Year地上生物量AGB(g/m2)3,1442.4670.065枯枝落叶Litterbiomass(g/m2)3,1440.9570.415 AGB: 地上生物量;Aboveground biomass Effects of N addition on the plant and soil microbial community in alpineKobresiatibeticameadow of Qinghai-Tibet Plateau WANG Changting1,*, WANG Genxu2, LI Xiangzhen3, WANG Yong1, ZI Hongbiao1, A De Luji1 1CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China2InstituteofHazardsandEnvironment,ChineseAcademicofSciences,Chengdu610041,China3ChengduInstituteofBiology,ChineseAcademicofSciences,Chengdu610041,China Effects of continuous six-year N addition on the quantitative properties of plant and soil microbial communities in alpineKobresiatibeticameadows were investigated experimentally by using field surveys and phospholipid fatty acid (PLFA) analyses. The experiment included four manipulative treatments involving both N and litter: added N (+N) with the litter removed (LR), +N with the litter left intact (LI), LI without N addition (-N), and LR with -N. Soil samples were collected at the depths of 0—10 and 10—20 cm. Aboveground biomass (AGB), litter biomass, microbial community composition, and nutrient content were measured. The results showed that (1) fertilization did not have significant effects on AGB and litter biomass. (2) N addition significantly increased the abundance of the microbial group PLFAs at the soil depth of 0—10 cm, particularly the abundance of the bacterial PLFAs (B PLFAs) and gram-positive bacterial PLFAs (G+PLFAs), but decreased microbial abundances at the soil depth of 10—20 cm. (3) The ratio of the normal saturated fatty acids/monounsaturated fatty acids and B PLFAs/fungal PLFAs (F PLFAs) increased with the increase in the soil depth. (4) G+PLFA and F PLFA contents were significantly and positively correlated to pH, available phosphorus, available nitrogen, and soil organic matter contents at 0—10 cm soil depth. The contents and abundance of fatty acids were mainly regulated and affected by initial nutrient level in the topsoil after short-term N addition. These results indicate that microbial communities in this alpine tundra are sensitive to both litter and N inputs, and that the vertical structures of these communities are particularly vulnerable. Kobresiatibeticameadow; phospholipid fatty acid (PLFA); microbial community; n addition 国家重点基础研究发展计划 (973计划) (2013CBA01807);国家自然科学基金项目 (31370542);中央高校基本科研业务费优秀科研团队及重大孵化项目 (2014NZYTDO1) 2015-08-04; 日期:2016-06-13 10.5846/stxb201508041642 * 通讯作者Corresponding author.E-mail: wangct@swun.edu.cn 王长庭,王根绪,李香真,王永,字洪标,阿的鲁骥.氮肥添加对高寒藏嵩草 (Kobresiatibetica) 沼泽化草甸和土壤微生物群落的影响.生态学报,2017,37(2):405-415. Wang C T, Wang G X, Li X Z, Wang Y, Zi H B, A De Luji.Effects of N addition on the plant and soil microbial community in alpineKobresiatibeticameadow of Qinghai-Tibet Plateau.Acta Ecologica Sinica,2017,37(2):405-415.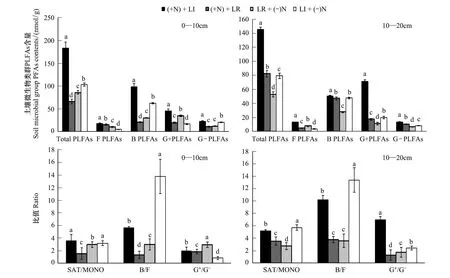
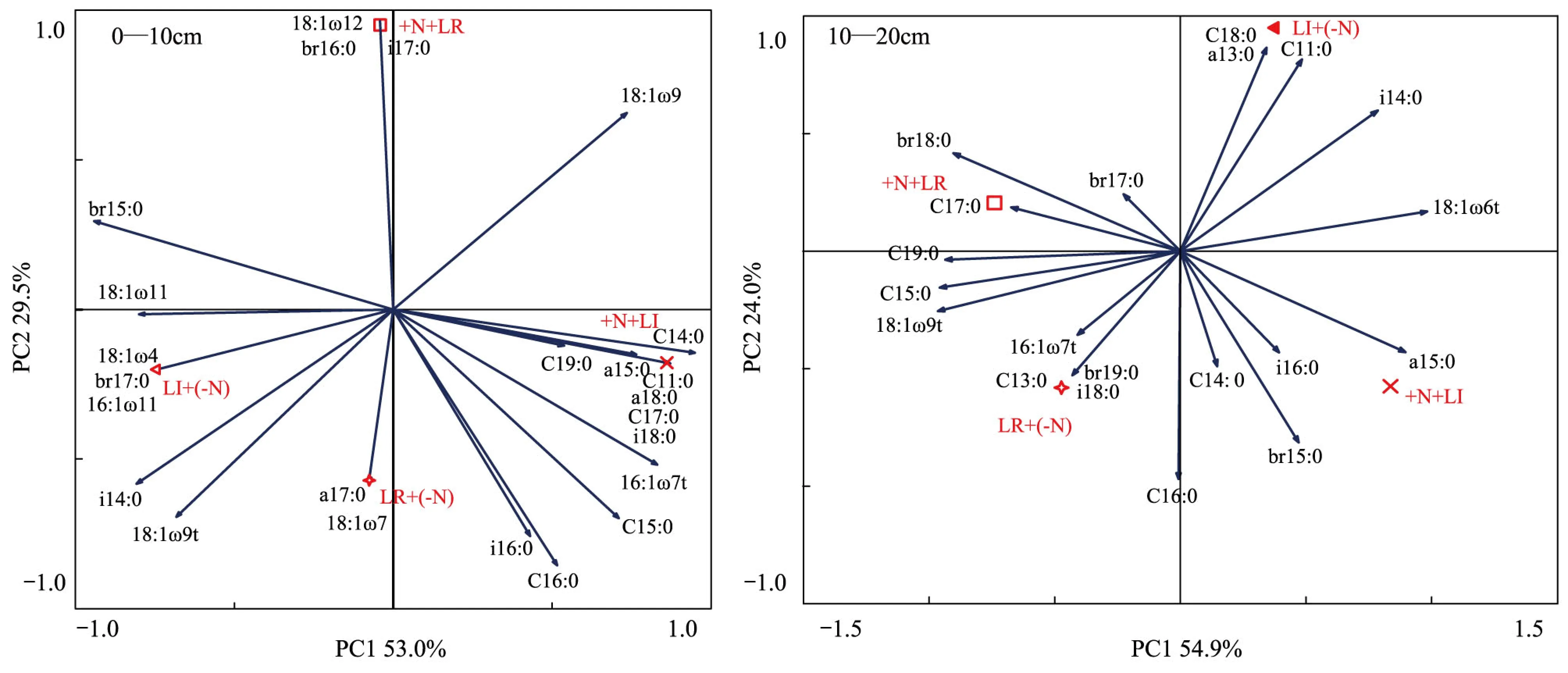
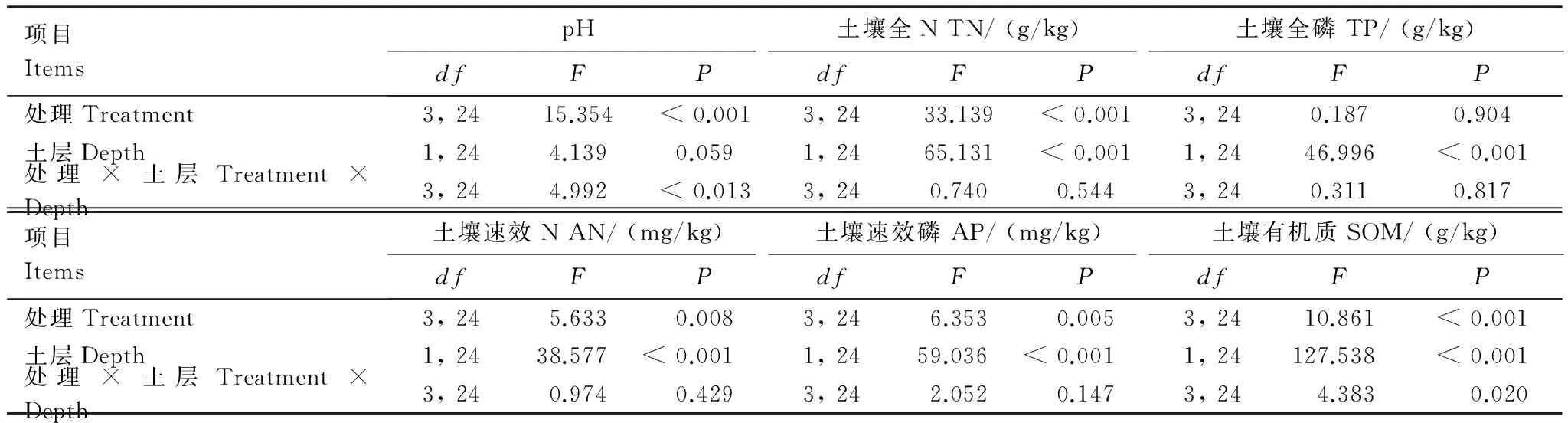
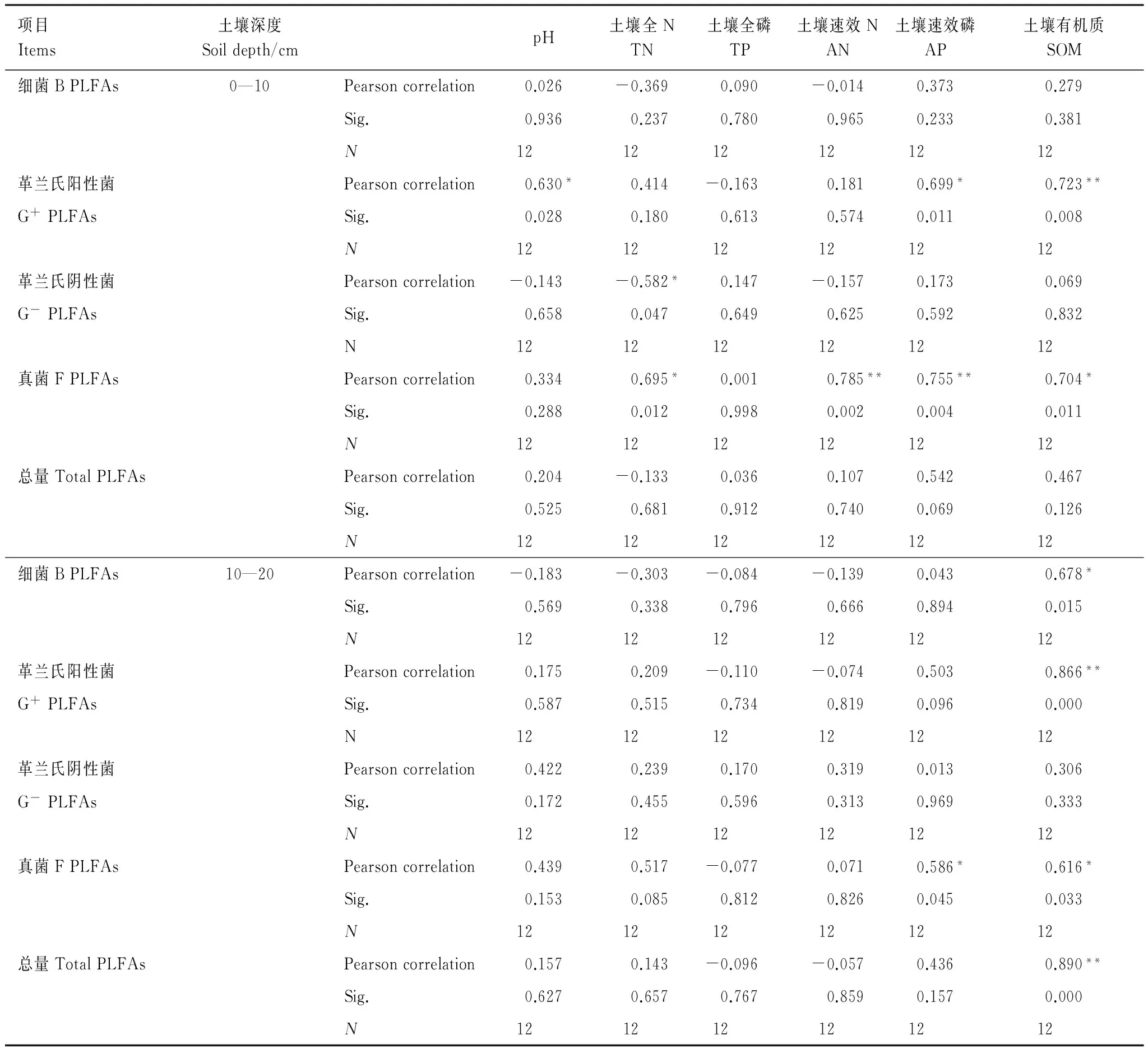
4 讨论与结论