女性青春期后痤疮患者血清性激素水平变化与发病的相关性
2017-01-20王翠媚冯伟军李庐娟罗丽丽高宇琳
王翠媚 冯伟军 周 均 李庐娟 罗丽丽 高宇琳
女性青春期后痤疮患者血清性激素水平变化与发病的相关性
王翠媚1冯伟军1周 均1李庐娟1罗丽丽1高宇琳2
目的探讨女性青春期后痤疮患者血清性激素水平变化及其对痤疮发生、发展的影响。方法回顾性选取2015年3月至2016年3月于东莞市石碣医院皮肤科门诊就诊的女性青春期后痤疮患者资料40例为观察组,同期在本院体检的健康女性40例为对照组。两组均于月经期第5天采集空腹静脉血3 ml,采用放射免疫法检测两组血清黄体生成素(LH)、卵泡刺激素(FSH)、催乳素(PRL)、雌二醇(E2)、睾酮(T)、双氢睾酮(DHT)、游离睾酮(FT)、性激素结合球蛋白(SHBG)的表达情况。按照观察组患者痤疮严重程度分级,分析其分级与性激素表达水平的关系。结果观察组患者血清T、DHT、FT的表达水平明显高于对照组,差异均有统计学意义(均P<0.05);观察组患者血清SHBG明显低于对照组,差异有统计学意义(P<0.05),两组其余指标差异均无统计学意义(均P>0.05)。观察组患者按照痤疮严重程度分级,患者不同严重程度分级的性激素表达水平比较,差异无统计学意义(P>0.05)。结论性激素中雄激素T、DHT及SHBG表达含量与女性青春期后痤疮的发病密切相关,但与痤疮严重程度分级无明显相关性。
痤疮;青春期后;雄激素;受体;性激素
青春期后痤疮指发生于25岁以上的成人痤疮,青春期起病,持续到青春期后仍不消退。本病以女性发病居多,主要发生在面部,轻者仅发生丘疹、脓疮,重者出现增生性或凹陷性瘢痕,严重影响患者的身心健康及生命质量[1-2]。目前痤疮的发病机制尚未明确,可能与性激素水平作用、毛囊内微生物、皮脂腺功能亢进、皮脂分泌过剩及炎性反应、免疫机制、遗传和心理因素等密切相关。关于痤疮患者激素水平的研究较多,其作用在痤疮发病中的影响力也得到证实,但各家研究结果不一[3-4]。本研究采用放射免疫法检测女性青春期后痤疮患者血清性激素水平变化,进一步探讨性激素在痤疮发病机制中的作用,深入了解女性青春期后痤疮的发病机制,为临床治疗痤疮提供科学依据。
1 资料与方法
1.1 一般资料回顾性选取2015年3月至2016年
3月于东莞市石碣医院皮肤科门诊就诊的女性青春期后痤疮患者资料40例为观察组,排除患有内分泌疾病的患者;选取同期在本院体检的健康女性40例为对照组。观察组患者年龄25~40岁,平均(34± 5)岁;病程1~10年;按Pillsbury四级改良分级法分级,Ⅰ级6例,Ⅱ级14例,Ⅲ级15例,Ⅳ级5例;近1年来未服用过避孕药或其他影响内分泌的药物。对照组年龄27~39岁,平均(34±4)岁,身体健康且无痤疮。本研究经医院伦理委员会审核批准。两组患者一般比较,差异无统计学意义(P>0.05)。
1.2 研究方法两组受试者均在月经期第5天采集空腹静脉血3 ml,离心分离血清后置于冰箱中统一检测。采用放射免疫法检测两组血清中黄体生成素(LH)、卵泡刺激素(FSH)、催乳素(PRL)、雌二醇(E2)、睾酮(T)、双氢睾酮(DHT)、游离睾酮
(FT)、性激素结合球蛋白(SHBG)的表达情况,具体操作严格按照说明书进行,检测仪器及所用放射免疫试剂盒均由瑞士罗氏公司提供。按照观察组患者痤疮严重程度分级,分析其分级与性激素表达水平的关系。
1.3 统计学分析采用SPSS 15.0统计软件进行数据处理,计量资料以±s表示,两组间比较采用t检验,多组间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组血清性激素水平比较观察组患者血清T、DHT、FT的表达水平明显高于对照组,差异均有统计学意义(均P<0.05);观察组患者血清SHBG明显低于对照组,差异有统计学意义(P<0.05),两组其余指标差异无统计学意义(P>0.05)。见表1。
2.2 观察组血清性激素水平与痤疮严重程度分级的相关性观察组患者痤疮不同严重程度分级的性激素表达水平比较,差异无统计学意义(P>0.05),提示患者的血清性激素水平与其痤疮严重程度分级无明显相关性,见表2。
3 讨论
近年来,随着经济的发展和人民生活水平的提高,痤疮逐渐成为严重影响人们容貌美观、生活质量及身心健康的疾病之一,尤其对女性青春期后痤疮患者而言,本病往往给患者带来很大的心理负担。尽管痤疮的发病原因和发生、发展机制比较复杂,但是在诸多影响因素中,激素的异常表达及其调控作用是比较受关注的作用机制之一。目前,对于女性痤疮患者的性激素表达水平研究较多,但研究结果尚不统一。
性激素指标中以雄激素水平与痤疮的发生关系最为密切,其中T、DHT是具有活性的雄激素,在刺激皮脂腺脂类合成、激发皮脂腺增生中发挥了重要作用,也是造成痤疮发病基础的主要原因[5]。5 α-还原酶能够把T转化为更具活性的DHT,是激发皮脂增生的主要原因,DHT具有结合皮脂腺细胞的受体,结合后能刺激皮脂腺细胞的增生和分泌,并能进一步通过促进皮肤细胞内核蛋白的合成而刺激脂类合成、加快皮脂腺细胞的生长周期,从而引起皮脂腺角化过度和皮脂分泌浓稠而排泄不畅,蓄积在毛囊皮脂腺系统内[6]。本研究结果发现,观察组患者血清T、DHT的表达水平明显高于对照组,差异均有统计学意义,证实雄激素T、DHT的表达水平异常可能是女性青春期后痤疮的重要发病机制之一,与既往研究[7-8]报道结果一致。
本研究结果发现,观察组患者的SHBG表达明显低于对照组,FT水平却高于对照组,推测可能由于女性青春期后痤疮患者体内雄激素水平表达异常增高,降低了肝脏中产生的SHBG含量,而当SHBG含量降低时,被SHBG结合的雄激素也随之减少,因此FT水平反而增加,这也解释了部分痤疮患者血清睾酮水平并不一定增高,但由于SHBG含量降低,致使直接作用于靶器官或靶细胞的活性T明显增高,从而促进皮脂腺分泌增加,加重痤疮症状[9-10]。
此外,本研究还对女性青春期后痤疮患者血清性激素水平与其痤疮严重程度分级进行相关性分析,结果发现,不同严重程度分级患者的性激素表达水平比较,差异无统计学意义。表明患者的血清性激素水平与其痤疮严重程度分级无明显相关性,提示尽管痤疮的发生与雄激素表达水平密切相关,但其表达增高程度与痤疮的病情发展并无明显关系,这对临床用药具有一定的指导价值[11]。因此,临床上对女性青春期后痤疮患者用药时,其药物剂量不需要根据患者的严重程度进行调整。综上所述,影响痤疮发生、发展的病理机制很复杂,雄激素T、DHT及SHBG表达与女性青春期后痤疮的发病密切相关,但与痤疮严重程度分级无明显相关性。由于各性激素表达水平、激素受体及激素代谢多个环节的变化均可能影响痤疮的发生及发展,对两者的关系尚需深入探讨,从而能够针对性激素的表达水平及受体变化开发针对性的药物,并指导临床选择治疗方案,为更好地预防和治疗女性青春期后痤疮提供科学的依据。
表1 两组血清性激素水平比较(±s)
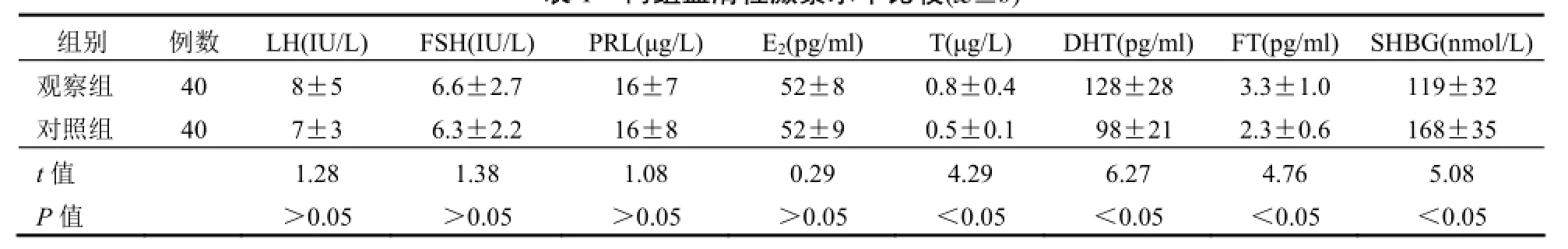
表1 两组血清性激素水平比较(±s)
组别 例数 LH(IU/L) FSH(IU/L) PRL(μg/L) E2(pg/ml) T(μg/L) DHT(pg/ml) FT(pg/ml) SHBG(nmol/L)观察组 40 8±5 6.6±2.7 16±7 52±8 0.8±0.4 128±28 3.3±1.0 119±32对照组 40 7±3 6.3±2.2 16±8 52±9 0.5±0.1 98±21 2.3±0.6 168±35 t值 1.28 1.38 1.08 0.29 4.29 6.27 4.76 5.08 P值 >0.05 >0.05 >0.05 >0.05 <0.05 <0.05 <0.05 <0.05
表2 观察组40例痤疮患者血清性激素水平与其痤疮严重程度分级的相关性(±s)
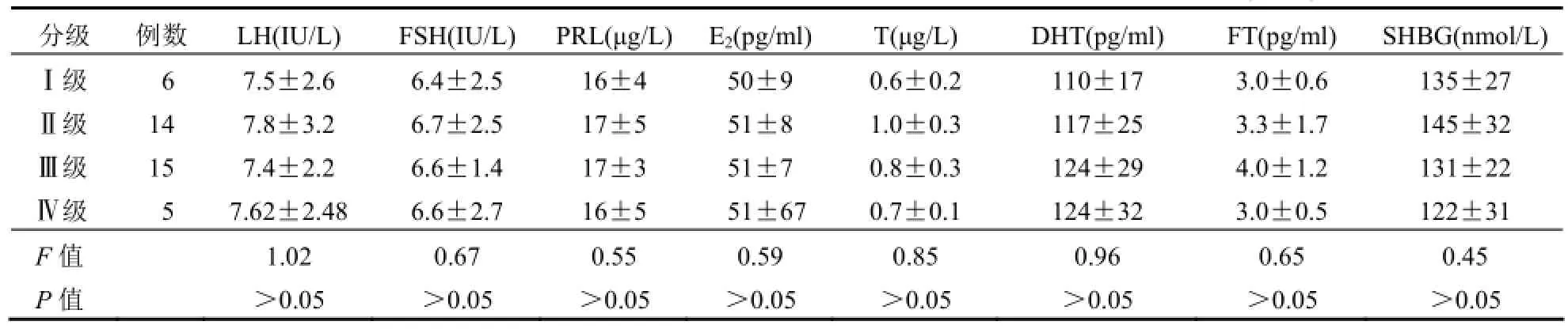
表2 观察组40例痤疮患者血清性激素水平与其痤疮严重程度分级的相关性(±s)
分级 例数 LH(IU/L) FSH(IU/L) PRL(μg/L)E2(pg/ml)T(μg/L) DHT(pg/ml) FT(pg/ml) SHBG(nmol/L)Ⅰ级 6 7.5±2.6 6.4±2.5 16±4 50±9 0.6±0.2 110±17 3.0±0.6 135±27Ⅱ级 14 7.8±3.2 6.7±2.5 17±5 51±8 1.0±0.3 117±25 3.3±1.7 145±32Ⅲ级 15 7.4±2.2 6.6±1.4 17±3 51±7 0.8±0.3 124±29 4.0±1.2 131±22Ⅳ级 5 7.62±2.48 6.6±2.7 16±5 51±67 0.7±0.1 124±32 3.0±0.5 122±31 F值 1.02 0.67 0.55 0.59 0.85 0.96 0.65 0.45 P值 >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 >0.05
[1] 杨智,邹勇莉,顾华,等.环境及遗传因素对痤疮发病影响的研究[J].皮肤病与性病,2009,31(3):5-10.
[2] 文莉,文晓懿,许成蓉.青春期后痤疮发病影响因素分析[J].华中科技大学学报,2011,40(4):441-444.
[3] 王琳,谢红付,李吉,等.青春期后女性痤疮与慢性应激及雄激素水平的相关性研究[J].中华皮肤科杂志,2008,4(3):166-169.
[4] 张景龙,杨惠敏,白雪,等.女性痤疮患者黄体期性激素水平与中医证型关系研究[J].中国皮肤性病学杂志,2009,23(10):65-67.
[5] 李金勇,王晓云,于维恒,等.女性青春后痤疮的发病因素分析[J].中国麻风皮肤病杂志,2010,26(2):98-100.
[6] 骆伟雄.痤疮患者血清性激素水平分析[J].皮肤性病诊疗学杂志,2010,17(5):43-44.
[7] 陈海燕,韩春雷,邱瑰君,等.丹参酮胶囊联合螺内酯治疗对女性青春期后痤疮患者血清性激素水平的影响[J].中国皮肤性病学杂志,2015,29(5):36-38.
[8] 王佳,邹大进.女性痤疮患者血清雄激素水平的变化[J].实用医药杂志,2009,26(6):1-2.
[9] 闵莉,李灿东,蔡东华,等.寻常痤疮中医证型与性激素水平相关研究[J].辽宁中医杂志,2010,37(6):12-13.
[10] 朱萍萍,陈力.中药在痤疮治疗中调节性激素水平的研究概述[J].中国中西医结合皮肤性病学杂志,2011,10(4):65-67.
[11] 张晓琳.中医治疗痤疮的疗效分析[J].中国中医指南, 2013,11(6): 277-278.
Serum sex hormone level of women after puberty acne patients and the correlation between sex hormone level and the pathogenesis of women after puberty acne
Wang Cuimei Femg Weijun Zhou Jun Li Lujuan Luo Lili Gao Yulin
Objective To study the serum sex hormone level of women after puberty acne patients and the correlationbetween sex hormone level and the pathogenesis of women after puberty acne.MethodsFrom March 2015 to March 2016,40 cases of women after puberty acne in Shijie hospital of Dongguan were collected as study group,in the same period in our hospital 40 cases of healthy women were collected as control group.3 ml venous blood of the two groups were collected at the fifth day of menses, and the expression of serum luteinizing hormone(LH),folliclestimulatinghormone(FSH),prolactin(PRL),estradiol(E2),testosterone(T),dihydrotestosterone(DHT),free testosterone(FT), sex hormone binding globulin(SHBG)of two groups were test by radioimmunoassay. According to the observation group of patients with acne severity classification, analysis of the relationship between the classification and sex hormone level.Results The expression of T,DHT,FT of study group were significantly higher than those of the control group(P<0.05),the expression of SHBG was significantly lower than that of the control group(P<0.05),and there were no significant difference of other indexs between two groups(P>0.05).According to severity classification, analyze the relationship between the expression level of sex hormones and severity classification,and found that there was no significant difference between the expression level of sex hormones and severity classification(P>0.05).ConclusionThe expression levels of sex hormone androgen T,DHT and SHBG were closely related to the pathogenesis of women after puberty acne,but it had no obvious effects of relation with severity classification of acne.
Acne;Puberty;Androgens;Receptor;Sex hormones
R758.73+3
A【DOI】10.12010/j.issn.1673-5846.2016.12.039
1东莞市石碣医院,广东东莞 523290
2东莞市妇幼保健院检验科,广东东莞 523000
