转基因水稻叶片外卷突变体的机理
2017-01-20朱秋强于曙光柯兰兰潘大仁
朱秋强,于曙光,柯兰兰,潘大仁
(1.福建农林大学生命科学学院,福建福州350002;2.青岛农业大学化学与药学院,山东青岛266109)
转基因水稻叶片外卷突变体的机理
朱秋强1,于曙光2,柯兰兰1,潘大仁1
(1.福建农林大学生命科学学院,福建福州350002;2.青岛农业大学化学与药学院,山东青岛266109)
以水稻品种明恢86和明恢86转基因水稻正常叶植株为对照组进行研究,对叶片横截面组织结构的观察发现,单位面积突变体外卷叶片的上表皮泡状细胞数量增加,推测外卷是由于泡状细胞数量增加引起的.遗传分析结果显示,该卷叶突变性状是由隐性单基因突变引起的.外源基因在卷叶突变体中为单拷贝,并且外源基因与卷叶性状共分离,说明卷叶性状是T-DNA插入引起的.T-DNA插入位点分析结果显示插入位点位于水稻第9号染色体长臂上的非基因区,是一个新的与水稻卷叶相关的突变位点.
卷叶突变体;泡状细胞;遗传分析;基因定位
水稻是最主要的粮食作物之一,尤其在中国这样的人口大国,在耕地有限的情况下,稳定和提高水稻单产就成为提高水稻产量最有效的途径之一,而改良水稻株型对提高水稻单产具有重要意义.水稻叶片的直立性和叶片的适度卷曲是水稻理想株型的重要因素,叶片的适度内卷能使叶片保持直立不披垂,从而减少叶片之间的互相遮挡,改善水稻群体的受光状况.近年来,越来越多的科学家开始关注水稻卷叶性状,致力于分离卷叶相关基因和探索水稻卷叶的相关机制.迄今为止已经分离克隆到了13个与水稻卷叶相关的基因[1-13],研究表明,卷叶性状的成因大部分与泡状细胞的发育异常相关.NRL1和RL14基因分别编码纤维素合酶和2GO-Fe(Ⅱ)加氧酶,它们对泡状细胞的发育起正调控作用,这2个基因缺失的突变体导致水稻泡状细胞的面积变小从而引起水稻叶片内卷[3].此外,ACL1基因编码一个含有保守功能域的未知蛋白,OsZHD1基因编码一个锌指结构同源结构域类转录因子,它们对水稻泡状细胞的发育也起到正调控作用.这2个基因的过表达导致水稻泡状细胞数量的增加,从而引起水稻叶片外卷[4,13].SLL1基因编码一个MYB家族的SHAQKYF类转录因子,sll1突变体的叶片远轴面后壁细胞发育缺陷和远轴面泡状细胞异常发育引起叶片内卷[8].Roc5基因负调控泡状细胞的形成和发育,其缺失表达导致上表皮泡状细胞数量增多而引起水稻叶片外卷[10].SRL1基因表达一个糖基磷脂酰肌醇锚定蛋白,该基因对水稻泡状细胞的发育起到负调控的作用,当其不表达的时候泡状细胞的数量增多[12].可见泡状细胞的发育对于水稻叶片的形态维持具有重要作用.
对泡状细胞发育的相关分子机制的探索是了解水稻卷叶分子机制的一个重要突破口.然而,已经克隆到的与水稻卷叶性状相关的基因未能形成一个有效的分子网络,无法说明水稻泡状细胞发育的分子机制.因此,为了了解水稻泡状细胞发育的分子机制,需要分离更多的相关基因以形成完整的分子网络.本研究以转基因水稻稳定高代中发现的一个叶片外卷的突变体为材料,探讨与卷叶发育相关的细胞学与分子机制.以期为进一步研究和利用水稻卷叶性状提供依据.
1 材料与方法
1.1 供试材料
供试材料为本实验室保存的转3α-HSD基因水稻稳定高代叶片外卷突变体(Rolled)、转3α-HSD基因水稻稳定高代正常平展叶植株(Unrolled)和转基因受体水稻品种明恢86植株(WT).外源3α-HSD基因是睾丸酮丛毛单胞菌的关键酶3α-羟类固醇脱氢酶/碳酰基还原酶基因,对环境污染物中的类固醇化合物有很好的降解作用.该卷叶突变体从第4片叶开始出现卷叶性状,苗期叶型正常.试验材料均隔离种植于福建农林大学试验田内,按常规方法进行田间管理.样品采集时间为出现卷叶性状的苗期末期与分蘖期初期之间.
1.2 水稻叶片石腊切片的组织观察
分别取WT、Unrolled和Rolled 3个材料的苗期第4或第5片叶片进行石蜡切片分析.首先把剪下来的叶片剪成约1 cm的小段,置于预先准备好的固定液中,放置12 h以上;然后依次进行脱水、透明、浸蜡、包埋、切片、染色和中性树胶封片等操作,用显微镜观察水稻叶片横截面切片.
1.3 外源基因拷贝数的分析
采用实时荧光定量PCR法确定转基因水稻外源基因的拷贝数[14].引物用Primer Premier 5.0设计,由上海生物工程有限公司合成.实时荧光定量PCR采用的引物为SPS-F:TTGCGCCTGAACGGATAT.SPS-R: CGGTTGATCTTTTCGGGATG.HSD-F:CAGCCGTCGTCATCTCGTCC.HSD-R:CCCGCATAGGCCAGATTTCC.定量PCR体系为SYBR Premix Ex Taq(2×)10 μL,上下游引物各0.4 μL,无菌蒸馏水7.2 μL,模板2 μL,总体积20 μL.PCR反应程序:预变性95℃,10 s(循环数1).PCR反应:95℃,10 s;65℃,20 s.退火过程中检测荧光值,进行40个循环.
1.4 T-DNA与突变性状的共分离分析
采用筛选显性纯合株的方法观察后代叶片表型,分别对100株自交后代进行叶片形态观察,后代均未出现卷叶突变体亲本的为显性纯合株.经过筛选获得10株显性纯合株,另随机选取20株卷叶植株,提取叶片DNA.T-DNA里包含3α-HSD基因,以3α-HSD基因序列设计引物进行PCR,验证显性纯合株和隐性纯合株中是否含有T-DNA.
1.5 T-DNA插入位点的分析
本试验采用TAIL-PCR法扩增T-DNA侧翼序列,然后通过数据库比对确定T-DNA在水稻基因组中的插入位点.首先用3条嵌套的特异引物分别和简并引物组合,以Rolled的叶片基因组DNA为模板进行TAIL-PCR,从而确定外源T-DNA插入位点.常见的基因定位包括分子标记法和QTL分析等[15-18],本研究的材料为转基因突变体,所以采用TAIL-PCR法.本研究转基因水稻所用的3α-HSD基因表达载体为以pBR322质粒载体构建的pBRHSD表达载体,由本研究室保存.根据表达载体序列设计T-DNA两端的3对特异引物,进行侧翼序列的TAIL-PCR扩增,所涉及的引物见表1.
2 结果与分析
2.1 水稻叶片的形态观察
观察不同生长期不同水稻材料间叶片和株型的差异情况.从图1可以看出正常水稻叶片是平展的,而卷叶突变体的叶片明显向外卷曲呈半筒状.
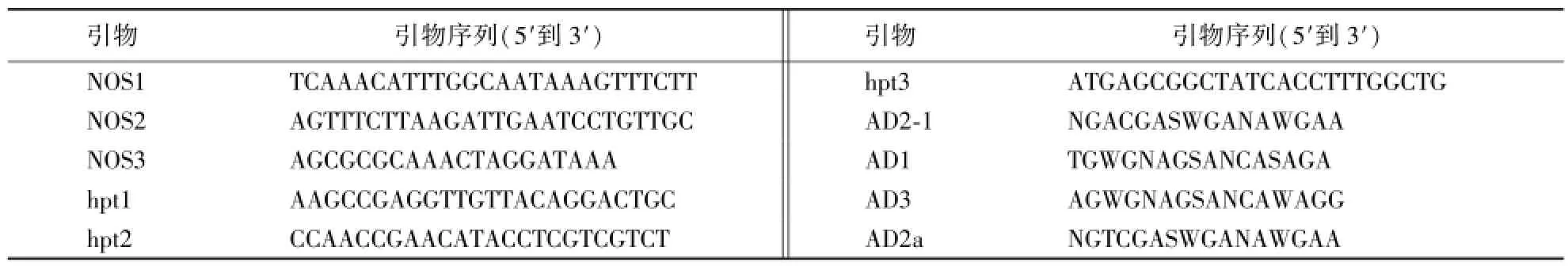
表1 TAIL-PCR引物Table 1 Primers of TAIL-PCR
2.2 水稻叶片横截面结构的差异
于苗期选取幼嫩的叶片进行石蜡切片分析,结果见图2.从图2可以看出,卷叶突变体的上皮层小侧脉旁的泡状细胞数目明显多于正常叶片的上皮层小侧脉旁的泡状细胞.上皮层泡状细胞是水稻叶片在不缺水时保持叶片平展的重要组织结构,而过多的上皮层泡状细胞则会导致叶片向反轴面卷曲,即叶片外卷.
2.3 卷叶性状的遗传性
以Rolled和WT互为父本和母本进行杂交获得F1代植株,记为Rolled/WT和WT/Rolled.叶片形态观察发现,F1代植株均为平展叶片,没有出现卷叶性状.F1代自交得到F2代,观察F2代的叶片形态,其分离情况见表2.
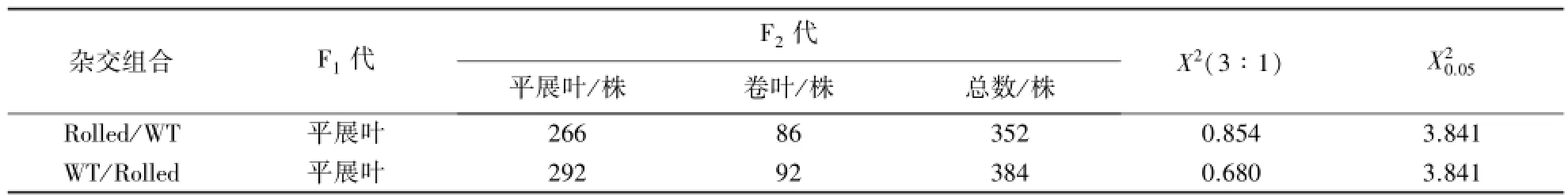
表2 F1性状表现及F2群体分离情况Table 2 Phenotypic expression of F1and segregation status of F2population
从表2可以看出,2个杂交组合Rolled/WT和WT/Rolled的F1代叶型均为平展叶,Rolled/WT和WT/ Rolled的F2代群体叶型为平展叶.卷叶的数量比分别为266∶86和292∶92,按1对等位基因的分离模式进行3∶1拟合卡方检验,Rolled/WT和WT/Rolled的X2(3∶1)分别为0.854和0.680,均小于(3.841),符合3∶1的孟德尔的单基因遗传分离规律.由此可见,该外卷性状是隐性单基因突变引起的.
2.4 外源基因拷贝数的确定
由于蔗糖磷酸合成酶基因SPS在水稻基因组中为单拷贝,所以选择蔗糖磷酸合成酶基因SPS为对照基因检测外源3α-HSD基因在转基因后代中的拷贝数.3α-HSD基因和SPS基因的标准曲线如图3所示.3α-HSD基因的标准曲线相关系数R2=0.992 7,相关性高,所以3α-HSD基因Ct值与起始模板数(HSD0)之间的相关性方程为:HSD0=10(-0.1424Ct+4.39).SPS基因的标准曲线相关系数R2=0.997 9,相关性高,所以SPS基因的Ct值与起始模板数(SPS0)之间的相关性方程为:SPS0=10(-0.2738Ct+7.82).
WT的3α-HSD基因的Ct值是24.84,SPS基因的Ct值是27.31,Rolled3α-HSD基因的Ct值是26.18,SPS基因的Ct值是27.25.由方程HSD0=10(-0.141Ct+4.3501)计算出样品3α-HSD基因的起始模板数,由方程SPS0=10(-0.274Ct+7.9246)计算出样品SPS基因的起始模板数.计算得到的结果为:WT的HSD0=20 195,SPS0=80 139;Rolled的HSD0=47 953,SPS0=40 162.水稻内参基因SPS是纯合二倍体,本试验的转基因植株也是经过筛选得到的卷叶突变纯合株,所以3α-HSD基因也是纯合二倍体.根据Ding的实时荧光定量PCR法确定转基因水稻外源基因拷贝数,计算结果表明,WT中3α-HSD基因的HSD0/SPS0为0.252,拷贝数为0;Rolled中3α-HSD基因的HSD0/SPS0为1.194,拷贝数为1,即为单拷贝.
2.5 T-DNA与卷叶性状的共分离检测
遗传分析结果表明,卷叶性状是隐性单基因突变引起的,选取WT和Rolled的杂交后代F2代为研究材料,观察卷叶性状与3α-HSD基因的共分离情况.由于卷叶性状是隐性单基因突变引起的,所以F2代中的平展叶植株中有杂合株的存在,需要先把F2代中的显性纯合株分离出来,最终分离得到10株显性纯合株.对显性纯合株和隐性纯合株进行3α-HSD基因的PCR验证.从图4可以看出,显性纯合株都没有TDNA,而隐性纯合株都有T-DNA,由此可以推断T-DNA与卷叶性状共分离.
2.6 外源基因插入位点的确定
外源T-DNA插入位点分析结果表明:以T-DNA右边界终止子nos序列设计的特异引物与简并引物的引物组合在3轮PCR之后没有获得条带;而以T-DNA左边界hpt基因序列设计的特异引物与简并引物的引物组合经过3轮PCR,hpt/AD2-1引物对获得1条500 bp左右的DNA条带,hpt/AD3引物对获得1条300 bp左右的DNA条带,结果见图5.回收条带后,先用软件DNAMAN进行比对,确认回收的DNA片段为T-DNA的侧翼序列.比对结果显示2个回收DNA条带中只有hpt/AD3引物对获得的300 bp左右的DNA条带是T-DNA的侧翼序列,而hpt/AD2-1引物对获得的500 bp左右的DNA条带不能与T-DNA末端序列配对,推测该扩增DNA条带是简并引物AD2-1自身配对扩增获得的非特异性条带.hpt/AD3引物对获得的300 bp左右的DNA条带采用NCBI的Blastn程序进行比对,结果显示该DNA片段与水稻9号染色体上的序列匹配率高达99%.进一步检索分析发现,T-DNA插入位点位于水稻9号染色体长臂上的7 504 113 bp处,处于非基因区.
T-DNA插入位点前后100 kb以内共有7个基因,其中上游基因为Os09g0292900,下游6个基因,距离插入位点最近的基因是下游的Os09g0293400,这些基因的功能均未知.经过同源性比对分析这些功能未知的基因,基因功能的预测结果如表3所示.
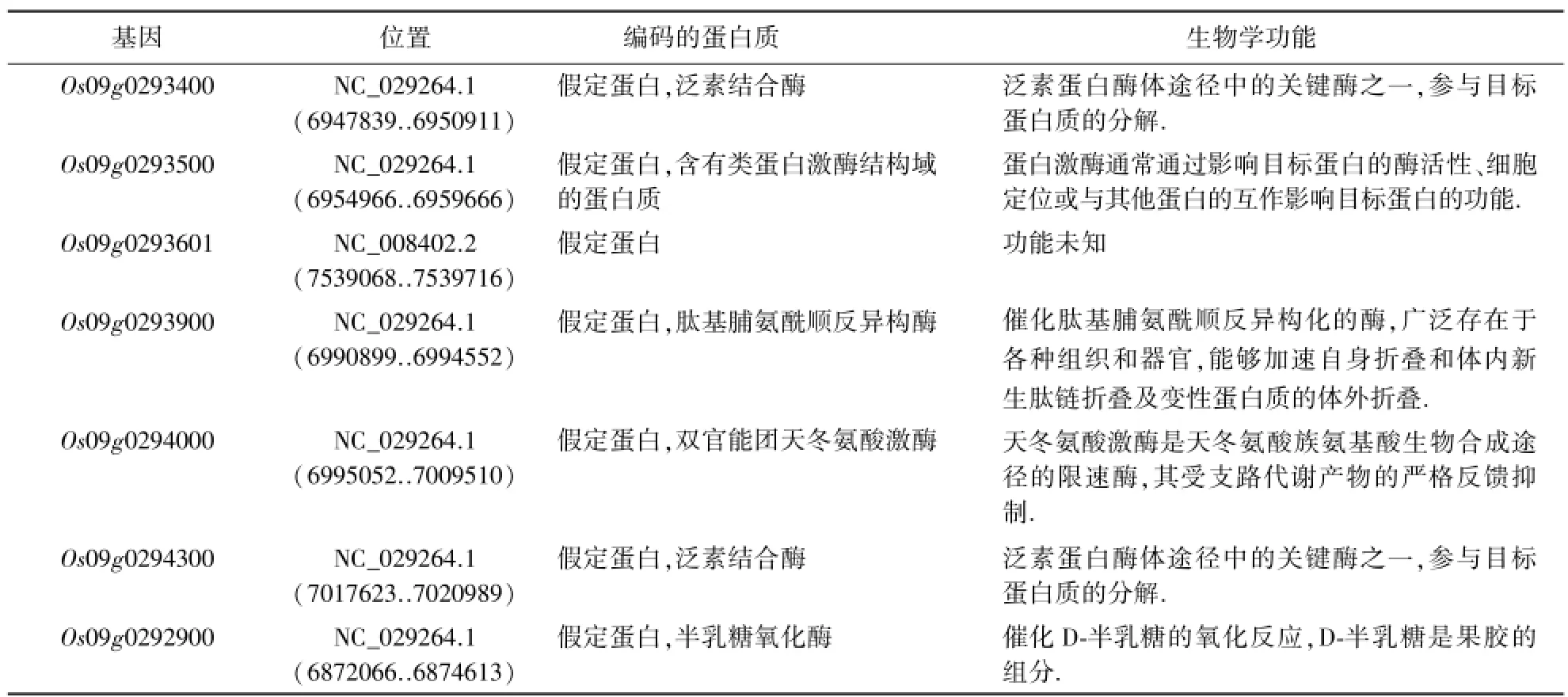
表3 T-DNA插入位点附近基因的功能预测Table 3 Prediction on function of genes near the insertion site of T-DNA
3 讨论
本研究以转基因水稻稳定高代中发现的叶片外卷突变体植株为材料,以水稻栽培品种明恢86和明恢86转基因水稻正常叶植株为对照组,进行了叶片横截面石蜡切片观察、卷叶性状遗传分析和外源T-DNA插入位点确定等研究.结果表明,突变体外卷叶片的上表皮泡状细胞数量增加造成叶片外卷;卷叶突变性状是由隐性单基因突变引起的;外源基因在卷叶突变体中为单拷贝,并与卷叶性状共分离;通过T-DNA插入位点分析,发现了一个新的与水稻卷叶相关的突变位点.
外源基因3α-HSD在卷叶突变体中的拷贝数为单拷贝,外源基因3α-HSD和卷叶性状共分离,外源TDNA插入位点位于水稻9号染色体长臂上的7 504 113 bp处,处于非基因区.外源基因为单拷贝且和卷叶性状共分离,说明卷叶突变是外源基因插入引起的.目前已发现的与水稻卷叶性状相关的基因分布于不同的水稻染色体上,其中定位在水稻9号染色体上的基因有3个.Zhang et al[8]发现一个控制水稻卷叶性状的隐性基因sll1-1,并将其定位于第9号染色体长臂上.sll1-1基因的缺失导致突变体水稻叶片的远轴面也出现了泡状细胞,从而导致水稻叶片内卷.Luo et al[11]也在一个内卷水稻突变体中发现一个可能与水稻卷叶相关的基因RL10(t),并将其定位在9号染色体长臂上.Yan et al[7]发现一个叶片完全内卷和小穗畸形的水稻突变体,通过图位克隆得到一个位于9号染色体上的与卷叶相关的RL9基因.这3个基因分别定位在9号染色体上的不同的位点上,sll1-1基因位于9号染色体长臂11 Mbp处,RL10(t)基因位于9号染色体长臂13 Mbp处,RL9基因位于9号染色体16 Mbp处,而本研究中发现的突变位点位于9号染色体长臂7.5 Mbp处,且距离较远,基本可以排除与本研究突变位点共分离的可能性.因此可以推断,本研究发现的与水稻卷叶相关的基因是一个新的与水稻外卷性状相关的突变位点.另外,已知的3个定位于9号染色体上的基因突变都造成水稻叶片内卷,而本研究中的突变体为叶片外卷.新的与水稻外卷性状相关的突变位点的发现为进一步探究水稻卷叶性状的相关分子机制提供了新的证据.
本研究通过对转基因水稻后代卷叶突变体的研究发现该突变体的卷叶性状是由于T-DNA的插入导致1对隐性基因发生突变,进而造成泡状细胞发育异常,最终导致水稻叶片外卷.T-DNA插入位点位于水稻第9号染色体的长臂上7.5 Mbp处的非基因区,通过对插入位点附近的基因进行分析得到与水稻泡状细胞发育相关的候选基因.
[1]FANG L,ZHAO F,CONG Y,et al.Rolling-leaf14 is a 2OG-Fe(Ⅱ)oxygenase family protein that modulates rice leaf rolling by affecting secondary cell wall formation in leaves[J].Plant Biotechnol J,2012,10:524-532.
[2]HIBARA K,OBARA M,HAYASHIDA E,et al.TheADAXIALIZED LEAF1 gene functions in leaf and embryonic pattern formation in rice[J].Dev Biol,2009,334:345-354.
[3]HU J,ZHU L,ZENG D,et al.Identification and characterization ofNARROW AND ROLLED LEAF1,a novel gene regulating leaf morphology and plant architecture in rice[J].Plant Mol Biol,2010,73:283-292.
[4]LI L,SHI Z Y,LI L,et al.Overexpression ofACL1(abaxially curled leaf 1)increased bulliform cells and induced abaxial curling of leaf blades in rice[J].Mol Plant,2010,3:807-817.
[5]SHI Z,WANG J,WAN X,et al.Over-expression of riceOsAGO7 gene induces upward curling of the leaf blade that enhanced erect-leaf habit[J].Planta,2007,226:99-108.
[6]WU R,LI S,HE S,et al.CFL1,a WW domain protein,regulates cuticle development by modulating the function ofHDG1,a class IV homeodomain transcription factor,in rice andArabidopsis[J].Plant Cell,2011,23:3 392-3 411.
[7]YAN S,YAN C J,ZENG X H,et al.ROLLED LEAF9,encoding a GARP protein,regulates the leaf abaxial cell fate in rice [J].Plant Mol Biol,2008,68:239-250.
[8]ZHANG G H,XU Q,ZHU X D,et al.Shallot-like 1 is aKANADItranscription factor that modulates rice leaf rolling by regulating leaf abaxial cell development[J].Plant Cell,2009,21:719-735.
[9]ZHANG J J,WU S Y,JIANG L,et al.A detailed analysis of the leaf rolling mutant sll2 reveals complex nature in regulation of bulliform cell development in rice(Oryza sativaL.)[J].Plant Biol(Stuttg),2015,17:437-448.
[10]ZOU L P,SUN X H,ZHANG Z G,et al.Leaf rolling controlled by the homeodomain leucine zipper classⅣgene Roc5 in rice[J].Plant Physiol,2011,156:1 589-1 602.
[11]LUO Z,YANG Z,ZHONG B,et al.Genetic analysis and fine mapping of a dynamic rolled leaf gene,RL10(t),in rice (Oryza sativaL.)[J].Genome,2007,50:811-817.
[12]XIANG J J,ZHANG G H,QIAN Q,et al.Semi-rolled leaf1 encodes a putative glycosylphosphatidylinositol-anchored protein and modulates rice leaf rolling by regulating the formation of bulliform cells[J].Plant Physiol,2012,159:1 488-1 500.
[13]XU Y,WANG Y,LONG Q,et al.Overexpression ofOsZHD1,a zinc finger homeodomain class homeobox transcription factor,induces abaxially curled and drooping leaf in rice[J].Planta,2014,239:803-816.
[14]DING J,JIA J,YANG L,et al.Validation of a rice specific gene,sucrose phosphate synthase,used as the endogenous reference gene for qualitative and real-time quantitative PCR detection of transgenes[J].J Agric Food Chem,2004,52:3 372-3 377.
[15]杨蜀岚,马洪丽,张书标,等.水稻长穗颈高秆隐性基因eui2的分子标记和定位[J].福建农林大学学报(自然科学版),2002,31(4):480-483.
[16]陈志伟,吴为人,景艳军,等.利用近等基因系验证水稻细菌性条斑病抗性QTL[J].福建农林大学学报(自然科学版),2005,34(3):273-277.
[17]陈志伟,景艳军,李小辉,等.水稻细条病抗性QTL qBlsr5a的验证和更精确定位[J].福建农林大学学报(自然科学版),2006,35(6):619-622.
[18]贾小丽,苗利国,林红梅,等.不同环境下水稻籽粒宽的QTL定位分析[J].福建农林大学学报(自然科学版),2013,42 (6):570-573.
(责任编辑:叶济蓉)
Preliminary investigation on outward rolled leaf mutant of transgenic rice
ZHU Qiuqiang1,YU Shuguang2,KE Lanlan1,PAN Daren1
(1.College of Life Sciences,Fujian Agriculture and Forestry University,Fuzhou,Fujian 350002,China;2.College of Chemistry and Medicine,Qingdao Agricultural University,Qingdao,Shandong 266109,China)
Outward rolling leaf is likely to improve light interception rate of rice.To investigate cytology and molecular mechanism of this trait,mutant plants 3α-HSD with stable traits of outward rolling leaf were used as the experimental group,with cultivated variety MH 86 and transgenic plants with flat leaves used as the control.Microscopic observation on cross section of leaves indicated that rolled leaf of mutant plants was caused by an increased number of bulliform cells.Genetic analysis showed that outward rolling leaf was attributed to the mutation of single recessive genes.This exogenous gene was a single copy in rolled leaf mutant,and co-segregated with rolled leaf trait,indicating that rolled leaf trait was likely caused by T-DNA insertion.Furthermore,analysis of T-DNA insertion site showed that this insertion located in the non-coding region in long arm of chromosome 9,which was a new mutation site related to the mechanism of this trait,related to rice leaf rolling.
bulliform cell;curled leaf mutant;genetic analysis;TAIL-PCR
Q946
:A
:1671-5470(2016)06-0655-07
10.13323/j.cnki.j.fafu(nat.sci.).2016.06.008
2016-06-20
:2016-08-21
农业部转基因重大专项资助项目(2008zx08009-003).
朱秋强(1986-),男,博士研究生.研究方向:生物化学与分子生物学.Email:181426249@qq.com.通讯作者潘大仁(1949-),男,教授,博士生导师.研究方向:生物技术.Email:pdr8598@163.com.
