盐效应和共同离子效应对方解石溶解度的影响及其地质意义
2017-01-17卓勤功张学军陈小兰
陈 勇, 王 淼, 刘 庆, 卓勤功, 张学军, 陈小兰
(1.中国石油大学地球科学与技术学院,山东青岛 266580; 2.海洋国家实验室海洋矿产资源评价与探测技术功能实验室,山东青岛 266071; 3.中国石油化工股份有限公司胜利油田分公司勘探开发研究院,山东东营 257015;4.中国石油勘探开发研究院,北京 100083; 5.山东科技大学地球科学与工程学院,山东青岛 266590)
盐效应和共同离子效应对方解石溶解度的影响及其地质意义
陈 勇1,2, 王 淼1,2, 刘 庆3, 卓勤功4, 张学军3, 陈小兰5
(1.中国石油大学地球科学与技术学院,山东青岛 266580; 2.海洋国家实验室海洋矿产资源评价与探测技术功能实验室,山东青岛 266071; 3.中国石油化工股份有限公司胜利油田分公司勘探开发研究院,山东东营 257015;4.中国石油勘探开发研究院,北京 100083; 5.山东科技大学地球科学与工程学院,山东青岛 266590)
储层矿物的生长和溶解受控于成岩流体,在恒定温度条件下,对不同盐度和离子类型溶液体系中的方解石溶解特性进行实验研究。结果表明,在低盐度(<20%)条件下,方解石溶解度随盐度增加而增大,但盐度过高会导致方解石溶解度降低,方解石溶解度最大值的盐度区间对应了高孔隙发育带;在相同浓度条件下,MgCl2体系中方解石的溶解度最大,NaCl体系中次之,KCl中最小,说明Mg2+的盐效应大于Na+和K+的盐效应,能促进方解石的溶解;Ca2+会因为共同离子效应而抑制方解石的溶解,反而有助于方解石沉淀(生长),其结果有助于地层保持良好的封闭性;Na2SO4的盐效应不明显,随浓度增大,方解石的溶解度快速降低;硫酸根对方解石溶解的抑制作用强于氯离子,表明Na2SO4水型可能不利于储层溶蚀次生孔隙的发育。
方解石; 溶解度; 生长; 盐效应; 共同离子效应; 储层物性
油气储层中方解石的溶解行为对碳酸盐岩储层和碎屑岩储层的物性有重要影响[1-5]。碳酸盐矿物溶解度受到温度、压力、pH值、二氧化碳分压pco2、有机酸等因素的影响[6-13]。对CaCO3-CO2-H2O体系[14],H2O-CO2系统与CaCO3的反应受方解石表面的H+、HCO3-、CO32-、H2CO3和Ca2+浓度的控制。岩溶地区一般同时存在白云岩、镁方解石、石膏和硬石膏,可以发现大量的Mg2+和SO42-,在许多地区还有Na+、K+和Cl-,高镁方解石矿物在自然环境中pCO2不断升高的条件下会被优先溶解[15]。不同类型离子的出现可以改变地层水(或地表水)的盐度和离子强度,进而影响离子的平衡和方解石的溶解行为。Newton和Manning[7]对方解石在NaCl-H2O体系中的溶解度进行了实验模拟,结果表明,溶解度随着温度(600~900 ℃)、压力(600~1 400 MPa)和盐度(0~0.6%)的增加而增加,其温度和压力主要针对下地壳和上地幔条件。Andersson等[8]对二氧化碳分压增加情况下沉积物中的碳酸盐岩溶解特征进行了研究。闫志为等[12-13]通过PHREEQC软件模拟讨论了氯化物和硫酸钠对方解石和白云石的溶解度影响,分析了盐效应和共同离子效应对方解石溶解度的影响,但缺乏实验数据支撑。一般情况下,盐度增大会导致矿物的溶解度增大,而共同离子效应会影响矿物的溶解平衡。笔者在恒定温度条件下,对不同盐度和离子类型体系中方解石的溶解和生长情况进行实验模拟,分析方解石溶解或生长的变化特征,探讨盐效应和共同离子效应对碳酸盐岩、碎屑岩储层物性的影响。
1 实 验
1.1 方解石溶解
在碳酸钙非饱和条件下方解石容易发生溶解,选用纯方解石晶体颗粒作为研究对象(一般长度都小于3 mm)以增大表面积来确保溶解反应尽快达到平衡。选用分析纯级别的NaCl、KCl、CaCl2、MgCl2和Na2SO4粉末作为盐类标准物质,利用分析天平、烧杯、玻璃棒、容量瓶和去离子水配制不同浓度的盐水溶液。具体步骤如下:①清洗容量瓶、塑料瓶、烧杯、玻璃棒等玻璃仪器,并干燥,准备样品,并配制溶液;②选取适量方解石颗粒,用分析天平量取其质量,误差±1 mg,记录好后放入100 mL容量瓶中;③加入100 mL配制好的溶液到容量瓶中,并密封;④重复②~③,以实现对系列不同浓度体系的实验,然后将放好样的容量瓶和塑料瓶标上标签,放入烘箱中,保持烘箱内的温度在50 ℃,实验时间为10 d以确保体系达到平衡(方解石溶解在几天内可以达到平衡[6]);⑤实验结束后取出方解石晶体样品,用去离子水清洗并干燥,用电子天平称量方解石晶体质量;⑥对比实验前后方解石的质量差,并计算溶解度。实验参数见表1。实验选择50 ℃是为了更多了解地表淋滤到早成岩阶段方解石的溶解特征,而淋滤溶蚀作用阶段对于碳酸盐岩储层有效孔隙的形成有着重要的贡献。实验溶液配制对于NaCl、KCl、MgCl2和Na2SO4主要考察阳离子的盐效应,因此选择相同阳离子浓度条件下的溶解实验;而对于CaCl2,主要考虑共同离子效应对方解石溶解的影响,因而浓度有所区别。
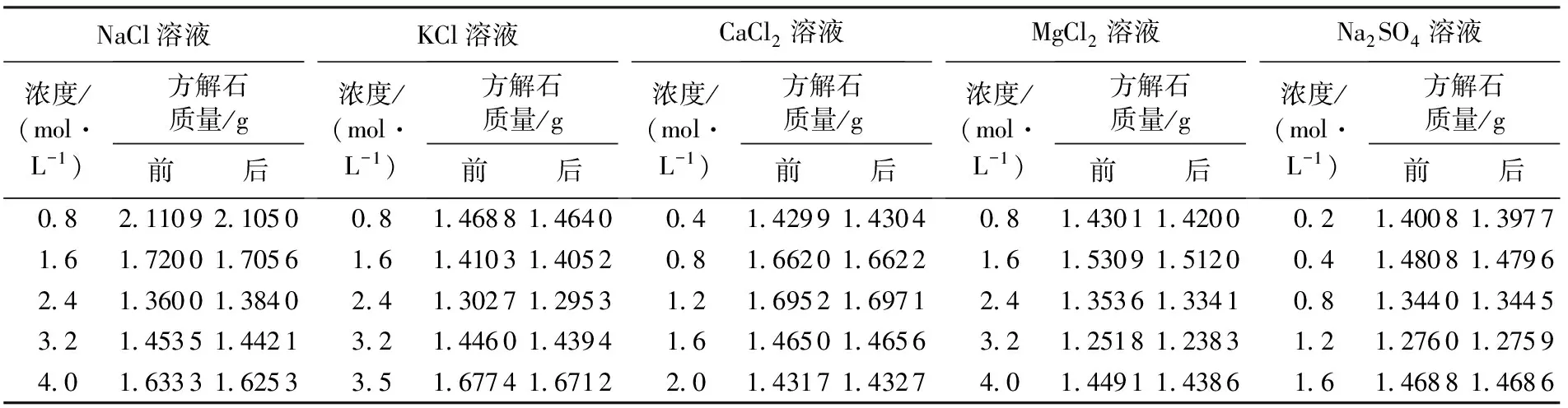
表1 50 ℃下方解石在不同体系中的溶解实验结果Table 1 Experimental results of calcite dissolution in different salt systems at 50 ℃
1.2 方解石生长
在碳酸钙饱和条件下方解石容易生长(胶结),由于NaCl是地层水中最常见的盐类,而且很多情况下用当量NaCl的含量表示地层水中的盐度。设计了不同质量分数浓度NaCl溶液中的方解石生长实验,在溶液中加入了过饱和的碳酸钙粉末,实验步骤与溶解实验相同,实验时间10 d,实验记录如表2。与溶解实验不同的是实验温度选择在90 ℃,这个温度对于大多数盆地处于烃源岩开始大规模排烃时期,方解石胶结与否对储层的物性影响很大,会直接影响到油气成藏。
2 结果分析
根据实验前后方解石矿物的质量差值和溶液体积可以计算方解石的溶解度或生长速率,在50 ℃条件下不同盐类体系中的方解石溶解度计算结果见表3。可以看出,方解石在NaCl、KCl、MgCl2、Na2SO4体系中表现出明显的溶解特征,而在CaCl2体系基本没有溶解,反而表现出轻微的生长,这是因为溶液中Ca2+浓度增大会导致方解石的溶解平衡反应向方解石沉淀方向进行,有利于晶体生长,但是考虑到电子天平的误差为±1 mg,生长量基本可以忽略(表2)。

表2 90 ℃下不同质量分数NaCl条件下 方解石生长速率实验结果Table 2 Experimental results of calcite growth in different NaCl mass fraction at 90 ℃
方解石的生长实验结果显示,在碳酸钙饱和条件下,方解石的生长基本可以忽略,而盐度的影响也没有明显的表现。原因是实验时间太短,而方解石的生长速率太慢。另一方面,因为NaCl质量分数较高,盐效应也会导致方解石的生长受到一定的抑制。
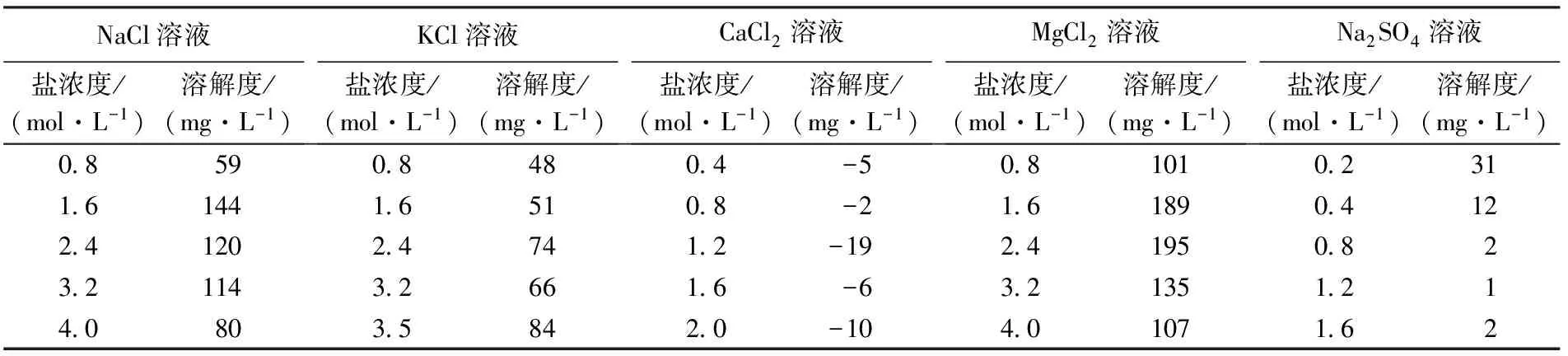
表3 50 ℃下不同类型溶液中的方解石溶解度Table 3 Solubility of calcite in different salt solution systems at 50 ℃
3 盐效应和离子效应的地质意义
3.1 盐效应对方解石溶解度的影响
根据实验结果,绘制方解石溶解度(s)与盐类浓度的关系图,可以分析溶解度与盐度的关系。结果显示,对于NaCl、KCl和MgCl2溶液体系具有相似的特征。对于NaCl溶液体系,方解石的溶解度表现出随着NaCl浓度先增大后减小的特点,在1.7 mol/L(相当于9.0%盐度)达到最大值,当NaCl浓度大于1.7 mol/L,随着NaCl浓度增大而溶解度减小,如图1所示。对于KCl溶液体系,具有与NaCl溶液体系相似的特征,方解石溶解度随KCl浓度增大而增大,在2.5 mol/L(相当于15.7%盐度)附近达到最大值,此后开始减小,如图2所示。对于MgCl2体系也有类似的特点,方解石的溶解度先随MgCl2浓度增加而增大,在2.0 mol/L(相当于16.0%盐度)附近达到最大值,此后随浓度增加而减小,如图3所示。实验结果都反映了在低浓度条件下溶解度随着盐度增加而增大,这证实了盐效应有助于方解石的溶解。因为在低盐度条件下,随着盐度增加,离子活动系数会降低,而在一定的温度和压力条件下矿物溶解的活度积是常数,从而导致矿物溶解度增大。方解石溶解度变化特征与闫志为等[13]在25 ℃下软件模拟结果的总体变化趋势基本相似,但是因为实验温度(50 ℃)与其模拟温度不同(25 ℃),方解石溶解度数值和最大值对应的盐浓度是不同的,而且变化曲线略有不同。

图1 方解石溶解度与NaCl浓度关系Fig.1 Solubility of calcite vs concentration of NaCl
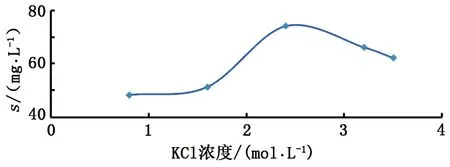
图2 方解石溶解度与KCl浓度关系Fig.2 Solubility of calcite vs concentration of KCl

图3 方解石溶解度与MgCl2浓度关系Fig.3 Solubility of calcite vs concentration of MgCl2
根据实验结果拟合计算可知,对于NaCl、KCl和MgCl2三种体系,方解石溶解度最大值对应的盐质量分数分别为9.0%、15.7%和16.0%,均小于20%,由此看出,在地层水盐度不是很高的条件下(小于20%),盐类的加入有助于方解石的溶解。尽管实验结果显示随着盐度的增大,会使方解石的溶解度有所降低,但总体都高于低盐度条件下的溶解度,这意味着储层地层水盐度高有利于方解石的溶蚀。对于油气储层而言,不管是碎屑岩中的方解石胶结物还是碳酸盐岩中方解石的溶解,对于溶蚀次生孔隙的形成都是非常重要的,因此基于地层水的含盐度和分布特征分析,研究结果对于寻找溶蚀次生孔隙发育带有重要的参考价值,即高盐度地层水分布带对应强溶蚀作用和高溶蚀次生孔隙带。
在相同浓度条件下,MgCl2体系中方解石的溶解度最大,NaCl体系中次之,KCl中最小,说明Mg2+的盐效应大于Na+和K+,能促进方解石的溶解。这暗示在碎屑岩中白云石交代方解石过程中(Mg2+增加)有助于方解石的溶解,而在石灰岩发生白云岩化过程也是Mg2+含量增加,同样可以促进方解石的溶解。这与闫志为等[13]的下软件模拟结论一致。
3.2 共同离子效应对方解石溶解度的影响
对于CaCl2溶液体系下,方解石基本没有溶解,质量反而有微量的增加,这是由于同离子效应导致方解石生长(沉淀)。方解石的溶解存在如下平衡:


对于Na2SO4溶液体系,随着浓度增大,方解石的溶解度快速降低(图4)。在1.0 mol/L溶解度达到最小值,之后随浓度增大略有增加,但不显著。研究结果与Li和Duan[16]的模拟结果趋势一致,即方解石在Na2SO4溶液中的溶解度小于纯水中的溶解度,硫酸根会抑制方解石的溶解。闫志为[12]在25 ℃下模拟结果认为Na2SO4溶液中方解石的溶解度会增大9倍多,与本次实验结果明显不同。由此看出,基于实验模拟结果分析更加可靠。相比氯化物(NaCl)溶液体系而言,方解石在硫酸盐(Na2SO4)溶液体系中的溶解度明显小很多,而且随浓度增加溶解度降低非常快,这说明硫酸根对方解石溶解的抑制作用强于氯离子。实验结果反映了Na2SO4水型不利于灰岩储层溶蚀次生孔隙的发育。
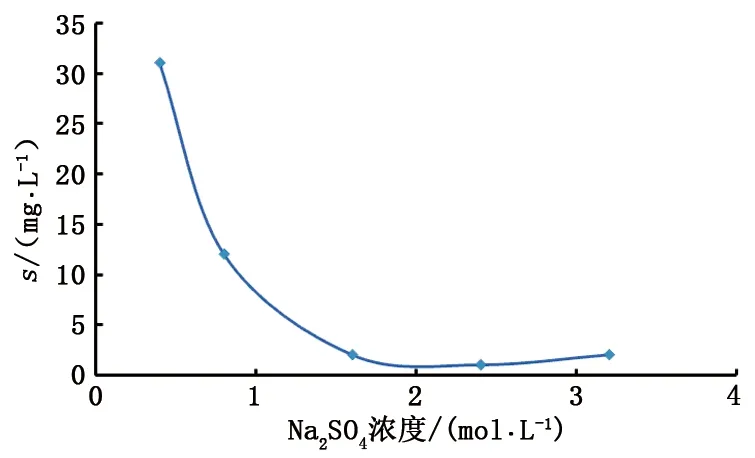
图4 方解石溶解度与Na2SO4浓度关系Fig.4 Solubility of calcite vs concentration of Na2SO4
4 实例分析
储层方解石的含量与孔隙度有密切的关系[17-21],表现为方解石含量越低,储层的孔隙度和渗透率越大。为进一步验证盐效应与方解石溶解之间的关系对储层溶蚀次生孔隙的影响,以东营凹陷北部陡坡带为例,通过对东营凹陷储层孔隙度、碳酸盐含量和矿化度垂向对比分析,探讨盐度(地层水矿化度)与储层物性的关系,结果见图5(据陈勇等,2015)。可以看出:在埋深位于2 400~3 200 m,地层水矿化度(盐度)明显升高,不少数据介于150~350 g/L,这与实验模拟结果的方解石溶解度最大值附近所对应的盐度范围基本一致,而在对应深度地层中碳酸盐含量有明显下降,储层孔隙度出现高值带,说明在此深度范围内溶蚀作用强度变大并产生大量次生孔隙,从而改善了地层的储集物性。这再次证明了盐效应对方解石溶解度有着重要的控制作用,而基于实验模拟结果,可以通过地层水矿化度分布特征来预测储层溶蚀次生孔隙发育带。值得注意的是,随着埋深加大,尽管地层水矿化度没有明显增大,但是碳酸盐含量增大,储层物性(孔隙度)迅速降低。这可能与温度和压力变化导致碳酸盐矿物(方解石)溶解度快速变化有关[17]。此外,方解石溶解度的研究对于油气田开发过程储层保护也有重要的意义,注水过程可能导致储层结垢而破坏有利通道[22],从而影响开发效果。因此,与油田开发有关的矿物溶解度研究也值得关注[1,22]。

图5 东营凹陷北部陡坡带储层物性、碳酸盐含量和矿化度垂向对比图Fig.5 Vertical comparison of physical properties of reservoirs, carbonate contents and TDS of the north steep slope bell in Dongying Sag
5 结 论
(1)盐效应能促进方解石的溶解,对于NaCl、KCl和MgCl2体系,随着盐度增加溶解度增大,50 ℃下方解石溶解度最大值对应的盐浓度质量分数都小于20%。实例分析证明溶解度最大值的盐度区间对应高孔隙发育带。
(2)在相同浓度条件下,MgCl2体系中方解石的溶解度最大,NaCl体系中次之,KCl中最小,说明Mg2+的盐效应大于Na+和K+,能促进方解石的溶解。
(3)共同离子效应抑制方解石的溶解,Ca2+浓度增大,不利于方解石溶解,反而有助于方解石沉淀(生长)。对于CaCl2水型而言,不利于地层中方解石的溶解,但有助于地层保持良好的封闭性,这有利于油气的保存。
(4)对于Na2SO4溶液体系,随着浓度增大方解石的溶解度快速降低。硫酸根对方解石溶解的抑制作用强于氯离子,表明Na2SO4水型可能不利于储层溶蚀次生孔隙的发育。
[1] 谢继容,孔金祥.砂岩次生孔隙形成机制[J].天然气勘探与开发,2000(1):52-55. XIE Jirong, KONG Jinxiang. Formation mechanism of secondary pores in sandstone[J]. Natural Gas Exploration and Development, 2000(1):52-55.
[2] 张萌.鄂尔多斯盆地上古生界碎屑岩次生孔隙形成机制的热力学计算和溶解实验模拟研究[D].成都:成都理工大学,2007. ZHANG Meng. For the characteristic of the dissolution of primary minerals related to clasticdiagenesis thermodynamics model and dissolution experiment modeling effort for secondary porosity forming mechanism of Upper-Palaeozoic, Erdos Basin[D]. Chengdu: Chengdu University of Technology, 2007.
[3] 钟大康,朱筱敏,周新源,等.次生孔隙形成期次与溶蚀机理:以塔中地区志留系沥青砂岩为例[J]. 天然气工业,2006,26(9):21-24. ZHONG Dakang, ZHU Xiaomin, ZHOU Xinyuan, et al. Phases of secondary pore generation and dissolution mechanism: taking silurian asphaltic sandstone in central Tarim Basin as an example[J]. Natural Gas Industry, 2006,26(9):21-24.
[4] CACIAGLI N C, MANNING C E. The solubility of calcite in water at 5-16 kar and 500-800 ℃[J]. Contributions to Mineralogy & Petrology, 2003,146(3):275-285.
[5] GLEDHILL D K, MORSE J W. Calcite solubility in Na-Ca-Mg-Cl brines[J]. Chemical Geology, 2006,133(3/4):249-256.
[6] 陈勇,王成军,孙祥飞,等. 碎屑岩储层矿物溶解度与溶蚀次生孔隙形成机理研究进展[J]. 矿物岩石地球化学通报,2015(4):830-836. CHEN Yong, WANG Chengjun, SUN Xiangfei, et al. Progress on mineral solubility and mechanism of dissolution secondary porosity foming in clastic reservoir[J]. Bulletin of Mineralogy, Petrology and Geochemistry,2015(4):830-836.
[7] NEWTON R C, MANNING C E. Experimental determination of calcite solubility in H2O-NaCl solutions at deep crust/upper mantle pressures and temperatures: implications for metasomatic processes in shear zones[J]. American Mineralogist, 2002,87(10):1401-1409..
[8] ANDERSSON A J, BATES N R, MACKENZIE F T. Dissolution of carbonate sediments under rising pCO2and ocean acidification: observations from Devils Hole, Bermuda[J]. Aquatic Geochemistry, 2007,13(3):786-791.
[9] 黄思静,黄可可,张雪花,等. 碳酸盐倒退溶解模式的化学热力学基础:与CO2有关的溶解介质[J]. 成都理工大学学报(自然科学版),2009,36(5):457-464. HUANG Sijing, HUANG Keke, ZHANG Xuehua, et al. Chemical thermodynamics foundation of retrograde solubility for carbonate: solution media related to CO2[J]. Journal of Chengdu University of Technology (Science and Technology Edition), 2009,36(5):457-464.
[10] COTO B, MARTOS C, PEA J L, et al. Effects in the solubility of CaCO3:experimental study and model description[J]. Fluid Phase Equilibria, 2012,324(26):1-7.
[11] 范明,胡凯,蒋小琼,等. 酸性流体对碳酸盐岩储层的改造作用[J]. 地球化学,2009,38(1):20-26. FAN Ming, HU Kai, JIANG Xiaoqiong, et al. Effect of acid fluid on carbonate reservoir reconstruction[J]. Geochimica, 2009,38(1):20-26.
[12] 闫志为. 硫酸根离子对方解石和白云石溶解度的影响[J]. 中国岩溶,2008,27(1):24-31. YAN Zhiwei. Influences of SO42-on the solubility of calcite and dolomite[J]. Carsologica Sinica, 2008,27(1):24-31.
[13] 闫志为,张志卫. 氯化物对方解石和白云石矿物溶解度的影响[J]. 水文地质工程地质,2009,36(1):113-118. YAN Zhiwei, ZHANG Zhiwei. The effect of chloride on the solubility of calcite and dolomite[J]. Hydrogeology and Engineering Geology, 2009,36(1):113-118.
[14] 刘再华,DREYBRODT W,韩军,等. CaCO3-CO2-H2O岩溶系统的平衡化学及其分析[J]. 中国岩溶,2005,24(1):1-14. LIU Zaihua, DREYBRODT W, HAN Jun, et al. Equilibrium chemistry of the CaCO3-CO2-H2O system and disscussions[J]. Carsologica Sinica, 2005,24(1):1-14.
[15] VAVOURAKI A I, PUTNIS C V, PUTNIS A, et al. Macro-to nanoscale study of the effect of aqueous sulphate on calcite growth[J]. Mineralogical Magazine, 2008,72(72):141-144.
[16] LI J, DUAN Z H. A thermodynamic model for the prediction of phase equilibriaand speciation in the H2O-CO2-NaCl-CaCO3-CaSO4system from 0 to 250 ℃, 1 to 1 000 bar with NaCl concentrations up to halite saturation[J]. Geochimica et Cosmochimica Acta,2011,75:4351-4376.
[17] 陈勇,王淼,王鑫涛,等. 东营凹陷沙四段地层水化学特征及其指示意义[J]. 中国石油大学学报(自然科学版),2015,39(4):42-52. CHEN Yong, WANG Miao, WANG Xintao, et al. Chemical characteristics and implications of formation water of the Es4Member in Dongying Sag[J]. Journal of China University of Petroleum(Edition of Natural Science), 2015,39(4):42-52.
[18] 季汉成,徐珍. 深部碎屑岩储层溶蚀作用实验模拟研究[J]. 地质学报,2007,81(2):212-219. JI Hancheng, XU Zhen. Experimental simulation for dissolution in clastic reservoirs of the deep zone[J].Acta Geologica Sinica, 2007,81(2):212-219.
[19] 韩慧萍. 塔里木盆地库车坳陷克拉2气田白垩系优质储层成岩作用的热力学模拟[D]. 北京:中国地质大学,2005. HAN Huiping. The thermodynamic simulation of diagenetic processes in Cretaceous high quality reservoir of the Kela 2 gas field in Kuqa Depression of Tarim Basin[D]. Beijing: China University of Geosciences, 2005.
[20] 肖林萍,黄思静. 方解石和白云石溶蚀实验热力学模型及地质意义[J]. 矿物岩石,2003,23(1):113-116. XIAO Linping, HUANG Sijing. Model of thermodynamics for dissolution of carbonater and its geological significances[J]. Journal of Mineral Petrol, 2003,23(1):113-116.
[21] 朱东亚,孟庆强,金之钧,等. 富CO2深部流体对碳酸盐岩的溶蚀-充填作用的热力学分析[J]. 地质科学,2012,47(1):187-201. ZHU Dongya, MENG Qingqiang, JIN Zhijun, et al. Thermodynamic analysis for carbonate dissolution-filling under influence of CO2-rich deep fluid[J]. Chinese Journal of Geology, 2012,47(1):187-201.
[22] 赵子刚,徐启,史连杰,等. 高温高压下碳酸钙的溶解度及朝阳沟注水油田低渗透储层结垢问题[J]. 油田化学,2003,20(1):4-6. ZHAO Zigang, XU Qi, SHI Lianjie, et al. Solubility of CaCO3in water at high temperatures and high pressures and scaling problems in water flooding low permeable reservoirs of Chaoyanggou in Daqing[J]. Oilfield Chemistry, 2003,20(1):4-6.
(编辑 刘为清)
Effect of salts and common ions on solubility of calcite and its geological implications
CHEN Yong1,2, WANG Miao1,2, LIU Qing3, ZHUO Qingong4, ZHANG Xuejun3, CHEN Xiaolan5
(1.School of Geosciences in China University of Petroleum, Qingdao 266580, China;2.LaboratoryforMarineMineralResources,QingdaoNationalLaboratoryforMarineScienceandTechnology,Qingdao266071,China;3.ExplorationandDevelopmentResearchInstituteofShengliOilfieldCompany,Dongying257015,China;4.PetroChinaExplorationandDevelopmentInstitute,Beijing100083,China;5.CollegeofEarthScienceandEngineering,ShandongUniversityofScienceandTechnology,Qingdao266590,China)
Growth and dissolution of minerals in petroleum reservoirs are controlled by the diagenesis fluids. The solubility characteristics of calcite in different salt and ions aqueous systems at stable temperature were investigated using experiments. The experimental results show that the solubility of calcite increases with the salinity rising (salinity<20%). However, it decreases under high salinity condition. And it is found that the fluids in reservoir contain salinity corresponding to the maximum solubility of calcite with high porosity. The solubility of calcite is the highest in MgCl2-H2O system, middle in NaCl-H2O system, lowest in KCl-H2O system at the same mole concentration of salt. This implies that the Mg2+has stronger salt effect on solubility of calcite than Na+and K+, which improves the dissolution of calcite. The Ca2+shows constraint on dissolving of calcite due to the common ion effect; however it may lead to growth of calcite, resulting in improving sealing ability of strata. The salt effect of Na2SO4is not remarkable, and the solubility of calcite decreases quickly with Na2SO4content increasing. The sulfate ion shows more constraint on dissolution of calcite than Cl-, which indicates that it is not suitable for forming of secondary porosity in reservoir containing Na2SO4.
calcite; solubility; growth; salt effect; common ion effect; reservoir property
2016-03-15
国家自然科学基金项目(41172111);国家科技重大专项(2016ZX05006-001);中央高校基本科研业务费专项(SD2013211151,16CX05005A)
陈勇(1976-),男,副教授,博士,硕士生导师,研究方向为储层水岩作用机制和油气成藏。E-mail:yongchenzy@upc.edu.cn。
1673-5005(2016)06-0033-07
10.3969/j.issn.1673-5005.2016.06.004
P 592
A
陈勇,王淼,刘庆,等.盐效应和共同离子效应对方解石溶解度的影响及其地质意义[J]. 中国石油大学学报(自然科学版),2016,40(6):33-39.
CHEN Yong, WANG Miao, LIU Qing, et al. Effect of salts and common ions on solubility of calcite and its geological implications[J]. Journal of China University of Petroleum (Edition of Natural Science), 2016,40(6):33-39.
