维生素A棕榈酸酯冻干脂质体的制备及稳定性
2017-01-16邱树虹王永军
邱树虹,王永军
维生素A棕榈酸酯冻干脂质体的制备及稳定性
邱树虹,王永军*
(沈阳药科大学药学院,辽宁沈阳,110016)
目的制备维生素A棕榈酸酯(VAP)冻干脂质体,并对其稳定性进行研究。方法用薄膜分散法制备维生素A棕榈酸酯脂质体,用正交设计法优化处方和制备工艺。以50 g·L-1海藻糖- 50 g·L-1蔗糖(质量比1∶1)为冻干保护剂进行冻干。采用HPLC法测定VAP脂质体中维生素A棕榈酸酯的含量及包封率。结果VAP脂质体冻干前平均粒径为(90.06±2.88) nm,zeta电位为-(5.08±0.18) mV,平均包封率为(90.06±1.73)%,冻干后复溶平均粒径为(83.40±0.78) nm,zeta电位为-(3.65±0.86) mV,平均包封率为(90.84±0.80)%。VAP冻干脂质体在4℃保存3 个月稳定。结论以最佳处方和工艺制备的VAP脂质体包封率高、重现性好。VAP冻干脂质体对光照和高温不稳定,应避光储存在4 ℃冰箱中。
药剂学;冻干脂质体;薄膜分散法;维生素A棕榈酸酯;稳定性
维生素A是最早被发现的维生素,能调节角膜上皮细胞增殖、分化和保存结膜杯状细胞,可促进视觉细胞内感光色素的形成,调试眼睛适应外界光线强弱的能力,以降低夜盲症和视力减退的发生,维持正常的视觉反应,并有助于对多种眼疾(如眼球干燥与结膜炎等)的治疗[1-3]。维生素A棕榈酸酯(vitamin A palmitate,VAP)是维生素A 的一种主要衍生物,对于维持正常的视功能及免疫系统具有重要作用[4]。VAP不溶于水,对热、光、空气和湿度敏感,稳定性极差,将VAP制备成脂质体可以增加它由UV辐射引起的氧化过程的稳定性,且易于与生物膜融合,促进药物吸收[5]。由于VAP脂质体为液体,储存过程中容易发生聚集、融合及药物泄露,且磷脂氧化、水解等问题使脂质体不稳定。制成冻干脂质体能够降低磷脂和药物的氧化速度,显著提高稳定性[6]。本文作者以薄膜分散法制备维生素A棕榈酸酯脂质体,采用冻干技术提高VAP脂质体的稳定性,并对其稳定性进行了研究。
1 仪器与材料
Adventurer电子分析天平AR1140(奥豪斯国际贸易有限公司),AG245电子分析天平(瑞士Mettler Toledo公司),RE-52A旋转蒸发仪(上海亚荣生化仪器厂),JY92-2D超声波细胞粉碎机(宁波新芝科器研究所),UV-1801紫外-分光光度计(北京瑞利分析仪器公司),H-600透射电镜JEM-1200EX、日立高效液相色谱仪(日本Hitachi公司),LDZ5-2低速自动平衡离心机(北京医用离心机厂),PHS-3C酸度计(上海雷磁仪器厂),FDE-1100冷冻干燥机(东京理化EYELA)。
维生素A棕榈酸酯(规格为1.70×106IU·g-1,美国sigma公司,批号 1411107,BR),大豆卵磷脂(纯度质量分数98.00%,规格100 g,上海太伟药业有限公司,批号 20140202),胆固醇(纯度质量分数99.6%,天津博迪华工有限公司,批号 20110712),滋养凝胶(规格为5 g,效价为5 000 IU,沈阳兴起药业有限公司,批号 140702),葡聚糖凝胶G-50(规格25 g,RegaL BiotechnoLogy Company),丁基羟基茴香醚(BHA,含量质量分数98.50%,美国Sigma公司,批号MKBM2264V),磷酸盐缓冲液(PBS,pH值7.40,0.50 mmol·L-1,参照《中华人民共和国药典》2010年版自行配制),甲醇(色谱纯,天津康科德科技有限公司),异丙醇(色谱纯,山东禹王实业有限公司化工分公司),其他试剂(分析纯,市售)。
2 方法与结果
2.1 维生素A棕榈酸酯冻干脂质体的制备
2.1.1 VAP脂质体的制备
称取处方量的大豆卵磷脂、胆固醇、维生素A棕榈酸酯、BHA和羟苯乙酯置于500 mL茄形瓶中,加入氯仿20 mL溶解。将茄形瓶置旋转蒸发仪上,35 ℃恒温水浴减压蒸馏除去有机溶剂,在内壁上形成均匀的类脂薄膜。加入45 ℃的0.50 mmol·L-1pH值7.00的PBS 10 mL轻摇,洗脱类脂膜,置旋转蒸发仪上,常压45 ℃恒温水化15 min,形成的脂质体为乳白色悬浮液,将所得的类脂质混悬液超声粉碎5 min,过0.45 µm滤膜整粒,即得。
2.1.2 VAP冻干脂质体的制备
以50 g·L-1海藻糖-50 g·L-1蔗糖(质量比1∶1)为冻干保护剂,将按“2.1.1”条制备的脂质体在氮气流下分装1 mL至西林瓶中。冷冻干燥,冻干程序为-80 ℃预冻12 h、-40 ℃ 3 h、-20 ℃15 h、30 ℃ 9 h,避光操作。复溶液为4.5 g·L-1氯化钠注射液。
2.2 VAP脂质体的含量测定
2.2.1 色谱条件
色谱柱:Phenomen C18柱(4.6 mm×150 mm,5 µm);检测波长:326 nm;柱温:40 ℃;流动相:甲醇-异丙醇(体积比95∶5);流速:1.0 mL·min-1;进样量:20 µL。在此色谱条件下,空白脂质体对测定无干扰,结果见图1。
2.2.2 线性关系考察
精密称取VAP对照品10 mg,置于10 mL量瓶中,加无水乙醇溶解并稀释至全量,摇匀,即得VAP对照储备液。分别精密吸取VAP对照储备液,制成50 µg·L-1和1.00、4.00、20.00、30.00、40.00和50.00 mg·L-1系列质量浓度的溶液。按“2.2.1”条色谱条件,分别进样20 µL。以VAP质量浓度()为横坐标,峰面积()为纵坐标,进行线性回归,得回归方程:=7.926 2×104- 8.604 9×103P,=0.999 9。结果表明,VAP质量浓度在50 µg·L-1~50.00 mg·L-1内与峰面积呈良好的线性关系。

1—Vitamin palmitate
2.2.3 精密度试验
精密吸取不同量的VAP对照储备液置于5 mL量瓶中,用无水乙醇定容,配制低(1.00 mg·L-1)、中(20.00 mg·L-1)、高(40.00 mg·L-1)3种质量浓度的VAP溶液,每种质量浓度平行制备6份,第1天测定日内精密度,连续进样3 d,测定日间精密度。结果显示,日内精密度低、中、高3 种质量浓度的RSD分别为0.45%、0.99%和1.02%(=6),日间精密度低、中、高3种质量浓度的RSD分别为0.95%、1.68%和1.19%(=18)。
2.2.4 回收率试验
按“2.1”条方法制备空白脂质体10 mL,精密吸取0.1 mL置于5 mL量瓶中,按处方药量的80%、100%和120%分别加入维生素A棕榈酸酯对照储备液80、100和120 μL,用无水乙醇定容,摇匀,每种质量浓度平行制备3份。过0.45 µm滤膜后,进行HPLC分析,进样量20 µL。根据峰面积计算测得药物含量,与加入药物含量比较,得回收率。低、中、高3种质量浓度的平均回收率分别为(101.18±1.11)%、(100.00±0.36)%和(101.27±0.14)%,RSD分别为0.14%、1.09%和0.36%。
2.3 脂质体包封率的测定
2.3.1 葡聚糖凝胶柱的制备
将葡聚糖凝胶颗粒(Sephadex G-50)浸泡在蒸馏水中,过夜,充分溶胀,装入底部垫有滤纸片的2.50 mL注射器中。待水分自然流下,将注射器置于离心机中,2 000 r·min-1离心3 min,使凝胶柱失水皱缩,凝胶部分高约2.30 cm,待用。
2.3.2 脂质体包封率的测定
采用微柱离心法测定VAP脂质体的包封率。总药物含量的测定:精密量取VAP脂质体0.10 mL置于5 mL量瓶中,加入无水乙醇破乳并稀释至全量,摇匀,过0.45 µm滤膜,采用HPLC法测定VAP含量。脂质体包封药物含量测定:精密量取VAP脂质体0.10 mL置于“2.3.1”条制备的葡聚糖凝胶柱上,2 000 r·min-1离心2 min;精密移取娃哈哈纯净水100 µL加至葡聚糖凝胶柱中,2 000 r·min-1离心3 min,重复3次。合并4次收集的洗脱液移至5 mL量瓶中,用无水乙醇定容,摇匀,过0.45 µm滤膜,待用。按“2.2”条方法测定药物含量。分别计算总药物含量(z)和脂质体包封药物的含量(b),按公式EE=b/z×100%计算脂质体的包封率。
2.4 脂质体粒径和zeta电位的测定
采用马尔文激光粒度分析仪分别对脂质体冻干前后样品溶液的粒径和zeta电位进行测定。
2.5 正交设计实验
2.5.1 影响因素及其水平的确定
以包封率为指标,对脂质体的制备进行单因素考察。分别考察药脂质量比、磷脂与胆固醇质量比、有机溶剂用量、成膜温度、水化温度、水化时间、水化介质(pH值7.4的PBS)浓度等因素对脂质体包封率的影响,结果见表1。由表1可知,药脂质量比、水化温度和水化介质的浓度对脂质体的包封率有较大影响。
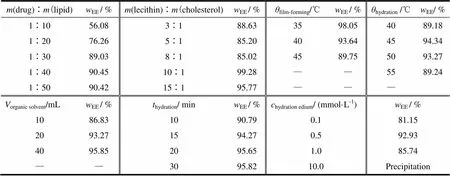
Table 1 The results of single factor experiments of affecting VAP liposome encapsulation efficiency
2.5.2 正交设计试验优化处方
根据查阅文献资料和单因素试验结果,以药物和磷脂质量比()、磷脂和胆固醇质量比()、水化温度()以及pH值7.00 PBS水化介质的浓度()为影响因素,每个因素设定3个水平安排正交试验,正交表见表2。

Table 2 Orthogonal test factors and levelsof influencing VAP liposome envelopment rate
2.5.3 正交设计试验结果
由表3可知,4个因素中对脂质体形成影响顺序为>>>,最佳处方和工艺条件为2322,即药脂质量比为1∶30,磷脂与胆固醇质量比为15∶1,水化温度为45 ℃,水化介质浓度为0.5 mmol·L-1。在脂质体放置过程中,磷脂与胆固醇质量比15∶1时不稳定,10 d即析出沉淀;而质量比10∶1时,25 d析出少量絮状沉淀。所以最终选择磷脂胆固醇质量比10∶1。

Table 3 Orthogonal design experiments and results of influencing VAP liposome encapsulation efficiency
Note:—Range
2.6 冻干脂质体复溶前后的稳定性考察
2.6.1 影响因素试验
将冻干脂质体和复溶脂质体分别于40 ℃、60 ℃、光照、室温[(15±2) ℃]和4 ℃放置,于第0、1、3、5、10天取样,测定粒径、电位、含量和包封率。
2.6.2 留样试验
另将3批冻干脂质体和复溶脂质体分别在室温和4 ℃条件下放样,于第30、60、180天取样,测定粒径、电位、含量和包封率。
2.7 VAP脂质体的质量评价
2.7.1 脂质体形态观察
取1滴冻干前VAP脂质体,滴加到专用铜网上,用质量分数为1%的磷钨酸染色,最后样品在100 kV下以透射电镜观察并照相,结果见图2。

Fig. 2 TEM of VAP liposomes
2.7.2 脂质体粒径和zeta电位的测定
采用马尔文激光粒度分析仪分别测定脂质体冻干前后的粒径和zeta电位,HPLC法测定冻干前后的含量和包封率,结果见表4。

Table 4 Particle size, zeta-potential, drug content and encapsulation efficiency of VAP liposomes before and after freeze-drying (n = 3)
2.8 稳定性试验
2.8.1 冻干脂质体复溶前后的影响因素试验结果
冻干脂质体复溶前后的影响因素试验结果见表5。结果表明:在光照条件下放置1 d,冻干脂质体复溶前后均不稳定;在60 ℃条件下放置5 d,冻干脂质体复溶前后均不稳定,冻干脂质体皱缩且复溶后略显黏稠,复溶液为黏稠溶液;在40 ℃条件下,放置10 d冻干脂质体复溶前后均不稳定;室温条件下,复溶脂质体放置10 d,含量下降约3.00%,冻干脂质体放置10 d,含量和包封率均无明显变化。
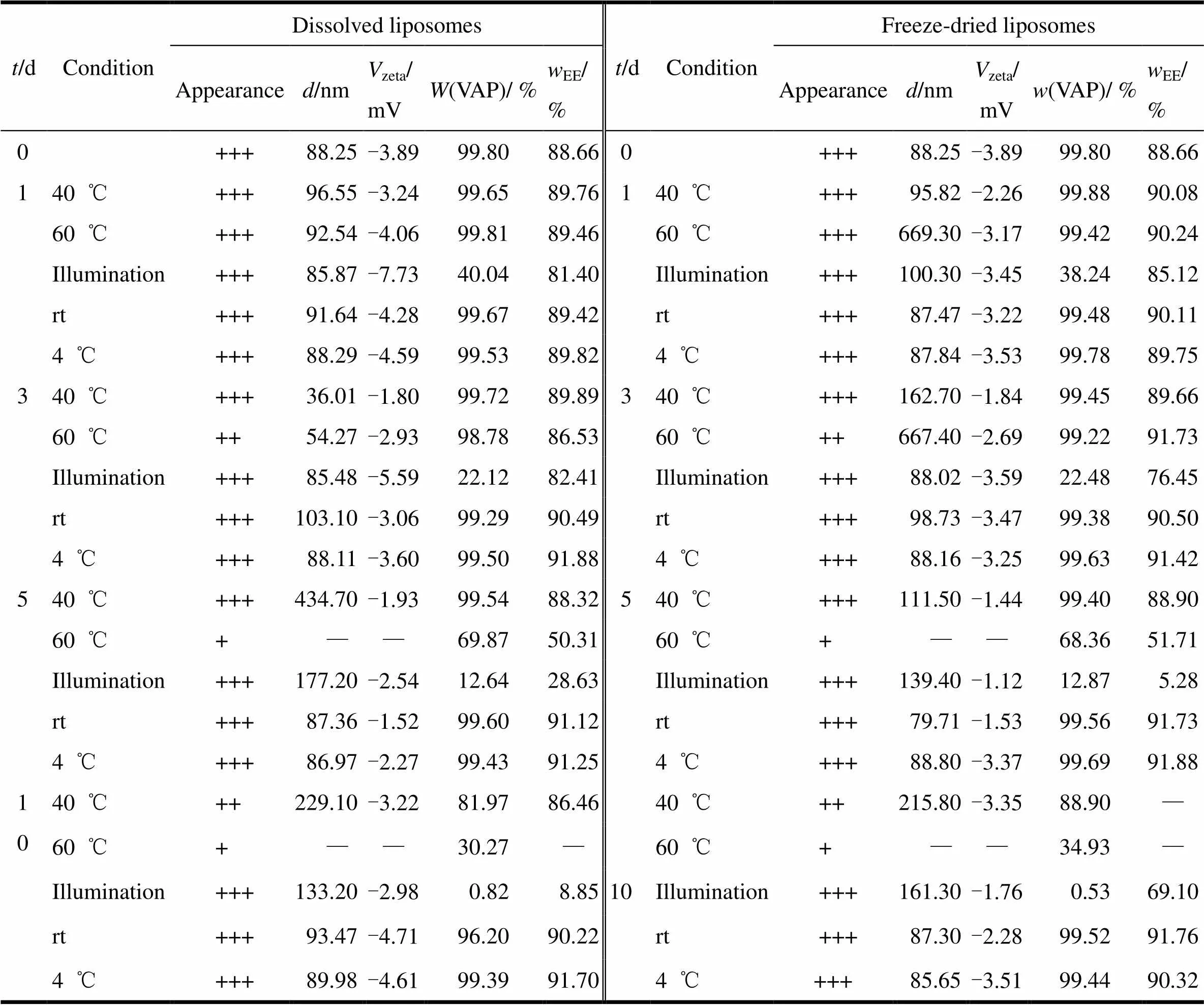
Table 5 Stability results of freeze-dried VAP liposome before and after redissolving
Notes: rt—Room temperature; Concrete evaluation index for freeze-dried liposomes: +++—White, smooth surface, without shrinkage, no collapse, easy to dissolve with light waving, dissolution solution as a semi-transparent mixed suspension; ++—A little shrinkage, light yellow suspension, dissolved difficult, needs strong vibration wave, dissolution solution as a semi-transparent mixed suspension; +—Shrinking and collapse seriously, become a deep yellow suspention, can not completely dissolved even with strong vibration wave, was viscous liquid. Liposomes solution after dissolution: +++—Precipitate out, as the semi-transparent mixed suspension; ++—Precipitate a small amount of floc; +—A large amount of precipitation, as viscous solution. ——The solution was so sticky that without determination
2.8.2 冻干脂质体复溶前后的留样试验结果
冻干脂质体复溶前后的留样试验结果见表6。结果表明:室温[(15±2)℃]条件下放置1个月,复溶液含量下降约10%,冻干脂质体含量下降约4%,包封率均无明显变化;4 ℃条件下,复溶后溶液放置1个月含量下降约5%,包封率无明显变化,冻干脂质体放置3个月,含量和包封率均无明显变化,依然稳定,继续留样观察。

Table 6 The properties of freeze-dried VAP liposome before and after redissolving after stability test at room temperature
Notes: Concrete evaluation index for freeze-dried liposomes: +++—White, smooth surface, without shrinkage, no collapse, easy to dissolve with light waving, dissolution solution as a semi-transparent mixed suspension; ++—A little shrinkage, light yellow suspention, dissolved difficult, needs strong vibration wave, dissolution solution as a semi-transparent mixed suspension; +—Shrinking and collapse seriously, become a deep yellow suspention, can not completely dissolved even with strong vibration wave, was viscous liquid. Liposomes solution after dissolution: +++—After long time placement, no precipitate out, as the semi-transparent mixed suspension; ++—After long time placement, precipitate a small amount of floc; +—After long time placement, precipitated a large amount of precipitation. ——The solution was so sticky that without determination
3 讨论
a. 维生素 A 棕榈酸酯结构中含有较多的不饱和双键,易氧化,稳定性较差。在脂质体的制备过程中,以磷脂作为成膜材料,本身存在磷脂氧化降解的问题,从而使脂质体在储存过程中不稳定。VAP原料药本身对光、热、氧不稳定,增加了制备过程中的难度,因此在脂质体制备过程中,应避光、充N2并加入适当抗氧剂和抑菌剂,提高VAP脂质体的稳定性。
b. VAP脂质体水溶液在4 ℃条件下能稳定1个月,之后会有絮状沉淀析出,不稳定。采用冻干技术提高了VAP脂质体的稳定性,冻干脂质体复溶前后测得各项指标均无明显变化。通过影响因素试验可看出冻干脂质体对光和热敏感;留样试验表明,冻干脂质体在室温条件下放置1个月不稳定,含量下降,在4 ℃冰箱中避光储存3个月依然稳定。
[1] 朱志伟. 最早被发现的维生素—维生素A[J]. 大学化学, 2010, 4: 54-56.
[2] 俞安, 尹红, 陈志荣, 等. 维生素A稳定性影响因素研究进展[J]. 中国食品学报, 2013, 13(1): 124-131.
[3] SINGH A K, DAS J.Liposome encapsulated vitamin A compounds exhibit greater stability and diminished toxicity[J]. Biophys Chem, 1998, 73 (1/2): 155-162.
[4] CARLOTTI M E, ROSSATTO V, GALLARATE M. Vitamin A and vitamin A palmitate stability over time and under UVA and UVB radiation[J]. Int J Pharm , 2002, 240( 1/ 2): 85-94.
[5] ARSIC I, VULETA G. Influence of liposomes on the stability of vitamin a incorporated in polyacrylate hydrogel[J]. Int J Cosmetic Sci, 1999, 21(4): 219–225.
[6] 王健, 李明轩. 冷冻干燥对提高脂质体稳定性的研究概况[J]. 中国医药工业杂志, 2005, 36(9): 576-580.
(本篇责任编辑:赵桂芝)
Preparation of vitamin A palmitate (VAP) freeze-dried liposomes and study of its stability
QIU Shuhong, WANG Yongjun*
(,,110016,)
ObjectiveTo prepare vitamin A palmitate (VAP) freeze-dried liposomes and study its stability. Methods The thin film dispersion method was used to prepare VAP liposomes and the orthogonal design method was employed to optimize the prescription and preparation technology. 50g·L-1trehalose and 50g·L-1sucrose (1∶1) was used as protective agent of freeze-drying. High performance liquid chromatography (HPLC) method was employed to evaluate the content and coating rate of vitamin A palmitate in VAP liposomes. Results Prior to lyophilization, average particle size was (90.06±2.88) nm, zeta potential was –(5.08±0.18) mV, average coating rate at (90.06±1.73)%, after lyophilization, the average particle size was (83.40±0.78) nm, zeta potential was –(3.65±0.86) mV, average coating rate was (90.84±0.80)% of the dissolving liposomes. VAP freeze-dried liposomes was stable at 4 ℃ for 3 months. Conclusion The results showed that encapsulation efficiency of VAP liposomes is high and has a good reproducibility, which was prepared by the optimized formulation and technology. VAP freeze-dried liposome is not stable when exposure to light or at high temperature. It stores at 4oC in the fridge.
pharmaceutics; freeze-dried liposomes; film dispersion method; vitamin A palmitate; stability
(2016)02–0043–10
10.14146/j.cnki.cjp.2016.02.002
R 94
A
2015-05-11
邱树虹(1988-), 女(汉族), 河北衡水人, 硕士研究生,E-mail qiushuhong.1988@163.com;
王永军(1977-), 男(汉族), 山东荣成人, 副教授, 博士, 硕士生导师, 主要从事新型抗癌药物纳米给药系统及药物制剂新剂型新技术等的研究, Tel. 024-23986325, E-mail i_maple@163.com。
