加兰他敏合成途径的研究进展
2017-01-13周日宝刘畅宇彭美晨王朝晖刘湘丹
周日宝,刘畅宇,彭美晨,王朝晖,刘湘丹*
(湖南中医药大学药学院,湖南长沙410208)
加兰他敏合成途径的研究进展
周日宝,刘畅宇,彭美晨,王朝晖,刘湘丹*
(湖南中医药大学药学院,湖南长沙410208)
加兰他敏是一种广泛用于治疗阿尔茨海默氏症等疾病的药物,但研究发现,植物中加兰他敏含量极少,故科研人员一直致力于加兰他敏的合成研究。迄今为止,研究工作者已提出多种加兰他敏化学合成策略,但因其化学合成方法存在产率低、成本高、步骤复杂等诸多缺陷,不利于投入实际生产,探索其生物合成途径是目前最有效替代办法。本文综述了近年来加兰他敏合成的相关研究,且着重介绍了其生物合成途径及其相关酶研究进展,并对其后续研究进行展望。
加兰他敏;生物合成途径;关键酶;基因调控;石蒜
加兰他敏(galanthamine,C17H21NO3),即雪花莲胺碱(lycoremine),又名强肌宁、尼瓦林[1],具有选择性和可逆性调节烟碱型乙酰胆碱受体及抑制乙酰胆碱酯酶(acetylcholinesterase,AchE)的双重作用。加兰他敏易于通过血脑屏障进入脑组织,对中枢神经作用较强[2-3],主要用于治疗记忆和认知功能方面疾病,对轻度或中度阿尔茨海默氏症(Alzheimer’s disease,AD)有很好的疗效,对早期至中期的AD临床治愈性达50~60%,与其他几种治疗AD的乙酰胆碱酯酶抑制剂相比,具有治疗范围广、毒副作用小、耐受性好等优点[4-5]。自1952年苏联首次从沃氏雪花莲(Galanthus woronawii Losink)的鳞茎中分离出来以后,加兰他敏一直作为药用价值较高的有效成分被广泛研究,1996年,其首次作为AchE抑制剂类药物于奥地利上市,后陆续作为治疗不同程度AD的药物获欧盟批准,并于2001年获美国FDA许可治疗AD。在目前全球老年人口增多,AD患者人数呈成倍增长的趋势下,加兰他敏作为一种疗效好、不良反应轻微、优势明显的中枢胆碱酯酶抑制剂[6-8],越发受到重视,并渐渐成为治疗AD的首选药物之一[4-8]。其次,加兰他敏还可用于治疗小儿麻痹后遗症、重症肌无力、闭角形青光眼、腹膜炎和术后肠肌麻痹等症,并且对肿瘤坏死因子的释放有抑制作用[9-11]。
目前,加兰他敏主要从石蒜科植物中提取,属于石蒜科植物的次级代谢产物,但因长期过度采挖,致使石蒜类野生资源濒临枯竭,且直接从植物中提取加兰他敏的得率极小。在如今人口老龄化程度日益严重的情况下,仅凭扩大石蒜科植物的种植面积、发展其快速繁殖技术等方法来获取加兰他敏已难以满足市场需求[9],故,开展对加兰他敏的合成研究很有意义。本文就当前加兰他敏的化学合成和生物合成研究现状进行综述,并对其今后发展做出展望。
1 加兰他敏的化学合成途径
自发现加兰他敏以来,国内外已对加兰他敏的化学合成开展了大量研究。1962年,Barton等[12]首次使用氧化偶联方法全合成加兰他敏;1969~1973年间,Kametani[13-15]研究小组一直致力于探索加兰他敏的合成,并提出三条不同的氧化偶合路线成功合成加兰他敏,但收率均不高,仅0.94~2.5%,或者直接通过去甲基加兰他敏半合成加兰他敏,尽管收率提高,但原料去甲基加兰他敏在自然界存在量极少;1988年始,Jerzy小组[16-17]以酪胺和异香草醛作为原料,经过缩合、还原、甲酰化、溴化、氧化和还原等反应得到加兰他敏,并于后续研究中首次提出以三仲丁基硼氢化锂(L.Selectride)作为还原剂立体全合成加兰他敏,但此途径具成本高、副产物多且需利用层析柱分离的缺陷;Kita[18]在此基础上更进一步对合成途径做出了改善,改用二(三氟乙酸)碘苯(PIFA)为氧化剂合成加兰他敏,并取得较好的结果。2001年,Guillou研究小组[19]提出利用分子内Heck反应全合成加兰他敏。2004年,Strahil Berkova等[20]研究发现那维定(narwedine)是加兰他敏合成的关键中间体,其对人的皮肤有严重刺激[4,21]。2006~2007年,刘涛等[22]进一步优化了加兰他敏的合成条件,利用酪胺和异香草醛经过五步反应成功合成外消旋加兰他敏;此外,该研究小组[23]还采用植物中提取加兰他敏过程中的副产品力可拉敏为原料,利用镧镍稀土合金催化,使其半合成加兰他敏,与全合成相比,此路线成本低、路线短,大大地推进了加兰他敏的工业化进程。且利用中间体对加兰他敏进行半合成制备,更有助于发展绿色产业。同时,张辅民[24]对加兰他敏的合成进行了新探索,用3-羟基-4-甲氧基苄醇为原料,发展了一条新的仿生合成路线,避免了中间体那维定对皮肤等的严重刺激。日本的Ishikawa[25]和美国的Magnus等[26]也先后发现了两条新途径,前者利用1-(2-苄氧基-3-甲氧基苯基)丙酮,应用双Michael-Clmsen串联反应合成关键中间体,巧妙利用Michael加成及逆Michael加成,从而得到消旋加兰他敏。后者先醚化取代酚,再3,3-迁移构建加兰他敏的B环得中间体,最后进行简单的亚胺缩合-还原反应构建D环,收率可达63%。近年,徐萍[27]提出了一种新思路,选用价格便宜的藜芦醛为起始原料,以硝基为占位基团,若此方案成功,将大大缩减合成成本。
综合分析发现,尽管国内外已有众多关于加兰他敏化学合成的报道,但其中大部分方法都存在不足:起始原料难以获得、关键中间体那维定对人的皮肤有严重刺激、加兰他敏产率低、合成成本高、步骤复杂等,致使目前加兰他敏的化学合成仅适用于实验室,无法投入工业生产。
2 加兰他敏的生物合成途径
2.1 加兰他敏生物合成途径的预测相关研究
目前,国内外关于加兰他敏的生物合成途径报道尚少,大多是以石蒜科植物为材料,对加兰他敏生物合成途径做出的推测。
1971年,Jeffs[28]提出了石蒜中加兰他敏生物合成途径的一种推测:因石蒜属生物碱结构与松叶菊碱相似,根据非洲番杏Sceletium strictum中松叶菊碱的生物合成途径,Jeffs推测加兰他敏有平行的生物合成途径,并得出其碳骨架可能由酪氨酸和苯丙氨酸构建。
1998年,Eichhorn[29]等以夏雪片莲(Leucojum amaestivum)为材料,通过放射性同位素标记法,确认加兰他敏直接由去甲基加兰他敏生成,并推断4'-O-甲基降孤挺花啶是石蒜属生物碱(如加兰他敏、文殊兰胺、石蒜碱等)的通用前体,推测加兰他敏的生物合成途径可能有五个步骤,儿茶酚氧位甲基转移酶(catechol-O-methyltransferase,COMT)先将降孤挺花啶(norbelladine)催化成4'-氧-甲基降孤挺花啶,再发生一系列反应得到加兰他敏。其中COMT的表达与丰度可能对植物中加兰他敏含量产生极大影响[30]。但因合成加兰他敏的直接前体去甲孤挺花啶难以得到,而加兰他敏属于异喹啉类生物碱,按照生物合成途径划分,是属于苯丙氨酸和酪氨酸系生物碱;Dewick等[31]补充推测降孤挺花啶是由来源于酪氨酸的酪胺和来源于苯丙氨酸的3,4-二羟基苯甲醛(原儿茶醛)合成;因此,3,4-二羟基苯甲醛和酪胺可看作是加兰他敏合成的较近前体物质[32]。故,推测植物体内加兰他敏生物合成途径主要分为六个步骤,即:原儿茶醛+酪胺→降孤挺花啶4-氧-甲基降孤挺花啶→N-去甲那维定→N-去甲加兰他敏→加兰他敏↔那维定,如图1所示。
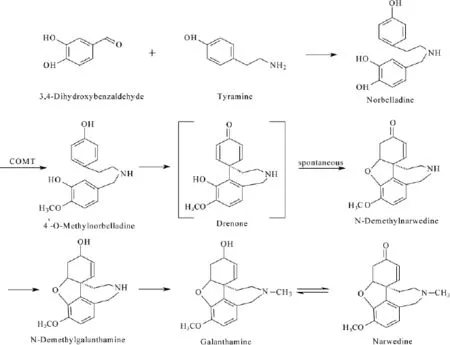
图1 加兰他敏可能生物合成途径
2014年,MB Kilgore研究小组[33]对加兰他敏生物合成途径取得了重大突破,其成功组装了黄水仙(Narcissus pseudonarcissus L.)转录组,并对转录组中氧-甲基转移酶的基因序列进行了识别并表达,分离纯化得到一个蛋白酶NpN4OMT,并证实其在加兰他敏生物合成中过程中,具催化降孤挺花啶产生4'-氧-甲基降孤挺花啶的作用;其后,该研究小组通过比对黄水仙、雪花莲、大雪片莲等转录组,发现了对位C-C苯酚耦合细胞色素P450-CYP96T1[34],具催化4'-氧-甲基降孤挺花啶产生N-去甲那维定的作用;2015年12月,Kutchan,Toni M.等[35]对其申请国家专利,公开试验中石蒜科生物碱(含加兰他敏)生物合成途径中的关键酶鉴定及关于加兰他敏等石蒜碱转基因生物工程等有关发现,并且对涉及于加兰他敏生物合成途径中的降孤挺花啶4'-氧-甲基转移酶、CYP96T1-3、以及降孤挺花啶合酶/还原酶进行编码。石蒜科主要生物碱合成可能途径如图2所示。
对于加兰他敏的生物合成,除上述途径,目前还有另一条可能途径:即利用莽草酸途径产生苯丙氨酸,通过苯丙烷代谢等得到原儿茶醛等中间产物,最后得到加兰他敏等生物碱,其中苯丙氨酸解氨酶(phenylalanine ammonialyas,PAL)是苯丙氨酸代谢途径中的关键酶和限速酶[9,36],但目前对于此途径的研究尚少。
2.2 生物合成途径相关酶的克隆及相关研究
2003年,谢峻等[37]对石蒜属次生代谢产物加兰他敏的生物合成提出了新思路,即通过基因改造,以构建转基因植物的方法来解决加兰他敏的来源。陈斌等[36]于2008年以忽地笑嫩叶为原料,采用RACE技术成功克隆了忽地笑中生物碱上游关键酶PAL基因核心片段和3'端片段,为忽地笑中PAL基因的全长基因克隆奠定了基础。梁丽建等[30]采用同源克隆与RACE相结合的方法,首次从石蒜叶片中克隆到可能与加兰他敏生物合成相关的COMT基因(COMT是一种S-腺苷-L-甲硫胺酸依赖的甲基转移酶,目前在烟草、玉米、唐松草和粟等多种植物中被克隆[38]。),并命名为LrCOMT,为加兰他敏基因调控技术提供研究基础。因研究者发现,石蒜类植物不同部位加兰他敏含量差异明显[39-41],推测其可能为不同部位基因存在差异,唐金凤等[9,42]借助mRNA差异显示技术(DD-PCR),对忽地笑中加兰他敏含量最高的花蕊及含量最低的花葶进行差异基因筛选并成功克隆其差异片段,确认了2个与忽地笑加兰他敏合成相关和1个可能与加兰他敏运输代谢调控有关的条带;桂柳姿等[43]通过RACE技术成功克隆出忽地笑加兰他敏合成途径中的COMT酶基因(La-COMT),并通过与烟草、唐松草、玉米和罂粟的COMT基因进行同源性比对,确认该序列是COMT序列,与梁丽建等[30]克隆的石蒜COMT(LrCOMT)基因编码相比,基因编码的氨基酸数目一致,但氨基酸序列有所不同。2015年,伍美慧[1]对上述桂柳姿等[43]获得的COMT基因片段成功构建pET-COMT重组质粒,并于大肠杆菌中高效表达出预期蛋白条带,为进一步研究加兰他敏生物合成代谢途径中关键酶提供基础。与此同时,别庆玲等[44]克隆得到一个新的忽地笑氧-甲基转移酶(OMT)基因(LaOMT),其在忽地笑鳞茎、根、叶和花中均有表达,但与桂柳姿等[32]得到的忽地笑COMT基因(LaCOMT)在碱基数目和序列上均存在一定差异,目前,LaOMT基因是否与忽地笑加兰他敏的合成相关尚有待证实。
3 其他生物技术生产加兰他敏的研究
除上述利用基因工程方法合成加兰他敏外,国内外亦有其他生物技术生产加兰他敏的研究。2008年,彭菲实验小组[45]发现忽地笑的不定根培养品中有加兰他敏的存在,推测离体培养忽地笑的不定根,可能成为合成加兰他敏的一条新途径。赵志敏等[32,46]以忽地笑鳞茎为材料,通过内生菌分离发酵的方法,从中检测出1株鉴定为半知菌纲青霉属的真菌能够产生加兰他敏,推测忽地笑内生真菌有望成为生产加兰他敏的新资源。此外,研究发现,在忽地笑培养过程中,添加酪胺等苯丙氨酸前体物对加兰他敏的合成起促进作用,而水杨酸、络氨酸等则不利于加兰他敏的积累,另外,植物激素对加兰他敏的积累也存在一定影响,有研究成果表明:高浓度的6-苄氨基腺嘌呤(6-BA)促进加兰他敏的合成,2,4-二氯苯氧乙酸(2,4-D)和浓度高于0.5 mg/L的1-萘乙酸(NAA)、吲哚丁酸(IBA)抑制加兰他敏的合成[47-49],这些研究也为加兰他敏合成代谢途径可能是通过苯丙烷代谢途径完成的提供佐证。
4 结论与展望
自发现加兰他敏对AD等中枢疾病的优良药用价值后,加兰他敏的提取和合成一直备受关注。目前生产加兰他敏的方法主要为化学合成法和植物提取法。前者的成本与从天然植物中直接提取相比相差无几甚至略高,而后者也因为过程繁琐,劳动强度大且产量极低,皆不利于大规模生产。为从根本上解决加兰他敏供不应求的现状,研究者需要另辟蹊径,运用现代生物技术,探索加兰他敏的生物合成途径,通过基因工程等手段,以获得加兰他敏高表达的植株。因石蒜科植物是提取加兰他敏的主要来源,探索石蒜科植物中加兰他敏的生物合成途径已成为研究热点,前景非常广阔。
目前,关于加兰他敏的生物合成途径仍不完善,需进一步对其进行研究验证。其中关键酶COMT的成功克隆,无疑为加兰他敏生物合成工业化生产带来了新希望。但植物的次生代谢是在多种酶的共同作用下完成的,受多因素影响,加兰他敏生物合成途径中尚有许多相关酶未得到深入研究。
随着加兰他敏生物合成途径研究的深入,研究者们需要选择合适的材料和方法来进一步对加兰他敏合成途径中的前体进行验证,找出途径中其他相关酶并探究酶之间的协同性,从而构建加兰他敏高表达的转基因植物模型。与其他石蒜科植物相比,忽地笑具加兰他敏含量相对较高、分布地域较广、便于采集等优势,后续研究中可选择忽地笑(黄花石蒜Lycoris aurea(L'Her.)Herb.)为研究材料,通过RACE和PCR等克隆技术,得到加兰他敏合成途径中相关酶基因,并进一步深入探索其生物合成途径及潜在酶,从基因水平上进行调控改造,达到其高表达目的,最终经过细胞培养、生物转化、发根培养等得到目的转基因植物。若设想实现,加兰他敏的大规模工业生产将会成为现实,经济效益也将十分可观。
[1]伍美慧.忽地笑加兰他敏生物合成代谢途径中关键酶基因克隆及表达[D].长沙:湖南中医药大学,2015.
[2]钱南萍.HPLC法测定氢溴酸加兰他敏分散片的含量[J].中国药师, 2003,6(7):430-431.
[3]孙秀琴,张凤莲.加兰他敏治疗阿尔茨海默病的研究[J].河南医药信息,2003,24(4):63.
[4]王晓燕.忽地笑植物中加兰他敏生物碱的提取和定位研究[D].南京:南京林业大学,2012.
[5]王晓燕,黄敏仁,韩正敏.石蒜属植物中加兰他敏的分离提取及其应用[J].南京林业大学学报(自然科学版),2004,28(4):79-83.
[6]唐君波,彭六保,崔巍,等.加兰他敏市场前景浅析[J].中国药房, 2006,17(22):1690-1692.
[7]Howes MJ,Houghton PJ.Plants used in Chinese and Indian traditional medicine for improvement of memory and cognitive function[J].Pharmacology,Biochemistry,and Behavior,2003,75 (3):513-527.
[8]马振英,赵文丽.氢溴酸加兰他敏获得美国批准[J].国外医学(药学分册),2001,28(6):378.
[9]唐金凤.黄花石蒜花蕊与花葶差异片段的克隆及其生物信息学分析[D].长沙:湖南中医药大学,2012.
[10]邓传良,周坚.石蒜属植物生物碱研究概况[J].中国野生植物资源,2004,23(6):13-14.
[11]LIU ZH,MA YF,WU JS,et al.Effect of cholinesterase inhibitor galanthamine on circulating tumor necrosis factor alpha in rats with lipopolysaccharide-induced peritonitis[J].Chinese Medical Journal,2010,123(13):1727-1730.
[12]Barton DHR,Kirby GW.Phenol Oxidation and Biosynthesis. Part V.The Synthesis of Galanthamine[J].Journal of the Chemical Society,1962,3(1):211-239.
[13]Kametani T,Yamaki K,Yagi H,et al.Studies on the syntheses of heterocyclic compounds.Part CCCXV.Modified total synthesis of (±)-galanthamine through phenol oxidation[J].Journal of the Chemical Society Perkin Transactions,1969,15(15):2602-2605.
[14]Kametani T,Shishido K,Hayashi E,et al.Syntheses of heterocyclic compounds CCCXCVI.Alternative total synthesis of(±) -galanthamine[J].Journal of Organic Chemistry,1971,36(9): 1295-1297.
[15]Kametani T,Terui T,Fukumoto K.Synthesis of 1-(3-and 4-chlorobenzyl)-1,2,3,4-tetrahydro-6,7-dimethoxy-isoquinoline andcyclized compounds by benzyne reaction(studies on the synthesesofheterocycliccompounds.CCXLI)[J].Yakugaku Zasshi,1968,88(7):915-918.
[16]Szewczyk J,Lewin AH,Carroll FI.An improved synthesis of galanthamine[J].Journal of Heterocyclic Chemistry,1988,25 (6):1809-1811.
[17]Szewczyk J,Wilson JW,Lewin AH,et al.Facile synthesis of (±)-,(+)-,and(-)-galanthamine[J].Journal of Heterocyclic Chemistry,1995,32(32):195-199.
[18]Kita Y,Arisawa M,Gyoten M,et al.Oxidative Intramolecular Phenolic Coupling Reaction Induced by a Hypervalent Iodine (III)Reagent:Leading to Galanthamine-Type Amaryllidaceae Al kaloids[J].Journal of Organic Chemistry,1998,63(19):6625-6633.
[19]Guillou C,Beunard JL,Gras E,et al.An Efficient Total Synthesis of(±)-Galanthamine[J].Angewandte Chemie,2001,113 (24):4881-4882.
[20]Berkov S,Sidjimova B,Evstatieva L,et al.Intraspecific variability in the alkaloid metabolism of Galanthus elwesii[J].Phytochemistry,2004,65(5):579-586.
[21]刘涛.加兰他敏合成工艺的研究[D].杭州:浙江大学,2006.
[22]刘涛,钱超,陈新志.外消旋加兰他敏全合成研究[J].浙江大学学报(自然科学版),2006,40(3):520-523.
[23]刘涛,陈新志,杜荣斌,等.加兰他敏的半合成研究[J].化学学报, 2007,65(8):711-714.
[24]张辅民.石蒜科生物碱crinamine、haemanthidine、pretazettine和galan thamine的全合成[D].兰州:兰州大学,2006.
[25]Ishikawa T,Kudo K,Kuroyabu K,et al.ChemInform Abstract: Domino Double Michael-Claisen Cyclizations:A Powerful General Tool for Introducing Quaternary Stereocenters at C(4)of Cyclohexane-1,3-diones and Total Synthesis of Diverse Families of Sterically Congested Alkaloids[J].Journal of Organic Chemistry,2008,73(19):7498-7508.
[26]Magnus P,Sane N,Fauber BP,et al.Concise Syntheses of(-) -Galanthamine and(+/-)-Codeine via intramolecular alkylation of a phenol derivative[J].Journal of the American Chemical Society,2009,131(44):16045-16047.
[27]徐萍.重酒石酸利斯的明和加兰他敏的合成研究[D].济南:山东师范大学,2011.
[28]JeffsPW,CampbellHF,FarrierDS,etal.Biosynthesis of mesembrine and related alkaloids,mode of incorporation of phenylalanine,and examination of norbelladines as precursors[J]. Journal of the Chemical Society D:Chemical Communications, 1971,5(5):228-230.
[29]Eichhorn J,Takada T,Kita Y,et al.Biosynthesis of the amaryllidaceae alkaloid galanthamine[J].Phytochemistry,1998,49 (4):1037-1047.
[30]梁丽建,江玉梅,夏冰,等.石蒜儿茶酚氧位甲基转移酶基因克隆与原核表达[J].西北植物学报,2012,32(1):23-28.
[31]Dewick PM.Medicinal Natural Products:A Biosynthetic Approach,Second Edition[M].USA:John Wiley&Sons Ltd,2001: 1-487.
[32]赵志敏.忽地笑离体培养与内生菌分离产生加兰他敏的研究[D].长沙:湖南中医药大学,2010.
[33]Kilgore MB,Augustin MM,Starks CM,et al.Cloning and Characterization of a Norbelladine 4'-O-Methyltransferase Involved in the Biosynthesis of the Alzheimer's Drug Galanthamine in Narcissus sp.aff.pseudonarcissus[J].Plos One, 2014,9(5):3065-3074.
[34]Kilgore MB,Augustin MM,May GD,et al.CYP96T1 of Narcissussp.aff.Pseudonarcissus Catalyzes Formation of the Para-Para'C-C Phenol Couple in the Amaryllidaceae Alkaloids[J]. Frontiers in Plant Science,2016,7:225.
[35]Kutchan TM,Kilgore M.Constructs and methods for biosynthesis of galanthamine:WO,2015196100(A1)[P].20151223.
[36]陈斌.石蒜生物碱的高速逆流色谱制备、含量动态变化及合成途径关键酶PAL基因核心片段克隆的研究[D].重庆:西南大学, 2009:4-5,49-60.
[37]谢峻,谈锋,冯巍,等.石蒜属植物分类鉴别、药用成分及生物技术应用研究进展[J].中草药,2007,38(12):1902-1905.
[38]Joshi CP,Chiang VL.Conserved sequence motifs in plant Sadenosyl-L-methionine-dependent methyltransferases[J].Plant Molecular Biology,1998,37(4):663-674.
[39]聂媛媛,周海翔,彭菲,等.HPLC法测定黄花石蒜不同部位的加兰他敏含量[J].湖南中医药大学学报,2009,29(5):51-53.
[40]刘湘丹,王姣,李凤娟,等.不同产地人工栽培黄花石蒜不同器官中加兰他敏含量测定[J].湖南中医药大学学报,2015,35(5):31-33.
[41]李子璇,江海,曹小勇,等.石蒜植株中加兰他敏的分布与含量测定[J].江苏农业科学,2009(3):291.
[42]唐金凤,鲁耀邦,桂柳姿.mRNA差异显示法筛选黄花石蒜中加兰他敏合成相关基因[J].湖南中医药大学学报,2012,32(7):34-36,49.
[43]桂柳姿,崔培梧,潘清平,等.忽地笑加兰他敏生物合成代谢途径中COMT酶基因克隆及序列分析[J].湖南中医药大学学报, 2013,33(3):35-40.
[44]别庆玲,徐晟,傅江燕,等.一个新的忽地笑O-甲基转移酶基因的克隆与原核表达[J].植物生理学通讯,2014,50(5):651-659.
[45]彭菲,钟湘云,谭朝阳,等.黄花石蒜不定根的离体诱导与培养研究[J].湖南中医药大学学报,2008,28(1):44-45,48.
[46]罗跃龙,杨帅,赵志敏,等.忽地笑鳞茎中产加兰他敏内生真菌的分离与鉴定[J].西北药学杂志,2011,26(4):241-243.
[47]李明凯.石蒜生物碱分析方法的建立及其生物合成的研究[D].合肥:安徽农业大学,2012.
[48]茹巧美,裴真明,郑海雷,等.忽地笑愈伤组织培养条件对加兰他敏合成的影响[J].广西植物,2010,30(3):411-415.
[49]李明凯.石蒜生物碱分析方法的建立及其生物合成的研究[D].合肥:安徽农业大学,2012.
(本文编辑 苏 维)
Advances in the Synthesis Pathways of Galanthamine
ZHOU Ribao,LIU Changyu,PENG Meichen,WANG Zhaohui,LIU Xiangdan*
(School of Pharmacy,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
Galanthamine is a drug that is widely used in the treatment of Alzheimer's disease and etc.But according to the studies,the extraction yield of galanthamine in natural plants is very limited,researchers have studied on the synthesis of galanthamine.So far,a variety of chemical synthesis strategies were proposed.However,due to the defects of the current chemical synthesis,such as low yield,high cost,complicated steps and etc,the methods are not conducive to practical production,at present,the most effective alternative is to explore the biosynthetic methods for galanthamine.The review summarizes the research advances in the synthesis of galantamine,and emphatically introduces the biosynthesis and synthesisrelated enzymes of galantamine,the further study prospects of galantamine's synthesis are expected.
galanthamine;biosynthetic pathway;key enzyme;gene control;Lycoris radiata(L'Her.)Herb.
R914
A
10.3969/j.issn.1674-070X.2016.12.021
2016-07-06
湖南省科技厅(2015SK2015);国家中医药管理局“药用植物学”重点学科资助(国中医药发[2009]30号);湖南省科技厅(2015NK2153);湖南省“中药学”重点学科建设项目资助(湘教通[2011]76号);湖湘中药资源保护与利用协同创新中心(湘教通[2015]351号)。
周日宝,男,博士,教授,主要从事中药资源质量与开发研究。
*刘湘丹,女,博士,副教授,E-mail:paeonia_dd@126.com。
