细胞粘附分子CD44在肾病综合征、慢性肾小球肾炎患者外周血表达水平
2017-01-12杨惠忠
杨惠忠
[摘 要] 目的:检测细胞粘附分子CD44在肾病综合征(Nephrotic syndrome,NS)、慢性肾小球肾炎(Chronic glomerulonephritis,CGN)患者外周血表达水平,探讨其临床意义。方法:选取我院2013年7月~2016年7月收治的57例NS患者、69例GGN患者及同期60名健康体检者,分别纳入NS组、GGN组及对照组,采用流式细胞仪检测3组受试者外周血单个核细胞CD44表达水平,并分析CD44表达水平与NS患者、GGN患者血浆白蛋白(ALB)、胆固醇(CE)、肌酐(Cr)、尿素氮(BUN)的相关性。结果:CGN组患者外周血CD44表达水平高于NS组,NS组患者外周血CD44表达水平高于对照组,差异有统计学意义(P<0.05)。Pearson相关分析示,外周血CD44表达水平与NS患者ALB呈负相关,与CE呈正相关,与CGN患者Cr、BUN呈正相关(P<0.05)。结论:NS、CGN患者外周血CD44表达水平超出正常范围,可能通过免疫机制参与NS、CGN的发生发展,同时,外周血CD44表达水平与患者肾功能存在一定相关性,对于辅助病情判断亦具有一定价值。
[关键词] 细胞粘附分子;CD44;肾病综合征;慢性肾小球肾炎
中图分类号:R692 文献标识码:A 文章编号:2095-5200(2016)06-094-03
DOI:10.11876/mimt201606035
肾病综合征(Nephrotic syndrome,NS)、慢性肾小球肾炎(Chronic glomerulonephritis,CGN)发病有多种因素参与,其中免疫损伤是二者发生过程中的共同环节 [1]。细胞免疫、体液免疫平衡失调是导致肾脏疾病发病并进展至终末期肾衰竭、影响患者生存质量的主要原因[2]。作为细胞粘附分子家族重要成员,CD44主要参与细胞与细胞、细胞与基质间特异性粘连过程,在肿瘤、器官移植排斥反应、自身免疫性疾病的发生发展中扮演着重要角色[3]。本研究就NS、CGN患者外周血CD44表达水平进行了检测与分析,探讨CD44在肾小球病变中作用机制。
1 资料与方法
1.1 一般资料
选取我院2013年7月—2016年7月收治的57例NS患者、69例GGN患者及同期60名健康体检者,分别纳入NS组、GGN组及对照组。NS患者、GGN患者均经病史、体格检查、实验室检查或肾脏病理组织学检查,并参照改善全球肾脏病预后组织(KDIGO)慢性肾脏疾病诊疗指南(2012年版)确诊[4],且入组前未接受相关治疗,排除合并感染、肝功能异常、其他免疫性疾病者,健康体检者血压、蛋白尿均处于正常范围内,既往无肾病史、严重感染史及免疫性疾病。各组受试者年龄、体质量指数(BMI)、性别等一般临床资料比较,差异无统计学意义(P>0.05)。本研究经我院医学伦理委员会批准,受试者均知情同意并签署书面协议。
1.2 研究方法
1.2.1 外周血CD44表达水平检测 于入组次日清晨抽取受试者空腹肘静脉抗凝血2 mL,使用淋巴分离液分离,以1×106/mL提取单个核细胞悬液,取细胞悬液100 μL,依次加入20 μL CD44-FITC(法国Immunotech公司)及阴性对照羊抗鼠IgG1-FITC(法国Immunotech公司),避光处理30 min后,使用Epics Altra 型流式细胞仪(美国Beckman Coulter公司)上机检测[5]。CD44表达水平计算方法[6]:CD44阳性细胞百分比=(待测标本内标记阳性细胞数/受检细胞总数)×100%-非特异结合细胞百分比。比较各组受试者外周血CD44表达水平的差异。
1.2.2 肾功能相关指标检测及相关性分析 于入组次日清晨抽取NS组、CGN组患者空腹肘静脉抗凝血2 mL,使用AU5800全自动生化分析仪(美国Beckman Coulter公司)对其血浆白蛋白(ALB)、胆固醇(CE)、肌酐(Cr)、尿素氮(BUN)进行检测,运用Pearson法计算CD44表达水平与ALB、CE、Cr、BUN的相关性。
1.3 统计学分析
数据采用SPSS19.0进行分析,性别以(n/%)表示,并采用χ2检验,年龄、BMI、CD44表达水平等计量资料以(x±s)表示,相关性分析采用Pearson法,以P<0.05为差异有统计学意义。
2 结果
2.1 外周血CD44表达水平
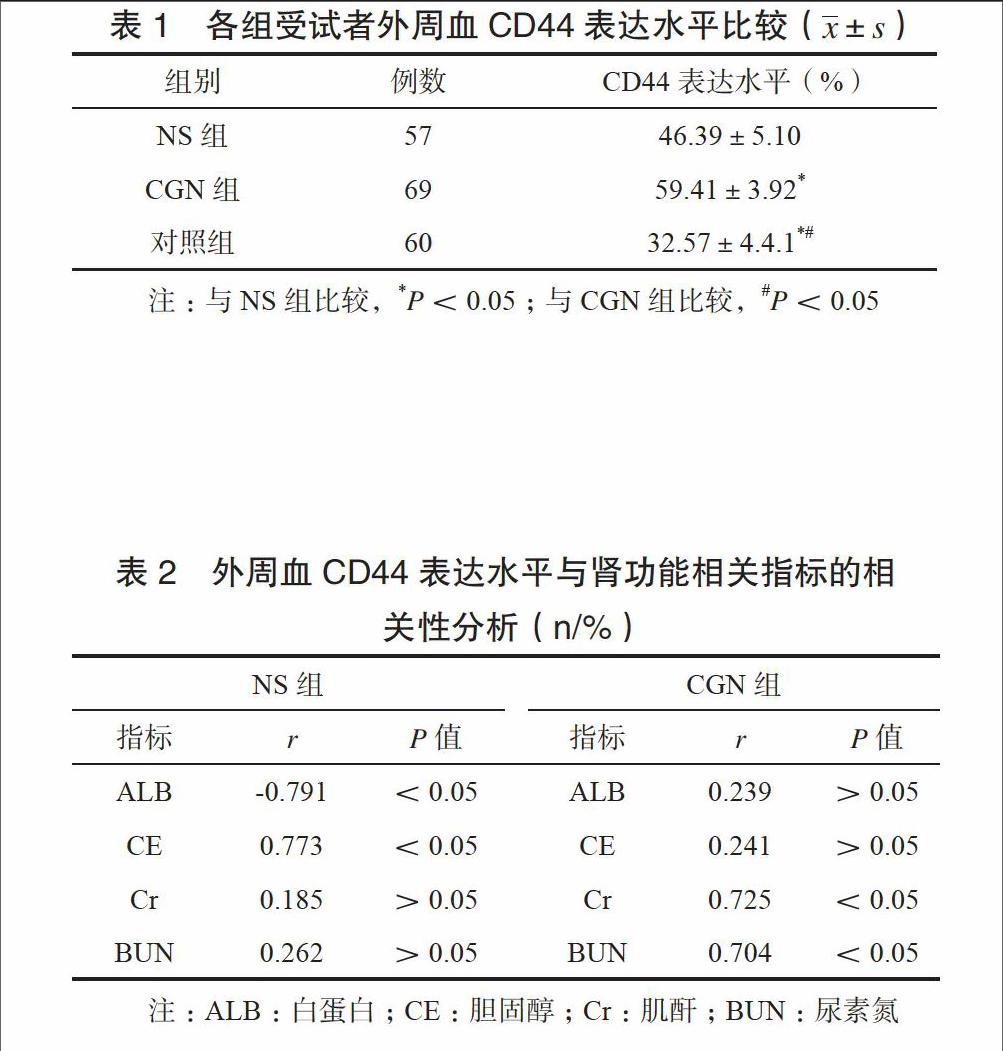
CGN组患者外周血CD44表达水平高于NS组,NS组患者外周血CD44表达水平高于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 外周血CD44表达水平与肾功能相关指标相关性
Pearson相关分析显示,外周血CD44表达水平与NS患者ALB呈负相关,与CE呈正相关,与CGN患者Cr、BUN呈正相关(P<0.05)。见表2。
3 讨论
细胞粘附分子是一类来自不同基因的配体/受体分子,具有介导细胞信号转导、调节细胞增殖分化等作用,在近年来肾脏疾病的机制研究中得到了广泛关注[7-8]。
研究发现,CD44在人类和大鼠正常肾脏组织中几乎无表达,肾小囊上皮细胞、亨氏拌升支粗段小管上皮细胞以及远端小管上皮细胞可见少量表达,但在肾脏疾病中,CD44蛋白表达往往处于异常增高状态[9]。Fogo等[10]
发现,系膜增生性肾炎患者外周血CD44表达水平明显升高,且与系膜细胞活化增殖、肾小球内炎症细胞浸润具有密切关联;邹丽萍等[11]指出,CD44可促进机体炎症因子分泌,参与炎症反应。本研究就CD44在NS、CGN患者外周血内表达水平进行了检测,结果表明,NS、CGN患者外周血CD44表达水平均处于异常升高状态,考虑与CD44诱导淋巴细胞在肾组织内广泛浸润、活化炎症和产生炎性因子等作用有关[12],说明CD44在NS、CGN发生发展过程中扮演了重要角色。
本研究相关性分析结果可见,CD44表达水平与NS患者ALB呈负相关,与CE呈正相关,其机制可能为:CD44具有调节细胞游走功能作用,可通过促进淋巴细胞在肾间质内广泛浸润,造成外周血淋巴细胞数量或功能异常、淋巴细胞亚群间比例失衡,而T淋巴细胞功能失调被认为是NS发病的重要机理之一[13-14],而NS患者以高脂血症、低白蛋白血症为主要表现[15],故随着NS患者外周血CD44表达水平的升高,其CE逐渐升高,ALB逐渐下降。
通过对CD44与CGN患者肾功能相关指标的分析,可以发现,CD44表达水平与患者Cr、BUN呈正相关,与ALB、CE无明显相关性,与CGN患者肾脏病理生理改变具有一致性:CGN患者肾小球滤过率的下降可导致肌酐清除率降低,继而导致体内Cr、BUN水平大幅上升,且其上升程度与患者病情具有密切关联[16],而CD44可与透明质酸配体结合,上调细胞活素类物质、化学活素类物质表达,参与CGN细胞免疫病理过程,促进巨噬细胞向肾小球、肾小管间质浸润,导致病情进展[17]。此外,Maruyama等[18]发现,肾脏疾病患者尿液内CD44细胞密度亦呈现明显增高状态,说明CD44对系膜细胞及系膜基质的影响在NS、CGN发生发展过程中可能发挥了一定作用。
因此,可以认为,细胞粘附分子CD44在NS、CGN患者外周血表达水平均呈现异常增高状态,说明CD44在NS、CGN发病过程中扮演了重要角色,与此同时,CD44与患者肾功能相关指标具有显著相关性,亦可为患者病情判断提供一定参考。本研究为NS、CGN发病机制的深入了解及临床防治策略的制定提供了思路,但需要注意的是,由于目前临床对于肾脏疾病的确切发病机制尚无明确阐释,关于CD44对NS、CGN发生发展的具体机理仍有待更深层次的研究加以了解。
参 考 文 献
[1] Smeets B, Stucker F, Wetzels J, et al. Detection of activated parietal epithelial cells on the glomerular tuft distinguishes early focal segmental glomerulosclerosis from minimal change disease[J]. Am J Pathol, 2014, 184(12): 3239-3248.
[2] Bever K M, Masha L I, Sun F, et al. Risk factors for venous thromboembolism in immunoglobulin light chain amyloidosis[J]. Haematologica, 2016, 101(1): 86-90.
[3] 王蔚, 樊均明, 陈辉珍. CD44对5/6肾切除大鼠残肾细胞增生和表型转化的影响[J]. 临床肾脏病杂志, 2005(1):22-24.
[4] Lu M, Wang C, Yuan Y, et al. Differentially expressed microRNAs in kidney biopsies from various subtypes of nephrotic children[J]. Exp Mol Pathol, 2015, 99(3): 590-595.
[5] 王莉. 细胞粘附分子CD44、CD62p在儿童原发性肾病综合征的表达及其相关性与临床意义的研究[D].济南:山东大学, 2003.
[6] Fogo A B, Cohen A H, Colvin R B, et al. Minimal change disease and focal segmental glomerulosclerosis[M]//Fundamentals of Renal Pathology. Springer Berlin Heidelberg, 2014: 45-58.
[7] Zhang J, Pippin J W, Krofft R D, et al. Podocyte repopulation by renal progenitor cells following glucocorticoids treatment in experimental FSGS[J]. Am J Physiol Renal Physiol, 2013, 304(11): F1375-F1389.
[8] Hamatani H, Hiromura K, Sakairi T, et al. Expression of a novel stress-inducible protein, sestrin 2, in rat glomerular parietal epithelial cells[J]. Am J Physiol Renal Physiol, 2014, 307(6): F708-F717.
[9] 肖敬川. 肾病综合征、慢性肾小球肾炎和2-糖尿肾病抗碳酸酐酶抗体、CD44和CRP的测定[D]. 武汉:中南大学, 2007.
[10] Fogo A B. Causes and pathogenesis of focal segmental glomerulosclerosis[J]. Nature Reviews Nephrology, 2015, 11(2): 76-87.
[11] 邹丽萍, 王伟, 张艳丽, 等. 粘附分子CD62P和CD44在毛细支气管炎患儿外周血中的表达及意义[J]. 中国当代儿科杂志, 2015, 17(11): 1200-1203.
[12] Tokgoz H, Caliskan U, Keles S, et al. Variable presentation of primary immune deficiency: two cases with CD3 gamma deficiency presenting with only autoimmunity[J]. Pediatr Allergy Immunol, 2013, 24(3): 257-262.
[13] Rampanelli E, Rouschop K M A, Claessen N, et al. Opposite role of CD44-standard and CD44-variant-3 in tubular injury and development of renal fibrosis during chronic obstructive nephropathy[J]. Kidney Int, 2014, 86(3): 558-569.
[14] 都兴华, 苏泽轩, 丁泓文, 等. CD44在大鼠肾缺血再灌注损伤中的表达及意义[J]. 中华实验外科杂志, 2015, 32(6): 1259-1260.
[15] Rampanelli E, Rouschop K, Teske G J D, et al. CD44v3-v10 reduces the profibrotic effects of TGF-β1 and attenuates tubular injury in the early stage of chronic obstructive nephropathy[J]. Am J Physiol Renal Physiol, 2013, 305(10): F1445-F1454.
[16] Ramani K, Pawaria S, Maers K, et al. An essential role of interleukin-17 receptor signaling in the development of autoimmune glomerulonephritis[J]. J Leukoc Biol, 2014, 96(3): 463-472.
[17] Peng Y, Ke M, Xu L, et al. Donor-derived mesenchymal stem cells combined with low-dose tacrolimus prevent acute rejection after renal transplantation: a clinical pilot study[J]. Transplantation, 2013, 95(1): 161-168.
[18] Maruyama T, Fukuda N, Matsumoto T, et al. Systematic implantation of dedifferentiated fat cells ameliorated monoclonal antibody 1-22-3-induced glomerulonephritis by immunosuppression with increases in TNF-stimulated gene 6[J]. Stem Cell Res Ther, 2015, 6(1): 1.