安徽铜陵白姜姜瘟病病原鉴定
2017-01-12胡洪涛朱志刚闵勇杨自文黄
胡洪涛++朱志刚++闵勇++杨自文++黄大野++姚经武++杨妮娜++龙同++程贤亮

摘 要:通过田间调查发现,铜陵白姜姜瘟病在铜陵当地表现出木质部黄心和黑心2种症状,通过TTC平板分离、致病性测定、16S rDNA以及青枯菌特异性鞭毛基因(fliC)检测表明,导致2种不同姜瘟病症状的病原菌均为青枯雷尔氏菌(Ralstonia solanacearum),但二者致病性存在明显差异。
关键词:铜陵;白姜;姜瘟病;青枯雷尔氏菌;病原鉴定
中图分类号:S632.5 文献标识码:A 文章编号:1001-3547(2016)24-0075-04
由青枯雷尔氏菌(Ralstonia solanacearum,简称青枯菌)侵染造成的细菌性青枯病是世界性重要病害之一,该菌可侵染54个科的450多种植物[1],但以茄科作物,如番茄、马铃薯等,受害最为严重。生姜青枯病,因其发病快、死亡率高、无有效防治手段,所以俗称姜瘟病[2]。安徽铜陵白姜种植历史悠久,姜块色白鲜嫩汁多、香味纯正、品质优良,并具药用价值,宋朝时被列为朝廷贡品,被誉为铜陵“八宝”之一。铜陵白姜种植面积约为400 hm2,年产量约为4 000 t,年产值近亿元,是当地重要的特色农业产业[3]。铜陵市义安区是铜陵白姜主产区,近年来该区姜瘟病的发生日益严重,连作田发病率50%以上,重病田甚至绝收,已经严重阻碍了当地生姜产业的可持续发展[3]。尽管对姜瘟病的研究进行多年,然而对铜陵姜瘟病病原的研究甚少。为此,开展了铜陵白姜姜瘟病病原检测的研究,以期为进一步有效防治该病提供科学依据。
1 材料与方法
1.1 样品收集
2016年5~8月,在铜陵市义安区兴化村等主要白姜产区分别挖取叶部呈现萎蔫状的生姜姜块,用清水将其表面泥土冲洗干净,吸水纸吸干,冰盒保存带回实验室。
1.2 病原菌分离
病原菌分离均于采样后48 h内在超净工作台(北京东联哈尔仪器制造有限公司,型号A2)上完成。样品先用无菌水冲洗3遍,晾干至表面无明显水滴,在75%的酒精中浸泡2~3 min,再用无菌水冲洗3遍,晾干至表面无明显水滴,用消毒刀片在姜块中部表面切一道长2~4 cm、深约2 mm的切口,用消毒镊子将其掰开,并用消毒牙签蘸取姜块中间部位汁液,在TTC平板上划线分离[4]。将分离平板置
于28℃培养箱培养24~72 h,所得单菌落超低温
(-80℃)保存于25%甘油管中。
1.3 致病性测定
病原菌制备:将病原分离物,接种于SPA液体培养基[5],摇床(北京东联哈尔仪器制造有限公司,型号DLHR-Q200)发酵48 h(28℃,150 r/min)后,将分光光度计(上海光学仪器721型)OD560值调至1.0,测定菌液浓度约为1×108 CFU/mL,备用。
将温室生长至5~8叶的铜陵白姜植株从营养钵中取出,用清水将根部冲洗干净,用消毒针在茎基部刺3个深度和间隔均约为1 cm的针孔,而后将根系置入病原菌发酵液中浸泡20 min。无菌水处理作为对照。每处理5株,重复2次。处理后的植株立即种植于营养钵中,置于人工气候箱(光周期
12 h/8 h,温度30℃,湿度85%)内培养7~10 d。
1.4 16S rDNA检测
纯化后的病原分离物直接用PCR扩增,采用16S rDNA通用引物对(F:5'-AGAGTTTGATCCTGGCTCAG-3',R:5'-GGTTACCTTGTTACGACTT-3'),PCR反应体系(50 μL):2×ES Taq Mix 25μL,正反引物各1 μL,模板1 μL,ddH2O 22 μL。反应条件:95℃ 1 min,95℃ 30 s,58℃ 1 min,72℃ 1.5 min,30个循环,72℃ 5 min。引物合成和PCR产物测序均由生工生物工程(上海)股份有限公司提供。
1.5 青枯菌鞭毛基因(fliC)基因检测
根据NCBI中青枯菌鞭毛基因(fliC)序列设计引物对(F:5'-GAACGCCAACGGTGCGAACT-3',R:5'-GGCGGCCTTCAGGGAGGTC-3')。反应体系和条件同1.4。
1.6 进化树分析
进化树分析在MEGA 7.0中完成。首先,采用Clustalw进行DNA序列比对(DNA Weight Matrix:IUB,其他采用默认参数)。进化树的构建采用Maxium Likehood方法、Tamura-Nei模式。
2 结果与分析
2.1 姜瘟病田间症状
在铜陵义安村田间调查表明,感染植株在患病初期,叶片褪绿,叶尖和叶缘先黄化,逐渐萎缩反卷下垂(图1A、B),病叶逐步从基部向上发展,至全株枯死。病株茎基部逐渐变软,维管束变色褐化、呈水渍状,挤压时,有污白色菌脓流出。患病姜块变软、维管束变色,根据维管束颜色,可分为黄色和黑色2种,俗称为黄心(图1C-a)和黑心(图1C-b)。黑心和黄心患病植株的姜块木质部分别呈现黄色、黑色,而地上部症状无明显差异,但相对于黄心症状,黑心症状病株萎蔫更快,病程更短。
2.2 致病性测试
致病性测试结果显示,在接种后12 d后,植株叶片呈现萎蔫状、卷缩,叶尖和叶缘失绿黄化,与田间病株症状完全一致(图2),表明所分离的病原物为姜瘟病病原。然而,接种黑心症状病原的植株萎蔫程度更甚、失绿更为严重,提示黑心症状病原的致病性可能更强。
2.3 病原形态鉴定
导致白姜黑心和黄心症状的病原分离物在TTC培养基菌落均为近圆形或梭形,中间略微凸起、中间粉红色至红色、周围为白色。病原菌均为单胞、杆状,大小为(0.5~0.7)μm×(1.5~2.0)μm,革兰氏染色阴性,而结晶紫染色显示两极着色深,与前人报道一致[6,7]。
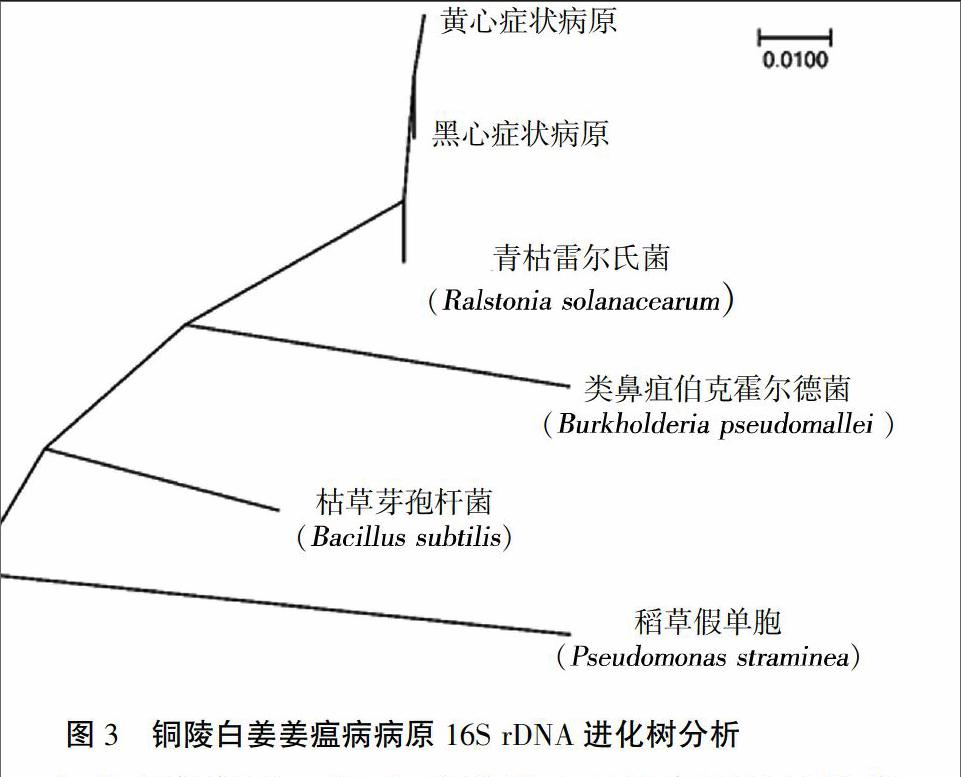
2.4 16S rDNA测序
采用16S rDNA通用引物对扩增和测序,结果表明,2种症状病原分离物的16S rDNA产物长度均为1 439 bp(NCBI序列号:KX785159.1和KX785160.1)。黄心和黑心症状病原的16S rDNA序列与NCBI里保存的青枯雷尔氏菌有高度相似性(>99%)(图3),而与其他菌如Bukholderia、Bacillus等,亲缘关系相对较远,表明无论是黄心还是黑心症状病原菌均为青枯雷尔氏菌。
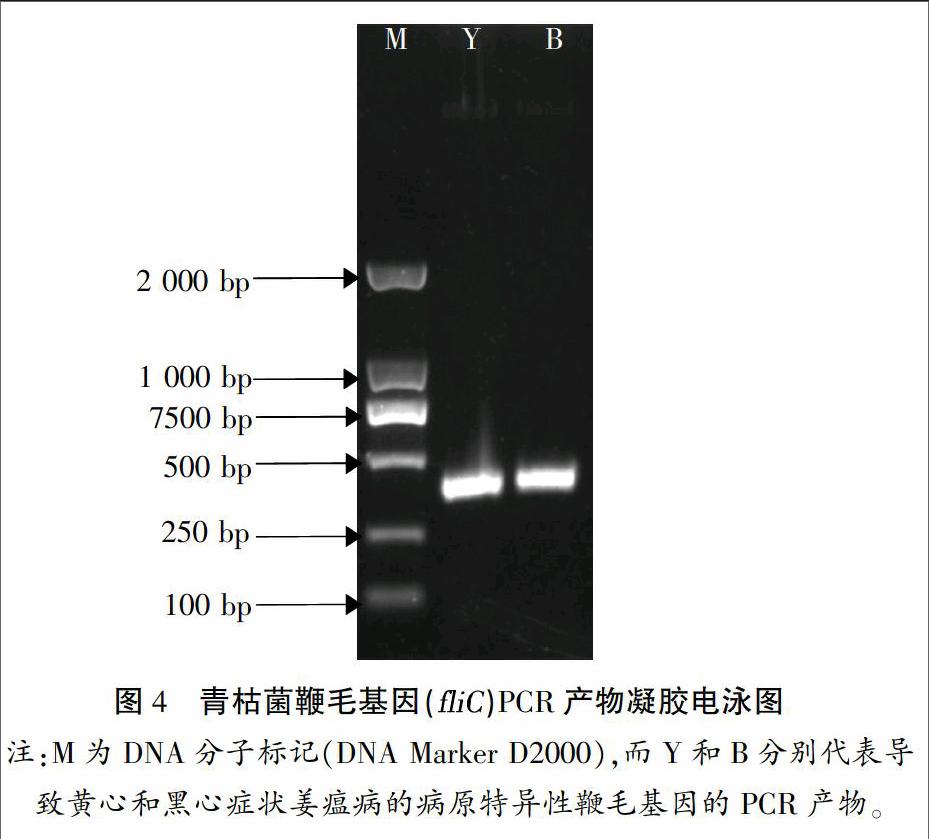
2.4 青枯菌特异性鞭毛基因(fliC)检测
为进一步确定铜陵白姜姜瘟病病原,根据前人研究结果[8],针对青枯菌特异性鞭毛基因(fliC)在NCBI上设计了1对引物,用于青枯菌特检测,结果如图4所示。测序结果显示,黄心和黑心症状的青枯菌fliC基因PCR产物长度分别为368、370 bp。由于5'端20~30 bp和3'端10 bp测序质量较低,因此,将两端低质量的碱基去掉,所得序列与NCBI中所保存的青枯菌fliC基因序列进行比对。如图5所示,导致白姜黄心和黑心症状的青枯菌fliC基因序列与NCBI保存的青枯菌完全一致。综上所述,可以确定导致铜陵白姜黄心和黑心症状姜瘟病的病原均为青枯菌。
3 讨论与结论
铜陵白姜为我国具有地方特色的名特优农产品,而近年来,日益严重的姜瘟病已经给当地白姜生产造成严重的经济损失,制约了白姜产业的健康、可持续发展。然而长期以来,缺乏对其病原菌的科学鉴定。本研究通过实地调研,发现姜瘟病病株表现为黄心和黑心2种不同症状,而通过TTC平板分离、形态学、致病性测定和分子生物学等手段,对铜陵白姜姜瘟病病株进行分离和鉴定,明确其病原均为青枯菌,但二者的致病性存在明显差异。
16S rDNA序列分析是植物病原细菌鉴定和分类的重要手段和依据 [9]。经序列比较和系统进化树分析证明铜陵白姜姜瘟病2种症状的病原与已知青枯菌在同一分支。然而,尽管2种症状病原遗传距离相当近,但仍然存在微小差距。尽管青枯菌特异性鞭毛基因扩增结果表明,黄心和黑心症状病原的序列与已知青枯菌完全一致,但由于致病性和16S rDNA序列存在差异,提示导致黄心和黑心症状青枯菌可能为不同的株系或者分化型[8]。前人研究表明,不同地区或寄主的青枯菌表现出明显生理分化或菌系多样性[10],而在地理位置和寄主相同的情况下,发现毒力差异性的青枯菌的相关报道尚不多见。青枯菌的致病性受多种基因调控[11],如果能从基因组学角度,深入研究其在DNA和转录组水平方面的差异,将有助于揭示青枯菌致病性的调控机制[12]。
参考文献
[1] Hayward A C. Biology and epidemiology of bacterial wilt caused by Pseudomonas solanacearum[J]. Annual Review of Phytopathology, 1991(29): 65-87.
[2] 刘铭,张敏,戢俊臣,等.中国姜瘟病的研究进展[J].中国农学通报,2005(6):337-340.
[3] 赵友前,赵德明,汪涛,等.铜陵县白姜姜瘟病的致病因素及防治技术[J].现代农业科技,2012(7):177.
[4] 方中达.植病研究方法[M].北京:中国农业出版社,1998:156-211.
[5] 车建美,刘波,张彦,等.青枯雷尔氏菌致病性生物测定方法的研究[J].福建农业学报,2011,26(5):804-807.
[6] 陈莉,高智谋,杨自保,等.安徽省姜瘟病病原细菌鉴定及有效药剂筛选[J].安徽农业科学,2007,35(18):5 479,
5 516.
[7] 赵志祥,严婉荣,陈圆,等.海南生姜青枯病病原菌鉴定[J]. 基因组学与应用生物学,2015,34(4):763-768.
[8] Sch?觟nfeld J, Heuer H, Van Elsas J D, et al. Specific and sensitive detection of Ralstonia solanacearum in soil on the basis of PCR amplification of fliC fragments [J]. Applied Environmental Microbiology, 2003, 69(12): 7 248-7 256.
[9] Weisburg W G, Barns S M, Pelletier D A, et al. 16S ribosomal DNA amplification for phylogenetic study[J]. Journal of Bacteriology, 1991, 173(2): 697-703.
[10] 徐进,顾钢,潘哲超,等.福建烟草青枯菌演化型及生化变种鉴定研究[J].中国烟草学报,2010,16(6):66-71.
[11] 蔡刘体,刘艳霞,石俊雄.青枯菌致病力的主要决定因子研究进展[J].贵州农业科技,2015,43(8):109-113.
[12] Salanoubat M, Genin S, Artiguenave F, et al. Genome sequence of the plant pathogen Ralstonia solanacearum [J]. Nature, 2002, 415(6 871): 497-502.
