海洋细菌Bacillus sp.753 的次生代谢产物分析*
2017-01-07孙玉林杨梅语辛欣欣甘文恒龚珍英邓文英陈道海
孙玉林,杨梅语,辛欣欣,甘文恒,龚珍英,李 玲,邓文英,刘 晓,陈道海
(1.岭南师范学院生命科学与技术学院,广东湛江 524048;2.环北部湾海洋药用动物利用与保护研究所,广东湛江 524048)
海洋细菌Bacillussp.753 的次生代谢产物分析*
孙玉林1,2**,杨梅语1,辛欣欣1,甘文恒1,龚珍英1,李 玲1,邓文英1,刘 晓1,陈道海1,2**
(1.岭南师范学院生命科学与技术学院,广东湛江 524048;2.环北部湾海洋药用动物利用与保护研究所,广东湛江 524048)
【目的】通过多种现代化波谱手段,探究海洋细菌Bacillus sp.753的次生代谢产物。【方法】采用硅胶柱层析、Sephadex LH-20凝胶柱层析和高效液相色谱分离技术,对海洋细菌Bacillus sp.753发酵液的化学成分进行研究,并运用NMR、MS和文献对照方法鉴定其化学结构。【结果】从这株细菌的发酵液中共分离得到12个单体化合物,分别为uridine (1),thymine (2),cyclo-(phe-lle) (3),cyclo-(ala-pro) (4),cyclo-(val-pro) (5),cyclo-(pro-leu) (6),cyclo-(phe-pro) (7),cyclo-(tyr-pro) (8),cyclo-(tyr-4-hydroxy-pro) (9),cyclo-(leu-pro) (10),cyclo-(pro-4-hydroxyl-lle) (11),cyclo-(D-pipecolinyl-L-leucine) (12)。【结论】化合物1~12均是首次从该株海洋细菌中分离得到,该实验结果不仅丰富了该株菌的化学成分类型,而且也增强了海洋细菌的研究价值。
海洋细菌 Bacillus sp.753 化学成分 结构鉴定
0 引言
【研究意义】随着对陆生微生物50多年的集中研究和开发,活性天然产物发现的重复率高达 95%,这种现状已成为制约新型药物研发的瓶颈。因此,迫切地需要从新的环境、资源中去寻找新型的活性代谢产物,于是人们将研究的目光投向海洋。海洋微生物的次生代谢产物具有特异、新颖、多种多样的化学结构和显著的生物活性,是开发新药的重要资源[1]。海洋细菌具有产生生物活性物质的潜力,其代谢途径多样、代谢产物种类特异,可为新的强效抗生素和抗病毒药物提供物质基础[2]。【前人研究进展】近年来,我国的科研工作者已经展开海洋细菌次生代谢产物的研究,不断丰富其代谢产物的化学成分种类。马小妮等[3]从深海沉积物中的海洋细菌 Psychrobacter submarinus 1A01998发酵粗提物中分离得到4个化合物,分别鉴定为环(L-脯氨酸-L-酪氨酸)、环(D-脯氨酸-L-酪氨酸)、3-吲哚甲醛和2′-O-甲氧基尿嘧啶核苷。苗子等[4]对具有抗肿瘤活性的海洋细菌 Halomonas elongate的次级代谢产物进行研究,从中发现3个活性化合物,分别为胸腺嘧啶-2′-脱氧核苷、环(L-甘氨酸-L-脯氨酸)二肽和1-(2′-脱氧-β-D-赤式-呋喃戊糖)-1-氢-1,2,4-三嗪酮。龙彬等[5]研究柳珊瑚Anthogorgia caerulea共生细菌Bacillus methylotrophicus发酵液的化学成分,从中分离出6个化合物,分别鉴定为环(脯氨酸-甘氨酸)二肽、环(S-脯氨酸-R-亮氨酸)二肽、胸苷、尿苷、原儿茶酸和3-Furancarboxylic acid-5-(hydroxmenthy)-(Furan)。于洋等[6]针对污损细菌组成的污损微生物膜展开研究工作,从中发现9种次级代谢产物,其中4种是二酮哌嗪(Diketopiperazine,DKP)类信号分子,即环(脯氨酸-甘氨酸)、环(脯氨酸-丙氨酸)、环(4-羟基-脯氨酸-亮氨酸)和环(脯氨酸-酪氨酸),以及尿嘧啶、胸腺嘧啶、对羟基苯乙醇、十五烷酸、邻苯二甲酸二(2-乙基己)酯。沈明曦等[7]对海洋细菌 Pantoea agglomerans 发酵液中的化学成分进行研究,从中分离鉴定出7个化合物,分别为对羟基苯丙酸(p-hydroxy-phenylpropionic acid)、N-乙酰酪胺( N-acetyltyramine)、对羟基苯乙醇(p - hydroxyphenylethyl alcohol)、对羟基苯乙酸甲酯(methyl 4-hydroxybenzeneacetate)、3-吲哚甲醛( 1H-indole-3- carbaldehyde)、环(4 -羟基-脯氨酸-亮氨酸) [cyclo-(4-hydroxyl-Pro-Leu)]、2-(4-羟苯基)-N-苯乙酰胺[2-(4-hydroxyphenethyl)-N-phenylacetamide]。【本研究切入点】在前期研究中发现,来源于太平洋加拿大海域中海泥的海洋细菌Bacillus sp.753,其菌株发酵液的乙酸乙酯粗提物有良好的抑菌和刺激携带有linx基因的工程菌发光的生物活性,因此我们就其次生代谢产物进行系统研究,以此来丰富海洋细菌的化学成分类型。【拟解决的关键问题】采用现代色谱分离和光谱分析技术,对该株细菌的单体化合物进行分离,并利用现代化波谱手段对其化学结构进行鉴定。
1 材料与方法
1.1 材料
超导核磁共振仪:Bruker DRX-500型,内标为TMS;ESI-MS:Finnigan LCQDECAXP HPLC-MASS;高效液相色谱仪:SHIMADZU LC-20A,YMC-Pack,ODS S-5μ 250×10 mm i.d.;层析用硅胶:正相硅胶(100~200目,200~300目),青岛海洋所化工厂;凝胶:Sephadex LH-20型,Pharmacia公司;反相硅胶:Rp-18型,Pharmacia 公司(80~100 μ);其它所用试剂均为分析纯。海洋细菌Bacillus sp.753于2008年采自太平洋加拿大海域中的海泥,种属由加拿大UBC大学Julin教授鉴定,标本存放于中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室。
1.2 方法
种子液和大发酵液均采用TSB培养基。从TSA平板上挑取研究菌株的单菌落,接入装有50 mL培养基的250 mL锥形瓶中,于37℃、180 r/min的摇床上培养48 h,即得种子液。然后再将种子液按3%(V/V)的量接入500 mL锥形瓶(总计200个,每瓶装150 mL培养基),于37℃、180 r/min的摇床上培养72 h后结束发酵。将30 L发酵液直接用乙酸乙酯(乙酸乙酯∶发酵液=1∶1,V/V)反复萃取4次,得到浸膏7.9 g。对乙酸乙酯萃取物采用硅胶柱色谱和半制备高效液相色谱等方法进行分离纯化。运用1H NMR、13C-NMR及文献报道对比方法,对分离纯化获得的单体化合物进行结构鉴定。
2 结果与分析
2.1 化合物1~12的分离纯化
将得到的浸膏7.9 g经硅胶 (100~200目)柱层析,以石油醚/丙酮(1∶0~0∶1,V∶V)系统进行梯度洗脱,得到6个亚流分 (Fr01~Fr06)。流分Fr04(0.98 g)经硅胶 (200~300目)柱层析,以石油醚/丙酮(8∶2,V∶V)进行等度洗脱,得到4个亚流分 (Fr0401~Fr0404)。亚流分Fr0404经半制备HPLC纯化,得到化合物1(SHIMADZU LC-20A,ODS S-5μ 250×10 mm i.d.,3 mL/min,甲醇与水的体积比为10∶90,tR=6.7 min,7.1 mg),2 (tR=11 min,2.5 mg),4 (tR=16.5 min,2.7 mg)。亚流分Fr0402经Sephadex LH-20柱层析,得到5个亚流分 (Fr040201~Fr040205)。亚流分Fr040203经半制备HPLC纯化,得到化合物5(甲醇与水的体积比为25∶75,tR=14.5 min,7.2 mg),7 (tR=53.0 min,18.3 mg),8 (tR=66.0 min,1.9 mg)。流分Fr03(0.71 g)经Sephadex LH-20柱层析后,得到4个亚流分 (Fr0301~Fr0304),亚流分Fr0304经半制备HPLC纯化,得到化合物10 (甲醇与水的体积比为30∶70,tR=12.5 min,7.3 mg),9 (tR=44 min,2.5 mg)。亚流分Fr0302经半制备HPLC纯化,得到化合物11(甲醇与水的体积比为30∶70,tR=24.0 min,4.5 mg);亚流分Fr0303经半制备HPLC纯化,得到化合物6(乙腈与水的体积比为10∶90,tR=40.0 min,2.7 mg),12(tR=47.5 min,4 mg)。流分Fr05 (0.90 g)经Sephadex LH-20柱层析后,得到5个亚流分 (Fr0501~Fr0505),亚流分Fr0503通过重结晶得到化合物3(5 mg)。
2.2 化合物1~12的结构
化合物1~12的结构如下图1所示。
化合物1:白色无定形粉末;1H NMR (500 MHz,DMSO-d6)δH10.96 (1H,brs,NH-1),0.76(1H,brs,NH-3),5.43 (1H,d,J=9.0 Hz,H-5),7.36(1H, d,J = 9.0 Hz,H-6)。经与文献[8]对照确定其为尿嘧啶。
化合物2:白色无定形粉末;紫外光254 nm下观察有明显的暗斑;1H NMR(500 MHz,CD3OD)δH10.99(1H,brs,NH-1),0.57(1H,brs,NH-3),7.24(1H,d,J=2.0 Hz,H-6),7.24 (1H,s,H-7)。经与文献[8]对照确定该化合物为胸腺嘧啶。
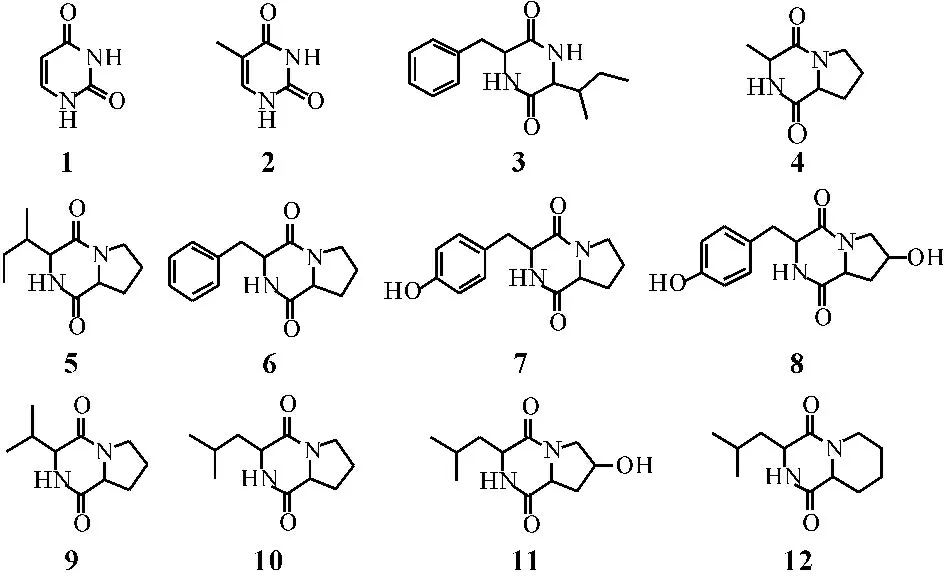
图1 化合物1~12的结构
Fig.1 Structures of compound 1~12
化合物3:白色无定形粉末;1H NMR(500 MHz,Acetone-d6)δH3.55 (1H,m, H-2),1.41 (1H,m,H-3),0.66(2H,m,H-4),0.94 (3H,m,H-5),0.84 (3H, m,H-6),4.14(1H,m,H-2′),3.30(1H,dd,J=5.0,13.5 Hz,H-3′a),2.85(1H, dd,J= 5.0,13.5 Hz,H-3′b),7.01-7.41(5H,m,H-5′-9′);13C-NMR(125 MHz,Acetone-d6)δC166.5(s,C-1),59.0(d,C-2),38.0 (d,C-3),22.5(t,C-4),12.5(q,C-5),15.9(q,C-6),169.7(s,C-1′),58.2(d,C-2′),39.5(t,C-3′),137.1(s,C-4′),131.4(d,C-5′),129.6(d,C-6′),128.3(d,C-7′),29.6 (d,C-8′),131.4(d,C-9′)。将以上数据与文献[9]对照,可确定化合物3为cyclo-(phe-lle)。
化合物4:白色无定型粉末;紫外光254 nm下观察有明显的暗斑;1H NMR(500 MHz,Acetone-d6)δH4.16 (1H,m,H-3),4.12 (1H,m,H-6),1.89-2.20 (4H,m,H-7-H-8),3.58(1H,m,H-9a),3.40 (1H,m,H-9b),1.35(3H,d,J=7.0 Hz,H-10);13C-NMR(125 MHz,Acetone-d6)δC171.8 (s,C-2),52.7 (d,C-3),168.3 (s,C-5),60.9 (d,C-6),28.9 (t,C-7),24.5(t,C-8),46.8 (t,C-9),7.0 (q,C-10)。将以上数据与文献[10]对照,可确定化合物4为cyclo-(ala-pro)。
化合物5:白色无定性粉末;1H NMR(500 MHz,Acetone-d6)δH3.72 (1H,m,H-3),4.09 (1H,m,H-6),2.20-2.37 (2H,m,H-7),1.85 (2H,m,H-8),3.51 (2H,m,H-9),1.84 (3H,m,H-10),0.96 (3H,d,J=7.0 Hz,H-11),1.03(3H,d, J=7.0 Hz,H-12)。将以上数据与文献[11]对照,确定化合物5为cyclo-(val-pro)。
化合物6:白色无定性粉末;1H NMR(500 MHz,CDCl3)δH3.80 (1H,m,H-3),4.10(1H,dd,J=6.5,10.0 Hz,H-6),1.81(1H,m,H-7a),2.40(1H,m,H-7b),1.81 (2H,m,H-8),3.53(2H,m,H-9),2.05(1H,m,H-10),1.24 (2H,m,H-11),0.93 (3H,d,J=7.5 Hz,H-12),1.01(3H,d,J=6.5 Hz,H-12)。将以上数据与文献[12]对照,确定化合物6为cyclo-(val-pro)。
化合物7:无色片状结晶(甲醇);1H NMR(500 MHz,CDCl3)δH4.34 (1H,m,H-3),4.07 (1H,m,H-6),2.05 (1H,m,H-7a),1.73(2H,m,H-7b and H-8a),1.41 (1H,m,H-8b),3.29 (1H,m,H-9a),3.08 (1H,m,H-9b),3.07 (1H,m, H-10a),3.00 (1H,m,H-10b),7.25 (5H,m,H-12-H-16),7.99 (1H,brs,NH-4)。参照文献[8],鉴定该化合物为cyclo-(phe-pro)。
化合物8:黄色粉末;1H NMR(500 MHz,CD3OD)δH4.47(1H,m,H-3),4.07(1H,m,H-6),2.14(1H,m,H-7a),1.83(2H,m,H-7b),1.63(2H,m, H-8),3.39 (1H,m,H-9a),3.50 (1H,m,H-9b),7.31 (2H,m,H-12,H-13),7.20(2H,m,H-15,H-16)。综合数据并与文献[13]对照,确定该化合物为cyclo-(tyr-pro)。
化合物9:白色无定性粉末;负离子ESIMS给出准分子离子峰m/z 275.3 [M-H]-;1H NMR(500 MHz,CDCl3)δH4.20 (1H,m,H-3),3.31 (1H,dd,J= 8.0, 9.0 Hz,H-6),2.14 (1H,m,H-7a),2.04(2H,m,H-7b),4.20 (2H,m,H-8),3.57(1H,dd,J= 3.5,12.5 Hz,H-9a),3.34(1H,dd,J=6.5,12.5 Hz,H-9b),3.12 (1H,dd,J= 4.5,14.0 Hz,H-10a),3.02(1H,dd,J=5.0,14.0 Hz,H-10b),7.26 (2H,m,H-12,H-16),7.17 (2H,m,H-13,H-15)。综合数据并与文献[14]对照,确定该化合物为cyclo-(tyr-4-hydroxy-pro)。
化合物10:白色无定性粉末。该化合物与化合物4的谱图很相似,提示该化合物也为二酮哌嗪类的化合物。与化合物4的氢谱仔细对比,发现唯一的区别在于化合物10中C-3位的取代基由甲基变为异丁基。与文献[11]对照,确定该化合物为cyclo-(leu-pro),核磁数据见表1。
化合物11:白色无定性粉末。该化合物与化合物10的谱图很相似,提示该化合物也为二酮哌嗪类的化合物。与化合物10的氢谱对比,发现唯一的区别在于化合物11中C-8位亚甲基上的1个氢被1个羟基所取代。与文献[8]对照,确定该化合物为cyclo-(pro-4-hydroxyl-lle),核磁数据见表1。
化合物12:白色无定性粉末。该化合物与化合物10的谱图很相似,提示该化合物也为二酮哌嗪类的化合物。仔细比较两者的氢谱,发现唯一的区别在于化合物12氢谱上多出1个亚甲基δH1.67(2H,m,H-9)。综合以上数据并和文献[14]比对,确定该化合物为cyclo-(D-pipecolinyl-L-leucine),核磁数据见表1。
表1 化合物10~12的氢谱数据
Table 11H (500 MHz) Spectroscopic data for compounds 10~12

编号No.10δH(JinHz)11δH(JinHz)12δH(JinHz)1233.94,(1H,m)4.23,(1H,m)3.92,(1H,m)4564.07,(1H,t,J=7.5Hz)4.19,(1H,m)4.08,(1H,m)72.62,(1H,m),2.02,(1H,m)2.13,(1H,m),2.17,(1H,m)2.01,(1H,m),1.89,(1H,m)81.90,(2H,m)4.21,(1H,m)1.60,(2H,m)93.61,(1H,m),3.51,(1H,m)3.46,(1H,m),3.60,(1H,m)1.67,(2H,m)102.34,(1H,m),2.02,(1H,m)1.65,(1H,m),1.81,(1H,m)3.63,(1H,m),3.53,(1H,m)111.50,(1H,m)1.64,(1H,m)2.40,(1H,m),1.89,(1H,m)121.06,(3H,d,J=7.0Hz)0.94,(3H,d,J=6.5Hz)1.78,(1H,m)130.91,(3H,d,J=7.0Hz)0.92,(3H,d,J=6.5Hz)0.98,(3H,d,J=6.5Hz)140.95,(3H,d,J=6.5Hz)
Note:Compounds 10,12 in CDCl3,11 in Pyr-d5
3 结论
本研究对来源于太平洋加拿大海域海泥中的海洋细菌Bacillus sp.753的化学成分进行系统研究,从中获得uridine(1),thymine(2),cyclo-(phe-lle)(3),cyclo-(ala-pro)(4),cyclo-(val-pro)(5),cyclo-(pro-leu)(6),cyclo-(phe-pro)(7),cyclo-(tyr-pro)(8),cyclo-(tyr-4-hydroxy-pro)(9),cyclo-(leu-pro)(10),cyclo-(pro-4-hydroxyl-lle) (11),cyclo-(D-pipecolinyl-L-leucine)(12)等12个单体化合物,其中化合物1,2为核苷类化合物,化合物3~12均为二酮哌嗪类化合物,并且均为首次从该株菌中分离得到。本研究也证明该株菌中主要的化学成分是二酮哌嗪类化合物,同时丰富了该属细菌中的化学成分类型,为进一步研究该菌属的海洋细菌提供参考资料。
[1] NEWMAN D J,HILL R T.New drugs from marine microbes:The tide is turning[J].Journal of Industrial Microbiology and Biotechnology,2006,33(7):539-544.
[2] 李大志,韩宝芹.海洋细菌活性代谢产物的研究进展[J].中国海洋药物杂志,2006,25( 5):51-55. LI D Z,HAN B Q.Progress in the active metabolites of marine bacterium[J].Chinese Journal of Marine Drugs,2006,25(5):51-55.
[3] 马小妮,苗子,程轩轩,等.深海细菌Psychrobacter submarinus 1A01998的次级代谢产物研究[J].广东药学院学报,2016,32(1):25-28. MA X N,MIAO Z,CHENG X X,et al.Study on the secondary metabolites from the marine bacterium Psychrobacter submarinus 1A01998[J].Journal of Guangdong Pharmaceutical University,2016,32(1):25-28.
[4] 苗子,马小妮,程轩轩,等.海洋细菌 Halomonas elon- gate 的次级代谢产物研究[J].广东药学院学报,2016,32(1):29-31. MIAO Z,MA X N,CHENG X X,et al.Study on the secondary metabolites from the marine bacteriumHalomonaselongate[J].Journal of Guangdong Pharmaceutical University,2016,32(1):29-31.
[5] 龙彬,高程海,胡丽琴,等.柳珊瑚共生菌Bucillus methylotrophicus发酵液化学成分研究[J].广西科学,2014,21(1):89-92. LONG B,GAO C H,HU L Q,et al.Study on chemical constituents from marine gorgonian-associated bacteriumBucillusmethylotrophicus[J].Guangxi Sciences,2014,21(1):89-92.
[6] 于洋,王建华,方圣涛,等.海洋污损细菌群落结构及其发酵液中化学成分的研究[J].海洋科学,2014,38(9):27-32. YU Y,WANG J H,FANG S T,et al.Study on community structure and chemical constituents of fermentation broth in biofouling biofilms[J].Marine Sciences,2014,38(9):27-32.
[7] 沈明曦,陈刚,李文,等.海洋细菌 Pantoea agglomera- ns化学成分的分离和结构鉴定[J].中国药物化学杂志,2012,22(2):127-130. SHEN M X,CHEN G,LI W,et al.Isolation and structure identification of chemical constituents from marine bacteriumPantoeaagglomerans[J].Chinese Journal of Medicinal Chemistry,2012,22(2):127-130.
[8] 刘涛,李占林,王宇,等.海洋细菌Bacillus subtilis次级代谢产物的研究[J].中国海洋药物杂志,2009,28(5):1-6. LIU T,LI Z L,WANG Y,et al.Studies on the secondary metabolites from the marine bacteria Bacillus subtilis[J].Chinese Journal of Marine Drugs,2009,28(5):1-6.
[9] 刘海滨,高昊,王乃利,等.红树林真菌草酸青霉(092007)的环二肽类成分[J].沈阳药科大学学报,2007,24(8):474-478. LIU H B,GAO H,WANG N L,et al.Cyclic dipeptide constituents from the mangrove fungus Penicillium oxalicum(No.092007)[J].Journal of Shenyang Pharmaceutical University,2007,24(8):474-478.
[10] 姚遥,田黎,李娟,等.海洋细菌Bacillus sp.中环二肽类代谢产物的研究[J].中国药物化学杂志, 2007,17(5):310-313. YAO Y,TIAN L,LI J,et al.Cyclo-dipeptide metabolites from the broth of marine bacterium Bacillus sp.[J].Chinese Journal of Medicinal Chemistry,2007,17(5):310-313.
[11] 艾峰,许强芝,杨妤,等.东海微生物中6种环二肽类天然活性物质的分离和鉴定[J].第二军医大学学报,2006,27(1):22-24. AI F,XU Q Z,YANG Y,et al.Bioactive cyclodipeptides extracted from marine microbes in East China Sea[J].Academic Journal of Second Military Medical University,2006,27(1):22-24.
(Continueonpage266)(Continuefrompage262)
[12] 漆淑华,钱培元,张偲.海洋细菌Pseudomonas sp.抗菌代谢产物的研究[J].天然产物研究与开发,2009,21(3):420-423. QI S H,QIAN P Y,ZHANG S.Antibacterial metabolites from marine bacterium Pseudomonas sp.[J].Natural Product Research and Development,2009,21(3):420-423.
[13] 付海超,钟惠民.海洋细菌Pseudomonas sp.次级代谢产物研究[J].青岛科技大学学报:自然科学版,2009,30(1):31-33. FU H C,ZHONG H M.Studies on the chemical constituents of marine bacterium Pseudomonas sp.[J].Journal of Qingdao University of Science and Technology:Natural Science Edition,2009,30(1):31-33.
[14] MITOVA M,TOMMONARO G,HENTSCHEL U,et al.Exocellular cyclic dipeptides from aRuegeriastrain associated with cell cultures ofSuberitesdomuncula[J].Marine Biotechnology,2004,6(1):95-103.
(责任编辑:米慧芝)
Analysis of the Secondary Metabolites of Marine BacteriumBacillussp.753
SUN Yulin1,2,YANG Meiyu1,XIN Xinxin1,GAN Wenheng1,GONG Zhenying1, LI Ling1,DENG Wenying1,LIU Xiao1,CHEN Daohai1,2
(1.Life Science and Technology School,Lingnan Normal University,Zhanjiang,Guangdong,524048,China;2.Round Beibu Gulf Institute for the Protection and Utilization of Marine Animals in Medicine,Zhanjiang,Guangdong,524048,China)
【Objective】To investigate the secondary metabolites of marine bacterium Bacillus sp.753 by various modern spectrum methods.【Methods】Constituents in the fermentation liquid of the marine bacteria were isolated and purified by silica gel,Sephadex LH-20,and semi-preparative reverse-phase HPLC(C18).Their structures were identified by NMR,MS and literatures.【Results】Twelve compounds were isolated from marine bacterium Bacillus sp.753 and their structures were identified as uridine (1),thymine (2),cyclo-(phe-lle) (3),cyclo-(ala-pro)(4),cyclo-(val-pro) (5),cyclo-(pro-leu) (6),cyclo-(phe-pro)(7),cyclo-(tyr-pro) (8),cyclo-(tyr-4-hydroxy-pro) (9),cyclo-(leu-pro)(10),cyclo-(pro-4-hydroxyl-lle) (11),cyclo-(D-pipecolinyl-L-leucine)(12).【Conclusion】Compounds 1~12 were isolated from this bacterium for the first time,which not only enriched the types of chemical composition in the Bacillus sp.753,but also increased the research value of the marine bacterium.
marine bacterium,Bacillus sp.753,chemical constituents,structure identification
http://www.cnki.net/kcms/detail/45.1075.N.20161123.1136.002.html
2016-08-15
孙玉林(1980-),男,讲师,主要从事海洋生物活性物质应用研究。
*岭南师范学院博士启动项目(ZL1313),广东省自然科学基金项目(2015A030310406),湛江海鲜食材资源可持续利用与保护科技服务平台项目(2014B040404071)和湛江海鲜食材资源可持续利用重点实验室项目(2015A06008)资助。
R914.4
A
1002-7378(2016)04-0258-05
网络优先数字出版时间:2016-11-23 【DOI】10.13657/j.cnki.gxkxyxb.20161123.001
**通信作者:孙玉林,E-mail:sunyulin07002@126.com;陈道海(1963-),男,教授,主要从事海洋药用动物的开发利用与保护研究,E-mail:daohaichen2002@163.com。
