天然本草添加卷烟烟气暴露大鼠肺组织代谢组学研究
2017-01-06苏加坤应旭辉罗娟敏王义明罗国安蔡继宝
苏加坤,应旭辉,罗娟敏,王义明,徐 达,罗国安,蔡继宝*
(1.江西中烟工业有限责任公司,江西 南昌 330096;2.珠海清大弘瑞生物科技有限公司,广东 珠海 519085;3.清华大学 化学系,北京 100084)
天然本草添加卷烟烟气暴露大鼠肺组织代谢组学研究
苏加坤1,应旭辉3,罗娟敏1,王义明2*,徐 达1,罗国安3,蔡继宝1*
(1.江西中烟工业有限责任公司,江西 南昌 330096;2.珠海清大弘瑞生物科技有限公司,广东 珠海 519085;3.清华大学 化学系,北京 100084)
应用代谢组学方法,比较研究了普通卷烟和含有天然本草添加剂卷烟对大鼠肺组织代谢的影响。运用液相色谱-质谱联用技术分别分析了对照组、普通卷烟及某品牌天然本草添加卷烟烟气暴露7,14,30 d时的大鼠肺组织样品,对所得数据用偏最小二乘判别分析(PLS-DA)进行模式识别并筛选生物标志物。结果显示,吸食普通卷烟和某品牌卷烟,均会损伤大鼠肺组织,造成磷脂代谢、脂肪酸代谢紊乱,其中有2只普通卷烟暴露组大鼠的肺组织样品显著异常,受到明显的氧化损伤。综合来看,特别是长时间烟气暴露状态下,吸食某品牌卷烟造成的肺组织损伤低于普通卷烟,表明烟草中添加天然本草在一定程度上可减轻烟气对机体的损伤。
液相色谱-质谱联用;代谢组学;天然本草添加卷烟;肺组织;生物标志物
吸烟有害健康早已得到人们的共识。为有效减少吸烟对人体健康的危害,国外烟草研究人员侧重于优化制烟工艺来降低卷烟的危害,如降低焦油释放量,但实际效果远不如预期[1-2]。我国学者自20世纪50年代起开始探讨天然本草与烟草的关系,并将其添加到卷烟中,以达到减毒降害的作用[3]。
代谢组学是通过研究外界干预等因素对生物体内代谢物造成的变化,从而更好地了解生物体的代谢过程[4-5],目前已被用于烟草相关减害机理的研究,如Vulimiri等[6]利用代谢组学方法研究了烟草主流烟气对肺上皮细胞的影响;石先哲等[7]用代谢组学方法研究了薄荷烟对大鼠尿液代谢的影响,认为在烟草中添加薄荷醇可减少烟草对大鼠的损伤。本研究运用液相色谱-质谱联用仪结合PLS-DA模式识别分析研究了普通卷烟和某品牌天然本草添加卷烟对大鼠肺组织代谢的影响,以期对烟气暴露引发的机体损伤及添加天然本草减害的机理进行解释,为天然本草在烟草减害中的应用提供科学依据。
1 实验部分
1.1 试剂与仪器
乙腈(质谱级)、甲醇(色谱级)均购自Fisher公司(USA),甲酸购自Acros公司(纯度98%,比利时)。亮氨酸-脑啡肽标准品(纯度≥97%,Leucine-enkephalin,LE)购于Sigma公司(USA)。LPC(16∶0)购于Avanti Polar Lipids公司(USA)。花生四烯酸(C20∶4)、亚油酸(C18∶2)、油酸(C18∶1)、棕榈油酸、棕榈酸购自Sigma-Aldrich公司(St.Louis,MO,USA)。实验用水为超纯水。
Waters AcquityTM超高效液相色谱系统(Waters,Millford,MA,USA),配备高压二元梯度泵、可控温自动进样器(最低4 ℃)和二极管阵列检测器。质谱检测器为Waters Premier TOF飞行时间质谱仪(Waters,Millford,MA,USA),配有ESI电离源接口和Lock-spray接口。Milli-Q超纯水系统(Millipore,Bedford,MD,USA)
1.2 动物实验及样本分析前处理
1.2.1 动物实验 90只Wistar大鼠分成 3组,分为对照组(空白对照,不暴露于烟气中)、普通卷烟组和某品牌天然本草添加卷烟组,每组30只,每组再分成3个小组,每个小组10只,分别烟气暴露7,14,30 d。普通卷烟和某品牌天然本草添加卷烟均由江西中烟工业有限责任公司提供。每只大鼠每天分别暴露20 min,控制卷烟烟气遮光率为70%,控制温度为(22±2) ℃,湿度保持在(21±0.5)%,氧气浓度保持在(21±0.5)%,压力为(101 325±40) Pa。在烟气暴露7,14,30 d时,分别给大鼠称重,经麻醉后取大鼠肺组织,用生理盐水洗净并用滤纸吸干水分,然后称重,在-80 ℃下保存。
1.2.2 肺组织样本前处理 取冻融后的肺组织样品,按1∶3(g/mL)加入生理盐水进行匀浆。取200 μL匀浆液,加入600 μL甲醇,涡旋2 min,于4 ℃下1 000 r/min离心15 min,取上清液过0.22 μm滤膜。
质量控制(QC)样品的制备:将烟气暴露14 d的所有待测大鼠肺组织匀浆液取出等量部分混合均匀后,按样品处理方法处理。
1.3 UPLC/Q-TOF-MS测定条件
色谱分离采用Waters公司AcquityTM-BEH C18反向分析柱(100 mm × 2.1 mm,i.d.1.7 μm,Waters,MA,USA),柱温为40 ℃,流速为0.4 mL/min。自动进样器温度设为4 ℃,每次进样4 μL。流动相:A为纯乙腈;B为0.1%甲酸水溶液,梯度洗脱程序:0~2 min,20%~55%A;2~11 min,55%~75%A;11~12 min,75%~95%A;12~15 min,95%A;15~16 min,95%~20%A;16~19 min,20%A。
质谱为电喷雾离子源(ESI),分析采用“V”模式,在负离子模式下采集数据。检测参数设置如下:脱溶剂气流量600 L/h,脱溶剂气温度350 ℃,锥孔气流量40 L/h,离子源温度120 ℃,毛细管电压2 500 V,锥孔电压30 V。质谱扫描范围为100~1 500m/z,扫描时间0.2 s,扫描间隔0.02 s。准确质量测定采用2 ng/mL亮氨酸-脑啡肽(Leucine-enkephalin,LE)溶液为锁定质量校准液,进行实时质量校正,质量校准选择“DRE”模式,流速2 μL/min。质量轴校准采用甲酸钠溶液(0.05 mol/L)进行。
1.4 数据处理与模式识别
1.4.1 色谱数据的提取和前处理 质谱数据处理采用Waters公司Markerlynx软件(Waters,MA,USA)进行色谱峰自动识别和峰匹配,将所得数据导入SIMCA-P软件(Umetrics AB,Ume.,Sweden)。采用SIMCA-P软件先对数据进行Mean-centering以及Pareto-scaling处理以减少大面积色谱峰带来的分析偏差,随后进行模式识别。两组间差异用t检验分析,p<0.05认为有显著性差异。
1.4.2 多元统计分析 首先采用无监督的PCA方法观察样本的聚集及离散状态以及离群点。为进一步区分烟气暴露组和对照组之间的组间差异,采用有监督的PLS-DA判定对于造成这种聚集和离散的主要差异变量,根据变量权重值(VIP)找到与吸烟密切相关的差异表达代谢物。
1.5 差异表达代谢物的鉴定
运用MassLynx软件中的i-Fit功能,对所筛查到的具有差异的代谢物进行分析,计算其可能的分子式,然后结合得到的精确质量数,在数据库(如KEGG,http://www.genome.jp;HMDB,http://www.hmdb.ca)中检索来鉴定标志物,部分标志物用标准品验证。


图1 大鼠肺组织典型样品在负模式(A)和正模式(B)下的质谱BPI图Fig.1 Base peak intensity(BPI) chromatograms of typical sample of rat lung in negative model(A) and positive model(B)

图2 肺组织QC样品在负模式下的质谱BPI图Fig.2 Base peak intensity(BPI) chromatogram of QC samples in negative model
2 结果与讨论
2.1 吸烟对大鼠体重的影响
各组大鼠在不同时期的体重变化结果显示,两吸烟组大鼠的体重增长明显减缓,与对照组相比具有显著差异;至实验后期,普通卷烟组的差异更为显著。这表明吸烟对大鼠体重生长有显著地抑制作用,普通卷烟抑制作用更显著。
2.2 生物样品的UPLC/Q-TOF-MS分析
在分析之前用QC样本考察了肺组织样品在质谱正、负离子模式下的响应情况。结果发现,在正离子模式下基线本底较高,信息量少;相比正离子模式,负离子模式具有更为丰富的信息(如图1),所以本研究采用负离子检测模式。
用QC样品考察了样品的长期稳定性,结果显示样品在36 h内稳定;至48 h,较多物质的信号衰减,成分发生改变,所以处理完的样品应在36 h内分析完毕。同时,为了保证分析方法的可靠性,在分析过程中穿插6个QC样品,从基峰强度(BPI)色谱图中选取8个典型的色谱峰,统计保留时间(Retention time,tR)和峰强度(Intensity)的变化情况,考察了方法和样品的稳定性,QC样本的BPI图见图2。结果显示,各色谱峰的保留时间相对标准偏差(RSD)为0.03%~0.37%,峰强度RSD为3.0%~6.9%,均小于10%,仪器的精密度及化合物的稳定性符合代谢组学研究的要求[8]。
2.3 烟气暴露大鼠代谢组学分析
采用 PCA方法对对照组、普通卷烟组和某品牌天然本草添加卷烟组大鼠肺组织样本的代谢谱数据按不同烟气暴露时间分别进行模式识别。从结果来看,虽然对照组与两卷烟暴露组基本能分开,但组内样品间离散较为严重,说明组内的个体差异较大,因此进一步采用偏最小二乘判别分析(PLS-DA)对各组样本进行判别分析。PLS-DA模式识别结果显示,各样品组内的聚集情况较好,组间也能得到较好分离,烟气暴露7 d的大鼠肺组织样品的模式识别对比结果见图3。




图4 烟气暴露大鼠不同时期肺组织样品的PLS-DA分析结果Fig.4 PLS-DA results for three groups of rats suffering different smoke exposed timesA,B,C are are lung samples of rats smoked for 7,14,30 days, respectively;□:normal control,+:normal tobacco smoked rats,△:certain commercial tobacco smoked rats
将所有样品用PLS-DA模式进行识别分组,结果见图4。可以看出各肺组织样品的组内聚集情况均较好,各组间均能得到有效分离,对照组与两吸烟组均有较好的分离,说明吸烟对机体的代谢有一定影响,造成代谢紊乱,但某品牌天然本草添加卷烟与普通卷烟两组间也具有较好分离,说明两者对机体的影响有一定的差异。随着烟气暴露时间的增长,3组间保持着一定的分离,说明作为烟气进入体内的直接作用器官,肺组织一直受到慢性损伤。
2.4 潜在生物标志物的鉴定
根据PLS-DA分析中的VIP值,筛选具有明显差异的化合物,共找到11个具有差异的化合物,结果如表1所示。
图5列出了几种已用标准品鉴定的重要代谢物在对照组大鼠、普通卷烟组大鼠和某品牌天然本草添加卷烟组大鼠肺组织样本中的相对含量变化。LPC(16∶0)与磷脂代谢有关,烟气暴露的两组大鼠因烟气的吸入造成磷脂大量降解,暴露30d后,某品牌天然本草添加卷烟降低的程度显著低于普通卷烟组,说明某品牌天然本草添加卷烟在大鼠磷脂代谢紊乱时,具有一定的保护作用使其受到的损害减少而接近正常组。
本研究经多元统计分析筛选得到的标志物中,大多是与磷脂及脂肪酸代谢相关的标志物。已有文献报道吸烟会引起磷脂降解[6],因此体内磷脂代谢异常可能与烟气中氧化性物质的吸入对机体细胞膜、脂蛋白、脂质等产生影响有关[6,9-10],而磷脂代谢的异常会增加心血管疾病的风险[11],特别是花生四烯酸水平的升高是心血管疾病的重要标志物之一[12],同时也是机体发生炎症反应的重要标志物之一[5],而炎症的发生与心血管疾病、癌症等疾病相关[13-14]。二十二碳五烯酸是亚麻酸的氧化产物,其水平减少与多种疾病相关,如冠心病、糖尿病[15]。

表1 潜在差异标志物的鉴定结果
tR:retention time;↑:up regulated;↓:downregulated,compared with normal control group;*:confirmed with reference substances


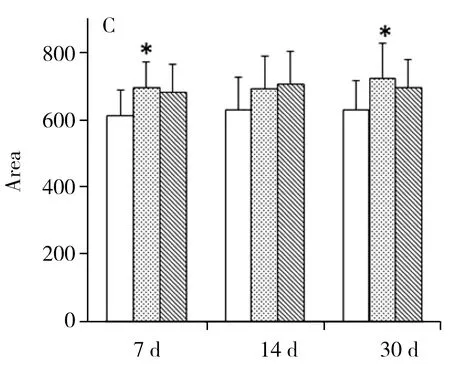
图5 重要标志物在大鼠不同烟气暴露时期的含量变化趋势图
花生四烯酸在体内由油酸转化而来,主要以磷脂的形式存在。当机体受到刺激时,花生四烯酸可以转化成前列腺素(PG),从而发挥多种生物活性。因此当大鼠受到烟气刺激时,体内产生了大量的花生四烯酸以保护机体。花生四烯酸在各烟气暴露组的水平均有上升,在暴露30 d时显示出显著差异,某品牌天然本草添加卷烟组整体水平略低于普通卷烟组,说明某品牌天然本草添加卷烟组大鼠受到的损害相对较小。
亚油酸在磷脂降解时产生,烟气暴露组的水平高于对照组,但吸食普通卷烟与某品牌天然本草添加卷烟对机体造成的损伤程度有所不同,吸食某品牌卷烟造成的损害相对较小,可能是某品牌天然本草添加卷烟中的天然本草成分高温裂解后可减少一些自由基等物质,从而减少因氧化应激造成的磷脂降解[16]。
大鼠在接触烟气时产生应激反应从而出现损伤,但总体来讲,某品牌天然本草添加卷烟的大鼠损伤程度较低,说明添加有天然本草添加剂的某品牌卷烟对机体有一定保护作用。但目前对于天然本草添加剂在卷烟中的作用机理仍然说法不一。一般认为,当含有天然本草添加剂的卷烟在燃烧时,该本草添加剂经挥发和升华等形成微粒相和气相成分,该类物质可捕获烟气中的自由基,降低多环芳烃类物质的生成,同时作用于呼吸系统或被肺泡吸收进入血液,从而对局部或全身起作用,减轻吸烟所引起的不良后果,使机体慢慢恢复[3]。
从吸食普通卷烟大鼠的肺组织样本外观来看,其表面有明显黑色沉着,特别是显著异常的样本,肺组织表面有大量黑色沉着。通过比较该异常样品与正常样品的色谱图(图6),可见两者的主要差异体现在图中方块所圈定的部分,通过进一步质谱解析(表2),发现多个与氧化损伤、炎症及癌症相关的潜在生物标志物。1-羟基芘是烟气中芘的代谢物,其作为多环芳烃代表性的致癌标志物多有报道[17]。7-甲基鸟苷是DNA甲基化产物,与癌症有显著相关性,甲基化DNA的产生也可以很好地反映烟气的氧化应激能力[18]。DNA氧化损伤后,若DNA修复不完全,或修复基因缺失,会造成染色体畸变和癌基因、抑癌基因突变,最终造成细胞癌变[19]。9,10-二羟基十八碳二烯酸和乙酰基-5-甲氧基犬尿氨酸均为氧化损伤的标志物。8-异前列腺素F2a和前列腺素D2均为脂质过氧化的产物,其中8-异前列腺素F2a由花生四烯酸氧化产生,与细胞膜的脂质过氧化作用有关,其水平可以反映机体内氧化应激和脂质过氧化的水平[20]。(异)前列腺素类物质水平的提高也是体内炎症反应发生的信号[21]。因此,可以看出该大鼠的肺组织因烟气暴露而受到了严重的氧化损伤,出现了炎症反应,并出现了与癌症相关的生物标志物。在含有天然本草添加剂的某品牌卷烟烟气暴露组大鼠的肺组织样本中未找到癌症相关的标志物,但长期吸食造成的磷脂代谢、脂肪酸代谢紊乱仍然会对机体造成慢性损伤,该结果与美国健康研究所的研究结果相符,他们在大量流行病学研究结果基础上得出的结论认为与未用过滤嘴或高焦油卷烟的烟民相比,吸用滤嘴或低焦油烟得肺癌和心脏病的发病率有显著差异,但是慢性肺部疾病无显著差异性[22]。
本实验中普通卷烟暴露组的大鼠共有30只,有2只出现严重的氧化损伤,这说明不同个体对于烟草中致癌物的敏感性有所不同,该结果也符合流行病学统计数据。据统计,尽管有80%~90%的肺癌与烟草暴露有关,但吸烟者中只有少于20%的人发展成为肺癌[23]。

图6 烟气暴露第14 d对照组正常肺组织样品(A),某品牌卷烟组肺组织样品(B)和普通烟组异常肺组织样品(C)的质谱负模式BPI图Fig.6 Base peak intensity(BPI) chromatograms of lung sample of normal control group(A),lung sample from a certain commercial tobacco(a specific tobacco with herbal additives) group(B) and abnormal lung sample from normal tobacco group(C) at 14 d exposed to smoke

表2 异常肺组织样品重要标志物的鉴定结果
3 结 论
本文运用液相色谱-质谱联用技术并结合PLS-DA模式识别分析方法研究了不同烟气暴露时期正常大鼠、普通卷烟组和某品牌天然本草添加卷烟组大鼠肺组织的代谢谱。结果表明,普通卷烟和某品牌天然本草添加卷烟均会对大鼠的肺组织造成损伤,特别是长期暴露会造成磷脂代谢、脂肪酸代谢等紊乱,但总体来说,天然本草添加卷烟对大鼠的损伤程度低于普通卷烟。目前天然本草添加剂中改善烟气对体内代谢的影响的物质基础仍然未知,其作用机制的阐明有待后续的进一步研究。
[1] Stavridis I,Deliconstantinos G.European Patent,PCT/GR94/00015.
[2] Berger C.United States Patent,US005713376A.
[3] Meng D L,Liu S H.Chin.Tob.Sci.(孟冬玲,刘绍华.中国烟草科学),2006,27(3):19-21.
[4] Zhu C,Liang Q L,Wang Y M,Luo G A.Chin.J.Anal.Chem.(朱超,梁琼麟,王义明,罗国安.分析化学),2010,38(7):1060-1068.
[5] Jia M Q,Xue Y,Wang Y,Xiong Y J,Yan C.J.Instrum.Anal.(贾孟琪,薛芸,王彦,熊野娟,阎超.分析测试学报),2016,35(2):172-178.
[6] Vulimiri S V,Misra M,Hamm J T,Mitchell M,Berger A.Chem.Res.Toxicol.,2009,22(3):492-503.
[7] Shi X Z,He Z H,Dou A B,Zhang F X,Lian W L,Xu G W.Chin.J.Chromatogr.(石先哲,何智慧,窦阿波,张凤霞,练文柳,许国旺.色谱),2010,28(8):765-768.
[8] Jiang Z T,Sun J B,Liang Q L,Cai Y F,Li S S,Huang Y,Wang Y M,Luo G A.Talanta,2011,84(2):298-304.
[9] Kaplan M,Aviram M.Clin.Chem.Lab.Med.,1999,37(8):777-787.
[10] Vayssier-Taussat M,Camilli T,Aron Y,Meplan C,Hainaut P,Polla B S,Weksler B.Am.J.Physiol.HeartCirc.Physiol.,2001,280(3):H1293-H1300.
[11] Lu Z L.Chin.J.Cardiol.(陆宗良.中华心血管病杂志),2001,29(5):62-64.
[12] Yalcin M,Aydin C.Clin.Exp.Pharmacol.Physiol.,2009,36(4):447-453.
[13] Semenza G L,Ruvolo P P.Biochim.Biophys.Acta,2016,1863:379-381.
[14] Coussens L M,Werb Z.Nature,2002,420(6917):860-867.
[15] Pedersen M H,Molgaard C,Hellgren L I,Lauritzen L.J.Pediatr.,2010,157(3):395-401.
[16] Qi J S.J.SouthwestUniv.Nationalities:Nat.Sci.Ed.(祁俊生.西南民族大学学报:自然科学版),1998,1:35-37.[17] Scherer G,Frank S,Riedel K,Meger-Kossien I,Renner T.CancerEpidemiol.Biomark.Prev.,2000,9(4):373-380.[18] Harman S M,Liang L,Tsitouras P D,Gucciardo F,Heward C B,Reaven P D,Ping W,Ahmed A,Cutler R.FreeRadicBiol.Med.,2003,35(10):1301-1309.
[19] Androutsopoulos V P,Tsatsakis A M,Spandidos D A.BMCCancer,2009,9:187.
[20] Morrow J D,Minton T A,Mukundan C R,Campbell M D,Zackert W E,Daniel V C,Badr K F,Blari I A,Roberts L J.J.Biol.Chem.,1994,269(6):4317-4326.
[21] Fujitani Y,Kanaoka Y,Aritake K,Uodome N,Okazaki-Hatake K,Urade Y.J.Immunol.,2002,168(1):443-449.[22] Rickert W S,Robinson J C,Young J C,Collishaw N E,Bray D F.Prev.Med.,1983,12(5):682-694.
[23] Wynder E L,Hoffmann D.CancerRes.,1994,54(20):5284-5295.
Lung Metabolome Research of Rats Exposed to Tobacco Smoke with Herbal Additives by Liquid Chromatography-Mass Spectrometry
SU Jia-kun1,YING Xu-hui3,LUO Juan-min1,WANG Yi-ming2*,XU Da1,LUO Guo-an3,CAI Ji-bao1*
(1.Tobacco Jiangxi Industrial Co.,Ltd.,Nanchang 330096,China;2.Zhuhai Qingda Hongrui Biotechnology Co.,Ltd.,Zhuhai 519085,China;3.Department of Chemsitry,Tsinghua University,Beijing 100084,China)
The effect of tobacco with herbal additives on the global metabolome of rat lung was studied using liquid chromatography-mass spectrometry(LC-MS).Lung samples from control rats,normal tobacco smoked rats and a certain commercial tobacco(a specific tobacco with herbal additives)smoked rats were analyzed,and the groups were exposed to smoke for one week,half month and one month,respectively.The data were processed by the method of partial least squares discriminant analysis(PLS-DA).The potential biomarkers were screened out according to VIP(Variable Importance in the Projection) and identified by database and standards.The PLS-DA results of different tobacco exposed periods showed that the metabolism of both the normal tobacco exposed group and the certain commercial tobacco exposed group were affected,mainly including phospholipid metabolism and fatty acid metabolism.In particular,two lung samples from rats exposed to normal tobacco were abnormal significantly as a result of suffering from a serious oxidative damage.Overall,especially prolonged exposure to smoke,the smoke damage of the certain commercial tobacco smoked rats was lower than that of the normal tobacco smoked rats,indicating that adding some herbal additives to tobacco could contribute at least partly to reduce the harm caused by smoking.
liquid chromatography-mass spectrometry(LC-MS);metabonomics;tobacco with herbal additives;lung;biomarker
2016-04-05;
2016-06-29
中国烟草总公司重大专项项目(110201401025(JH-03))
10.3969/j.issn.1004-4957.2016.12.002
O657.72;TS452.4
A
1004-4957(2016)12-1521-07
*通讯作者:蔡继宝,研究员,研究方向:烟草化学,Tel:0791-88286946,E-mail:jbcai@ustc.edu.cn 王义明,教授,研究方向:生命分析化学,Tel:010-62781688,E-mail:wangyiming1688@163.com
