干旱胁迫对冬小麦幼苗叶片光合生理特性的影响
2017-01-06张庆琛郑少萌刘应敏裴冬丽
张庆琛,郑少萌,刘应敏,裴冬丽
(1.河南农业大学农学院,河南粮食作物协同创新中心,河南郑州450002;2.商丘师范学院植物与微生物互作重点实验室,河南商丘476000;3.新疆农业大学林业研究所,新疆乌鲁木齐830052)
干旱胁迫对冬小麦幼苗叶片光合生理特性的影响
张庆琛1,2,郑少萌1,刘应敏2,3,裴冬丽2
(1.河南农业大学农学院,河南粮食作物协同创新中心,河南郑州450002;2.商丘师范学院植物与微生物互作重点实验室,河南商丘476000;3.新疆农业大学林业研究所,新疆乌鲁木齐830052)
为了解冬小麦幼苗叶片光合生理指标对干旱胁迫的响应,以周麦22为材料,研究了20%PEG-6000持续胁迫以及复水对小麦幼苗叶片的光合作用、光合关键酶和抗氧化酶活性的影响。结果表明,随着干旱的持续,与对照组相比,干旱组小麦幼苗叶片的叶绿素(a+b),叶绿素a/叶绿素b,Rubisco活性及生物量均下降,根冠比增加;净光合速率及PEPC,PPDK,NADP-ME,SOD,CAT,APX,POD活性均呈先升后降趋势,最大增幅分别为18.4%(处理1 d),77.6%(处理1 d),79.2%(处理3 d),69.2%(处理1 d),155.6%(处理3 d),71.6%(处理3 d),129.4%(处理3 d),143.5%(处理1 d),复水3 d各参数均有所恢复。说明短期干旱胁迫诱导冬小麦幼苗叶片的C4途径光合酶活性的高表达,部分补偿了Rubisco活性下降对光合固碳造成的不利影响;诱导抗氧化酶活性的增加,有效增强了活性氧清除能力,减轻了氧化带来的伤害;C4途径光合酶可能在冬小麦耐旱生理机制中起着重要作用。
冬小麦;幼苗;干旱胁迫;气体交换参数;光合酶;抗氧化酶
干旱是影响小麦生长发育和产量形成的重要因素之一,尤其在苗期,干旱会引起小麦分蘖不足、叶片叶绿素含量和可溶性蛋白含量下降、苗弱、根冠比增加,对中后期生长造成不可恢复的不利影响[1]。因此,在小麦幼苗期开展干旱逆境研究是其耐旱机制探讨的一个重要生育时期。水分短缺会诱导小麦幼苗叶片抗氧化系统酶活性增加,从而清除因逆境产生的活性氧的危害[2];同时水分短缺不利于小麦幼苗叶片进行光合作用[3],降低了干物质质量[4]。在许多C3作物叶片中除存在Rubisco外还含有一套完整的PEPC,PPDK,NADP-ME等C4途径光合酶系统[5-8],植株在正常生长条件下,C4光合酶活性较低,但在逆境条件下其活性会发生变化[9]。水稻在光氧化条件下,其叶片PEPC活性增加[10];小麦在轻度干旱条件下,其旗叶和穗器官的C4光合酶活性增加,可以一定程度上调节逆境对光合作用的影响[11]。贾少磊等[12]分析了一天内西农1043幼苗叶片光合酶对干旱的响应,结果发现,C4光合关键酶活性增加。然而,有关长时间干旱、复水后,小麦幼苗叶片光合酶、抗氧化酶活性的动态响应以及光合酶与耐旱性关系的报道少见。
本试验测定和分析了7 d持续干旱及复水后周麦22幼苗叶片的光合特性、光合关键酶和抗氧化酶的变化,旨在了解冬小麦光合生理指标对干旱的响应情况,为冬小麦耐旱育种提供一定的理论依据。
1 材料和方法
1.1 试验材料
供试材料为河南省主栽冬小麦品种周麦22,由商丘师范学院植物与微生物互作重点实验室提供。
1.2 试验方法
精选饱满的种子,经10%H2O2浸泡消毒10min,用自来水冲洗数次,25℃催芽2d,待胚根长至2cm,移至Hoagland营养液的培养箱(54 cm×35 cm× 20 cm)(含自制42孔浮漂板用于载苗),每箱定苗42株,然后放入人工气候室培养,每24 h更换一次营养液。气候室昼/夜温度为25℃/20℃,光周期为18 h/6 h,光强为800 μmol/(m2·s)。待幼苗生长至四叶一心时,利用添加 20%PEG-6000的Hoagland营养液进行处理,并设不添加PEG为对照组,每个处理10箱重复。分别于干旱胁迫0,1,3,5,7 d和复水1 d(R1),3 d(R3)测定相关指标。
1.3 测定项目及方法
1.3.1 气体交换参数 于 9:00—11:00利用Li-6400XT便携式光合仪测定第4片完全展开且受光一致的叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)。测定时设置叶室温度为25℃,光强为1 000 μmol/(m2·s),3次重复。
1.3.2 叶绿素含量和水分利用效率(WUE) 选取第4片叶,参照李合生[13]的方法测定叶绿素含量,参照Fischer等[14]的方法计算单叶水平上的WUE。 3次重复。WUE(μmol/mmol)=Pn/Tr。
1.3.3 生物量 于干旱胁迫0,3,7 d和复水3 d,每个处理选取10株并分离地上部和根,105℃杀青20 min,80℃烘至恒质量测其质量,并计算根冠比。
1.3.4 光合关键酶(Rubisco,PEPC,PPDK和NADPME)活性 酶液提取按Ku等[15]的方法稍作改进。取0.5g叶样液氮磨碎,加4mL预冷的提取液(50mmol/L Tirs-HCl(pH值 7.0),10 mmol/L MgCl2,1 mmol/L EDTA,5 mmol/L DTT,5%PVP,10%甘油),4℃,12 000 r/min离心20 min,上清液即为酶粗提液,并按照Bradford[16]的方法对可溶性蛋白浓度进行测定。光合酶测定按以下具体方法操作,6次重复。
Rubisco活性测定参照Camp等[17]的方法进行。1 mL反应体系含50 mmol/L Tricine-NaOH(pH值7.9),10 mmol/L KCl,1 mmol/L EDTA,2 mmol/L DTT,0.2 mmol/L NADH,5 mmol/L ATP,15 mmol/L MgCl2,10 mmol/L NaHCO3,5 mmol/L磷酸肌酸,2 U肌酸磷酸激酶,4 U 3-磷酸甘油酸激酶和3-磷酸甘油醛脱氢酶,30℃保温10 min,最终加入0.5 mmol/L RuBP启动反应。并且按照如下公式计算酶活性。
Rubisco活性(μmol/(mg·h))=(ΔA340×N)/(6.22×2×d×Δt×V×C)。其中,酶活性为每小时每毫克蛋白固定CO2的微摩尔数;ΔA340为340 nm吸光度的变化值;N为酶液稀释倍数;6.22为每微摩尔NADH在340 nm处的吸光系数;2表示每固定1 mol CO2还原2 mol NADH;d为比色光程(cm);Δt为ΔA340所用时间(h);V为酶液用量(mL);C为酶液蛋白含量(mg/mL)。
PEPC活性测定参照Ku等[15]的方法进行。1 mL反应体系含50 mmol/L Tricine-KOH(pH值8.0),0.1 mmol/L EDTA,10 mmol/L MgCl2,0.2 mmol/L NADH,10 mmol/L NaHCO3,1 mmol/L DTT,3 U NAD-苹果酸脱氢酶,0.03 mL酶液,30℃保温10 min,最终加入2 mmol/LPEP启动反应。PEPC活性(μmol/(mg·h))计算同Rubisco。
PPDK活性测定参照Sayre等[18]的方法稍作改进。1 mL反应体系含0.1 mol/LTris-HCl(pH值8.0),10 mmol/L MgCl2,0.1 mmol/L EDTA,5 mmol/L DTT,1.25 mmol/L丙酮酸,50 mmol/L NaHCO3,2.5 mmol/L K2HPO4,2 U PEPC,3 U MDH,0.16 mmol/L NADH,0.03mL酶液,30℃保温10min,最终加入1.25mmol/L ATP启动反应。PPDK活性(μmol/(mg·h))计算同Rubisco。
NADP-ME活性参照Sayre等[18]的方法稍作改进。1 mL反应体系中含有2.5 mmol/L Tris-HCl(pH值8.3),0.5 mmol/L EDTA,2.5 mmol/L L-苹果酸,0.25 mmol/LNADP,0.03 mL酶液,30℃保温10 min,最终加入5 mmol/L MgCl2启动反应。NADP-ME活性(U/(mg·h))以每分钟A340减少0.01为一个酶活单位。
1.3.5 抗氧化酶(SOD,CAT,APX和POD)活性采用PBS缓冲液提取酶液,SOD活性测定参照氮蓝四唑(NBT)光化学还原法进行[13];CAT,POD活性测定按张志良等[19]的方法进行;APX活性按沈文飚等[20]的方法进行测定,分别以每分钟A240,A470,A290变化0.01为一个酶活单位。6次重复。
1.4 数据处理
采用Microsoft Excel和SPSS 13.0软件进行相关数据的统计和分析。
2 结果与分析
2.1 干旱胁迫对小麦叶片光合特性的影响
2.1.1 对气体交换参数的影响 由图1可知,随着干旱时间持续,干旱组小麦幼苗叶片的净光合速率、蒸腾速率和气孔导度均呈先升后降的趋势,其中,胁迫1 d后,净光合速率达到21.7 μmol/(m2·s),较对照组提高了18.4%,胁迫7d降至3.8μmol/(m2·s),较对照下降了79.3%;胞间CO2浓度则呈先降后升的趋势;复水后干旱组的各气体交换参数均有所恢复,但干旱组的光合速率、蒸腾速率和气孔导度仍显著低于对照组。说明短期干旱胁迫能够通过增加蒸腾和气孔调节等方式维持较高净光合速率;长期持续干旱胁迫,会迅速诱导叶片蒸腾下降和气孔关闭,以减少水分的散失;干旱持续7 d对小麦气体交换参数产生了较深远的影响。
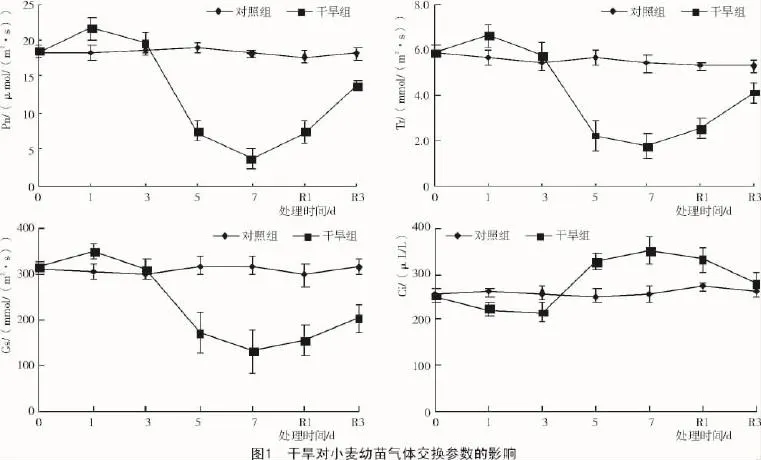
2.1.2 对叶绿素含量和WUE的影响 植物叶片叶绿素(a+b)含量大小可反映捕获光能能力的高低,叶绿素a/叶绿素b的值与光能转换能力密切相关。由图2可知,干旱组小麦幼苗叶绿素(a+b)含量和叶绿素a/叶绿素b自从水分胁迫3 d后开始均显著低于对照组,胁迫7 d后降幅达到最大,分别下降了45.3%和24.8%;复水后叶绿素(a+b)含量和叶绿素a/叶绿素b的值有所恢复,但仍显著低于对照组。表明持续干旱会明显减少叶绿素含量,抑制叶片光能捕获与转化能力,这也与前述净光合速率等测定结果相印证。
干旱组小麦幼苗的水分利用效率在胁迫5 d内与对照组间均无显著差异,但是在干旱7 d降至2.1 μmol/mmol,下降了13.1%;复水后水分利用效率逐渐恢复。表明持续干旱通过影响净光合速率间接影响着水分利用效率(图3)。


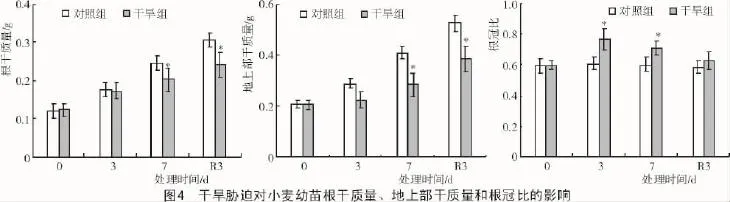
2.1.3 对生物量的影响 从图4可以看出,随着干旱时间的持续,干旱组小麦幼苗的根干质量、地上部干质量较对照组均下降,复水后仍显著低于对照组,说明持续干旱胁迫7 d对小麦地上部、根部等生物量造成了较长远的不利影响。而根冠比随着干旱时间的持续而增加,胁迫3,7 d均显著高于对照组,说明冬小麦幼苗可以通过增加根冠比部分缓解水分胁迫造成的不利影响。
2.2 干旱胁迫对光合关键酶活性的影响
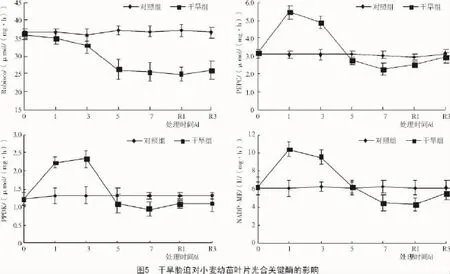
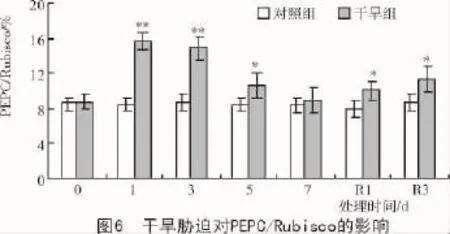
从图5可以看出,正常水分条件下,Rubisco,PEPC,PPDK,NADP-ME光合关键酶活性在各个测定时刻与对照间均无明显差异。随胁迫时间的延长,干旱组的Rubisco呈下降趋势,复水1 d降至最低,下降了32.0%,复水3 d后略有回升,但仍显著低于对照组;C4途径PEPC,PPDK,NADP-ME酶活性均呈先升后降趋势,最大增幅分别达到了77.6%(处理1 d),79.2%(处理3 d),69.2%(处理1 d),最大降幅分别为26.2%(处理7 d),27.6%(处理7 d),30.0%(复水1 d)。PEPC/Rubsico值可反映C4途径酶活性的相对强弱,短期干旱胁迫和复水后干旱组的PEPC/Rubsico比对照组显著提高,干旱7 d与对照组无明显差异(图6)。说明短期干旱诱导C4途径光合酶活性的增加,补偿Rubsico活性下降对光合作用的不利影响,从而维持较高的净光合速率;但是长期胁迫迅速降低了各酶活性,影响了光合固碳能力。
2.3 干旱胁迫对抗氧化酶活性的影响
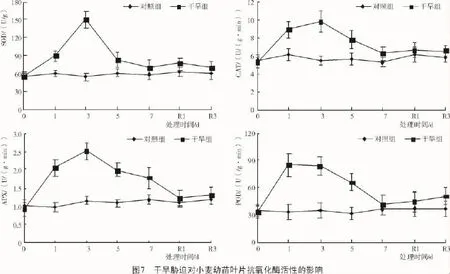
从图7可以看出,干旱组小麦幼苗叶片SOD,CAT,APX和POD活性均随持续胁迫基本呈先升后降的趋势,较对照组各时刻均有所增加,分别最大提高了155.6%(处理3 d),71.6%(处理3 d),129.4%(处理3 d),143.5%(处理1 d)。复水后干旱组除POD活性有所升高外,其他酶活性均接近于对照组。说明短期干旱胁迫可诱导抗氧化酶活性的增加,有利于清除活性氧对其自身的氧化伤害。
3 讨论与结论
叶绿素在光能捕获和转换中起着重要作用,Rubisco为C3途径的关键酶,在小麦等C3作物的光合固碳中起着重要作用。本研究结果发现,干旱胁迫降低了冬小麦幼苗叶片的叶绿素含量和Rubisco活性,抑制了植株生长,增加了根冠比,表明干旱胁迫影响光合作用和生物量的形成,这与前人研究结果相一致[3,12]。复水3 d内,干旱组的叶绿素含量、Rubisco活性、根干质量、地上部干质量等指标有所恢复,但仍显著低于对照组,说明持续干旱7 d对小麦光合、生物量造成了较深远的不利影响,这为从事小麦干旱逆境研究工作提供了一定借鉴。
PEPC,PPDK,NADP-ME等为C4途径的关键酶,在小麦中其活性存在差异[7],PEPC具有固定大气CO2和再固定C3作物呼吸释放CO2的作用[21]。本研究结果发现,冬小麦幼苗叶片的PEPC,PPDK,NADP-ME等C4光合酶变化随持续干旱呈先升后降的趋势,与净光合速率的变化趋势相似,表明短期干旱诱导C4光合酶活性高表达,部分补偿了因Rubisco活性下降对光合固碳造成的不利影响,这可能是冬小麦在水分胁迫下仍保持较高的净光合速率的重要原因。然而,长期干旱胁迫使得C3,C4光合酶活性,叶绿素(a+b)含量和叶绿素/叶绿素b的值下降,超出冬小麦叶片生理基础,导致其净光合速率急剧下降。
干旱等逆境将打破植物体内活性氧产生与清除的动态平衡关系,导致活性氧在体内大量积累。抗氧化系统的酶类主要有SOD,CAT,APX和POD等,在干旱胁迫下植株酶活性增加有效增强活性氧清除能力,减轻氧化伤害,以实现构建新的动态平衡的目的[22]。本研究结果发现,随着干旱的持续,冬小麦幼苗叶片SOD,CAT,APX和POD抗氧化酶活性变化呈先升后降趋势,表明短期胁迫诱导抗氧化酶活性增加,用以维系新的动态平衡,但随胁迫的持续活性氧的积累超出抗氧化酶清除能力,其活性反被抑制呈现下降。复水后干旱组SOD,CAT,APX活性恢复接近于对照组的值,而POD活性仍有所升高,可能是由POD双重性作用引起的,即POD一方面可清除H2O2,表现为保护效应;一方面在逆境后期参与叶绿素的降解、活性氧的生成,表现为伤害效应[22]。
抗氧化酶系统能够积极响应干旱胁迫,此系统清除活性氧的过程被认为是作物耐旱机制的一个重要方面。然而,耐旱机制是一个复杂的过程,已有研究表明,C3途径关键酶Rubisco在小麦中可作为一个耐旱的代谢指标[23]。本试验还发现,C4光合关键酶(PEPC,PPDK,NADP-ME)活性也能够积极响应干旱胁迫,故推测C4光合关键酶可能在冬小麦耐旱生理机制中起着重要作用。
[1]曹翠玲,李生秀.水分胁迫下氮素对分蘖期小麦某些生理特性的影响[J].核农学报,2004,18(5):402-405.
[2]单长卷,赵新亮,汤菊香.水杨酸对干旱胁迫下小麦幼苗抗氧化特性的影响[J].麦类作物学报,2014,34(1):91-95.
[3]叶君,邓西平,王仕稳,等.干旱胁迫下褪黑素对小麦幼苗生长、光合和抗氧化特性的影响[J].麦类作物学报,2015,35(9):1-9.
[4]郭瑞盼,辛泽毓,王志强,等.干旱胁迫对小麦非结构性碳水化合物代谢的影响及其与抗旱性的关系[J].华北农学报,2015,30(2):202-211.
[5]Nutbeam A R,Duffus C M.Evidence for C4photosynthesis in barley pericarp tissue[J].Biochemical and Biophysical Research Communications,1976,70:1198-1203.
[6]Aoyagi K,Bassham J A.Pyruvate orthophosphate dikinase of C3seeds and leaves as compared to the enzyme from maize[J].Plant Physiology,1984,75:387-392.
[7]Signal H R,Sheoran I S,Singh R.In vitro enzyme activities and product of 14 CO2assimilation in flag leaf and ear parts of wheat[J]. Photosynthesis Research,1986,8:113-122.
[8]Hibberd J M,Quick W P.Characteristics of C4photosynthesis in stems and petioles of C3flowering plants[J].Nature,2002,415:451-453.
[9]李卫华,郝乃斌.C3植物中C4途径的研究进展[J].植物学通报,1999,16(2):97-106.
[10]焦德茂,季本华.光氧化条件下两个水稻品种光合电子传递和光合酶活性的变化[J].作物学报,1996,22(1):43-48.
[11]魏爱丽,王志敏,翟志席,等.土壤干旱对小麦旗叶和穗器官C4光合酶活性的影响[J].中国农业科学,2003,36(5):508-512.
[12]贾少磊,吕金印,刘昌欣,等.PEG胁迫对抗旱性不同的小麦幼苗光合关键酶活性的影响 [J].麦类作物学报,2014,34(7):976-982.
[13]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:130-134,267-268.
[14]Fischer R A,Turner N C.Plant production in the arid and semiarid zones[J].Annual ReviewofPlant Physiology,1978,29:277-317.
[15]Ku M S B,Agarie S,Nomura M,et al.High-level expression of maize phosphoenolpyruvate carboxylase in transgenic rice plants[J]. Nature Biotechnology,1999,17:76-80.
[16]Bradford MM.A rapid and sensitive method for the quantitation of microgramquantities ofprotein utilizingthe principle ofprotein-dye dinding[J].Annals ofBiochemics,1976,72:248-254.
[17]Camp P J,Huber S C,Burke J J,et al.Biochemical changes that occur during senescence of wheat leaves[J].Plant Physiology,1982,70:1641-1646.
[18]Sayre R T,KennedyR A,Pringnitz D J.Photosynthetic enzyme activities and localization in Mollugo verticillata populations differing in the levels of C3and C4cycle operation[J].Plant Physiology,1979,64:293-299.
[19]张志良,瞿卫菁,李小方.植物生理学实验指导[M].北京:高等教育出版社,2009:277-278.
[20]沈文飚,徐朗莱,叶茂炳,等.抗坏血酸过氧化物酶活性测定的探讨[J].植物生理学通讯,1996,32(3):203-205.
[21]Matsuoka M,Hata S.Comparative studies of phosphoenolpyruvate carboxylase from C3and C4plants[J].Plant Physiology,1987,85:947-951.
[22]赵丽英,邓西平,山仑.活性氧清除系统对干旱胁迫的响应机制[J].西北植物学报,2005,25(2):413-418.
[23] Nagya Z,Németha E,Guóth A,et al.Metabolic indicators of drought stress tolerance in wheat:Glutamine synthetase isoenzymes and Rubisco [J].Plant Physiology and Biochemistry,2013,67:48-54.
Effects of Drought Stress on Photosynthetic Physiology Characteristics in Winter Wheat Seedling Leaves
ZHANGQingchen1,2,ZHENGShaomeng1,LIUYingmin2,3,PEI Dongli2
(1.College ofAgronomy,Henan Agricultural University,Collaborative Innovation Center ofHenan Grain Crops,Zhengzhou 450002,China;2.KeyLaboratoryofPlant-Microbe Interactions,Shangqiu Normal University,Shangqiu 476000,China;3.Institute ofForestry,XinjiangAgricultural University,Urumqi 830052,China)
To understand the effects of drought stress on photosynthetic physiology parameters of winter wheat seedling leaves,this paper took Zhoumai 22 as material,and analyzed the effect of20%PEG-6000 last for 7 days and re-water to the photosynthesis,the key photosynthetic enzymes and antioxidase activities of winter wheat seedling leaves.The result showed that as drought stress continuing, compared with the control,the Chl(a+b),Chla/Chlb,Rubisco activity and biomass all declined of wheat seedling leaves in the drought group,while the radio of root to shoot dry weight increased.Net photosynthetic rate and the enzymes activities in the leaves all showed a rise first followed by a decline.The maximum increase of net photosynthetic rate was 18.4%in one day after drought treatment,the activities ofPEPC,PPDK,NADP-ME,SOD,CAT,APXand PODwas 77.6%(1 d),79.2%(3 d),69.2%(1 d),155.6%(3 d),71.6%(3 d),129.4%(3 d),143.5%(1 d),respectively.All of the parameters were restored in 3 days after re-water.These results indicated that short-term drought stress could enhance the activity of C4pathway photosynthetic enzymes and it could partial offset the negative influence to photosynthetic carbon fixation with the decreasing of the Rubisco activity.It could increase the activity of antioxidases.The abilityin clearingup active oxygen were effectivelyenhanced and could use it to reduce the harm ofoxidation.C4pathway enzymes might playan important role in physiological mechanismofdrought-resistant ofwinter wheat seedlings.
winter wheat;seedling;drought stress;gas-exchange parameters;photosynthetic enzymes;antioxidant enzymes
S512.1+1
A
1002-2481(2016)08-1077-06
10.3969/j.issn.1002-2481.2016.08.06
2016-04-29
国家自然科学基金项目(31571997)
张庆琛(1981-),男,河南夏邑人,讲师,硕士,主要从事小麦分子育种研究工作。裴冬丽为通信作者。
