纳米材料在影像辅助的肿瘤光热治疗中的应用
2017-01-06孙蒙蒙王卓然高卫平
孙蒙蒙,王卓然,高卫平
清华大学 医学院 生物医学工程系,北京 100084
纳米材料在影像辅助的肿瘤光热治疗中的应用
孙蒙蒙,王卓然,高卫平
清华大学 医学院 生物医学工程系,北京 100084
肿瘤光热治疗作为一种利用局部高温热杀伤肿瘤的疗法,与传统疗法相比具有微创、副作用小、辅助杀菌等优势。目前研究发现的光热转化材料种类繁多,将各种不同的纳米材料应用于肿瘤光热治疗,在动物肿瘤模型实验中都取得了较好的治疗效果,其中许多材料兼具或易与影像探针结合而具有临床成像功能。近年来影像辅助的肿瘤光热治疗的研究发展迅速。本文综述了近年来兼具影像功能的纳米材料在肿瘤光热治疗中的最新应用进展,并探讨了这一新兴领域的发展趋势。
影像;肿瘤治疗;光热治疗;纳米材料
0 引言
癌症已成为如今世界第二大致死病因,其发病率、致死率仍在逐年上升。目前癌症临床治疗以手术、化疗、放射治疗为主,其缺点也十分明显:手术创伤面大、易感染、易复发;化疗与放疗易产生耐药性、副作用大。近年来新疗法不断涌现,如免疫治疗、生物治疗、热疗等。肿瘤热疗即利用激光、超声、微波、磁场等物理能量加热肿瘤,利用过高热杀死肿瘤细胞。热治疗具有准确微创、低副作用、简单易行、可重复治疗、辅助消毒杀菌等多项优势,其中近红外激光热疗(简称光热治疗)纳米材料的研究最为广泛。
近红外激光是指波长在700~1300 nm,即近红外区的光束。许多纳米材料在此区域有明显的光吸收,并可将其转化为热量,具有光热治疗的潜力。主要包括:有机化合物如ICG[1],高分子如聚吡咯(Polypyrrole,PPy)[2]、聚苯胺[3],碳纳米材料(碳纳米管、C60)等共轭效应的纳米体系;无机类包括金纳米材料(金纳米壳、金纳米棒、金纳米星)、钯纳米颗粒、硒化铜纳米颗粒、氧化钨纳米线等[4]。此外,还包括新型的热转化纳米体系,如通过自组装或原位合成的金纳米颗粒(Gold Nanoparticles,GNPs)胶束[5-6]。
这些纳米材料的光热转化特性均可通过光热成像(Photothermal Imaging,PTI)、光声成像(Photoacoustic Imaging,PAI)形象表征,此外它们通常还具有其他的造影潜力。在临床上影像技术可有效地应用于肿瘤的诊断,辅助或指导治疗过程,实现可视化治疗或诊疗一体化。影像可以辅助热疗以评价热疗效果,也可引导热疗。
纳米材料根据其组成不同,具有不同的影像潜力。含高密度元素的纳米材料,可用于X射线计算机断层扫描(X-ray Computed Tomography,X-CT)成像,如Au、I[7];磁性纳米材料可用于核磁共振成像(Magnetic Resonance Imaging,MRI),如磁性氧化铁、Gd3+[8];含放射性核素的纳米材料可用于正电子放射断层成像(Positron Emission Tomography,PET),如18F、64Cu[9];含发射γ-光子的放射性元素的纳米材料可用于单光子发射CT(Single Photon Emission CT,SPECT)成像,如125I[10]。
1 应用于光声成像的光热治疗纳米材料
用于光热治疗的纳米材料由于近红外区强吸收的特性,在入射光、尤其是近红外激光照射下,呈现区别于正常组织的光吸收,纳米材料吸收光子并转化为热,释放的热量导致局部温度升高,热膨胀而产生的压力波便是可检测的光声信号。而光声成像正是利用这些超声波信号获得组织器官或材料的断层或三维图像[11]。因而,光热治疗纳米材料均可通过光声成像检测、表征其体内分布和代谢情况。
在光热治疗中,光声成像可作为辅助手段表征纳米材料在治疗部位的富集情况。比如常用的光热治疗材料——金纳米棒具有很好的光声成像效果。Agarwal合成了最大吸收峰为810 nm的金纳米棒,原位注射在小鼠后肢即可产生明显区别于其他组织的光声信号[12]。同理,其他可用于近红外光热治疗的纳米材料均可以通过光声成像检测其治疗部位的信号分布情况。
此外,在光热治疗中,光声成像更可以作为可视化手段监测纳米材料的分布,从而利用光声成像引导其光热治疗。陈小元和聂志鸿合成金纳米囊泡负载光敏剂Ce6,系统注射后通过光声成像监测纳米颗粒在肿瘤内的停留情况。纳米颗粒原位注射后在肿瘤局部的光声信号提高3.8倍,此时利用近红外激光照射可有效促进光热转换升温与光敏剂释放,通过光热、光动力学治疗有效杀伤肿瘤(图1),并抑制复发[13]。戴志飞课题组合成了PPy光热转化纳米材料,并利用光声成像表征其不同时间内在体内分布的情况,以判断光热转化剂PPy在体内可降解、代谢的性质[2]。

图1 Ce6@金纳米囊泡用于光声成像辅助的肿瘤光学治疗示意图[13]
2 应用于X-CT影像的光热治疗纳米材料
X-CT成像是临床诊断和治疗中常用的影像手段,根据不同组织、材料对X射线的吸收与透过率的不同,获得断面或立体图像。含高密度元素的纳米材料在X射线下具有较强、区别于正常组织的信号,因此在用于光热治疗的同时兼具CT造影功能。
金纳米材料是常用的具有CT影像功能的光热治疗纳米材料。Sangeeta N. Bhatia课题组合成了PEG化的金纳米棒,通过CT影像判断PEG-GNRs在肿瘤处的富集情况,从而引导肿瘤的光热治疗,并评价其生物分布[14]。崔大祥课题组则在GNRs表面包裹一层SiO2并修饰以叶酸(Folic Acid,FA)分子,获得了具有靶向功能的光热转化纳米材料。在光热杀伤肿瘤的剂量下,通过明显的CT影像快速、直观的评价不同时间内纳米材料在肿瘤处的肿瘤靶向功能与效果,结果发现静脉注射后12 h肿瘤处富集剂量达到最大值,以此时间点指导肿瘤光热治疗可达到药物的最大利用度[7]。
此外,钨在X射线作用下具有区别于正常组织器官的信号。刘庄课题组合成的WS2-PEG纳米片,利用CT辅助表征其瘤内分布:在原位注射的纳米材料CT信号可提高5.7倍,静脉注射24 h后肿瘤处信号强度增强至2.5倍,充分表征了纳米材料在肿瘤处的富集情况,根据CT结果在合适的时间点开展光热治疗可有效杀灭肿瘤[15]。
3 应用于MRI影像的光热治疗纳米材料
MRI可从组织器官中获得电磁信号并重建信息,不使用影像探针也可成像,被认为是一种相对安全的临床成像手段。磁性的光热治疗纳米材料在MRI作用下可增强其影像效果,呈现出与正常组织器官明显的信号差别,因此可辅助其光热治疗。
磁性氧化铁相关的材料是光热治疗与MRI结合中最常用的纳米材料。但单独的磁性氧化铁纳米颗粒不具有近红外光热转化效果,因此多与常见的光热转化材料相结合,如金纳米材料。Chen-Chi M. Ma和Kuo-Chen Wei利用高分子链将磁性纳米颗粒修饰在金纳米棒的表面(图2A),得到具有MRI影像功能的光热治疗纳米材料[16]。Myung-Haing Cho和Taeghwan Hyeon利用化学键将磁性纳米颗粒与金种结合在SiO2纳米颗粒表面,并原位生长金壳层(图2B),形成光热治疗纳米颗粒,既保存了磁性纳米颗粒的MRI信号、又实现光热材料杀伤肿瘤细胞的效果[17]。施剑林和李永生则利用高分子聚集成有机层包裹超顺磁氧化铁纳米材料、外侧生长一层金壳合成Fe3O4@hybrid@Au纳米颗粒(图2C),兼具光热治疗与MRI影像双功能[18]。同时,施剑林和陈航榕以磁性氧化铁为核心通过双层SiO2连接金纳米棒,合成Fe3O4@SiO2@mSiO2-GNRs纳米材料(图2D),在光热治疗、MRI影像外还吸附化疗药物,实现了影像辅助的组合治疗[19]。
此外,磁性氧化铁还常与碳基光热转化纳米材料形成复合材料。李勇刚、郭亮和刘庄利用氧化石墨烯负载磁性氧化铁,并利用PEG修饰稳定纳米结构,合成了GO–IONP–PEG纳米材料[20],经静脉注射后通过MRI跟踪材料的体内分布,在24 h(肿瘤最佳富集时间点)进行光热治疗,可达到最佳治疗效果。
除了磁性氧化铁纳米颗粒,许多其他材料也具有磁性。Gd3+具有良好的磁性,戴志飞通过聚乙二醇将Gd3+连接到PPy纳米材料表面,合成的PPy-PEG-Gd是具有MRI影像功能的光热转化纳米材料[12]。
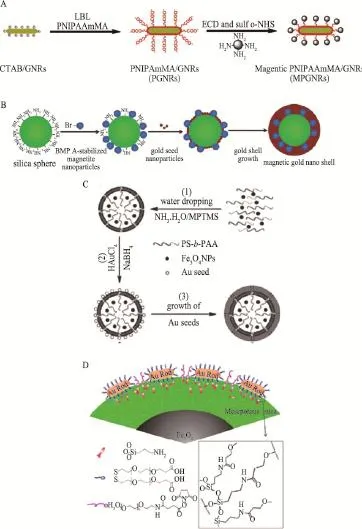
图2 MRI辅助的肿瘤光热治疗纳米材料合成示意图
4 应用放射成像的光热治疗纳米材料
光热治疗纳米材料表面大多容易修饰,若在其中引入放射性元素,如18F、64Cu,则可在光热治疗的同时实现功能性PET成像,具有区别于正常组织的高灵敏度。其中64Cu由于其适合的半衰期与正电子活力的特性,是最常用的通过被光热治疗纳米材料螯合而实现PET影像的放射性源[13]。碳纳米管作为一种光热治疗纳米材料,具有良好的共轭结构,是常用的螯合剂。戴宏杰和陈小元课题组就利用单臂碳纳米管表面修饰的螯合剂螯合64Cu合成了兼具PET影像的光热治疗纳米材料[21],可清晰地显示出材料在体内的代谢及分布情况。Chun Li课题组不通过螯合剂直接合成了[64Cu]CuS纳米颗粒,巧妙地将光热治疗与PET成像直接结合,通过影像引导,静脉注射的纳米材料也可有效抑制肿瘤生长(~ 65%)[22]。
5 应用光学成像的光热治疗纳米材料
光热转化纳米材料在近红外激光作用下吸收光子,能量以热的形式释放,有些材料也可同时以光的形式释放能量,如碳纳米管。碳纳米管特殊的共轭结构及表面缺陷,可在近红外波段吸收光子而激发荧光,是一种兼具荧光性质的近红外光热转化材料。戴宏杰利用高分子修饰单臂碳纳米管(Single-walled Carbon Nanotubes,SWNTs),在肿瘤荧光成像(Fluorescence Imaging,FI)中呈现较高的空间分辨率,在低浓度下即可实现光热治疗[23]。
将荧光分子探针与光热转化纳米材料相结合是最常见的设计策略,贵金属纳米材料由于其特殊的表面等离子体共振效应可增强多种荧光分子的荧光信号,如金纳米棒、金纳米壳等。何赛灵正是利用GNRs表面的LSPR效应对3.3’二乙基硫醛三碳菁化碘(DTTC)的荧光增强效应,设计合成了GNRs-DTTC-PEG纳米颗粒。纳米颗粒的尺寸效应更容易在肿瘤中滞留、富集,即利用肿瘤增强渗透和滞留效应(Enhanced Permeability and Retention,EPR)使纳米材料在肿瘤局部的浓度增加,也加强了影像效果,因此可利用荧光成像辅助肿瘤的光热治疗[24]。利用类似的原理,Yongdoo Choi在GNRs表面连接了光敏剂——氯酞菁铝(Al(III) Phthalocyanine Chloride Tetrasulfonic Acid,AlPcS4)荧光染料及PEG,在近红外激光作用下,GNRs发热变形并释放AlPcS4,恢复荧光,实现光热治疗同步的荧光成像与光动力学治疗[25]。Kwangmeyung Kim和Cheol-Hee Ahn则在GNRs表面通过酶响应多肽引入荧光染料Cy5.5,多肽在肿瘤部位被特有的基质金属蛋白酶识别、切割从而释放染料并恢复荧光,从而实现了靶向的荧光辅助成像[26]。
类似的,有机光热治疗纳米材料也可结合荧光分子实现辅助的荧光成像。刘庄利用PEG将荧光分子Cy7修饰在石墨烯表面[27],利用荧光成像辅助表征光热材料的体内代谢及分布情况。陈华兵则利用聚天冬氨酸-PEG的嵌段高分子与ICG组装为纳米颗粒,其中ICG兼具光热治疗和荧光成像功能[1],实现了光热治疗-荧光成像一体化。
6 应用多模态造影的光热治疗纳米材料
光热治疗中的影像研究已逐渐多样化,单一的影像手段有时并不能完全准确的表征光热转化纳米材料。许多光热治疗纳米材料可结合多种影像探针,同时进行多种成像,即多模态成像。CT与MRI作为最常用的影像手段,在光热治疗辅助影像的研究中也是最常与其他影像结合的手段,如PET-CT、SPECT-CT、MRI-荧光成像等。不同纳米材料在多模态影像辅助的光热治疗中的应用情况,见表1。
7 总结与展望
肿瘤光热治疗以其局部精准微创、对正常组织无损伤等优势,受到了越来越多的关注,有望在浅表肿瘤的治疗中发挥更大优势。光热转化纳米材料的设计也正在向着多元化、多功能化发展,结合影像手段实现可视化治疗也已经成为肿瘤光热治疗的热点之一。影像与光热治疗相结合不仅可以辅助判断治疗效果,还可以引导光热治疗,这为肿瘤光热治疗的准确性以及临床应用提供了重要的辅助作用。实现肿瘤可视化的光热治疗,最直接的策略是利用光热转化纳米材料易修饰的特性,将影像分子探针与之结合,形成稳定的多功能纳米体系,根据不同需求在光热治疗的同时实现影像功能。这种策略为肿瘤光热治疗的可行性提供了重要支持并取得了广泛的研究成果,但仍存在许多问题与挑战,亟待进一步解决。
肿瘤光热治疗纳米材料的毒性一直是制约其应用的重要问题,在设计影像结合的光热治疗纳米体系时,既要考虑材料毒性,也要考虑成像探针的生物安全性。如何利用生物相容性的材料、分子,通过简单易行的策略合成具有生物相容性、安全性、功能性的多功能纳米材料,是一个结合了化学、材料学、药学、临床医学等多学科交叉的关键科学问题,也是可视化光热治疗最终走向临床应用的重要研究方向。
目前肿瘤的临床治疗中,传统、单一的疗法并不能有效、理想地治愈肿瘤,肿瘤治疗正向着多功能化、可视化的方向发展。因此,在结合影像手段之外,光热治疗应进一步结合化疗、放疗,实现组合治疗或辅助手术治疗,不仅有望治愈原发肿瘤,更有希望解决转移性肿瘤的治疗问题。
纳米材料在体内靶向肿瘤的问题也是一项挑战,目前的多功能光热治疗纳米材料多通过EPR效应在肿瘤内富集,靶向分子、配体修饰后在体内应用的效果仍不明显;原位注射的纳米材料不易滞留,也存在利用度低的问题。如何利用有效的主动靶向和被动靶向实现多功能光热转化纳米材料在肿瘤部位的有效富集,仍需进一步研究和探索。

表1 不同纳米材料在多模态影像辅助的光热治疗中的应用
[1] Yang H,Maoa H,Wan Z,et al.Micelles assembled with carbocyanine dyes for theranostic near-infrared fuorescent cancer imaging and photothermal therapy[J].Biomaterials,2013,34(36):9124-9133.
[2] Zha Z,Deng Z,Li Y,et al.Biocompatible polypyrrole nanoparticles as a novel organic photoacoustic contrast agent for deep tissue imaging[J].Nanoscale,2013,5(10):4462-4467.
[3] Ju E,Dong K,Liu Z,et al.Tumor Microenvironment Activated Photothermal Strategy for Precisely Controlled Ablation of Solid Tumors upon NIR Irradiation[J].Adv Funct Mater,2015,25:1574-1580.
[4] Jaque D,Martínez Maestro L,del Rosal B,et al.Nanoparticles for photothermal therapies[J].Nanoscale,2014,6(16):9494-9530.
[5] Huang P,Lin J,Li W,et al.Biodegradable Gold Nanovesicles with an Ultrastrong Plasmonic Coupling Effect for Photoacoustic Imaging and Photothermal Therapy[J].Angew Chem Int Ed Engl,2013,52(52):13958-13964.
[6] Nakamura T,Tamura A,Murotani H,et al.Large payloads of gold nanoparticles into the polyamine network core of stimuliresponsive PEGylated nanogels for selective and noninvasive cancer photothermal therapy[J].Nanoscale,2010,2(5):739-746.
[7] Huang P,Bao L,Zhang C,et al.Folic acid-conjugated Silicamodified gold nanorods for X-ray/CT imaging-guided dualmode radiation and photo-thermal therapy[J].Biomaterials, 2011,32(36):9796-9809.
[8] Liang X,Li Y,Li X,et al.PEGylated Polypyrrole Nanoparticles Conjugating Gadolinium Chelates for Dual-Modal MRI/ Photoacoustic Imaging Guided Photothermal Therapy of Cancer[J].Adv Funct Mater,2015,25(9):1451-462.
[9] Shokeen M,Anderson CJ.Molecular Imaging of Cancer with Copper-64 Radiopharmaceuticals and Positron Emission Tomography (PET)[J].Acc Chem Res,2009,42(7):832-841.
[10] Jang B,Park S,Kang SH,et al.Gold nanorods for target selective SPECT/CT imaging and photothermal therapy in vivo[J].Quant Imaging Med Surg,2012,2(1):1-11.
[11] Wang LV,Hu S.Photoacoustic tomography:in vivo imaging from organelles to organs[J].Science,2012,335(6075):1458-1462.
[12] Agarwal A,Huang SW,O’Donnell M,et al.Targeted gold nanorod contrast agent for prostate cancer detection by photoacoustic imaging[J].J Appl Phys,2007,102:064701.
[13] Lin J,Wang S,Huang P,et al.Photosensitizer-Loaded Gold Vesicles with Strong Plasmonic Coupling Effect for Imaging-Guided Photothermal/ Photodynamic Therapy[J].ACS Nano,2013,7(6):5320-5329.
[14] von Maltzahn G,Park JH,Agrawal A,et al.Computationallyguided photothermal tumor therapy using long-circulating gold nanorod antennas[J].Cancer Res,2009,69(9):3892-3900.
[15] Cheng L,Liu J,Gu X,et al.PEGylated WS2Nanosheets as a Multifunctional Theranostic Agent for in vivo Dual-Modal CT/ Photoacoustic Imaging Guided Photothermal Therapy[J].Adv Mater,2014,26(12):1886-1893.
[16] Yang HW,Liu HL,Li ML,et al.Magnetic gold-nanorod/ PNIPAAmMA nanoparticles for dual magnetic resonance and photoacoustic imaging and targeted photothermal therapy[J].Bi omaterials,2013,34(22):5651-5660.
[17] Kim J,Park S,Lee JE,et al.Designed fabrication of multifunctional magnetic gold nanoshells and their application to magnetic resonance imaging and photothermal therapy[J].Angew Chem Int Ed Engl,2006,45(46):7754-7758.
[18] Dong W,Li Y,Niu D,et al.Facile synthesis of monodisperse superparamagnetic Fe3O4 Core@hybrid@Au shell nanocomposite for bimodal imaging and photothermal therapy[J].Adv Mater,2011,23(45):5392-5397.
[19] Ma M,Chen H,Chen Y,et al.Au capped magnetic core/mesoporous silica shell nanoparticles for combined photothermo-/chemo-therapy and multimodal imaging[J].Biomaterials, 2012,33(3):989-998.
[20] Ma X,Tao H,Yang K,et al.A Functionalized Graphene Oxide–Iron Oxide Nanocomposite for Magnetically Targeted Drug Delivery, Photothermal Therapy, and Magnetic Resonance Imaging[J].Nano Res,2012,5(3):199–212.
[21] Liu Z,Cai WB,He LN,et al.In vivo biodistribution and highly effcient tumour targeting of carbon nanotubes in mice[J].Nat Nanotechnol,2007,2:47-52.
[22] Zhou M,Zhang R,Huang M,et al.A chelator-free multifunctional [64Cu]CuS nanoparticle platform for simultaneous micro-PET/CT imaging and photothermal ablation therapy[J].J Am Chem Soc,2010,132(43):15351-15358.
[23] Robinson JT,Welsher K,Tabakman SM,et al.High performance in vivo near-IR (> 1μm) imaging and photothermal cancer therapy with carbon nanotubes[J].Nano Res,2010,3(11):779-793.
[24] Qian J,Jiang L,Cai F,et al.Fluorescence-surface enhanced Raman scattering co-functionalized gold nanorods as near-infrared probes for purely optical in vivo imaging[J].Biomaterials, 2011,32(6):1601-1610.
[25] Jang B,Park JY,Tung CH,et al.Gold nanorod-photosensitizer complex for near-infrared fluorescence imaging and photodynamic/photothermal therapy in vivo[J].ACS Nano, 2011,5(2):1086-1094.
[26] Yi DK,Sun IC,Ryu JH,et al.Matrix metalloproteinase sensitive gold nanorod for simultaneous bioimaging and photothermal therapy of cancer. [J].Bioconjugate Chem,2010,21(12):2173-2177.
[27] Yang K,Zhang S,Zhang G,et al.Graphene in mice: ultrahigh in vivo tumor uptake and effcient photothermal therapy[J].Nano Lett,2010,10(9):3318-3323.
[28] Lu W,Zhang G,Zhang R,et al.Tumor site-specifc silencing of NF-kappaB p65 by targeted hollow gold nanosphere-mediated photothermal transfection[J].Cancer Res,2010,70(8):3177-3188.
[29] Lu W,Melancon MP,Xiong C,et al.Effects of photoacoustic imaging and photothermal ablation therapy mediated by targeted hollow gold nanospheres in an orthotopic mouse xenograft model of glioma[J].Cancer Res,2011,71(19):6116-6121.
[30] Shi X,Gong H,Li Y,et al.Graphene-based magnetic plasmonic nanocomposite for dual bioimaging and photothermal therapy[J].Biomaterials,2013,34(20):4786-4793.
[31] Ma Y,Tong S,Bao G,et al.Indocyanine green loaded SPIO nanoparticles with phospholipid-PEG coating for dualmodal imaging and photothermal therapy[J].Biomaterials, 2013,34(31):7706-7714.
[32] Yang K,Hu L,Ma X,et al.Multimodal imaging guided photothermal therapy using functionalized graphene nanosheets anchored with magnetic nanoparticles[J].Adv Mater,2012,24(14):1868-1872.
[33] Peng CL,Shih YH,Lee PC,et al.Multimodal imageguided photothermal therapy mediated by 188Re-labeled micelles containing a cyanine-type photosensitizer[J].ACS nano,2011,5(7):5594-5607.
Nano-materials for Image-guided Tumor Photo-thermal Therapy
SUN Meng-meng, WANG Zhuo-ran, GAO Wei-ping
Department of Biomedical Engineering, School of Medicine, Tsinghua University, Beijing 100084, China
Photo-thermal therapy (PTT) is based on localized heating by light absorption for selective ablation of abnormal cells. PTT is highly selective to diseased sites, minimally invasive to normal tissues, and antiseptic in comparison with traditional therapies. The key component of PTT is photothermal transducers that can absorb and convert near-infrared light (NIR) into heat with high effciency. Up to date, a variety of NIR photothermal transducers have been developed. Application of NIR photothermal conversion nano-materials in imaging-assisted PTT as well as its development trend is focused in this review.
imaging; tumor therapy; photothermal therapy; nano-materials
R730.5
A
10.3969/j.issn.1674-1633.2016.06.005
1674-1633(2016)06-0024-05
2015-10-24
2015-12-17
国家自然科学基金面上项目(21274043);国家自然科学基金重点项目(21534006)。
高卫平,教授,从事生物材料与纳米医学研究。
通讯作者邮箱:gaoweiping@mail.tsinghua.edu.cn
