AgNO3对橡胶树花药愈伤组织形态及体胚发生的影响
2017-01-04戴雪梅黄天带杨先锋辛士超黄华孙
戴雪梅, 黄天带, 李 季, 杨先锋, 辛士超, 黄华孙
( 中国热带农业科学院橡胶研究所/农业部橡胶树生物学与遗传资源利用重点实验室/国家橡胶树育种中心, 海南 儋州 571737 )
AgNO3对橡胶树花药愈伤组织形态及体胚发生的影响
戴雪梅, 黄天带, 李 季, 杨先锋, 辛士超, 黄华孙*
( 中国热带农业科学院橡胶研究所/农业部橡胶树生物学与遗传资源利用重点实验室/国家橡胶树育种中心, 海南 儋州 571737 )
橡胶树的花药愈伤组织在长期继代过程中,胚性易下降甚至丧失;而AgNO3作为乙烯活性抑制剂,被广泛应用于植物组织培养中。该研究以继代培养4 a以上的热研7-33-97花药愈伤组织为材料,在继代培养基中添加2.5 mg·L-1AgNO3预培养35 d后,观察预培养前后愈伤组织表形及其细胞形态的变化,并设计不同浓度AgNO3及不同处理时间对其进行体胚诱导,90 d后分别统计胚状体总数和正常胚数。结果表明:浅黄色质地柔软的愈伤组织在含AgNO3的培养基上预培养后能转变成鲜黄色易碎愈伤组织,在倒置显微镜下前者大多表现为不规则多边形,细胞内含物较稀薄;而后者则呈圆形或椭圆形,细胞内含物丰富,属于典型的胚性细胞。在体胚诱导的第1个月添加5 mg·L-1AgNO3能显著促进体胚的发生,AgNO3浓度升至10 mg·L-1时体胚发生受到抑制,且畸形胚的形成率显著增加;在含5 mg·L-1AgNO3的培养基中培养2个月以上,体胚发育明显受阻,大部分形成畸形胚。该研究结果在一定程度上恢复了橡胶树长期继代花药愈伤组织的胚性能力,并提高了其体胚发生频率,为橡胶树花药胚性愈伤组织长期继代培养过程中胚性的保持提供了参考。
橡胶树, 花药愈伤组织, AgNO3, 细胞形态, 体胚发生
巴西橡胶树(Heveabrasiliensis)所产的天然橡胶是极其重要的工业原料和四大战略物资之一,品种改良一直是橡胶产业的首要任务。传统的人工授粉有性杂交育种在橡胶树品种改良上有着举足轻重的地位,但存在工作量大、周期长、容易受环境因素影响等问题。随着现代生物技术的发展,生物技术育种方式如工厂化组培苗繁育、基因转化、原生质体培养及体细胞杂交等愈来愈受到科研工作者的青睐,成为传统杂交育种的重要辅助手段。这些生物技术育种方式的开展均有赖于胚性愈伤组织的获得及通过体胚发生途径再生完整植株。在橡胶树中,胚性愈伤组织的获得主要有花药培养和内珠被培养两种途径。其中,花药培养是橡胶树离体培养中研究最多的一个方向,也是橡胶树生物技术育种的主要途径(谭德冠等,2005)。经由花药培养获得的易碎胚性愈伤组织可通过继代培养快速增殖,再进行批量的体胚诱导和植株再生(Hua et al,2010),或者进行悬浮培养建立胚性悬浮细胞系,以此作为原生质体培养的最佳分离材料(戴雪梅等,2014)。然而,在研究过程中胚性愈伤组织随着继代培养次数的增加胚性特征逐渐消失,体胚发生能力逐年下降甚至完全丧失,导致难于进行下一步的科学研究。因此,在获得良好的胚性愈伤组织后如何维持其胚性特征并提高体胚发生能力具有重要的研究意义。
AgNO3是一种乙烯活性抑制剂,可能参与多胺、乙烯和钙介导的信号途径,在植物离体培养中具有广泛的应用(Kumar et al, 2009)。在木本植物中,AgNO3能够有效地促进胚性愈伤组织的形成(范咏梅等,2003),并能维持胚性愈伤组织的胚性特征(叶新荣等,1994;赖钟雄等,1997)以及提高体细胞胚胎的发生频率(Kong & Yeung, 1994; Giridhar et al, 2004)。此外,在植物离体培养中AgNO3具有促进不定芽分化(Uliaie et al, 2008)以及不定根形成(Ma et al, 1998)的作用。然而,在橡胶树离体培养中尚未见有使用AgNO3的相关研究报道。本研究通过在继代培养基及体胚诱导培养基上添加不同浓度的AgNO3并设计不同处理时间,探讨AgNO3对长期继代培养后胚性明显下降甚至丧失的花药愈伤组织形态及其体胚发生的影响,以期恢复继代培养长达4 a的橡胶树花药愈伤组织的胚性能力,并提高其体胚发生频率,为橡胶树花药胚性愈伤组织长期继代培养过程中胚性的保持提供参考。
1 材料与方法
1.1 材料
研究材料为本实验室诱导并持续继代培养4 a以上的热研7-33-97花药愈伤组织,期间约每20 d用继代培养基M1(表1)继代1次。
1.2 方法
1.2.1 培养基 本研究所使用的培养基成分及其功用详见表1。
1.2.2 预培养 将持续继代培养4 a以上呈浅黄色松软的热研7-33-97花药愈伤组织转入添加2.5 mg·L-1AgNO3的继代培养基M1中进行预培养,20 d后挑取新长出的愈伤组织继续转入含相同浓度AgNO3的继代培养基中培养,15 d后取预培养和未预培养的愈伤组织,分别用适量液体培养基(成分为去除植物凝胶的继代培养基)悬浮分散后吸取适量细胞悬液至载玻片上,于倒置显微镜下进行细胞形态的观察。
1.2.3 体胚诱导 AgNO3处理浓度筛选:取上述经预培养35 d后的愈伤组织分别转入添加0、2.5、5、10 mg·L-1AgNO3的体胚诱导培养基M2(表1)中进行体胚诱导培养,30 d后将愈伤组织转到不含AgNO3的体胚诱导培养基中继续进行诱导和成熟培养, 以不经预培养的愈伤组织转入不含AgNO3的体胚诱导培养基中在相同条件下培养作为对照(CK)。

表 1 本研究所使用的培养基成分及其功用
AgNO3处理时间筛选:取经预培养35 d后的愈伤组织转入添加5 mg·L-1AgNO3的体胚诱导培养基M2中分别培养30、60、90 d后,再转入去除AgNO3的体胚诱导培养基中继续培养。
以上均在(27 ± 1)℃、黑暗条件下进行,每30 d更新1次培养基,90 d后统计每种处理形成的胚状体总数和正常体胚数。每处理设3次重复,每个重复包括3皿,每皿起始接种量约2 g愈伤组织。
1.3 数据处理
采用DPS 7.05软件进行统计分析。
2 结果与分析
2.1 预培养对愈伤组织细胞形态的影响
图版Ⅰ显示,热研7-33-97花药愈伤组织在添加2.5 mg·L-1AgNO3的继代培养基中预培养35 d后,原本呈浅黄色质地柔软的愈伤组织逐渐变成鲜黄色且易碎。在显微镜下观察发现,不经预处理的愈伤组织细胞大多为不规则多边形,细胞内含物较稀薄,而经预处理后的愈伤组织细胞呈圆形或椭圆形,细胞内含物丰富,属于典型胚性愈伤组织的细胞形态。说明在继代培养基中添加AgNO3能促进胚性愈伤组织形成,使原本胚性特征消失的愈伤组织朝着胚性愈伤组织的方向转变,重新恢复胚性特征。
2.2 AgNO3对愈伤组织体胚诱导的影响
在体胚诱导的第1个月于培养基中添加不同浓度的AgNO3对愈伤组织的体胚发生有很大影响。图版Ⅱ显示,在含不同浓度AgNO3的体胚诱导培养基培养30 d后均有白色球形胚的出现, 其中5 mg·L-1AgNO3处理体胚发生情况明显优于其余浓度;转入去除AgNO3的体胚诱导培养基中继续培养60 d后,从5 mg·L-1AgNO3处理的愈伤组织获得的胚状体总数和正常体胚数均显著高于其余浓度处理,而10 mg·L-1AgNO3处理虽然获得的胚状体总数显著高于2.5 mg·L-1AgNO3处理,但大部分胚状体发育缓慢或畸变,最终仅获得极少数的正常体胚(表2);低于5 mg·L-1AgNO3处理,获得的正常体胚数占胚状体总数在30%以上,而10 mg·L-1AgNO3处理获得的正常体胚数尚不足胚状体总数的10%,表明在体胚诱导培养基中添加低浓度(0~5 mg·L-1)的AgNO3不仅能促进花药愈伤组织的体胚发生,且体胚畸形化的发生几率相对较低,而高浓度(10 mg·L-1)的AgNO3虽然在一定程度上也能促进体胚发生,但不利于其正常发育,极大增加了畸形化的几率。对照则完全没有体胚的形成,表明经过4 a以上的继代培养,其体胚发生能力已完全丧失,而AgNO3处理使其体胚发生能力得到了一定恢复。
2.3 AgNO3处理时间对愈伤组织体胚形成的影响
表3和图版Ⅲ显示,在体胚诱导的第1个月添加5 mg·L-1AgNO3,不仅可以显著提高体胚发生的频率, 而且90 d后正常体胚的形成频率较高; 当愈伤组织在含有5 mg·L-1AgNO3的体胚诱导培养基培养60 d再转入不含AgNO3的体胚诱导培养基中培养30 d后,大部分体胚发生畸变,仅获得极少数的正常胚;当愈伤组织一直在含有5 mg·L-1AgNO3的体胚诱导培养基中培养90 d后,几乎所有体胚均畸形化或褐化。这表明只有在体胚诱导的初期即第1个月内添加适量的AgNO3才能有效促进体胚的发生以及正常胚的形成。
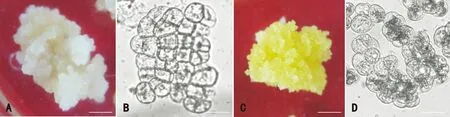
图版 I AgNO3预培养前后愈伤组织的细胞形态 A. 未预培养的愈伤组织(标尺=5 mm); B. 未预培养愈伤组织的细胞形态(标尺=25 μm); C. 经预培养的愈伤组织(标尺=5 mm); D. 经预培养愈伤组织的细胞形态(标尺=25 μm)。Plate I Cell morphology of callus before and after pre-culture with AgNO3 A. Callus before pre-culture (Bar=5 mm); B. Cell morphology of callus before pre-culture (Bar=25 μm); C. Callus after pre-culture (Bar=5 mm); D. Cell morphology of callus after pre-culture (Bar=25 μm).

图版 Ⅱ 不同浓度AgNO3处理30 d后体胚发生情况 (标尺=10 mm) A. 对照; B. AgNO3 0;C. AgNO3 2.5 mg·L-1; D. AgNO3 5 mg·L-1; E. AgNO3 10 mg·L-1。Plate Ⅱ Somatic embryogenesis from different concentrations of AgNO3 treatments for 30 d (Bar=10 mm)A. CK; B. AgNO3 0; C. AgNO3 2.5 mg·L-1; D. AgNO3 5 mg·L-1; E. AgNO3 10 mg·L-1.

图版 Ⅲ 5 mg·L-1AgNO3处理不同时间体胚发生情况 (标尺=5 mm) A. 处理30 d; B. 处理60 d; C. 处理90 d。Plate Ⅲ Somatic embryogenesis from different treating time with 5 mg·L-1 AgNO3 (Bar=5 mm)A. Treated by AgNO3 for 30 d; B. Treated by AgNO3 for 60 d; C. Treated by AgNO3 for 90 d.
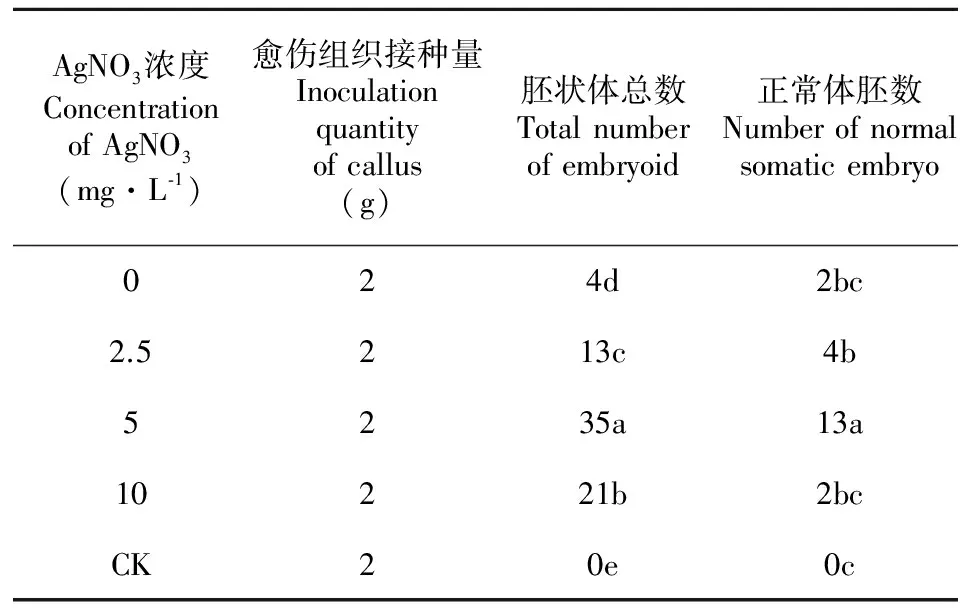
AgNO3浓度ConcentrationofAgNO3(mg·L⁃1)愈伤组织接种量Inoculationquantityofcallus(g)胚状体总数Totalnumberofembryoid正常体胚数Numberofnormalsomaticembryo024d2bc2.5213c4b5235a13a10221b2bcCK20e0c
注: 同列数字不同小写字母表示在0.05水平上差异显著。下同。
Note: Different small letters in the same column indicate significant differences at 0.05 level. The same below.
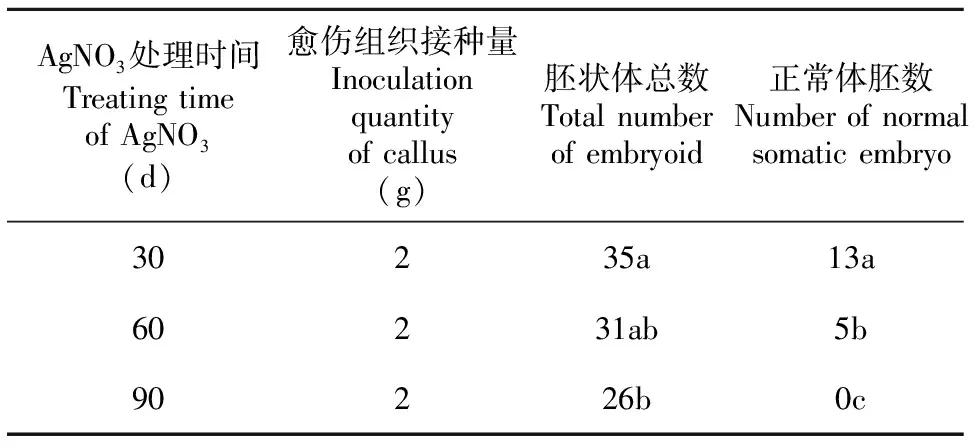
表 3 AgNO3处理不同时间对体胚发生的影响
3 讨论与结论
从橡胶树花药培养诱导的黄色易碎胚性愈伤组织在长期的继代保存过程中,颜色逐渐变浅,且容易衰老褐化,虽然在继代培养基中仍能旺盛生长,但其体胚发生能力逐年下降甚至完全丧失。类似的现象在其他植物的组织培养过程中也普遍存在(薛美凤等,2002;肖望等,2008;刘清波等,1998;刘德华,1995)。在显微镜下观察发现,其细胞形态也发生了变化,多为不规则多边形,胞质内含物较稀薄。本研究在继代培养基中添加2.5 mg·L-1AgNO3处理一段时间后能使胚性特征消失的橡胶树花药愈伤组织重新朝胚性愈伤组织的方向发展,表明AgNO3在一定程度上能恢复橡胶树长期继代花药愈伤组织的胚性能力。但有研究指出持续多代在继代培养基中添加AgNO3会抑制细胞的生长,使愈伤组织出现褐变衰老的现象,与长期在不含AgNO3的继代培养基中培养有相同的趋势,只是程度相对较轻(叶新荣等,1994;赖钟雄等,1997)。因此,在胚性愈伤组织的长期继代保存过程中宜采用添加和去除AgNO3的继代培养基交替进行培养,这样既能维持愈伤组织的胚性能力,同时也可在一定程度上防止愈伤组织由于生长旺盛而过快衰老和褐化。
王泽云等(1984)在橡胶树花药培养过程中通过定期连续切片观察表明橡胶树花药愈伤组织起源于花药断口处、药端、药隔及药壁的薄壁细胞,愈伤组织、胚状体和植株的染色体计数结果显示90%以上属于二倍体,花药植株的遗传表现也进一步证实其起源于体细胞。Hua et al(2010)通过花药培养诱导愈伤组织及体细胞胚并通过次生体胚发生途径获得了一批可作为橡胶树新型种植材料的自根幼态无性系植株。然而橡胶树花药愈伤组织的体胚发生频率普遍不高,且因品种和花期的不同而有很大差异(王泽云等,1980)。Modeste et al(2013)在对橡胶树愈伤组织体胚诱导的研究中优化了生长素2,4-D和细胞分裂素KT的浓度及配比,本文则着重于研究在植物生长发育过程中可能参与多种信号途径的AgNO3对橡胶树体胚发生的影响。研究结果表明在体胚诱导培养基中添加较低浓度的AgNO3可有效促进橡胶树花药愈伤组织体胚的形成及正常发育,而使用高浓度的AgNO3虽然也能诱导出胚状体,但其后发育受到严重阻碍,最终引发畸变,这在其它物种中也有类似的报道(Fernandez et al, 1999;Fuentes et al,2000)。而在水曲柳未成熟合子胚为外植体的体胚诱导中发现,AgNO3对其体胚诱导的频率影响不大,但在培养基中添加1 mg·L-1AgNO3的能促进体胚发生的同步化,并有效阻止畸形胚的形成(Kong et al, 2012)。此外,AgNO3处理时间对体胚发生及其后的发育也有很大影响。张鹏等(1997)认为AgNO3处理时间的长短取决于原基形成的时间,培养物一旦形成原基后即可去除AgNO3,长时间在含AgNO3的培养基中培养,会产生毒害作用,增加畸变的风险。本研究结果证实了这一观点,发现在橡胶树花药愈伤组织的体胚诱导中,球形胚形成后即移除AgNO3能获得更多的正常胚,而一直在含AgNO3的培养基中进行体胚诱导和成熟培养,将导致所有的胚状体发生畸变。
本研究表明AgNO3在一定程度上能恢复橡胶树长期继代花药愈伤组织的胚性能力,并且具有促进体胚形成的作用,但受其使用浓度和处理时间的限制,只有使用合适的浓度并控制处理时间才能有效促进体胚的形成,高浓度及长时间的处理均不利于体胚的正常发育。
DAI XM, HUANG TD, LI J, et al, 2014.Effects of different explants on isolation and regeneration of protoplast in rubber tree [J]. Mol Plant Breed, 12(6): 1259-1264. [戴雪梅, 黄天带, 李季, 等, 2014. 不同外植体对橡胶树原生质体分离和再生的影响 [J]. 分子植物育种, 12(6): 1259-1264.]FAN YM, LI DD, GAN L,et al, 2003. Effect of AgNO3on the induction of embryogenic callus of bingtang orange [J]. J Hunan Agric Univ (Nat Sci Ed), 29(4): 338-340. [范永梅, 李东栋, 甘霖, 等, 2003. 硝酸银对冰糖橙胚性愈伤组织诱导的影响 [J]. 湖南农业大学学报(自然科学版), 29(4): 338-340.]
FERNANDEZ S, MICHAUX-FERRIERE N, COUMANS M, 1999. The embryogenic response of immature embryo cultures of durum wheat (Triticumdurum): histology and improvement by AgNO3[J]. Plant Growth Regul, 28(3): 147-155.
FUENTES SRL, CALHEIROS MBP, MANETTI-FILHO J,et al, 2000. The effects of silver nitrate and different carbohydrate sources on somatic embryogenesis inCoffeacanephora[J]. Plant Cell Tiss Org Cult, 60(1): 5-13.
GIRIDHAR P, INDU EP, VINOD K,et al, 2004. Direct somatic embryogenesis fromCoffeaarabicaL andC.canephoraP ex Fr. under the influence of ethylene action inhibitor-silver nitrate [J]. Acta Physiol Plant, 26(3): 299-305.
HUA YW, HUANG TD, HUANG HS, 2010. Micropropagation of self-rooting juvenile clones by secondary somatic embryogenesis inHevabraesiliensis[J]. Plant Breed, 129(2): 202-207.
KONG DM, SHEN HL, LI N, 2012. Influence of AgNO3on somatic embryo induction and development in manchurian ash (FraxinusmandshuricaRupr. ) [J]. Afr J Biotechnol, 11(1): 120-125.
KONG L, YEUNG EC, 1994. Effects of ethylene and ethylene inhibitors on white spruce somatic embryo maturation [J]. Plant Sci, 104(1): 71-80.
KUMAR V, PARVATAM G, RAVISHANKAR GA, 2009. AgNO3-a potential regulator of ethylene activity and plant growth modulator [J]. Electron J Biotechnol, 12(2): 1-15.
LAI ZX, PAN LZ, CHEN ZG, 1997. Establishment and maintenance of longan embryogenic cell lines [J]. J Fujian Agric Univ, 26(2): 160-167. [赖钟雄, 潘良镇, 陈振光, 1997. 龙眼胚性细胞系的建立与保持 [J]. 福建农业大学学报, 26(2): 160-167.]
LIU DH, 1995. Callus subculture and somatic embryogenesis in tea plant [J]. Acta Agron Sin, 21(4): 470-474. [刘德华, 1995. 茶树愈伤组织继代培养与体细胞胚发生 [J]. 作物学报, 21(4): 470-474.]
LIU QB, LIU XM, ZHOU PH, 1998. Studies on the characteristics of physiology and biochemistry of embryonal calli in the subculture [J]. J Hunan Agric Univ, 24(3): 180-183. [刘清波, 刘选明, 周朴华, 1998. 水稻胚性愈伤组织继代培养中的生理生化特性 [J]. 湖南农业大学学报, 24(3): 180-183.]
MA JH, YAO JL, COHEN D,et al, 1998. Ethylene inhibitors enhanceinvitroroot formation from apple shoot cultures [J]. Plant Cell Rep, 17(3): 211-214.
MODESTE KK, EDMOND KK, GILLES KN, et al. 2013. Influence of plant growth regulators on somatic embryogenesis induction from inner teguments of rubber (Heveabrasiliensis) seeds [J]. Afr J Biotechnol, 12(16): 1972-1977.
TAN DG, SUN XP, ZHANG JM, 2005. Tissue culture ofHeveabrasiliensisMuell. Arg [J]. Plant Physiol Comm, 41(5): 674-678. [谭德冠, 孙雪飘, 张家明, 2005. 巴西橡胶树的组织培养 [J]. 植物生理学通讯, 41(5): 674-678.]ULIAIE ED, FARSI M, GHREYAZIE B,et al, 2008. Effects of genotype and AgNO3on shoot regeneration in winter cultivars of rapeseed (Brassicanapus) [J]. Pak J Biol Sci, 11(16): 2040-2043.
WANG ZY, WU HY, ZENG XS, et al, 1984. Embryogeny and origin anther plantlet ofHeveabrasiliensis[J]. Chin J Trop Crops, 5(1): 9-15. [王泽云, 吴胡叶, 曾宪松, 等, 1984. 巴西橡胶花药胚的发生和花药植株起源的研究 [J]. 热带作物学报, 5(1): 9-15.]
WANG ZY, ZENG XS, CHEN CQ, et al, 1980. Induction of rubber plantlets from anther ofHeveabrasiliensisMuell. Arg.invitro[J]. Chin J Trop Crops, 1(1): 16-27. [王泽云, 曾宪松, 陈传琴, 等, 1980. 用离体花药诱导巴西橡胶植株的研究 [J]. 热带作物学报, 1(1): 16-27.]
XIAO W, CHEN XN, HUANG SL, 2008. Differentiation potential and chromosome number of embryogenic suspension cells ofMusaacuminatacv. Mas (AA) in subculture [J]. J Fruit Sci, 25(6): 946-949. [肖望, 陈晓娜, 黄少丽, 2008. 在继代培养中贡蕉胚性悬浮细胞的分化能力和染色体数目的变化 [J]. 果树学报25(6): 946-949.]
XUE MF, GUO YL, LI MY, et al, 2002. Effects of long-term subculture on embryogenesis capability of cotton callus and somatic variation [J]. SW Chin J Agric Sci, 15(4): 19-21. [薛美凤, 郭余龙, 李名扬, 等, 2002. 长期继代对棉花胚性愈伤组织体胚发生能力及再生植株变异的影响 [J]. 西南农业学报, 15(4): 19-21.]YE XR, ZHANG WC, WAN SY, 1994. Establishment of embryogenic cell line of Bananza Navel Orange (CitrussinensisOsb. ) [J]. J Fruit Sci, 11(2): 81-83. [叶新荣, 章文才, 万蜀渊, 1994. 柑桔胚性细胞系的建立 [J]. 果树科学, 11(2): 81-83.]
ZHANG P, FU AG, WANG AG, 1997. Role and possible mechanism of AgNO3in plant cultureinvitro[J]. Plant Physiol Comm, 33(5): 376-379. [张鹏, 傅爱根, 王爱国, 1997. AgNO3在植物离体培养中的作用及可能的机制 [J]. 植物生理学通讯, 33(5): 376-379.]
Effects of AgNO3on morphology and somatic embryogenesis of anther callus ofHeveabrisiliensis
DAI Xue-Mei, HUANG Tian-Dai, LI Ji, YANG Xian-Feng,XIN Shi-Chao, HUANG Hua-Sun*
( Rubber Research Institute, CATAS/ Key Laboratory of Biology and Genetic Resources of Rubber Tree, Ministry ofAgriculture/StateCenterforRubberTreeBreeding, Danzhou 571737, Hainan, China )
It is a common problem that the embryogenic competence of rubber tree anther callus might be gradually declined or even completely lost during long-term subculture. As a potent inhibitor of ethylene action, AgNO3is widely used in plant tissue culture. In this study, more than four years old anther callus was used as a material for the research of the appearance and cell morphology changes by pre-culturing on subculture medium supplemented with 2.5 mg·L-1AgNO3. In order to promote the frequency of somatic embryogenesis, different concentrations of AgNO3were added to somatic embryo induction medium, and different treatment time with AgNO3was tested. Total number of embryoid and number of normal somatic embryos were respectively counted after 90 d. The results showed that the pale yellow soft callus could turn into bright yellow fragile callus after pre-culture on medium containing 2.5 mg·L-1AgNO3. Under an inverted microscope, the former was mostly irregular polygon with relatively thin cytoplasm, and the latter was seen to be sphere or ellipsoid, rich in cytoplasm, which was considered to be typical embryogenic cell. Adding 5 mg·L-1AgNO3to somatic embryo induction medium during the first month, significantly enhanced somatic embryo production, while 10 mg·L-1AgNO3inhibited somatic embryogenesis and more abnormal embryos emerged. Development of somatic embryo was obviously hindered when callus was cultured on the induction medium containing 5 mg·L-1AgNO3for more than 2 m, and most of them were deformity. In conclusion, this study recovered the embryogenic characteristics of long-term subculture anther callus to some extent, and increased the frequency of somatic embryogenesis, which provides references for maintaining embryogenic capability during long term subculture of anther callus inHeveabrisiliensis.
Heveabrisiliensis, anther callus, AgNO3, cell morphology, somatic embryogenesis
10.11931/guihaia.gxzw201511029
2015-11-25
2016-04-01
海南省自然科学基金(20163136);中国热带农业科学院橡胶研究所基本科研业务费专项(1630022013002) [Supported by the the natural Science Foundation of Hainan (20163136); the Fundamental Research Funds for Rubber Research Institute, CATAS (1630022013002)]。
戴雪梅(1981-),女,广东五华人,博士,助理研究员,从事橡胶树组织培养和原生质体培养等研究,(E-mail)xuemeidai@126.com。
*通讯作者: 黄华孙,研究员,博士生导师,从事橡胶树种质资源与品种选育,(E-mail)xjshhs@163.com。
Q945.4
A
1000-3142(2016)12-1426-06
戴雪梅, 黄天带, 李季, 等. AgNO3对橡胶树花药愈伤组织形态及体胚发生的影响 [J]. 广西植物, 2016, 36(12):1426-1431
DAI XM, HUANG TD, LI J, et al. Effects of AgNO3on morphology and somatic embryogenesis of anther callus ofHeveabrisiliensis[J]. Guihaia, 2016, 36(12):1426-1431
