短链酰基辅酶A脱氢酶在心脏成纤维细胞胶原表达和细胞增殖中的作用*
2017-01-04舒朝辉曾振华黄秋菊李忠洪刘培庆陈少锐臧林泉周四桂
舒朝辉, 曾振华, 黄秋菊, 李忠洪, 刘培庆, 陈少锐, 兰 天, 臧林泉, 周四桂△
(1广东药科大学临床药学系,广东 广州 510006; 2中山大学药学院药理与毒理学实验室,广东 广州 510006)
短链酰基辅酶A脱氢酶在心脏成纤维细胞胶原表达和细胞增殖中的作用*
舒朝辉1, 曾振华1, 黄秋菊1, 李忠洪1, 刘培庆2, 陈少锐2, 兰 天1, 臧林泉1, 周四桂1△
(1广东药科大学临床药学系,广东 广州 510006;2中山大学药学院药理与毒理学实验室,广东 广州 510006)
目的: 研究短链酰基辅酶A脱氢酶(short-chain acyl-CoA dehydrogenase,SCAD)在心脏成纤维细胞胶原表达和细胞增殖中的作用,探讨其与心肌纤维化之间的关系。方法:以血管紧张素II(angiotensin II,Ang II)刺激心脏成纤维细胞建立胶原表达和细胞增殖模型,并采用SCAD的最优干扰序列siRNA-1186进行干扰,检测SCAD的mRNA、蛋白表达、酶活性、脂肪酸β氧化速率、ATP以及游离脂肪酸含量的变化;观察其对心脏成纤维细胞胶原表达和细胞增殖的影响。结果:与对照组相比,在Ang II诱导的心脏成纤维细胞增殖和胶原表达模型中,SCAD的mRNA和蛋白表达均显著下调。与阴性对照序列组相比,siRNA-1186干扰后心脏成纤维细胞的SCAD表达和酶活性明显下降,心脏成纤维细胞脂肪酸β氧化速率以及ATP生成明显降低,并且游离脂肪酸含量明显增多。同时,心脏成纤维细胞出现明显增殖,I、III型胶原的表达明显增加。结论:SCAD表达失调可能导致了心脏成纤维细胞异常增殖、胶原分泌紊乱,上调 SCAD可能成为干预心肌纤维化的重要环节之一。
短链酰基辅酶A脱氢酶; 心脏成纤维细胞; 心肌纤维化; 能量代谢; 胶原
心脏主要由心肌细胞和间质细胞构成,而间质细胞中心脏成纤维细胞(cardiac fibroblasts)占到了40%~60%[1-2],心脏成纤维细胞不仅对心肌细胞有结构上的支持和保护作用,还具有自分泌和旁分泌功能,而且会影响心肌的结构和生理功能。目前认为,心肌肥厚是增加高血压致残率和致死率的一个重要独立危险因素,并且心脏成纤维细胞的增殖是导致心肌肥厚重要的病理生理基础[3]。在肥厚后期,心脏成纤维细胞增殖以及胶原分泌紊乱,进一步发展为心肌纤维化,最终导致心力衰竭。然而,诱发心脏成纤维细胞增殖和胶原表达紊乱的相关因素以及线粒体在心脏成纤维细胞增殖和胶原表达中的机制尚未完全阐明。
心肌是耗能最多的组织之一。哺乳动物胚胎期心脏主要以葡萄糖和乳酸作为能源,出生后则为以脂肪酸氧化为主;但在病理性心肌肥厚时脂肪酸氧化降低,糖酵解增加,心肌能量代谢发生“胚胎型转换”[4]。短链酰基辅酶A脱氢酶(short-chain acyl-CoA dehydrogenase,SCAD)是酰基辅酶A脱氢酶家族中的一员,特异性地分解短链酰基辅酶A底物,是脂肪酸 β 氧化的第一个限速步骤,是脂肪酸氧化的关键酶[5]。我们采用定量蛋白质组学 DIGE技术比较16周龄自发性高血压大鼠和血压正常大鼠的心肌蛋白质组,首次发现SCAD 在自发性高血压大鼠肥厚心肌中的表达明显降低[6]。而在后续的研究中也发现,SCAD对病理性心肌肥厚和心肌细胞凋亡具有负性调控作用[7-9]。心肌纤维化是病理性心肌肥厚由代偿向失代偿转化的重要病理过程,是引发心力衰竭的核心环节[10]。然而,SCAD在心肌纤维化中的作用尚不清楚。
本研究在细胞水平模拟心肌纤维化,以血管紧张素II(angiotensin II,AngⅡ)建立心脏成纤维细胞增殖和胶原表达模型,观察SCAD在心脏成纤维细胞增殖和胶原表达中的作用,从心脏能量代谢方面探讨心肌纤维化的发病机制,以期为心肌纤维化寻找新的分子标志物,并为心肌纤维化治疗寻找新的药物作用靶点。
材 料 和 方 法
1 材料
RT-PCR 测定试剂盒、TRIzol和 SYBR Green购于 TaKaRa; II型胶原酶购于Gibco;BCA 蛋白定量试剂盒和 Western blot发光液购于 Thermo;亚细胞结构线粒体提取试剂盒以及台盼蓝购于博士德生物;脂肪酸β氧化速率比色法检测试剂盒和细胞 SCAD 活性比色法定量检测试剂盒购于上海杰美基因;血管紧张素II和单克隆鼠抗 α-tubulin购于Sigma;单克隆兔抗 SCAD 购于 Abcam;I、III型胶原抗体购于Proteintech;羟脯氨酸和游离脂肪酸测定试剂盒购于南京建成生物工程研究所; CCK-8试剂盒购于Dojindo;ATP检测试剂盒购于碧云天生物技术有限公司。
2 方法
2.1 SD大鼠原代心脏成纤维细胞培养 采用本实验室已发表的方法分离及培养成年大鼠心脏成纤维细胞[9],取200~250 g雄性大鼠,颈椎脱臼法处死,在无菌条件下取出心脏,采用胶原酶-胰酶-胶原酶循环消化法,得到单细胞悬液,收集细胞后差速贴壁1 h去除心肌细胞,置于37 ℃、5% CO2培养箱中培养,隔天换液。按照上述分离制备的心脏成纤维细胞,经vimentin抗体的免疫细胞化学染色,纯度可达98%以上。2.2 CCK-8法检测细胞活力 细胞以每孔5×103个接种于96孔板,待细胞贴壁后,给予不同浓度Ang II(0.1、1、10、100、1 000 nmol/L)刺激细胞24 h或者浓度100 nmol/L的Ang II 作用细胞不同时间(6、12、24、36、48 h),每孔加入10 μL CCK-8溶液,4 h后用酶标仪于450 nm波长测定吸光度(A)值。
2.3 台盼蓝染色实验 细胞以每孔1×104个接种于12孔板,待细胞贴壁后,给予不同浓度Ang II(0.1、1、10、100、1 000 nmol/L)刺激细胞24 h或者浓度100 nmol/L的Ang II 作用细胞不同时间(6、12、24、36、48 h),制备单细胞悬液,用浓度为0.1%的台盼蓝染色,3 min内,用计数板分别计数活细胞和死细胞。镜下观察,死细胞被染成蓝色,而活细胞拒染。
2.4 Real-time PCR检测 mRNA 的表达 按照TRIzol说明书步骤提取细胞总 RNA,紫外分光光度计检测RNA样品的260和280 nm波长下的A值,检测纯度并计算出 RNA的浓度。参照RT-PCR试剂盒说明书进行逆转录反应。按照SYBR Green说明书反应体系加入荧光染料、引物和RT 产物后在Bio-Rad CFX96 PCR仪中进行real-time PCR反应。反应程序为:95 ℃ 10 s; 95 ℃ 5 s, 60 ℃ 30 s,循环40次。引物由上海生工合成,具体引物序列见表1。
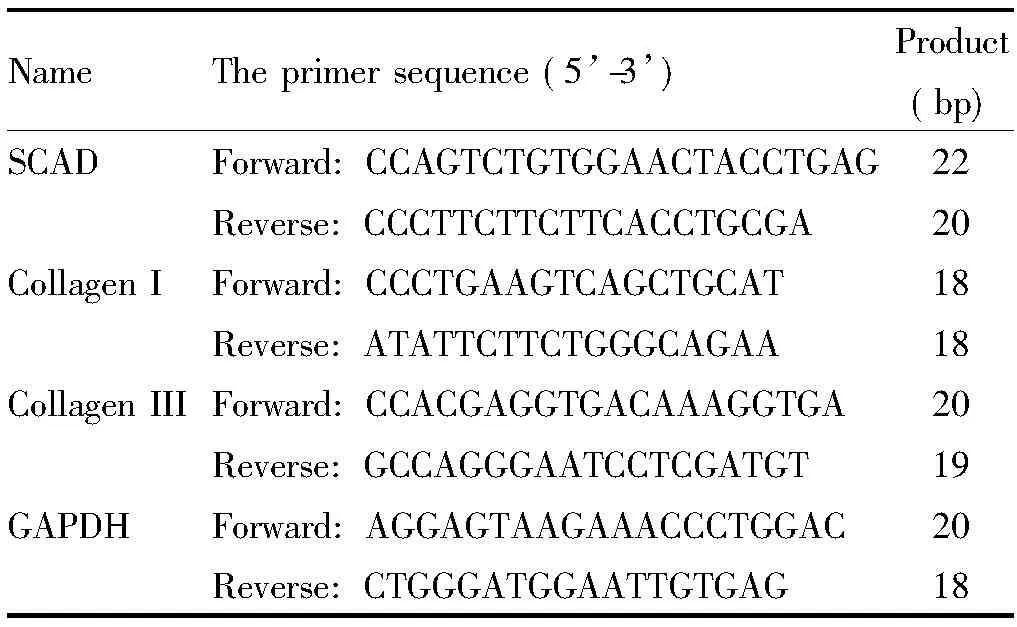
表 1 Real-time PCR实验的引物序列
2.5 Western blot法检测蛋白的表达 提取各组心脏成纤维细胞总蛋白, BCA试剂盒检测细胞蛋白含量后调整上样量,分装、变性,配置10% SDS分离胶和5% 浓缩胶进行电泳,电泳结束后转移至PVDF膜(Bio-Rad),室温封闭1 h 后加入I抗(SCAD,1∶1 000;Collagen I, 1∶1 000; Collagen III, 1∶1 000; α-tubulin,1∶10 000),过夜。漂洗后加II抗,室温孵育1 h,化学发光试剂增强反应, X线压片曝光、显影、定影,结果采用ImageJ 图像分析系统对条带进行分析。
2.6 SCAD 酶活性的检测 按照实验分组处理细胞,收集细胞后置于冰上裂解 30 min,取上清液用BCA蛋白定量试剂盒定量蛋白。酶活性检测是基于 2,6-二氯靛酚钠(2,6-dichlorophenol indophenol,DCPIP)作为人工电子受体,替代黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD),在 SCAD 的作用下,由短链酰基辅酶 A 提供的电子, 经过硫酸甲酯吩嗪(phenazine methosulphate,PMS)的传递,被还原为无色产物,通过分光光度仪的峰值变化(600 nm 波长)来定量分析 SCAD 的活性。严格按照说明书采用酶标仪法进行检测。
2.7 siRNA干扰 siRNA干扰序列购于上海吉玛制药技术有限公司。采用本实验室筛选出的最优干扰序列siRNA-1186进行实验,其正义链序列为5’-CCGCAUCACUGAGAUCAUTT-3’,反义链序列为5’-AUAGAUCUCAGUGAUGCGGTT-3’。转染方法按照公司提供的转染试剂说明书进行。
2.8 胶原合成的检测 通过测定细胞中羟脯氨酸的含量反映胶原合成情况。实验严格按照说明书采用酶标仪法进行检测。羟脯氨酸含量(mg/L)=(测定A值-空白A值)/(标准A值-空白A值)×标准品浓度×样品测试前稀释倍数。
2.9 脂肪酸β氧化速率的检测 使用差速离心法提取细胞中的线粒体,严格按照亚细胞结构线粒体提取试剂盒说明书操作。比色法测定脂肪酸β氧化速率是一种通过底物棕榈酰肉碱的氧化产生电子,由铁氰化物捕获而还原,其还原速率的检测用来评价脂肪酸β氧化的速率,具体操作严格按照脂肪酸β氧化速率比色法检测试剂盒说明书进行。
2.10 游离脂肪酸含量的测定 游离脂肪酸能与铜离子结合形成脂肪酸铜盐而溶于氯仿中,其含量与游离脂肪酸含量成正比,用铜试剂测定其中的铜离子含量,即可推算出游离脂肪酸的含量。我们采用游离脂肪酸测定试剂盒(比色法)检测心脏成纤维细胞中游离脂肪酸的含量,操作方法严格按照说明书进行。
2.11 ATP含量的测定 ATP检测试剂盒根据萤火虫萤光素酶催化萤光素发光时需要ATP提供能量的原理而设计。当萤火虫萤光素酶和萤光素都过量时,发光强度与ATP浓度在一定范围内成正比。操作方法严格按照说明书进行。
3 统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 13.0统计软件处理,组间比较采用单因素方差分析,运用Bonferronit检验进行组间两两比较,以P<0.05为差异有统计学意义。
结 果
1 Ang II对心脏成纤维细胞增殖的影响
CCK-8比色法检测不同浓度Ang II (0.1、1、10、100、1 000 nmol/L)刺激心脏成纤维细胞 24 h后,细胞生长良好,细胞增殖呈浓度依赖性,且Ang II浓度为100 nmol/L和1 000 nmol/L时,二者无显著性差异; 用100 nmol/L Ang II 处理不同时间(0、6、12、24、36、48 h)后,发现细胞增殖呈时间依赖性,且Ang II处理36 h和48 h时无显著性差异 。此外,台盼蓝染色结果表明,心脏成纤维细胞数量在100 nmol/L Ang II处理不同时间(0、6、12、24、36、48 h)后,基本呈现时间依赖性,且在36 h和48 h无显著性差异; 在不同浓度Ang II (0.1、1、10、100、1 000 nmol/L)刺激下表现出浓度依赖性,且在100 nmol/L时有显著性差异。因此,我们选择浓度为100 nmol/L的Ang II作用36 h作为后续实验的条件,见图1。
2 Ang II对心脏成纤维细胞中SCAD的mRNA和蛋白表达的影响
Real-time PCR实验结果显示,随着Ang II 处理时间和浓度的增加,心脏成纤维细胞内SCAD的mRNA表达明显下调。Western blot实验结果与 real-time PCR结果呈现一致的趋势,SCAD的蛋白表达均出现下调,以浓度100 nmol/L Ang II作用36 h和48 h时,SCAD的下调最为显著(P<0.01),见图2。

Figure 1.The cell proliferation in Ang II-treated cardiac fibroblasts detected by CCK-8 assay (A, B) or cell counting after Trypan blue staining (C, D). A, C: the cardiac fibroblasts were treated with 100 nmol/L Ang II for various incubation time periods; B, D: the cardiac fibroblasts were treated with different concentrations of Ang II for 36 h. Con: control. Mean±SD.n=3.*P<0.05,**P<0.01vsCon.
图1 各组心脏成纤维细胞的增殖情况

Figure 2. The expression of SCAD at mRNA (A, B) and protein (C, D) levels in Ang II-treated cardiac fibroblasts. A, C:the cardiac fibroblasts were treated with Ang II for different time periods; B, D: the cardiac fibroblasts were treated with different concentrations of Ang II for 36 h. Con: control. Mean±SD.n=3.*P<0.05,**P<0.01vsCon.
图2 Ang II 刺激后心脏成纤维细胞SCAD mRNA和蛋白表达的变化
3 Ang II和siRNA-1186对心脏成纤维细胞SCAD表达、SCAD酶活性、脂肪酸β氧化速率、ATP及游离脂肪酸含量的影响
用siRNA-1186干扰序列转染心脏成纤维细胞, 可见siRNA可以明显减少心脏成纤维细胞中SCAD的mRNA和蛋白表达量,降低SCAD的酶活性。此外,心脏成纤维细胞对脂肪酸的氧化能力下降,表现在脂肪酸β氧化速率的下降以及ATP生成的减少。与阴性对照组相比,siRNA-1186组的脂肪酸β氧化速率显著下降,ATP生成也明显减少,且心脏成纤维细胞内游离脂肪酸含量显著增多,其程度与刺激因素Ang II作用于心脏成纤维细胞的结果一致,表明SCAD的表达下调可能导致了心脏成纤维细胞脂肪酸 β 氧化能力下降,见图3。

Figure 3. The expression and activity of SCAD, fatty acid beta-oxidation rate, ATP content and free fatty acid content in the cardiac fibroblasts treated with Ang II (100 nmol/L, 36 h) or siRNA-1186 (72 h). Con: control; NC: negative control. Mean±SD.n=3. *P<0.05,**P<0.01vsCon;#P<0.05,##P<0.01vsNC.
图3 siRNA-1186和Ang II对心脏成纤维细胞SCAD mRNA和蛋白表达、SCAD酶活性、脂肪酸β氧化速率、ATP和游离脂肪酸含量的影响
4 Ang II和siRNA-1186对心脏成纤维细胞增殖的影响
由图4可见,与阴性对照序列组相比,siRNA-1186干扰序列通过瞬时转染敲低SCAD基因的表达后,CCK-8结果表明心脏成纤维细胞的增殖明显增强,其程度与刺激因素Ang II诱导的细胞增殖趋势一致;此外,台盼蓝染色结果也表明,siRNA-1186干扰序列通过瞬时转染敲低SCAD基因的表达后,心脏成纤维细胞的数量出现显著性增长,与CCK-8结果一致。这表明SCAD表达量的降低可能是造成心脏成纤维细胞出现增殖的一个重要因素。

Figure 4.The cell proliferation was measured 72 h after transfection with siRNA-1186 or treated with Ang II for 36 h by CCK-8 assay(A) and Trypan blue staining (B). Con: control; NC: negative control. Mean±SD.n=3.**P<0.01vsCon;##P<0.01vsNC.
图4 siRNA-1186和Ang II对心脏成纤维细胞增殖的影响
5 Ang II和siRNA-1186对心脏成纤维细胞羟脯氨酸含量的影响
由图5可见,用siRNA-1186干扰序列敲低SCAD的表达后,心脏成纤维细胞内羟脯氨酸的含量显著增加,与Ang II 诱导心脏成纤维细胞增殖导致的羟脯氨酸含量变化趋势一致。这表明SCAD的下调可能导致了心脏成纤维细胞胶原合成能力的改变。

Figure 5. Collagen synthesis was determined by hydroxyproline assay in the cardiac fibroblasts treated with Ang II at 100 nmol/L for 36 h or transfected with siRNA-1186 for 72 h. Con:control; NC: negative control. Mean±SD.n=3.**P<0.01vsCon;##P<0.01vsNC.
图5 siRNA-1186和Ang II 对心脏成纤维细胞羟脯氨酸含量变化的影响
6 Ang II和siRNA-1186对心脏成纤维细胞I、III型胶原mRNA和蛋白表达的影响
siRNA-1186干扰序列敲低SCAD的表达后,心脏成纤维细胞 I、III型胶原的表达较阴性对照组显著上升,与Ang II 刺激心脏成纤维细胞导致的I、 III
型胶原表达趋势一致,且real-time PCR与Western blot实验的结果保持一致。这表明SCAD的下调可能导致了心脏成纤维细胞I、III型胶原的表达紊乱,见图6。
讨 论
心肌纤维化是由于心脏成纤维细胞过度增殖,导致胶原蛋白过量积聚,胶原成分发生改变或浓度增加所引起的病理过程。主要表现为各型胶原比例失衡,胶原蛋白含量增加及其结构重排,进而影响心脏功能,最终导致心力哀竭的发生。心肌纤维化是多种心脏疾病发展的共同结局,可导致心脏收缩功能障碍、心律失常及室颤的发生,最终演变成难以治疗的充血性心力衰竭[11]。因此,防治心肌纤维化的研究具有重要临床意义。
目前认为,心脏能量代谢有望成为治疗心力衰竭的靶点[12-13],并且对心脏能量代谢的研究主要集中于心肌细胞。我们的前期研究首次发现,与能量代谢密切相关的SCAD参与调控病理性心肌肥厚与心肌细胞凋亡[7,14]。然而,心脏成纤维细胞也是心脏的重要组成部分,参与了心肌纤维化进程。此外,心肌纤维化是心肌肥厚由代偿向失代偿转化的重要病理过程,是引发心力衰竭的核心环节[15]。在心肌肥厚中心肌细胞能量代谢异常已有大量报道[16-18],然而,心肌纤维化时心脏成纤维细胞的能量代谢是否发生变化鲜有报道。因此,从心肌能量代谢角度防治心肌纤维化,延缓心力衰竭进程,可能是一条新思路。

Figure 6. The expression of collagen I and collagen III in the cardiac fibroblasts treated with Ang II (100 nmol/L, 36 h) or siRNA-1186 (72 h). A: the mRNA expression of collagen I and collagen III by real-time PCR; B: the representative images and quantitative analysis of Western blotting for determining the protein levels of collagen I and collagen III. Con: control; NC: negative control. Mean±SD.n=3.**P<0.01vsCon;##P<0.01vsNC.
图6 siRNA-1186和Ang II对心脏成纤维细胞I、III型胶原mRNA和蛋白表达的影响
线粒体的脂肪酸 β 氧化经过脱氢、水化、再脱氢和硫解4个步骤产生能量。SCAD是酰基辅酶A脱氢酶家族成员之一,直接参与脂肪酸β氧化第一步的脱氢过程。我们的前期研究发现,SCAD负性调控病理性心肌肥厚和心肌细胞凋亡[8, 14]。由于心脏成纤维细胞的增殖和胶原代谢失衡是引发心肌纤维化的重要环节,而SCAD是否参与心肌纤维化过程尚未见报道。因此,我们进一步探讨了SCAD在心脏成纤维细胞增殖以及胶原表达中的作用。
在本研究中,我们采用Ang II诱导心脏成纤维细胞增殖模型,观察不同浓度Ang II作用24 h或100 nmol/L Ang II作用不同时间对心脏成纤维细胞增殖的影响。CCK-8以及台盼蓝染色结果提示,Ang II诱导心脏成纤维细胞增殖具有一定的时间和浓度依赖性。此外,在心脏成纤维细胞增殖的时效和量效实验中,SCAD的mRNA和蛋白表达均出现明显下调,并且呈一定的时间和浓度依赖性。以上结果表明,SCAD表达下调可能与Ang II 诱导心脏成纤维细胞增殖密切相关。
为了进一步明确SCAD与心脏成纤维细胞增殖和胶原表达的关系,我们采用RNA干扰技术,观察到siRNA沉默心脏成纤维细胞SCAD基因的同时,心脏成纤维细胞出现明显增殖,胶原含量及其表达明显增加,与Ang II诱导心脏成纤维细胞的趋势一致,SCAD表达下调直接促进了心脏成纤维细胞增殖及胶原合成,表明SCAD表达下调在心肌纤维化中可能具有重要作用。此外,siRNA在引起心脏成纤维细胞SCAD表达下调的同时,SCAD酶活性也明显下降,脂肪酸β氧化速率减小,ATP生成减少,游离脂肪酸含量显著升高,与Ang II引起心脏成纤维细胞脂肪酸代谢的变化一致。表明SCAD的表达下调可能导致了心脏成纤维细胞脂质代谢障碍。以上结果提示,SCAD的表达下调可能导致了心脏成纤维细胞脂肪酸 β 氧化能力下降,从而引起ATP生成减少,游离脂肪酸含量增加,导致心脏成纤维细胞增殖及胶原表达增加。
综上所述,SCAD在心脏成纤维细胞增殖和胶原表达中发挥了至关重要的作用,为我们进一步研究SCAD在心肌纤维化中的作用奠定了基础。然而,SCAD在心肌纤维化中的具体作用机制还需进一步研究。
[1] Zhang P, Su J, Mende U. Cross talk between cardiac myocytes and fibroblasts: from multiscale investigative approaches to mechanisms and functional consequences[J]. Am J Physiol Heart Circ Physiol, 2012, 303(12):H1385-H1396.
[2] Jiang X, Zhang F, Ning Q. Losartan reverses the down-expression of long noncoding RNA-NR024118 and Cdkn1c induced by angiotensin II in adult rat cardiac fibroblasts[J]. Pathol Biol, 2015, 63(3):122-125.
[3] 黄志刚. IL-10 对血管升压素诱导 SD 大鼠心脏成纤维细胞增殖和胶原合成的影响及其与心脏重构关系的研究[D]. 西安:第四军医大学, 2006.
[4] Kolwicz SC Jr, Tian R. Glucose metabolism and cardiac hypertrophy[J]. Cardiovasc Res, 2011, 90(2):194-201.
[5] Pena L, Angle B, Burton B, et al. Follow-up of patients with short-chain acyl-CoA dehydrogensae and isobutyryl-CoA dehydrogenase deficiencies identified through newborn screening: one center’s experience[J]. Genet Med, 2012,14(3):342-347.
[6] Zhou SG, Zhou SF, Huang HQ, et al. Proteomic analysis of hypertrophied myocardial protein patterns in renovascularly hypertensive and spontaneously hypertensive rats[J]. J Proteome Res, 2006, 5(11):2901-2908.
[7] Zeng Z, Huang Q, Shu Z, et al. Effects of short-chain acyl-CoA dehydrogenase on cardiomyocyte apoptosis[J]. J Cell Mol Med, 2016, 20(7):1381-1391.
[8] 曾振华, 黄秋菊, 黄金贤, 等. 短链酰基辅酶 A 脱氢酶在心肌细胞凋亡中的作用[J]. 中国病理生理杂志, 2015, 31(9): 1589-1594.
[9] Huang J, Xu L, Huang Q, et al. Changes in short-chain acyl-CoA dehydrogenase during rat cardiac development and stress[J]. J Cell Mol Med, 2015, 19(7):1672-1688.
[10]Wang P, Zhou S, Xu L, et al. Hydrogen peroxide-mediated oxidative stress and collagen synthesis in cardiac fibroblasts: blockade by tanshinone IIA[J]. J Ethnopharmacol, 2013, 145(1):152-161.
[11]Daskalopoulos EP, Janssen BJA, Blankesteijn WM. Myofibroblasts in the infarct area: concepts and challenges[J]. Microsc Microanal, 2012, 18(1):35-49.
[12]李 娜. PDE5 抑制剂 Sildenafil 对心梗后心衰线粒体能量代谢保护及机制研究[D]. 西安:第四军医大学, 2015.
[13]范 凡. 乙醛脱氢酶 2 缺失加重压力超负荷诱导的心功能不全及心肌能量重构的机制研究[D]. 上海:复旦大学, 2014.
[14]黄秋菊, 黄金贤, 曾振华, 等. ERK1/2/PPARα/SCAD 信号途径对生理性和病理性心肌肥大的调控[J]. 中国病理生理杂志, 2014, 30(8): 1427-1432.
[15]陆小龙. 拉西地平对心脏成纤维细胞增殖和胶原合成的影响及其信号转导机制的研究[D]. 西安:第四军医大学, 2008.
[16]Duhaney TAS, Cui L, Rude MK, et al. Peroxisome proli-ferator-activated receptor α-independent actions of fenofibrate exacerbates left ventricular dilation and fibrosis in chronic pressure overload[J]. Hypertension, 2007, 49(5): 1084-1094.
[17]张 峰. 糖尿病性心肌病的发病机制及能量代谢干预对心肌保护作用的实验研究[D]. 武汉:华中科技大学, 2007.
[18]Lal H, Ahmad F, Zhou J, et al. Cardiac fibroblast GSK-3β regulates ventricular remodeling and dysfunction in ischemic heart[J]. Circulation, 2014, 130(5):419-430.
(责任编辑: 林白霜, 罗 森)
Effects of short-chain acyl-CoA dehydrogenase on collagen expression and proliferation of rat cardiac fibroblasts
SHU Zhao-hui1, ZENG Zhen-hua1, HUANG Qiu-ju1, LI Zhong-hong1, LIU Pei-qing2, CHEN Shao-rui2, LAN Tian1, ZANG Lin-quan1, ZHOU Si-gui1
(1DepartmentofClinicalPharmacy,GuangdongPharmaceuticalUniversity,Guangzhou510006,China;2DepartmentofPharmacologyandToxicology,SchoolofPharmaceuticalSciences,SunYat-senUniversity,Guangzhou510006,China.E-mail:zhousg201014@163.com)
AIM: To investigate the effect of short-chain acyl-CoA dehydrogenase (SCAD) on collagen expression and proliferation of rat cardiac fibroblasts and to explore the relationship between SCAD and cardiac fibrosis. METHODS: The model of proliferation and collagen expression of rat cardiac fibroblasts induced by angiotensin II was established. After treatment with siRNA-1186, the expression of SCAD at mRNA and protein levels, fatty acids beta oxidation rate, ATP, the enzyme activity of SCAD and free fatty acids in the rat cardiac fibroblasts were determined. RESULTS: The mRNA and protein expression of SCAD was decreased in the rat cardiac fibroblasts induced by angiotensin II compared with the control cells, and the expression of collagen I and collagen III was significantly upregulated. Compared with negative control group, SCAD expression and activity, fatty acid beta-oxidation rate and ATP significantly decreased in siRNA-1186 group, but the content of free fatty acids were obviously increased in the rat cardiac fibroblasts, and the expression of collagen I and collagen III was significantly up-regulated. CONCLUSION: The expression and synthesis disorder of collagen may be triggered by down-regulation of SCAD. SCAD may be a promising therapeutic target for myocardial fibrosis.
Short-chain acyl-CoA dehydrogenase; Cardiac fibroblasts; Myocardial fibrosis; Energy metabolism; Collagen
1000- 4718(2016)12- 2184- 08
2016- 04- 18
2016- 09- 13
国家自然科学基金资助项目(No. 81000072;No. 81670239);广东省科技计划(No. 2014A020212315);广东省自然科学基金资助项目(No. 2016A030313729);广东药科大学“创新强校工程”研究生教育建设项目(No. 20140300);广东省“十二五”医学重点学科,依托广东药科大学附属第一医院、药科学院。
R363
A
10.3969/j.issn.1000- 4718.2016.12.010
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-39352123; E-mail: zhousg201014@163.com
