天然辅助细胞在初次和再次RSV感染所诱发气道炎症反应中的作用
2017-01-03胡海燕戚菲菲王丹丹刘北星
胡海燕, 徐 蕾, 戚菲菲, 王丹丹, 刘 静, 曾 胜, 刘北星
(中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122 )
天然辅助细胞在初次和再次RSV感染所诱发气道炎症反应中的作用
胡海燕, 徐 蕾, 戚菲菲, 王丹丹, 刘 静, 曾 胜, 刘北星*
(中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122 )
天然辅助细胞(natural helper cell,NHC)是近期发现的二型固有淋巴细胞的一种,因其在病毒感染后分泌大量Th2型细胞因子,故在病毒感染所诱发的气道炎症反应中发挥重要作用。呼吸道合胞病毒(Respiratory Syncytial Virus, RSV)是最常见的呼吸道病毒,也是一个反复感染的过程。NHC在RSV感染过程发挥的作用尤其是在再次感染中具体作用尚不清楚,故本研究建立初次及再次感染模型,通过计数肺泡灌洗液(BALF)中炎性细胞数量,HE染色观察肺病理炎症反应,Real-time RT-PCR法检测肺组织及NHC内Th1/Th2型细胞因子IFN-γ、IL-5、IL-13mRNA的表达,膜表面染色检测肺组织内CD45+Lin-ST2+标记的NHC数量,细胞膜内染色检测分泌Th1/Th2型细胞因子IFN-γ、 IL-5、IL-13的NHC数量,探讨NHC在初次及再次RSV感染所诱发导致气道炎症反应中的作用。结果显示与再次RSV感染相比,初次RSV感染引起的肺炎症反应明显加重,且肺组织内Th2型细胞因子IL-5、IL-13mRNA表达水平亦明显增多,提示与再次RSV感染相比,初次RSV感染可能通过诱导机体产生更多的Th2型细胞因子,进而导致较重的气道炎症。流式细胞分析术发现初次RSV感染鼠肺组织内NHC总数及IL-5+NHC,IL-13+NHC数量明显多于再次RSV感染组,提示与再次RSV感染相比,初次RSV感染诱导更多的Th2型NHC进入肺组织,参与气道炎症。研究证实NHC通过分泌Th2型细胞因子,尤其是IL-5和IL-13,介导RSV感染所诱发的气道炎症反应。
呼吸道合胞病毒(RSV);天然辅助细胞(NHC);初次RSV感染;再次RSV感染
支气管哮喘是由多种细胞和多种细胞因子共同参与的慢性气道炎症性疾病, 其主要病理改变是慢性气道炎症、气道高反应及气道重塑[1]。病毒感染是诱发并加重哮喘的主要原因[2]。呼吸道合胞病毒(Respiratory Syncytial Virus, RSV)是呼吸道常见微生物,也是诱发和加重哮喘的主要病毒之一[3]。机体感染RSV可导致与哮喘发作时相似的炎症反应,引起气道高反应,从而导致可逆性气道阻塞,促进了哮喘的发展。流行病学证据显示,呼吸道病毒感染不仅可促进哮喘急性加重,且可造成或促进机体对过敏原的过敏反应,从而发展成哮喘[2]。但其中的具体作用机制尚不清楚,有研究认为适应性免疫细胞如CD4+T、CD8+T参与其中,但阻断T细胞后,因RSV感染导致的气道炎症反应依然存在[4],故推测除T细胞以外,其他免疫细胞,特别是固有免疫细胞,可能也参与RSV感染时的气道炎症反应。有文献报道,固有免疫细胞如肥大细胞在RSV感染后通过STAT1途径调控肺部嗜碱性粒细胞IL-4的表达参与[5]。也有研究认为巨噬细胞在RSV感染阶段产生炎性细胞因子,并且通过局部细胞因子和趋化因子的作用促进肺部炎性症状[6]。有最新研究发现天然辅助细胞(natural helper cell,NHC)在RSV诱导导致气道炎症反应中,通过IL-33/ST2途径产生IL-13,导致嗜酸性细胞浸润和气道的高反应性,加重和诱发哮喘的发生[7]。但这些研究大多是针对于初次RSV感染。NHC在初次感染及再次RSV感染所诱发的不同炎症反应中作用如何尚无相关报道。故在本研究中,利用初次和再次RSV感染的BALB/c鼠模型,探讨NHC介导气道炎性反应的作用,从NHC这一新视角,揭示初次及再次RSV感染对哮喘发生发展的影响作用。
1 材料与方法
1.1 材料
1.1.1 动物 4周龄雌性BALB/c鼠,SPF级动物饲养室内常规饲养。
1.1.2 细胞株 人喉癌上皮细胞系Hep-2为本实验室保存细胞株,用含10%FCS的RPMI-1640常规传代培养。
1.1.3 病毒 人类呼吸道合胞病毒A2型(RSV A2),Hep-2细胞增殖病毒,30%蔗糖超速离心法分离病毒粒子,-80 ℃冰箱保存。病毒滴度用组织细胞半数感染量(50% tissue culture infectio-ns dose,TCID50)表示。
1.1.4 试剂 RNA提取试剂盒、逆转录试剂盒和荧光实时定量PCR试剂盒购自TaKaRa生物工程有限公司;FITC anti-mouse lineage、PE anti-mouse McAb、APC anti-mouse CD45购自 Biolegend公司;Percp anti-Mouse ST2(IL-33R)购自 eBioscience公司。
1.2 方法
1.2.1 感染模型 4周龄雌性BALB/c鼠随机分成初次感染组和再次感染组。初次感染组为4周龄鼠饲养4周后经鼻感染2×105TCID50的RSV病毒;再次感染模型为4周龄鼠经鼻感染2×105TCID50RSV病毒,4周后,再次经鼻感染相同剂量RSV。二组鼠均在感染后第2天收集相关实验材料,用于实验研究。
1.2.2 肺炎性细胞分类计数 用1 mL PBS冲洗BALB/c鼠肺泡,收集肺泡灌洗液,离心后取细胞悬液做涂片,吉姆萨染色,显微镜下随机选择视野,计数200个细胞,分别计数炎性细胞如嗜酸性粒细胞和中性粒细胞数量及其百分比。
1.2.3 肺组织病理标本制作及染色 取模型鼠左下肺,制作石蜡切片,常规HE染色,光学显微镜观察肺组织形态结构及肺炎症反应。
1.2.4 Real-time RT-PCR 技术检测细胞因子mRNA的表达 利用TRIzol试剂盒提取肺组织及NH细胞的RNA, SuperscriptⅡ逆转录试剂盒合成cDNA。采用Real-time RT-PCR技术检测模型鼠肺组织及肺提取的NH细胞的Th1型细胞因子IFN-γ和Th2型细胞因子IL-5、IL-13的mRNA表达水平。引物序列见表1。

表1 引物序列Table 1 The sequences of the PCR amplication primers
1.2.5 肺淋巴细胞的提取 模型鼠深度麻醉后用20 mL PBS经心脏灌流去除血管内淋巴细胞。取肺组织,剪碎后用200 μg/mL 胶原蛋白酶D和40 μg/mL DNaseⅠ消化1.5 h,制成单细胞悬液,利用淋巴细胞分离液分离淋巴细胞。
1.2.6 细胞膜表面染色 将肺组织淋巴细胞浓度调整至1×106个/mL。分别加入单克隆抗体(FITC-anti-mouse-lineage,PerCP-anti-mouse-ST2,APC-anti-mouse-CD45),避光冰浴30 min, 表达CD45+Lin-ST2+的细胞为天然辅助细胞。
1.2.7 细胞内染色 肺淋巴细胞加入PMA+ionomycin+BFA刺激培养5 h后,膜表面标记CD45+Lin-ST2+的NHC,然后细胞破膜后加入PE-anti-mouse IL-5、IL-13、IFN-γ抗体,避光冰浴30 min,流式细胞仪检测分析IL-5+的CD45+Lin-ST2+标记的NHC、IL-13+的CD45+Lin-ST2+标记的NHC,IFN-γ+的CD45+Lin-ST2+标记的NHC的数量。
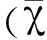
2 结果与分析
2.1 初次及再次RSV感染导致不同的肺炎症反应 如图1所示,初次和再次RSV感染均导致BALB/c鼠肺泡灌洗液中炎性细胞数量增多。但与再次RSV感染鼠相比,初次RSV感染鼠诱导更多的炎性细胞,如中性粒细胞、嗜酸性粒细胞和淋巴细胞侵入肺组织。HE染色亦观察到初次感染组肺组织炎性细胞浸润明显,小支气管和周围组织有明显的炎症细胞浸润,而再次感染组炎症反应明显减轻(图2)。

图1 BALB/c鼠感染RSV后肺泡 灌洗液中炎性细胞数量Fig.1 The number of inflammatory cells in the BAL fluids of BALB/c mice after RSV infection *P<0.05,**P<0.01 与初次感染组对比,下图同 *P<0.05, **P<0.01, compared with the primary infection

图2 初次RSV感染及再次感染肺病理改变Fig.2 Primary RSV infection and reinfection of pulmonary pathological changes
2.2 初次及再次感染RSV诱导产生Th1/Th2型细胞因子水平不同
Real-time RT-PCR检测肺组织内Th1/Th2型细胞因子mRNA的表达水平。结果显示,对比再次RSV感染组,初次RSV感染鼠肺组织内Th1型细胞因子IFN-γmRNA明显减少,而Th2型细胞因子IL-5、IL-13mRNA增多,提示Th1/Th2型细胞因子平衡失调可能是导致气道炎症反应不同的重要原因(图3)。

图3 RSV感染鼠肺组织内Th1/Th2型细胞因子mRNA表达水平Fig.3 The expression of Th1/Th2 cytokine mRNA in the lungs of mice after RSV infection
2.3 NHC参与RSV感染所诱发的气道炎症反应
应用流式细胞术检测发现,与再次RSV感染组相比,初次RSV感染组BALB/c鼠肺组织内NHC数量以及分泌Th2型细胞因子IL-5、IL-13的NHC数量均明显增多,但分泌Th1型细胞因子IFN-γ的NHC数量无明显变化(图4)。Real-time RT-PCR检测技术进一步发现初次感染RSV,肺组织NHC内IL-5、IL-13 mRNA表达水平亦明显高于再次RSV感染组鼠(图5),提示RSV初次感染可能通过诱导Th2型NH细胞肺浸润,加重感染鼠肺局部炎症。

图4 肺组织NHC的绝对数量及产生IL-5/IL-13 NHC数量Fig.4 The absoulute number of NHC as well as IL-5/IL-13-producing NHC in the lungs

图5 肺NHC IL-5/IL-13mRNA表达水平Fig.5 The expression of IL-5/IL-13mRNA in pulmonary NHC
3 讨 论
RSV感染不能建立较长久的免疫记忆和免疫保护,故RSV反复感染的情况极为常见。但机体初次及再次感染RSV时会出现不同的免疫学反应。研究发现,当 BALB/c鼠初次感染RSV时引发气道高反应性,肺泡灌洗液(BALF)中炎性细胞增多(图1),HE染色时肺组织病理反应明显(图2)。RSV感染致气道淋巴细胞聚集,产生多种细胞因子,并促使炎性介质释放,加速嗜酸粒细胞成熟、活化和气道浸润,导致肺出现炎性症状[8]。与初次RSV感染组相比,再次RSV感染时BALB/c鼠肺泡灌洗液中炎性细胞数量减少,且肺组织的病理反应减轻(图2),提示再次RSV感染可能通过诱导免疫保护,从而降低气道高反应性,减少嗜酸粒细胞肺浸润及气道黏液分泌[9]。研究显示,机体感染RSV时,表现为Th2型细胞因子分泌增加,诱导机体产生更多的IgE类抗体,导致气道炎症反应加重,诱发哮喘的发生及加重[10]。Th2型细胞因子的主要代表为IL-5、IL-13,在RSV感染诱导的哮喘中发挥重要作用。当机体感染RSV后,IL-5分泌增加导致气道重塑及气道上皮下纤维增生,尤其是对嗜酸性细胞的成熟、分化、激活发挥重要作用。嗜酸性细胞的增多导致肺浸润加重,诱发及加重哮喘的发生[11]。而IL-13过度表达促进气道黏液分泌、刺激气道上皮细胞释放嗜酸粒细胞趋化因子,诱导气道高反应性及IgE合成,同时导致杯状细胞增生和上皮的纤维化,并刺激肺成纤维细胞增殖,参与气道重建,对哮喘的发生发展具有重要作用[12-13]。本研究显示,初次RSV感染可诱导产生更多的Th2型细胞因子。感染鼠肺组织内IL-5、IL-13mRNA表达水平增多,Th1型细胞因子IFN-γmRNA表达水平明显减少。与此相反,当再次感染发生时,肺组织内Th2型细胞因子分泌减少,而Th1型细胞因子分泌增多(图3),提示再次感染可能通过提高机体Th1型应答,下调Th2型应答,从而减轻RSV感染所导致的气道炎症病变。本研究发现,与再次RSV感染组相比,初次RSV感染组诱导肺组织局部浸润更多地表达CD45+Lin-ST2+的炎性细胞,即天然辅助细胞(图4),提示NHC可能在介导RSV诱发的气道炎症发生方面发挥重要作用。NHC属于固有淋巴细胞家族,其区别于T、B、NK细胞[14],可在IL-25、IL-33刺激下分泌IL-5与IL-13等Th2型细胞因子[15-16]。NHC分泌Th2型细胞因子IL-5与IL-13,进而促进嗜酸性粒细胞与杯状细胞增生,引起呼吸道粘液分泌、平滑肌收缩,导致气道的炎症反应及气道高反应[17-19]。在病毒诱导的气道炎症反应中,NHC是Th2型细胞因子的重要来源[20]。有文献报道,由流感病毒(IVA)感染所引起的呼吸道炎症反应主要是肺部NHC发挥作用。流感病毒(H3N1)感染诱导NHC产生Th2型细胞因子IL-5和IL-13,介导气道高反应性[21-22]。本研究发现初次感染RSV明显增加BALB/c鼠肺淋巴细胞NHC总数,且IL-5+NHC、IL-13+NHC数量也明显增多(图4)。病毒感染诱导NHC分泌更多的Th2型细胞因子如IL-5、IL-13(图5),提示NHC在RSV感染导致气道炎症反应的发生发展过程中起促进作用。最新研究显示,在BALB/c鼠初次感染RSV时,肺NHC产生大量的IL-13,诱发嗜酸细胞肺浸润[8],进一步证实,NHC参与RSV感染所诱发气道炎症反应。
哮喘的发生与发展与众多因素相关。有大量研究证实呼吸道病毒感染与哮喘发作密切相关,但其在诱发哮喘中的具体作用机制尚未清楚,还需要更多的资料和实验来证实。本研究从固有免疫细胞天然辅助细胞的角度研究其中的作用,为提示两者间的相关性提供进一步的佐证。
[1] Mailaparambil B,Grychtol R,Heinzmann A.Respiratory syncytial virusbronchiolitis and asthma-insights from recent studies and implications fortherapy[J]. Inflamm Allergy Drug Targets,2009, 8(3): 202-207.
[2] Schwarze J,Gelfand EW.Respiratory viral infections as promoters ofallergic sensitization and asthma in animal models[J]. Eur Respir J, 2002 ,19(2): 341-349.
[3] Kato M, Ishioka T, Kita H, et al. Eosinophil granular proteins damagebronchial epithelial cells infected with respiratory syncytial virus[J]. Int Arch Allergy Immunol, 2012, 158 Suppl 1:11-18.
[4] Tregoning JS, Yamaguchi Y, Wang B, et al. Genetic susceptibility to thedelayed sequelae of neonatal respiratory syncytial virus infection is MHCdependent[J]. J Immunol, 2010,185(9): 5384-5391.
[5] Moore ML,Newcomb DC,Parekh VV,et al.STAT1 negatively regulateslung basophil IL-4 expression induced by respiratory syncytial virus infection[J]. J Immunol, 2009, 183(3): 2016-2026.
[6] Pribul PK, Harker J, Wang B, et al. Alveolar macrophages are a major determinant of early responses to viral lung infection but do not influence subsequent disease development[J]. J Virol, 2008, 82(9): 4441-4448.
[7] Jing Liu, Jianqi Wu, Feifei Qi, et al. Natural helper cells contribute topulmonary eosinophilia by producing IL-13 viaIL-33/ST2 pathway inamurine model of respiratory virus infection[J]. Int Immunopharma col, 2015, 28(1): 337-343.
[8] Papi A, Johnston SL. Rhinovirus infection induces expression of its own receptor intercellular adhesion molecule 1 (ICAM-1) viaincreased NF-kappaB-mediated transcription[J]. J Biol Chem, 1999, 274(14): 9707-9720.
[9] Hamelmann E, Gelfand EW. Role of IL-5 inthe development of allergen indued airway hyper responsiveness [J]. Int Arch Allergy Immunol, 1999, 120(1):8-16.
[10]Kellner J, Gamarra F, Welsch U, et al. IL-13 Ralpha2 reverses the effects of IL-13 and IL-4 on bronchial reactivity and acetylcholine-induced Ca2+signaling[J]. Int Arch Allergy Immunol, 2007, 142(3): 199-210.
[11]Halim TY, Krauss RH, Sun AC, et al. Lung natural helper cells are acritical source of Th2 cell-type cytokines in protease allergen-induced airway inflammation[J]. Immunity, 2012, 36(3): 451-463.
[12]Dakhama A, Park JW, Taube C, et al. Alteration of airway neuropeptideexpression and development of airway hyperresponsiveness following grespiratory syncytial virus infection[J]. Am J Physiol Lung Cell Mol Physiol, 2005, 288(4): 761-770.
[13]Cautivo KM, Bueno SM, Cortes CM, et al. Efficient lung recruitment ofrespiratory syncytial virus-specific Th1 cells induced by recombinant bacillus Calmette-Guérin promotes virus clearance and protects from infection[J]. J Immunol, 2010, 185(12): 7633-7645.
[14]Moro K, Yamada T, Tanabe M, et al. Innate production of T(H)2 cytokines by adipose tissue-associated c-Kit(+)Sca-1(+) lymphoid cells[J]. Nature, 2010, 463(7280): 540-544.
[15]Fort MM, Cheung J, Yen D, et al. IL-25 induces IL-4, IL-5, and IL-13 and Th2-associated pathologies in vivo[J]. Immunity, 2001,15(6): 985-995.
[16]Barlow JL, McKenzie AN.Type-2 innate lymphoid cells in human allergicdisease[J]. Curr Opin Allergy Clin Immunol, 2014,14(5): 397-403.
[17]Ali S,Huber M,Kollewe C, et al. IL-1 receptor accessory protein isessential for IL-33-induced activation of T lymphocytes and mast cells[J]. Proc Natl Acad Sci USA, 2007, 104(47):18660-18665.
[18]Smithgall MD, Comeau MR, Yoon BR, et al. IL-33 amplifies both Th1-and Th2-type responses through its activity on human basophils, allergen-reactive Th2 cells, iNKT and NK cells[J]. IntImmunol, 2008, 20(8): 1019-1030.
[19]Suzukawa M, Iikura M, Koketsu R, Nagase H,et al. An IL-1 cytokine member, IL-33, induces human basophil activation via its ST2 receptor[J].J Immuno, 2008, 181(9): 5981-5989.
[20]Gorski SA, Hahn YS, Braciale TJ.Group 2 innate lymphoid cell productionof IL-5 is regulated by NKT cells during influenza virus infection[M]. PLoSPatogh, 2013,9(9):e1003615.
[21]Chang YJ, Kim HY, Albacker LA, et al. Innate lymphoid cells mediateinfluenza-induced airway hyper-reactivity independently of adaptive immunity[J]. Nat Immunol, 2011,12(7): 631-638.
[22]Lukacs NW, Tekkanat KK, Berlin A, et al. Respiratory syncytial viruspredisposes mice to augmented allergic airway responses via IL-13-mediatedmechanisms [J]. J Immunol, 2001,167(2): 1060-1065.
The Role of Natural Helper Cells Play in Airway Inflammation Induced by Primary and Secondary RSV Infection
HU Hai-yan, XU Lei, QI Fei-fei, WANG Dan-dan, LIU Jing, ZENG Sheng, LIU Bei-xing
(Teach. &Res.Div.ofImmunol.,Schl.ofBasicMed.Sci.,ChinaMed.Uni.,Shenyang110122)
Natural helper cells (NHC) are ones of the type 2 innate lymphocytes found recently. It has been reported that NHC can secret large amounts of cytokine type Th2, therefore, they play important role during the airway inflammation induced by viral infection. RSV is the most common respiratory virus, it is also a process of repeated infection. NHC may play an important role in RSV-induced airway inflammation. However, the role of NHC play in RSV infection, particularly in secondary infection is still unclear. Therefore, in this study a model of primary and secondary infection was constructed, and the role of NHC in RSV-induced airway inflammation has been observed. By using BALB/c mice that were infected intranasally with RSV, the number of inflammatory cells in the BAL fluids was counted. Lung histopathology was determined by HE staining. The expression of IFN-γ, IL-5, IL-13 mRNA in lung tissue are determined and NHC by RT-PCR. The number of CD45+Lin-ST2+marked NHC and IL-5+NH cells, IL-13+NHC on membrane surface in lung tissue, the number of NHC of IFN-γ, IL-5, IL-13 type Th1/Th2 cytokine were determined by intracellular membrane staining, to investigate the role of NHC in RSV induced by primary and secondary infections. The results showed that as compared with the secondary RSV infection, the lung inflammation reaction caused by RSV infection was worsened significantly, moreover, the expression level of cytokine IL-5, IL-13mRNA type Th2 increased significantly, suggested that as compared with the secondary infection, the primary RSV infection might induce the organism to produce more cytokine Th2, and caused the airway inflammation to worsen. Flow cytometry analysis has found that the total number of NHC in mice lung tissue during RSV primary infection as well as the number of IL-5+NHC, IL-13+NHC were more than the secondary infection group, suggested that as compared with the secondary infection, the RSV primary infection induce more NHC of type Th2 to enter into lung tissue and take part the airway inflammation. The study has proved that NHC intermediately induce airway inflammation through secretion of cytokine of type Th2, particularly IL-5 and IL-13.
RSV; natural helper cells (NHC); RSV primary and secondary infection
国家自然科学基金项目(81273239/H1005 )
胡海燕 女,硕士研究生。主要从事病毒与哮喘研究。E-mail:hyhu1821@aliyun.com
* 通讯作者。女,教授,博士生导师。主要从事病毒与哮喘方面的研究。E-mail:bxliu@mail.cmu.edu.cn
2015-08-10;
2015-09-20
Q939.93;R392.1
A
1005-7021(2016)05-0038-06
10.3969/j.issn.1005-7021.2016.05.007
