豆科植物中异黄酮类化合物生物合成的研究进展
2016-12-30王秋媛范成林
王秋媛,姜 兰,范成林
(1.安顺市农业委员会,贵州 西秀 561000,2.贵州省安顺市西秀区农业局,贵州 西秀 561000)
豆科植物中异黄酮类化合物生物合成的研究进展
王秋媛,姜 兰,范成林*
(1.安顺市农业委员会,贵州 西秀 561000,2.贵州省安顺市西秀区农业局,贵州 西秀 561000)
异黄酮是一类主要在豆科植物中合成的次级代谢产物,鉴于异黄酮类化合物在维持人类和植物健康的过程中发挥的重要作用,人们不约而同地把研究的重点集中于异黄酮的药理分析及其合成途径中来。异黄酮合成的前体为丙苯氨酸,通过苯丙氨酸途径合成最后以葡糖基化和丙二酰糖基化的衍生物形式贮存于液泡中,为方便在未来的研究,介绍了植物异黄酮及其相关衍生物合成途径的最新研究进展。
异黄酮;豆科植物;合成途径
异黄酮是一类只能在豆科植物天然合成的次级代谢产物,包括大豆苷元、染料木黄酮、黄豆黄素,以及经过生物体的糖基化、丙二酰基化加工生成的衍生物如丙二酰大豆黄甙、丙二酰燃料木甙、丙二酰黄豆黄甙、葛根素等9种异黄酮类物质[1-4]。异黄酮在豆科植物与微生物相互作用的过程中发挥了重要的作用,它可以促进豆科作物的根与根瘤菌的结合,诱导根瘤的形成,提高豆科植物固氮的能力;又能充当植物抗病毒素,抵抗真菌的浸染[1]。异黄酮是一类结构与雌性激素相似的化合物,能产生类似雌性激素类似的效应[5],被人们喻植物雌性激素。研究表明,异黄酮能够提高人类的抗氧化能力,有利于人们永葆青春、健康长寿;有助于预防或者缓解目前高发的中老年人心血管疾病;能够在一定程度上治疗一些妇科疾病,缓解绝经期女人状骨质疏松的症状等[6]。通过体外试验和流行病学研究表明,摄入一定量的异黄酮对与激素相关的癌症(乳腺癌、前列腺癌)有广泛的防治作用[7-9],一个延续了两年的试验表明,补充异黄酮类化合物,对绝经前期女性的乳腺密度没有影响,但是能有效防止绝经后期女性乳腺增生[10]。异黄酮能够通过调节细胞周期及促进细胞的凋亡,从而抑制癌变细胞(如乳腺癌、前列腺癌、肝癌、白血病及淋巴癌细胞)的无限增殖[11-16]。此外,食用富含异黄酮的食物能够有效降低肺癌、乳腺癌、前列腺癌、直肠癌以及心血管疾病的发生[17]。异黄酮类化合物在促进人类身体健康以及能够防治很多疾病的这种特性引起了药物学家和生物科学家极大的兴趣,人们不约而同地把目光投向异黄酮类化合物的生物合成途径的研究上来,希望通过基因/代谢工程提高豆科植物合成异黄酮类化合物的能力,或通过基因改造使非豆科植物也能合成异黄酮类化合物,以进一步满足人类健康生活对异黄酮类化合物的需求。
1 异黄酮的合成途径
合成异黄酮的前体为苯丙氨酸,通过苯丙氨酸途径合成最后以葡糖基化和丙二酰糖基化的衍生物形式贮存于液泡中[18]。作为苯丙氨酸途径的一个分支,异黄酮与类黄酮合成的上游途径相同相同,如分别在苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(C4H)、4-香豆酸:辅酶A连接酶(4CL)、查尔酮合成酶(CHS)、查尔酮还原酶(CHR)、查尔酮异构酶(CHI)等酶的催化作用下将芳香族化合L-物苯丙氨酸[19],在下游途径中,异黄酮由4,5,7-三羟基黄烷酮/甘草黄素分别在异黄酮合成酶(IFS)和二羟基异黄烷酮还原酶(HID)的作用下催化合成,最后经过一系列的羟基化、甲基化和糖基化作用修饰,运输储存在液泡中[20](图1)。.大豆苷元(1)、染料木素(2)和黄豆黄素(3)三种主要的异黄酮类化合物的合成途径不尽相同。大豆苷元首先在查耳酮合成酶(chalcone synthase, CHS)的催化作用下合成查耳酮,然后产生分支,继而同大多数植物一样,一部分查耳酮由查耳酮还原酶摧花合成甘草黄素,最后由豆科植物中特异存在的酶——异黄酮合成酶催化合成。人们对染料木素的合成途径至今还不是十分清楚,但可以肯定的是,染料木素是以甘草素为底物合成的[21]。黄豆黄素的合成,同花青素、类黄酮的合成共享底物4,5,7-三羟基黄烷酮,异黄酮合成酶(IFS)和黄烷酮-3-羟化酶( F3H)竞争底物4,5,7-三羟基黄烷酮合成黄豆黄素或者3-羟基黄酮(如图1所示)。虽然这三种异黄酮类化合物的合成途径有所不同,但是可以确定的是,无论哪一条分支途径,最终都由异黄酮合成酶(IFS)催化甘草素发生分子内芳基转移反应生成异黄酮[22-24],继而通过糖苷转移酶等一序列酶催化反应生成糖基化或者丙二酰基化产物贮存于细胞液泡中。在苯丙氨酸途径合成异黄酮的过程中,存在着黄烷酮-3-羟化酶和异黄酮合成酶底物竞争的反应,异黄酮合成酶的催化活性越强,反应生成的异黄酮越多,反之异黄酮产物越少。所以,抑制黄烷酮-3-羟化酶的活性或者抑制其编码基因的表达,以及促进异黄酮合成酶在豆科植物内超表达是提高豆科植物合成异黄酮能力的主要途径。

图1 苯丙氨酸途径合成异黄酮的部分图解,图中列出了各种参与合成的酶、中间产物和本途径中的一些分枝,虚线箭头表示有很多反应步骤,大箭头表示的步骤还不甚明了。Fig.1 A partial diagram of the phenylpropanoid pathway. Intermediates and enzymes involved in isoflavone synthesis, as well as some branch pathways, are shown. Dotted arrows represent multiple steps; the block arrow represents speculative steps.
2 异黄酮合成相关的催化酶
作为苯丙氨酸代谢途径的一个分支,异黄酮合成的上游途径同类黄酮、花青素等色素合成的催化酶相同,如苯丙酰胺裂解酶,肉桂酸-4-羟化酶,4-香豆酸:辅酶A连接酶,查尔酮合成酶,查尔酮还原酶,查尔酮异化酶,异黄酮合成酶和2-羟基黄烷酮还原酶等。在下游途径中,参与催化异黄酮合成的酶是异黄酮合成酶、二羟基异黄酮还原酶,以及一系列异黄酮合成后修饰的糖基化酶、乙酰基化酶、甲基化酶等。异黄酮合成酶是豆科植物所特有的催化酶,这是其他科的植物不能自然合成异黄酮的最主要的原因。此外,黄烷酮-3-羟化酶的活性影响异黄酮的生成量,因为在异黄酮(黄豆黄素)合成过程中,异黄酮合成酶(IFS)与黄烷酮-3-羟化酶同时竞争底物4,5,7-三羟基黄烷酮。在本文中,我们将主要讨论豆科植物所特有的异黄酮合成酶,以及异黄酮合成后修饰的一系列糖基化、乙酰基化和甲基化酶。
异黄酮合成酶,又叫二羟基异黄酮合成酶(2-HIS),是一种属P450细胞色素超家族CYP93C亚族的色素合成酶,异黄酮合成酶苯丙氨酸代谢途径分支中催化合成异黄酮的第一个关键酶,在豆科植物异黄酮类合成过程中发挥了不可替代的作用。异黄酮合成酶在异黄酮合成过程中催化甘草黄素/4,5,7-三羟基黄烷酮分子内原子重新排列,生成2.4.7-三羟基异黄酮/2,4,5,7-四羟基异黄酮(如图2),这一反映过程中需要NADPH+和分子氧的参与,并且是在内质网膜上完成的[25]。Jung等首次在大豆及其他种类的豆科植物中获得了两种不同的类型的异黄酮合成酶编码基因,并通过转基因技术实现了在拟南芥中合成异黄酮类化合物[24]。此外,tian等在很多能积累黄酮类或者花青素等但不能合成异黄酮的非豆科植物如烟草和拟南芥中转入异黄酮合成酶基因,能够在这些植物的相应起器官中检测到异黄酮的积累[26]。到目前为止,人们已经从17种豆科植物中分离识别了28种异黄酮合成酶相关基因编码的氨基酸序列,这些氨基酸序列的相似度性达到95%以上(斯图加特大学P450工程数据库,http://www.cyped.uni-stuttgart.de),其中包括来自三叶草(Trifolium repens)的IFS2基因[27]、野葛(Pueraria montana var. lobat)[28]和泰国葛根(Pueraria candolleivar. mirific)的IFS基因[29]等。
二羟基异黄烷酮还原酶,是异黄酮生物合成的最后一个关键酶,催化2,4,7-三羟基异黄酮/2,4,5,7-四羟基黄烷酮在自然条件下或者在2-羟基异黄酮还原酶的催化下脱水生成异黄酮(如图2)[30]。二羟基异黄烷酮还原酶是一种分子质量为38kDa,等电点pH为5.1,最佳活性pH值为6.8的单链催化酶[31]。Akashi等分别克隆获得了刺甘草和大豆的二羟基异黄烷酮还原酶(HID)的cDNA,酶活动力学试验表明,刺甘草HID只能催化还原2,7-二羟基-4-甲氧基异黄烷酮,二大豆HID既能催化4’-羟基-2-羟基异黄烷酮,又能催化4’-甲氧基-2-羟基异黄烷酮还原反应生成异黄酮[30]。
异黄酮合成后修饰的相关酶,异黄酮合成之后,经过一系列糖基化、乙酰基化、甲基化酶的修饰后储存在液泡中。参与异黄酮合成后修饰相关酶相关的研究至今开展的还不多,He等利用EST数据库,通过race技术获得了15个糖基转移酶(UGTs)编码基因的序列,生物信息学软件翻译后的蛋白质序列比对分析表明,这些基因的活性中心(UDP-结合中心)位于多肽序列的碳端,序列间的相似度在22%-80%之间。同拟南芥UGTs基因序列的进化分析表明,这15个基因中的11个基因可划分到拟南芥UGTs的两个类群中,其中5个基因可划到D类,另外6个可划到E类[28]。Wang等利用转录组测序,获得了22个UDP-糖基转化酶和45个氧甲基转化酶基因的unigene,这些基因可能与异黄酮后期修饰有关[20]。
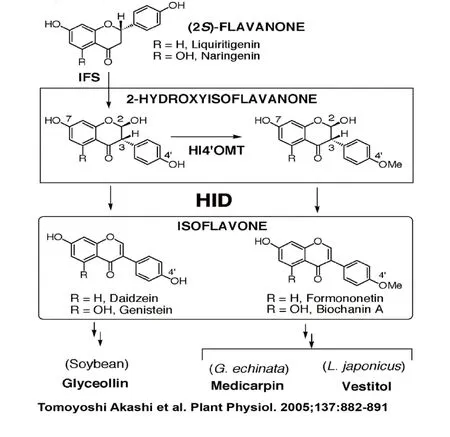
图2 异黄酮合成酶、2-羟基异黄烷酮还原酶作用示意图Fig.2 Catalyze function verifying of isoflavone synthase and 2-hydroxyyisoflavanone dehydratase in isoflavone biosynthesis pathway
3 异黄酮在细胞中的合成部位及其运输
异黄酮主要在内质网上合成,贮存于液泡中,这说明异黄酮存在细胞内运输的现象。除此之外,异黄酮甚至可以从一个细胞运输到另一个细胞中。Dhaubhadel等研究显示,大豆的种子、豆荚和叶都能合成异黄酮,但大豆合成的异黄酮主要储存在种子和根部,而且大豆种子异黄酮的含量还受母本的影响[2],他们的研究指出,以异黄酮合成量较高的品系作母本的杂交F1代种子异黄酮含量最高,母本自交次之,父本自交异黄酮含量最低。但涉及异黄酮运输的基因及其运输途径至今还基本上没有报道。
4 提高豆科植物异黄酮合成量及在非豆科植物中合成异黄酮
鉴于异黄酮重要的药理特性,人们希望通过基因/代谢工程技术提高豆科植物异黄酮的产量及把相关基因等转入非豆科植物使一些非豆科植物也能合成异黄酮类,使之满足人们健康生活对异黄酮类的需求。
Yu等将玉米中促进花青素积累的CI和R转录因子转入大豆中,发现转基因阳性植株总异黄酮合成量是非转基因对照的三倍之多,但是各种异黄酮成分的含量变化较大。之后,他们同时将CI、R转录因子和一个抑制F3H的基因转入大豆中,发现转基因植株总异黄酮含量是对照株的四倍以上,且黄豆黄素的含量大为提高[3]。
Tian等构建了一个作用于内质网膜的异黄酮合成酶/查尔酮异构酶(IFS/CHI)复合酶基因并转入酵母和烟草中表达,结果发现转基因烟草植株的花瓣、叶片等积累了大量的异黄酮(黄豆黄素),且含量高于只转入异黄酮合成酶的植株[6]。
Chun-Hat Shih等将大豆异黄酮合成酶的cDNA转入西红柿,发现转基因植株叶片中含有大量的黄豆黄素,同时,西红柿果实的表皮中也发现有少量黄豆黄素的积累[32]。
以上研究表明,异黄酮不仅仅只能在豆科作物中合成,在人工改造的条件下,西红柿、烟草和拟南芥等非豆科植物也能有异黄酮类的合成,这有可能为解决某些地域的人们不能通过大量豆产品摄取异黄酮类的难题提供了参考。
5 展望
异黄酮是一种只能在豆科植物中自然合成的次生代谢物质,在豆科植物与环境的作用特别是在保护植物免受病原菌的侵害以及豆科植物与固氮菌作用的过程中发挥了巨大作用。同时,摄入一定量的异黄酮,能够在减轻女士绝经期症状、抗氧化、降低中老年人骨质疏松症、心血管疾病以及减轻癌症的发生等方面发挥很大的作用。近年来,人们对大豆等主要农作物异黄酮合成的途径已经研究得相当深入,也通过基因/代谢工程技术改造非豆科植物使之能够合成异黄酮方面取得了巨大的成就,但是对如葛等一些比较重要的豆科植物异黄酮合成及运输等方面还不甚了解。为了能够获得更多的异黄酮类物质以满人们健康生活的需求,在一些异黄酮积累量高的植物的异黄酮合成途径及如何提高其异黄酮产量方面依然有待进一步研究。本文简单综述了异黄酮合成途径研究的一些进展,希望对未来的相关研究有所帮助。
[1] Prashant Misra, Ashutosh Pandey, Shri Krishna Tewari et al. Characterization of isoflavone synthase gene from Psoralea corylifolia: a medicinal plant.Plant Cell Rep 2010, (29):747-755.
[2] Sangeeta Dhaubhadel, Brian D. McGarvey, Ruthanne Williams et al. Isoflavonoid biosynthesis and accumulation in developing soybean seeds. Plant Molecular Biology , 2003, 53:733-743.
[3] Oliver Yu, June Shi, Aideen O. Hession et al. Metabolic engineering to increase isoflavone biosynthesis in soybean seed. Phytochemistry 2003, 63 753-763.
[4] XianZhi He Jack W. Blount Shujun Ge et al. A genomic approach to isoflavone biosynthesis in kudzu (Pueraria lobata). Planta (2011) 233:843-855.
[5] 胡晓娟, 黄晓书, 李卫华,等. 高效液相色谱法测定保健食品中的大豆异黄酮. 分析试验室, 2008, 27(1): 103-106.
[6] L. Tian, R.A. Dixon et al. Engineering isoflavone metabolism with an artificial bifunctional enzyme. Planta 2006, 224: 496-507.
[7] Duffy C., Perez K., Partridge A., Implications of phytoestrogen intake for breast cancer. CA Cancer J. Clin.2007, 57, 260-77.
[8] Allred C. Ju, Y. H. Allred K. F, Chang J., et al. Dietary genistin stimulates growth of estrogen-dependent breast cancer tumors similar to that observed with genistein. Carcinogenesis 2001, 22, 1667-1673.
[9] Day J. K, Besch-Williford C., McMann T. R.,et al. Dietary genistein increased DMBA-induced mammary adenocarcinoma in wild-type, but not ER alpha KO, mice. Nutr. Cancer 2001, 39, 226-232
[10] Mark J. Messina, Charles L. Loprinzi. Soy for Breast Cancer Survivors: A Critical Review of the Literature.The Journal of Nutrition, 2001, 131, 3095—3018
[11] Swami S., Krishnan A. V., Peehl D. M., et al. Genistein potentiates the growth inhibitory effects of 1, 25-dihydroxyvitamin D3 in DU145 human prostate cancer cells: role of the direct inhibition of CYP24 enzyme activity.Mol. Cell. Endocrinol.2005, 241, 49-61.
[12] Katdare M., Osborne M. P., Telang N. T. Soy isoflavone genestein modulates cell cycle progression and induces apoptosis in HER-2/neu oncogene expressing human breast epithelial cells. Int. J. Oncol.2002, 21, 809-816.
[13] Su S. J., Chow N. H., Kung M. L.,et al. Effects of soy isoflavones on apoptosis induction and G2-M arrest in human hepatoma cells involvement of caspase-3 activation, Bcl-2 and Bcl-XL down regulation, and Cdc2 kinase activity. Nutr.Cancer.2003, 45, 113-23.
[14] Rayna N. J., Momparler L., Charbonneau M., et al. Antileukemic activity of genistein, a major isoflavone present in soy products. J. Nat. Prod.2008, 71, 3-7.
[15] Matsui J., Kiyokawa N. Takenouchi H., Taguchi T., et al. Dietary bioflavonoids induce apoptosis in human leukemia cells. Leuk. Res.2005, 29, 573-581.
[16] Park S. S., Kim Y. N., Jeon Y. K., Kim Y. A.,et al., Genistein-induced apoptosis via Akt signaling pathway in anaplastic large-cell lymphoma. Cancer Chemother. Pharmacol.2005, 56, 271-278.
[17] Nagata Y., Sonoda T, Mori M.,et al., Akaza H. Dietary isoflavones may protect against prostate cancer in Japanese men.J. Nutr. 2007, 137, 1974-1979.
[18] Graham T. L., 1991. Flavonoid and isoflavonoid distribution in developing soybean seedling tissues and in seed and root exudates. Plant Physiol. 95, 594-603.
[19] Thomas Vogt. Phenylpropanoid Biosynthesis.Molecular Plant , 2010 ,3(1): 2-20
[20] Xin Wang, Shutao Li, Jia Li, et al. De novo transcriptome sequencing in Pueraria lobata to identify putative genes involved in isoflavones biosynthesis.Plant Cell Rep (2015) 34:733-743
[21] Latunde-Dada, A.O., Cabello-Hurtado, et al. Flavonoid 6-hydroxylase from soybean (Glycine maxL.), a novel plant P-450 monooxygenase. J. Biol. Chem. 276, 1685-1688.
[22] Akashi T., Aoki T., Ayabe S.,. Cloning and functional expression of a cytochrome P450 cDNA encoding 2-hydroxyisoflavanone synthase involved in biosynthesis of the isoflavonoid skeleton in licorice. Plant Physiol, 1999, 121, 821-828.
[23] Steel C.L., Gijzen M., Qutob D., et al. Molecular characterization of the enzyme catalyzing the aryl migration reaction of isoflavonoid biosynthesis in soybean. Arch. Biochem. Biophys, 1999, 367, 146-150.
[24] Jung W., Yu O., Lau S.-M.C., et al., 2000. Identification and expression of isoflavone synthase, the key enzyme for biosynthesis of isoflavones in legumes. Nat. Biotechnol. 18, 208-212.; erratum Jung, W., Yu, O., Lau, S.C., O’Keefe, D.P., Odell, J., Fader, G., McGonigle, B., 2000. Nat. Biotechnol. 18, 559.
[25] Georg KOCHS, Hans GRISEBACH et al. Enzymic synthesis of isoflavones. Eur. J. Biochem. 155,311 -318 (1986)
[27] Franzmayr B.K., Rasmussen S., Fraser K.M., et al.: Expression and functional characterization of a white clover isoflavone synthase in tobacco. - Ann. Bot. 110: 1291-1301, 2012.
[28] He, X., Blount, J.W., et al.: A genomic approach to isoflavone biosynthesis in kudzu (Pueraria lobata). - Planta 233: 843-855, 2011.
[29] Wiriyaampaiwong, P., Thanonkeo S., Thanonkeo P.: Molecular characterization ofisoflavone synthase gene from Pueraria candolleivar. mirifica. Afr. J. agr. Res. 7: 4489-4498, 2012.
[30] Akashi T., Aoki T., Ayabe S. (1999) Cloning and functional expression of a cytochrome P450 cDNA encoding 2-hydroxyisoflavanone synthase involved in biosynthesis of the isoflavonoid skeleton in licorice. Plant Physiol 121:821-828.
[31] Takashi Hakamatsuka, Kazumi mori, Yutaka Ebizuka and Ushio Sankawa. Purification of 2-Hydroxyisoflavanome Dehydratase from the Cell Culture ofPueraria Labata. Phytochemistry, 1998, 49(2): 497—505
[32] Chun-Hatshih, Yuan-ling Chen et al. Accumulation of Isoflavone Genistin in Transgenic Tomato Plants Overexpressing a Soybean Isoflavone Synthase Gene. J. Agric. Food Chem.2008,56,5655-5661.
The Research Advances of Isoflavonoids Biosynthesis in Legumes Plants
WANG Qiu-yuan, JIANG Lan, FAN Cheng-lin*
(1.AnshunCommissionofAgriculture,Xixiu,Guizhou561000,China,2.XixiuBureauofAgriculture,Xixiu,Guizhou561000,China)
Isoflavonoids are a class of secondary metabolism natural products predominantly synthetised in legumes plants. Because of the benefits for human and plants healths, attentions have drawn on isoflavoniods and the pathways for isoflavonoids biosynthesis, though the molecular mechanism of isoflavonoids biosynthesis is still unknown. The isoflavonoids were synthesized through phenylalanine pathway, and stored in vacuoles as glycosylation and deacetylation derivatives. In this review, provided an overview of resent advances in our understanding of biosynthesis of isoflavonoids and relative compounds, and summarize advantage ways to study the pathway and key enzymes for isoflavonoids and corresponding derivatives synthesizing for future study.
isoflavonoids; legumes plants; pathway
2016-05-05
王秋媛(1989-),女,农艺师,主要从事农业技术推广工作。
范成林(1980-),男,高级农艺师,农技推广站站长,主要从事农业技术推广工作。
