比较两种ELISA试剂盒在猪伪狂犬病血清抗体检测中的一致性
2016-12-27全炎铭贾泽颖郭又春刘修权刘莉如伊秀春陈华林
全炎铭 贾泽颖 刘 邓 郭又春 刘修权 刘莉如 伊秀春 陈华林
(北京三元集团畜牧兽医总站,北京 100192)
比较两种ELISA试剂盒在猪伪狂犬病血清抗体检测中的一致性
全炎铭 贾泽颖 刘 邓 郭又春 刘修权 刘莉如 伊秀春 陈华林
(北京三元集团畜牧兽医总站,北京 100192)
比较两种ELISA试剂盒检测结果的一致性,为流行病学调查和临床诊断筛选适合的商品化试剂盒。采用来自两个厂家的野毒抗体 (gE)和免疫抗体 (gB)ELISA检测试剂盒分别检测362份和392份猪血清,应用Kappa检验比较试验数据的一致性。结果显示:两种猪伪狂犬病抗体 (gE)检测试剂盒联合检测出95份抗体阳性和256份阴性,符合率97.24%,结果一致性为极强 (Kappa值0.932);两种猪伪狂犬病抗体 (gB)检测试剂盒联合检测出351份抗体阳性和9份阴性,符合率91.84%,一致性为弱 (Kappa值0.347)。以上结果说明,两种猪伪狂犬病抗体 (gE)检测试剂盒都适用于PRV gE抗体检测,而两种猪伪狂犬病抗体 (gB)检测试剂盒差异较大,需慎重选择。
猪伪狂犬病;ELISA试剂盒;比较;Kappa检验
伪狂犬病(Pseudorabies,PR)是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的一种急性传染病,其特征为发热、奇痒及脑膜炎症状[1-2]。该病曾得到很好的控制,但2011年至今,从北方向南方,PR疫情再次抬头,席卷我国大部分地区,许多免疫过基因缺失苗的规模化阴性猪场瞬间转阳,很多研究[3-6]表明此次大面积的猪场发病是由变异的PRV引起。虽然近期该病看似得到控制,很多野毒感染阳性稳定场很少发病,仅出现混合感染病例,但是在种猪场各个生长阶段的猪群野毒感染的高阳性率,很大程度上影响了国内养猪业持续发展,增加了疫病防控的复杂性[7-9],同时PR野毒感染率居高不下,存在疫情暴发的风险。因此,为了保证被检猪群的安全性和加快阳性猪场的野毒净化措施,有效开展野毒感染抗体与免疫抗体水平的跟踪监测显得十分重要[7-8]。
病毒抗体监测的方法较多,其中酶联免疫吸附试验(ELISA)具有客观、敏感、特异、快捷等优点,为国际贸易中抗体检测指定方法之一,目前已经广泛运用于临床诊断和血清学调查中[10-12]。本研究通过比较国内运用较为广泛的两种进口PR病毒野毒抗体gE和gB抗体ELISA检测试剂盒,检测样本来源清晰的PR阳性猪场和阴性猪场血清,对其检测结果的一致性进行评估和分析,为合理选择诊断试剂盒提供参考。
1 材料与方法
1.1检测样品
猪血清采自9个不同的规模化猪场(阳性猪场3个,阴性猪场6个),为本实验室保
存的秋季抽检血清样本。选取392份生长阶段清晰的血清样本进行免疫抗体检测(除25~30日龄哺乳仔猪外,其他均免疫过PRV gE基因缺失弱毒苗),再从这392份血清中剔除PR阴性场(A猪场)30份血清进行野毒抗体检测。
1.2检测试剂
ELISA进口试剂盒分别购买于美国爱德士(IDEXX)公司和西班牙海博莱(HIPRA)公司。PRV-gpI(gE)抗体检测试剂盒:IDEXX(批号为99-09836 FM349),HIPRA(批号为 CAE.IM90);gB抗体检测试剂盒:IDEXX(批号为99-09732 EM176),HIPRA(批号为FS6397)。
1.3检测方法及结果判定
猪伪狂犬病病毒gE抗体检测方法均按试剂盒说明书进行。IDEXX:读取OD650值,用S/N值来判定结果(S/N=样品OD值/阴性对照平均OD值),其中S/N≤0.6判为阳性,S/N>0.7为阴性,0.6<S/N≤0.7为可疑;HIPRA:读取OD450值,采用IN%值判定(IN%=(阴性对照平均OD值-样品OD值)/阴性对照平均OD值*100%),其中IN%>45为阳性,IN%<40为阴性,40≤IN%≤45为可疑。
猪伪狂犬病病毒gB抗体检测方法也按试剂盒说明书进行。IDEXX:读取OD650值,用S/N值来判定结果,其中S/N≤0.5为阳性,S/N>0.6为阴性,0.5<S/N≤0.6为可疑;HIPRA:测定OD405值并计算S/P值,S/P= (样品OD值-阴性对照平均OD值)/(阳性对照平均OD值-阴性对照平均OD值),其中S/P≥0.5为阳性,S/P<0.5为阴性。
如有结果差异,选取两试剂盒检测结果不一致的血清样本,再检测1次,取2次平均OD值作为最终结果判定。
1.4统计学方法和判定指标
采用EXCEL处理数据,使用SPSS 19.0统计软件对两种试剂盒检测结果进行分析。应用Kappa检验判定一致性,其中Kappa值<0,提示一致性极差;Kappa值在0~0.2,表示一致性微弱;Kappa值在0.21~0.4,一致性弱;Kappa值在0.41~0.6,中度一致;Kappa值在0.61~0.80,较高一致性;Kappa值>0.80,极强一致性。通过符合率、Kappa值等统计学指标,并结合送检猪场流行病学情况综合评价试验检测结果。
2 结果
2.1 Kappa检验比较猪伪狂犬病病毒gE抗体检测试剂盒
采用两种试剂盒检测结果见表1,总体样品结果的符合率为97.24%。根据Kappa一致性检验,Kappa值为0.932,表明两种试剂盒检测结果有极强的一致性。
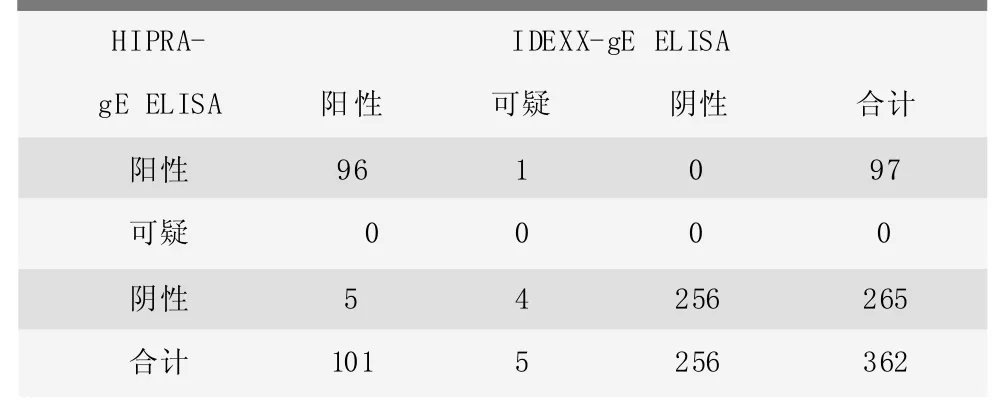
表1 两种gE抗体试剂盒检测结果一致性分析 (份)
两种猪伪狂犬病病毒gpI(gE)抗体检测结果显示,362份样品中有10份样品结果不一致,分析发现这10份血清样品的IDEXX检测结果S/N值都是介于0.4~0.7之间,且分别来源于1份种公猪样品(B033-1),1份哺乳仔猪样品(B033-P5),1份母猪样品(B036-8)和7份育成育肥猪样品。不相符合猪血清样品检测结果见表2。

表2 两种gE抗体试剂盒检测不相符合血清样品结果比较
2.2 Kappa检验比较猪伪狂犬病病毒gB抗体检测试剂盒
猪伪狂犬病病毒gB抗体检测试剂盒检测结果见表3,总体样品检测结果的符合率为91.84%。Kappa值为0.347,判定结果为弱,表明两种产品检测结果存在较弱的一致性。
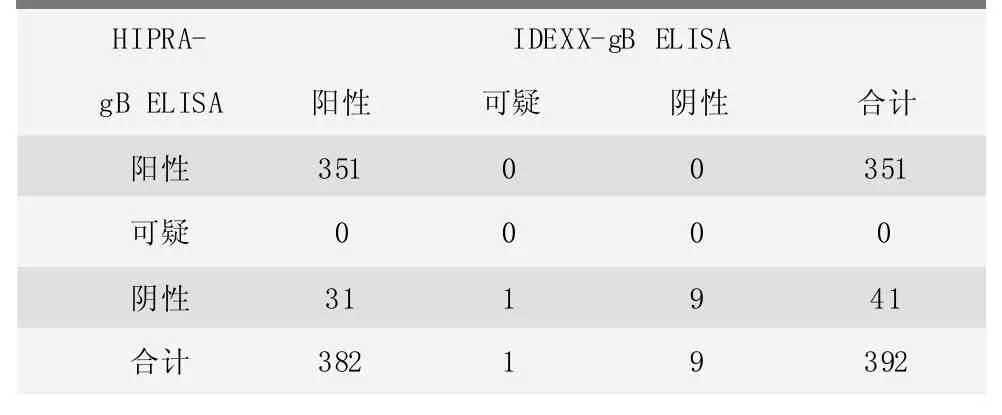
表3 两种gB抗体试剂盒检测结果一致性分析 (份)
两种gB ELISA试剂盒检测结果可见,392份猪血清样品中,有33份样品结果不一致,分析检测差异主要集中在育成育肥猪群(中大猪),4份育仔猪。参考送检猪场的送样信息可看出,用这两种试剂盒检测PR阴性场和阳性场一部分中大猪血清样品出现了明显差异,见表4。
3 分析与讨论
Kappa统计量是Cohen在1960年首先提出的一种旨在校正机遇可能后衡量一致性的方法,也是一种用于检验分类变量资料的一致性和重现性的统计指标[13]。具体而言,在研究工作中,可用来检验比较两种检查或测定方法结果的一致性,以及评估临床诊断结果或调查结果的重现性问题[14]。近几年来,该方法在检验医学研究、流行病学及临床资料可靠性考察衡量方面的应用越来越广泛[14-16],但在兽医实验室检测中较少。随着国家对一些重大动物疫病防控的高度重视,在强制免疫成为防疫的关键一环后,临床诊断和抗体跟踪监测显得尤为重要,于是市面上很多兽医临床诊断试剂盒,如雨后春笋不断涌现,可以应用Kappa一致性检验对其进行比较和评估[10-12,17]。
猪伪狂犬病的防治主要依靠疫苗接种和常规诊断检测,猪PR病毒野毒抗体检测采用gE抗体检测试剂盒,诊断猪群是否感染猪伪狂犬病野毒株。PRV gE和gB抗体检测试剂盒可用于PR诊断和该病的综合防治及PR净化效果的评估。本研究根据Kappa值为0.932这个判定指标,表明两个厂家gE-ELISA试剂盒一致性极强,说明两种试剂盒在血清学诊断和监测中差异不显著,均可用于临床个体样本和群体野毒抗体检测,这与杨涛等[17]报道的基本一致。

表4 两种gB抗体试剂盒检测不相符合血清样品结果比较
在规模化猪场猪群PRV gE野毒抗体检测的同时,采用gB抗体检测试剂盒对猪群免疫后产生的抗体水平进行检测,能更好地反映猪群PR防疫水平和抵制强毒感染的能力。通过我们对北京部分规模化养殖猪场PR的摸底排查和持续的跟踪监测,了解到目前猪场普遍使用PRV gE基因缺失弱毒苗防控PR,近一两年内出现很多PR阳性稳定场,全群受野毒侵蚀,后备猪群表现高的阳性率,是母猪群阳性率居高不下,其猪群中隐性感染的猪只随之进入后备群,在猪场中形成循环感染,造成PR难以净化的重要原因。但是出现的猪群免疫后持续性抗体水平(gB抗体高达95%以上)这种奇怪的现象引人深思,而本研究通过比较两种gB抗体检测试剂盒,检测结果差异较大,一致性为弱,提示两种试剂盒至少有一种结果不可靠,对两者检测结果存在差异的33份猪血清进行分析不难看出,主要集中在中大猪的检测样本中,HIPRA-gB ELISA结果检出阴性,符合当前猪场中大猪群抗体低,容易感染的实际背景。表明不管是PR阴性场还是PR阳性场部分中大猪群免疫抗体水平低,加上卫生环境差,容易激发混合感染而发病,有必要加强育成育肥猪舍的日常消毒卫生和生物安全工作。因此建议在开展PR免疫后gB抗体检测时,应根据实验室检测群体来源和检测对象,慎重选择不同的诊断试剂盒[10,12]。
当然,根据实际检测样本计算的Kappa值仅仅只是一个样本的统计量,是反映一致性程度的数值[10],体现两种检查方法或试剂检测的一致性水平,可作为可靠性参考,但不是判定试剂盒或方法好坏优劣的唯一性指标,还需要参考敏感性、特异性和稳定性等指标[11-12],以及抽样误差和实验检测中不可控的其他影响因素。
[1]BARBARA ES,JEFFERY JZ,SYLVIE DA,et al.猪病学(第9版)[M].赵德明,张仲秋,沈建忠,等译.北京:中国农业大学出版社,2008.
[2]白文彬,于康震.动物传染病诊断学[M].北京:中国农业出版社,2002.
[3]吴云飞,朱玲,徐志文,等.伪狂犬病病毒四川株的分离鉴定及增殖特性[J].中国兽医学,2013,43(6):557-564.
[4]彭金美,安同庆,赵鸿远,等.猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析[J].中国预防兽医学报,2013,35(1):1-4.
[5]Yu X,Zhou Z,Hu D,et al.Pathogenic pseudorabies virus, China,2012 [J].Emerging Infectious Diseases,2014,20(1): 102-104.
[6]范克伟,戴爱玲.吴德峰.等.猪伪狂犬病毒Jiangxi-FZ株的分离鉴定及其重要毒力基因分子特征 [J].中国人兽共患病学报, 2015,31(12):1103-1110.
[7]党占国,高进勇,孙哲,等.2012-2015年我国部分地区规模化猪场伪狂犬病血清流行病学调查 [J].畜牧与兽医,2016,48(8): 76-79.
[8]吴植.规模化猪场伪狂犬病的抗体监测与分析[J].中国兽医杂志,2016,52(7):42-43.
[9]邹敏,杨旭兵,郑辉,等.2012-2013年我国部分地区猪伪狂犬病流行病学调查[J].中国动物检疫,2015,32(4):1-5.
[10]李知新,刘光远,赵燕,等.一致性检验比较两种弓形虫抗体检测试剂盒[J].甘肃畜牧兽医,2016,1(46):81-84.
[11]吴华伟,高金源,邓永,等.国内5种猪圆环病毒PCV2抗体检测试剂盒的比较试验[J].中国兽药杂志,2011,45(6):11-12.
[12]刘华,詹松鹤,何长生,等.应用Kappa检验比较猪蓝耳病ELISA抗体检测试剂盒[J].中国动物检疫,2014,31(11):95-96.
[13]王洁贞,韩兢,刘彦训,等.Kappa统计量在一致性和重现性检验中的应用[J].山东医科大学学报,1996,34(3):209-212.
[14]张波.Kappa一致性检验在流行病学中的应用举例 [J].宁夏医学院学报,1995,17(4):336-337.
[15]夏邦世,吴金华.Kappa一致性检验在检验医学研究中的应用[J].中华检验医学杂志,2006,29(1):83-84.
[16]杨有业,张秀明.临床检验方法学评价[M].北京:人民卫生出版社,2008:296-312.
[17]杨涛,李谓娟.Kappa检验比较2种猪伪狂犬病gE抗体ELISA检测试剂盒[J].福建畜牧兽医,2015,37(6):11-13.
S858.28
A
1673-4645(2016)12-0045-04
2016-12-04
三元种业自立课题(SYZY20130019)
全炎铭(1984-),湖南湘西人,硕士研究生,E-mail:26326109@qq.com
