产脂肪酶菌株的常压室温等离子体诱变及高通量筛选方法的建立
2016-12-26冯凤琴
曹 茜 冯凤琴,2
(浙江大学生物系统工程与食品科学学院1,杭州 310058)(浙江大学馥莉食品研究院2,杭州 310058)
产脂肪酶菌株的常压室温等离子体诱变及高通量筛选方法的建立
曹 茜1冯凤琴1,2
(浙江大学生物系统工程与食品科学学院1,杭州 310058)(浙江大学馥莉食品研究院2,杭州 310058)
脂肪酶由于可催化的反应种类和底物类别多,且具有位置选择性和异构体选择性等特点而常用于结构酯的合成和油脂改性等领域。丝孢酵母(Trichosporonsp.)是一种产脂肪酶菌种,但生产能力偏低是限制该菌实现工业化生产的重要因素。本研究利用常压室温等离子体(ARTP)对丝孢酵母野生菌进行诱变处理,并建立了96孔板培养结合对硝基苯酚棕榈酸酯(p-NPP)法测定酶活力的高通量筛选方法,实现了60个突变菌株的初筛。以酶活力为筛选指标时,突变率和正突变率分别为51.7%和28.3%。8株初筛菌株的摇瓶发酵结果显示,A13和A5的产酶提高最显著,培养96 h后分别比野生菌增加2.64倍和1.54倍,且2个突变菌株的遗传稳定性良好。对比研究发现,突变菌株A13相较野生菌的最大优势在于提前24 h便能达到最高产酶量。
丝孢酵母 脂肪酶 常压室温等离子体 诱变 高通量筛选
脂肪酶(EC 3.1.2.3)是最常见的生物催化剂之一,能够水解三酰甘油酯,生成游离脂肪酸、二酰甘油酯、单酰甘油酯和甘油。事实上,脂肪酶不但能够催化水解反应,还能催化各种合成反应,包括酯化、酯交换、酸解、醇解和氨解等[1-2]。由于脂肪酶可催化的反应种类和底物类别多,因而已广泛应用于食品、药物、饲料、化妆品、清洁剂等领域[3]。此外,相比于化学法催化,酶催化能在较低温度下进行,更重要的是,脂肪酶具有底物专一性、位置选择性和异构体选择性等特点,在结构酯的合成和油脂改性等反应中催化生成的副产物少,降低了后续分离纯化的难度。
微生物产脂肪酶因其多样的催化能力、产量高、便于基因操作、生产无季节波动、在廉价的培养基上菌体即可快速生长、批量生产容易等优点,比植物种子和动物体内的脂肪酶应用更为普遍[4]。产脂肪酶的微生物种类较多,细菌、放线菌、酵母和霉菌均有报道[5],本研究所涉及的菌株为丝孢酵母(Trichosporonsp.),该类菌所产脂肪酶的分子质量在28~55 ku之间[6-9]。
国内对于丝孢酵母脂肪酶的报道较少,少数涉及诱变的研究主要利用紫外和化学诱变剂等传统方法,张苓花等[10]利用紫外和硫酸二乙酯的复合诱变将一种丝孢酵母的胞外酶活提高了76%,宋欣等[11]通过紫外和亚硝酸的复合诱变筛选到酶活提高155%的菌株。但生产能力偏低仍然是该类菌实现工业化生产的瓶颈,为获取高产能力的菌株,本课题组尝试利用常压室温等离子体(ARTP)诱变丝孢酵母野生菌。ARTP利用氦气辉光放电产生的等离子体射流作用于微生物,对菌株的遗传物质造成损伤,细胞因此启动的修复过程中会产生大量的错配位点,并最终稳定遗传进而形成突变株。ARTP具有射流温度低、对菌株无热损伤、无需真空装置、对生物大分子作用明显等优点[12-13],是一种获得非转基因突变体的新型快速诱变技术。
ARTP作用后可产生种类丰富的突变库,这对筛选到目标菌株是非常有利的,但同时也给筛选工作造成了较大的压力。传统的解决方法是利用摇瓶发酵逐个培养,工作量相当巨大。因此,建立有效的快速筛选方法极为重要。本研究试图通过在96孔板上实现培养发酵和酶活测定来建立高通量的筛选方法,从而完成对ARTP作用后丝孢酵母突变体的筛选,以期获得高产脂肪酶的突变菌株并为其他快速筛选研究提供参考。
1 材料与方法
1.1 试验材料与仪器
1.1.1 菌株
试验菌株为本实验室自油污土壤样品(采自浙江杭州)筛选分离后保存,经26S rDNA核苷酸序列测定鉴定为丝孢酵母(Trichosporonsp.)。
1.1.2 培养基
斜面和平板培养基:酵母浸出粉5 g/L,蛋白胨10 g/L,葡萄糖20 g/L,琼脂粉14 g/L;种子培养基:酵母浸出粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L;发酵培养基:酵母浸出粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,橄榄油10 mL/L。
1.1.3 主要试剂
对硝基苯酚棕榈酸酯(p-NPP,≥98%)和Trizma©base(≥99.9%):Sigma-Aldrich 有限公司(St. Louis, USA);对硝基苯酚(p-NP,分析纯):阿拉丁试剂(上海)有限公司;酵母浸出粉和蛋白胨:杭州微生物试剂有限公司。
1.1.4 主要仪器设备
ARTP-Ⅱ型诱变育种系统:无锡思清源生物科技有限公司;Multiskan Mk3型酶标仪:Thermofisher(上海)仪器有限公司;恒温培养振荡器:上海智城分析仪器制造有限公司;H1650-W型高速离心机:湖南湘仪实验室仪器开发有限公司。
1.2 ARTP诱变
1.2.1 菌悬液的制备
从丝孢酵母的斜面接一环至种子摇瓶(装有50 mL种子培养基的250 mL锥形瓶),于30 ℃振荡培养48 h,恒温振荡器的振速为200 r/min。培养完毕后,取1 mL菌液离心并去上清,向菌体沉淀中加入1 mL生理盐水(质量浓度为8.5 mg/mL)重悬,制得待照射的菌悬液。
1.2.2 诱变方法和条件
将10 μL菌悬液(含菌量为2.40×107cfu/mL)均匀涂布于已灼烧灭菌的载片上,并将载片置于气流端口2 mm处,等离子体的工作气体为高纯氦气,气流量10 SLM,处理功率120 W,处理时间分别为0、30、60、90、120、150和180 s。在该条件下,等离子体温度小于40 ℃。样品处理完毕后,将载片放于1 mL生理盐水中振荡1 min以洗脱菌体,适量稀释后取100 μL涂布于平板,于30 ℃下培养后计数.
1.3 高通量筛选方法
1.3.1 多孔板初筛
96孔板中每孔加入200 μL发酵培养基,将平板上生长出的菌落用1 μL接种环接种到各孔中培养,每个菌落各接3孔为3个平行试验。将接菌后的96孔板固定于恒温培养振荡器中,在30 ℃、200 r/min的条件下培养发酵。每隔12 h取样5 μL至另一96孔板测定发酵液的酶活,测定方法如下:每孔中除移入的样品外,另加入100 μL Tris-HCl缓冲液(0.05 mol/L, pH=8)和5 μL p-NPP(3 mg/mL,溶剂为乙腈),反应混合物在150 r/min、40 ℃的条件下反应30 min,利用酶标仪在405 nm下测量各孔的吸光度,比较突变菌株和野生菌的测量值,计算出相对酶活。
1.3.2 摇瓶复筛
将96孔板筛选出的高产脂肪酶突变株各接种一环至发酵摇瓶(装有50 mL发酵培养基的250 mL锥形瓶)以复筛出最优菌,每个突变株做3个平行试验。各摇瓶在转速为200 r/min、温度为30 ℃的振荡器中培养,每隔24 h取样1 mL,10 000 r/min离心5 min后取上清液即为粗酶液,测定其活力。酶活力测定采用p-NPP为底物的方法[14],并根据目标脂肪酶的反应条件做了少量修改:2.1 mL Tris-HCl缓冲液、200 μLp-NPP和100 μL适当稀释的酶液(缓冲液与底物的浓度同1.3.1节)均加入5 mL EP管中,将反应混合物于40 ℃水浴中搅拌反应10 min,反应结束后置于冰水浴中同时加100 μL ZnSO4(0.1 mol/L)以终止反应,用0.45 μm水系滤膜过滤后405 nm下比色测定。脂肪酶的1个酶活力单位(U)定义为每分钟从底物中释放1 μmol的p-NP所需要的酶量。
1.4 遗传稳定性分析
为了研究诱变菌株的遗传稳定性,将复筛出的2株高产突变株分别连续传代5次,并将各代接种于发酵摇瓶培养96 h,测定各代发酵液的脂肪酶活力和菌体的生物量。酶活力的测定方法同1.3.2节;生物量的测定采用干重法:取1 mL发酵液至已经称重的2 mL EP管中,10 000r/min离心5 min后保留菌体沉淀,将沉淀用生理盐水清洗3次,105 ℃下烘干至恒重,测定菌体干重。
1.5 发酵特性对比研究
将野生菌及2株突变菌株各接种一环至种子摇瓶中培养,每隔12或24 h取样1 mL测定生物量,用以绘制生长曲线。生物量的测定方法同1.4节。
取培养36 h的3株菌的种子液1 mL至发酵摇瓶中发酵产酶(接菌量为2%)。每隔12或24 h取样1 mL,10 000 r/min离心5 min后保留上清液和沉淀,用以测定酶活力和生物量,测定方法分别同1.3.2节和1.4节。
1.6 数据处理
1.6.1 突变率计算
将96孔板筛选测定的相对酶活大于120%或者小于80%的菌株定义为突变株,产酶提高的突变株定义为正突变。总突变率=(突变菌株数/总菌株数)×100%;正突变率=(产酶提高的突变菌株数/总菌株数)×100%。
1.6.2 统计分析
利用SPSS 17.0对遗传稳定性测定结果进行单因素方差分析,α=0.01。
2 结果与分析
2.1 ARTP诱变的致死率曲线
等离子体产生的活性粒子除了能够破环微生物的细胞壁和细胞膜,还能够到达细胞内部,显著作用于遗传物质,从而造成大部分微生物死亡[15-16]。但少数菌体却能够通过自身的修复机制存活下来,这些存活下来的菌体由于遗传物质发生了部分改变,可能引起表型的变化,因此能为不同目标的筛选提供丰富的突变库。
如图1所示,ARTP对丝孢酵母具有明显的作用效果,只需照射30 s就能够达到85.4%的致死率,之
后的致死率增长虽然变缓,但在30 s到120 s之间时,处理时间与致死率仍然存在明显的正相关,120 s之后,致死率稳定在98%以上,到180 s时达到99.8%。随机性是非转基因突变的最大特点,致死率和正突变率的关系并不十分清楚,主要取决于诱变方法和菌株本身的特性[17]。本研究选择了致死率在98%以上的受试样品中筛选高产脂肪酶的目标菌。

图1 ARTP对丝孢酵母的致死率曲线
2.2 突变菌株的高通量筛选
观察在平板上生长出的菌落形态,无论是否经过ARTP处理以及处理时间的长短,菌落形态都没有发生明显的变化:白色,表面突起,有明显的皱褶。因此,不能将形态改变作为筛选参考,这就更突显了建立高通量筛选方法的重要性。
利用碱滴定脂肪酶水解乳化油脂单位时间释放的游离脂肪酸的量为传统的测定脂肪酶活力的方法[18],该方法操作相对复杂,很难实现高通量的筛选。p-NPP是由棕榈酸和p-NP结合生成的一种酯类,当作为脂肪酶的催化底物时,可水解产生p-NP,其在405 nm具有最高吸收峰,且吸光度的大小与浓度在一定范围内成正比,因此能够用于反应脂肪酶的水解活力。由于该法操作简便、灵敏度高,可用于构建产脂肪酶微生物快速筛选的方法。

注:96孔板发酵48 h,虚线表明增长或减少20%。
图2显示了60株诱变后菌株相对于野生菌产酶的酶活力大小,野生菌的相对酶活为1,与虚线位置的比较可以发现,许多菌株都发生了显著的变化。通过计算得出,ARTP对丝孢酵母的突变率为51.7%,其中正突变率为28.3%。在17株正突变菌株中有8株菌的产酶提高超过35%,其编号分别为A5、A11、A13、B1、B20、C7、C11和C13,将这8株菌和野生菌分别转接于发酵摇瓶培养,以进一步筛选出最优菌株。
每24 h从发酵摇瓶中取样测定脂肪酶活力,结果如图3所示。在摇瓶发酵中,培养48 h后各菌株开始产酶,但此时所产酶量较少,且差异不显著,之后进入快速产酶阶段,到72 h时,产酶的差异逐渐表现出来。通过计算得出:摇瓶发酵72 h后,A13的酶活比野生菌增长5.14倍,A5增长1.55倍,增长最少的C11提高了30.4%;发酵96 h后,由于野生菌的胞外酶增速积累,这个差距得以缩小,但A13仍比野生菌发酵液的酶活增长2.64倍,A5增长1.54倍。显著的酶活提高表明,ARTP确实对丝孢酵母产生了有效的生物作用,使得一些突变株的产酶能力得以明显改变。
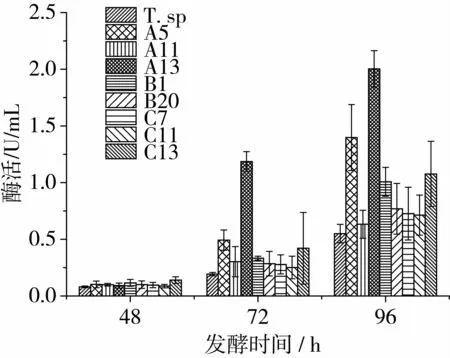
图3 野生菌与8株突变株的摇瓶发酵复筛酶活
比较摇瓶发酵和96孔板发酵结果可以得出,由96孔板筛选出的高产菌株在摇瓶中也表现出产酶显著提高,这表明快速筛选方法是可靠的,而且可能由于多孔板中加入的培养基较少,使得依靠橄榄油作为碳源的时间提前,发酵48 h时就有明显的产酶,这说明快速筛选不仅体现在同时可筛的数量较多,也体现在发酵时间的缩短。但96孔板培养也存在一些弊端,由于体系缩小,营养成分、氧气等都会不同程度地限制产酶量,并且这些限制因素随着菌株的产酶能力越高表现得越突出。因此,多孔板培养可作为初筛,在缩小目标菌范围后利用摇瓶发酵确定最佳突变株。
2.3 高产突变株的遗传稳定性
经过多孔板和摇瓶发酵2轮筛选之后,得到了2株产酶较优的突变株,即A5和A13。由于可遗传的变异对于发酵工程才是有意义的,因此本研究从生物量和产酶2个方面研究了这2株菌的遗传稳定性。
图4a显示了A5连续传代5次后各代在摇瓶发酵中的生物量和产酶情况。由图可知,生物量和胞外酶活力虽都略有起伏,但整体表现稳定,并未出现明显的衰退。为了进一步确认,利用SPSS 17.0对这5代的结果进行单因素方差分析。各代的生物量在99%的置信区间内差异不显著(P=0.029>α),酶活的差异同样不显著(P=0.087>α)。
A13的遗传稳定性也同样进行了验证,如图4b所示,突变株A13的生物量和酶活在传代过程中整体表现平稳,根据方差分析的结果,各代间生物量的显著性为0.082,酶活的显著性为0.055,均大于0.01,这表明在该置信区间内差异不显著,突变株A13也具有良好的遗传稳定性。


图4 突变株的遗传稳定性
2.4 野生菌及突变株的发酵特性
为了进一步探究突变株A5和A13与野生菌的差异性,本课题组详细研究了3株菌的生长和产酶特性。种子培养基中各菌的生长曲线如图5所示,野生菌和突变株的生长趋势及生物量并无显著差异,均是在12 h后进入对数期,48 h后进入稳定期。将培养36 h的种子液接入发酵摇瓶中发酵产酶,3株菌的生长和产酶情况如图6所示,与图5相比,由于对数期种子液的作用,菌株生长没有出现明显的迟缓期,值得一提的是,48 h后3株菌的生物量积累并未完全停止,而是继续缓慢增长,这很可能得益于橄榄油继续提供碳源。对比生长曲线和产酶曲线可以发现,48 h后生长放缓的同时,产酶则开始快速积累,突变株A13产酶的增速尤为突出,96 h后逐渐达到平衡,但此刻野生菌的胞外酶却加速积累,这使得发酵120 h后3株菌的产酶并无明显差异。对比研究表明,突变株A13的最大优势在于将达到最高产酶的时间提前了24 h。
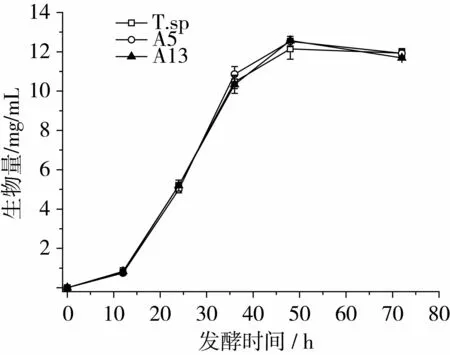
图5 野生菌和突变株在种子培养基中的生长曲线

图6 野生菌和突变株在发酵培养基中的生长和产酶曲线
3 结论
本研究采用一种新型的突变技术ARTP对产脂肪酶丝孢酵母进行诱变,这是首次将该技术应用于丝孢酵母属。对60株经等离子体照射后存活的菌株进行筛选,以酶活力作为筛选指标,突变率为51.7%,正突变率为28.3%,突变效果良好。
为了提高筛选效率,建立了96孔板初筛结合摇瓶发酵复筛的高通量筛选方法。若1个菌株做3次平行试验,1块96孔板可最多同时筛选32株菌,大大缩短了筛选周期;意外的收获在于,在小体积发酵中,该菌的产酶时间比摇瓶发酵提前,这进一步缩短了筛选时间。但由于96孔板对于菌株产酶能力的完全表现存在一定的制约,因此将筛选出的8株较优菌通过摇瓶发酵进行验证,从中筛选出了2株最优突变株A13和A5,培养发酵96 h之后,A13产酶提高2.64倍,A5提高1.54倍。在连续传代5次之后,这2株突变菌株在生物量和产酶能力方面表现出良好的遗传稳定性。
进一步的对比研究发现,在48~96 h期间,A13和A5的产酶一直高于野生菌,但这之后野生菌更快的产酶速度使得在120 h时3株菌的产酶量无差异。这表明,产酶时间提前才是突变株的最大优势,A13达到最大产酶量的时间比野生菌提前了24 h。
[1]Villeneuve P, Muderhwa J M, Graille J, et al. Customizing lipases for biocatalysis: a survey of chemical, physical and molecular biological approaches [J]. Journal of Molecular Catalysis B-Enzymatic, 2000, 9(4-6): 113-148
[2]Gandhi N N. Applications of lipase [J]. Journal of the American Oil Chemists Society, 1997, 74(6): 621-634
[3]Ventura S P M, Sousa S G, Freire M G, et al. Design of ionic liquids for lipase purification [J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2011, 879(26): 2679-2687
[4]Hasan F, Shah A A ,Hameed A. Industrial applications of microbial lipases [J]. Enzyme and Microbial Technology, 2006, 39(2): 235-251
[5]曹茜,冯凤琴. 微生物脂肪酶的研究进展及其在食品中的应用 [J]. 中国食品学报, 2013(10): 136-143
[6]Chen J, Shimura S, Kirimura K, et al. Purification of extracellular lipases fromTrichosporonfermentansWU-C12 [J]. Journal of Fermentation and Bioengineering, 1994, 77(5): 548-550
[7]Dharmsthiti S ,Ammaranond P. Purification and characterization of lipase from a raw-milk yeast (Trichosporonasteroides) [J]. Biotechnology and Applied Biochemistry, 1997, 26(2): 111-116
[8]Song X, Qu Y, Shin DH, et al. Purification and characterization of lipase fromTrichosporonsp. Y-11 and its use in ester synthesis of unsaturated fatty acids and alcohols [J]. Journal of Microbiology and Biotechnology, 2001, 11(6): 951-956
[9]Kumar S S, Arora N, Bhatnagar R, et al. Kinetic modulationofTrichosporonasahiiMSR 54 lipase in presence of organic solvents: Altered fatty acid specificity and reversal of enantio selectivity during hydrolytic reactions [J]. Journal of Molecular Catalysis B: Enzymatic, 2009, 59(1): 41-46
[10]张苓花,王运吉. 高产脂肪酶菌株的诱变筛选 [J]. 生物技术, 1996, 6(2): 20-22
[11]宋欣,曲音波. 耐碱性脂肪酶产生菌的选育及酶学性质的研究 [J]. 工业微生物, 1999, 29(4): 22-26
[12]Wang L Y, Huang Z L, Li G, et al. Novel mutation breeding method forStreptomycesavermitilisusing an atmospheric pressure glow discharge plasma [J]. Journal of Applied Microbiology, 2010, 108(3): 851-858
[13]Li G, Li HP, Wang LY, et al. Genetic effects of radio-frequency, atmospheric-pressure glow discharges with helium [J]. Applied Physics Letters, 2008, 92(22): 221504
[14]Yoo H Y, Simkhada J R, Cho S S, et al. A novel alkaline lipase fromRalstonia with potential application in biodiesel production [J]. Bioresource Technology, 2011, 102(10): 6104-6111
[15]Pompl R, Jamitzky F, Shimizu T, et al. The effect of low-temperature plasma on bacteria as observed by repeated AFM imaging [J]. New Journal of Physics, 2009, 11(11): 115023
[16]Morfill G, Kong M G ,Zimmermann J. Focus on plasma medicine [J]. New Journal of Physics, 2009, 11(11): 115011
[17]金丽华, 方明月, 张翀,等. 常压室温等离子体快速诱变产油酵母的条件及其突变株的特性 [J]. 生物工程学报, 2011, 27(3): 461-467
[18]Saxena R K, Davidson W S, Sheoran A, et al. Purification and characterization of an alkaline thermostable lipase fromAspergilluscarneus[J]. Process Biochemistry, 2003, 39(2): 239-247.
Mutagenesis of Atmospheric and Room Temperature Plasma for Lipase-Producing Strain and Establishment of High Throughput Screening Method
Cao Xi1Feng Fengqin1,2
(College of Biosystems Engineering and Food Science, Zhejiang University1, Hangzhou 310058)(Fuli Institute of Food Science, Zhejiang University2, Hangzhou 310058)
Because of various reaction types, substrates, regioselectivity, isomer selectivity and other features, lipases have been widely used in a multitude of fields, especially structure lipids synthesis and oil modification. Trichosporon sp. is a kind of lipase-producing strain, but relatively low yield limits its industrial production. The atmospheric and room temperature plasma (ARTP) were used to conduct mutagenic treatment on trichosporon aquatile wild mushroom and a high throughput screening method using 96-well plates was set up; in this protocol, enzyme activity of fermented broth was measured byp-nitrophenylpalmitate (p-NPP) method, preliminary screening of 60 mutant strains were finished. The mutation rate were positive mutation rate were 51.7% and 28.3% respectively when enzyme activity was regarded as the screening index. According to the results of shake-flask fermentation of 8 preliminary screening strains, enzyme yields of A13 and mutant A5 were prominent which were respectively 2.64 and 1.54 times higher than that of the wild strain after 96 h cultivation. And both of them showed good genetic stability. Compared with wild strain mutant A13 reached the plateau of yield of enzyme 24 h ahead of time, which is the most important advantage to this mutant.
Trichosporon aquatile., lipase, atmospheric and room temperature plasma, mutagenesis, high throughput screening
TQ925+.6
A
1003-0174(2016)02-0052-06
浙江省重大科技专项(2012C12005-2)
2014-06-26
曹茜,女,1988年出生,博士,食品科学
冯凤琴,女,1964年出生,教授,博士生导师,食品化学与食品生物技术
