失败模式与影响分析方法在药品检验中的应用探讨
2016-12-26詹宇杰
詹宇杰
(重庆市食品药品检验检测研究院·重庆市药物过程与质量控制工程技术研究中心,重庆 401121)
失败模式与影响分析方法在药品检验中的应用探讨
詹宇杰
(重庆市食品药品检验检测研究院·重庆市药物过程与质量控制工程技术研究中心,重庆 401121)
目的 提高药品检验管理体系风险管理能力。方法 通过对药品检验5个子系统功能的分析,建立“人”子系统的失败模式,并进行影响分析,对风险优先数高的失败模式进行控制。结果 明确了药品检验5个子系统的主要功能,建立了11个“人”子系统的失败模式,并进行了影响分析,对不能接受的风险(失败模式)进行了有效控制。结论 在药品检验中应用失败模式与影响分析,能有效地管理风险,使管理体系得到持续改进。
失败模式与影响分析;药品检验;风险管理;失败模式
2011年1月1日,《药品生产质量管理规范》(GMP)2010年修订版开始实施,将风险管理这一全新管理方式引入药品生产质量管理。在质量认证、生产许可、注册核查、监督检查中,越来越多地涉及到风险管理。“风险”是危害发生的可能性和该危害严重性的组合,“风险管理”是风险的评估、控制、沟通和回顾的系统化过程[1]。失败模式与影响分析(FMEA)是风险管理中的重要工具,20世纪50年代,美国开始将其应用于航天、航空、汽车工业的可靠性分析。FMEA在药品生产质量风险管理中应用广泛,对风险的分析和控制易于理解、掌握。笔者通过对药品检验系统进行分析,明确各子系统功能,为建立失败模式提供数据,应用FMEA对药品检验中的风险进行评估和控制,使管理体系得到持续改进。
1 FM EA概述
1.1 分析方法
FMEA对于汇总故障重要模式、引起故障的因素和故障可能的效应,是一种强有力的工具。失败模式、影响及危害性分析(FMECA)是FMEA的扩展[2],在实际应用中习惯与FMEA合并使用。FMEA有多种实施方法和表达形式,通常是对系统进行分析,通过识别失败模式、相关失败原因及失败的直接或最终影响来实现[2]。FMEA是一种识别各种潜在失败模式严重性并给出为降低风险所采取措施的方法[2],不仅进行分析、评估,还对不接受的风险提出降低风险的改进措施,使系统内已经认识到的风险通过适当控制均可接受。基本步骤是:按子系统列出各个失败模式的结果→对失败结果给出严重性(SEV)的分数→列出失败模式的原因(可以是多个)→给出原因出现概率(OCC)的分数→识别用于发现失败模式当前的控制手段→对每一个原因和控制手段给出发现可能性(DET)的分数→对每一条计算风险优先数(RPN)(RPN=SEV×OCC×DET)→基于RPN确定失败模式和原因的优先次序(评估)→确定对不可接收的风险采取的行动→采取行动后重新计算风险优先数(pRPN)→基于pRPN重新对失败模式和原因进行评估,确定是否接受。
1.2 主要步骤
确定失败模式:系统能否正常工作是由系统中某些重要单元的性能决定的,系统性能评价的关键是识别那些重要的单元。首先应评估系统边界范围内的所有项目,确定潜在的失败模式。评估应在分析对象相对应的最低层次上进行,分析子系统和系统功能可能的失败原因及失败影响[2]。
失败原因:应确定和描述各种潜在失败模式最有可能的失败原因。失败原因可通过分析现场失败(失败的真实检验过程)或试验件失败(模拟检验过程)来确定[2]。药品检验系统按要素分为5个子系统,它们某一个功能的缺失就是一个失败模式,通过分析失败的原因,可按表1评分方法评估其影响或危害性。

表1 评估失败模式影响(危害)严重性(SEV)的评分
失败原因发生的概率(OCC):为了恰当地评估失败模式的影响或危害性,应确定每一个失败原因的发生概率(OCC),见表2。

表2 评估失败原因发生的概率(OCC)评分[1]
失败原因被发现的可能性(DET):在系统或用户受到影响(危害)前识别和消除失败的可能性。DET值的排序通常与严重性(SEV)、发生概率(OCC)的排序相反。DET值越高,发现的可能性越小。较低的可发现性(DET)将导致较高的风险优先数(RPN),处理失败模式的优先级较高。见表3。

表3 评价发现可能性(DET)的评分
失败模式风险优先数的评估:风险优先数是定量确定危害性的一种方法,是SEV,OCC,DET三者的乘积,即RPN=SEV×OCC×DET。RPN可用于确定减缓和消除失败模式的优先次序。除了依据RPN的大小外,失败模式的严重性也是重要考量的因素,如RPN相同,严重性高者优先[2]。RPN在实际使用中,将1~8定义为低风险,可直接接受;9~36为中度风险、37~125为高风险,应采取适当措施降低严重性、发生概率和提高发现可能性,使风险削减后达到可接受程度。风险削减后再对严重性(pSEV)、发生几率(pSEV)、发现可能性(pDET)、风险优先数(pRPN)进行评估,得到新的优先排序,并在日常工作中予以相应程度的关注。
2 药品检验系统分析及FM EA的应用
2.1 5个子系统
药品检验是指对药品、保健食品、化妆品、药品包装材料与容器等进行的监督检验、评价检验、委托检验、注册检验、进口检验等。药品检验是一个相关或相互影响要素的集合,这个集合就是“系统”,包括硬件、软件(及其相互作用)或过程。药品检验的基本过程:样品接收及样品信息录入(包括检前留样)→样品分检→样品检验→检验数据汇总→合成报告书→报告书的审核签发→报告书打印、发放、寄送与存档。为了便于分析,笔者将药品检验系统按要素分为“人”“机”“料”“法”“环”5个子系统。
“人”子系统包括机构和人员。基本功能:满足检验任务和检验服务的组织机构,足够数量的经过有效培训的具有适当资质的各类人员,明确清晰、层次界线分明的机构和人员的职责,人员身心健康,健全的培训体系,良好的机构和人员的评价系统。该子系统最活跃、最不稳定,也最难控制,是最重要的子系统。
“机”子系统包括仪器、设备,特别是关键仪器、设备的校准、确认、使用与维护等。基本功能:关键仪器、设备经适当确认,校准的范围和精度满足相关检验的要求,按相应的操作规程使用和维护。药品检验机构现阶段对仪器设备的确认工作做得不够,是今后改进的重要方向。
“料”子系统包括待检样品、检前留样、检验所需要的对照品、标准品、菌种、试药、试剂、气体、容器、耗材等。基本功能:待检样品能真实反映商品(产品)的质量属性,符合审计要求的稳定的供应商或生产商,按规定程序、条件接收、贮存、发放对照品、标准品、菌种、试药、试剂、气体、容器、耗材。
“法”子系统是药品检验的管理标准、检验标准、操作规程、各种记录及报告书,也就是文件系统,包括质量手册、程序文件,管理程序、检验标准,操作规程,各种记录,报告书等。基本功能:文件层次清晰,所有文件均受控,管理和操作都以文件为依据,如实记录各种操作,即没有记录即没有发生,避免口头传递、交流重要信息,报告书寄送及时、存档安全有序。检验中标准的更新、补充检验方法与项目、主管部门的临时要求都是活跃的变量,应该特别给予关注。
“环”子系统包括检验的外部环境和内部环境,主要是检验房屋内的环境。主要功能:足够的空间和功能明确的区域,相关操作、仪器与设备所在空间及对照品、标准品、菌种、试药、试剂等的贮存条件应在规定温度、湿度、光照的环境内,精密仪器定置环境防震防磁防潮,无菌、微生物限度、不溶性微粒、内毒素检查等操作在相应的洁净环境下,危险物品的防燃防爆环境与设施,检验的各种操作防止相互影响,确保检验环境对人员的保护。
2.2 FM EA在“人”子系统中的应用
药品检验实验室“人”子系统包括组织架构、职责、资质、培训、健康等,见表4和表5。可见,失败模式1和7由于RPN低于9而没有采取新措施降低风险就直接接受了,其余9个失败模式都针对原因和原有控制方法采取了新的措施来降低RPN使其达到可接受的程度。药品检验既是一个复杂的系统,又是一种服务。在服务FMEA中,通常可在发生度和可检测度范围内做预期改变,而严重度保持不变[4]。
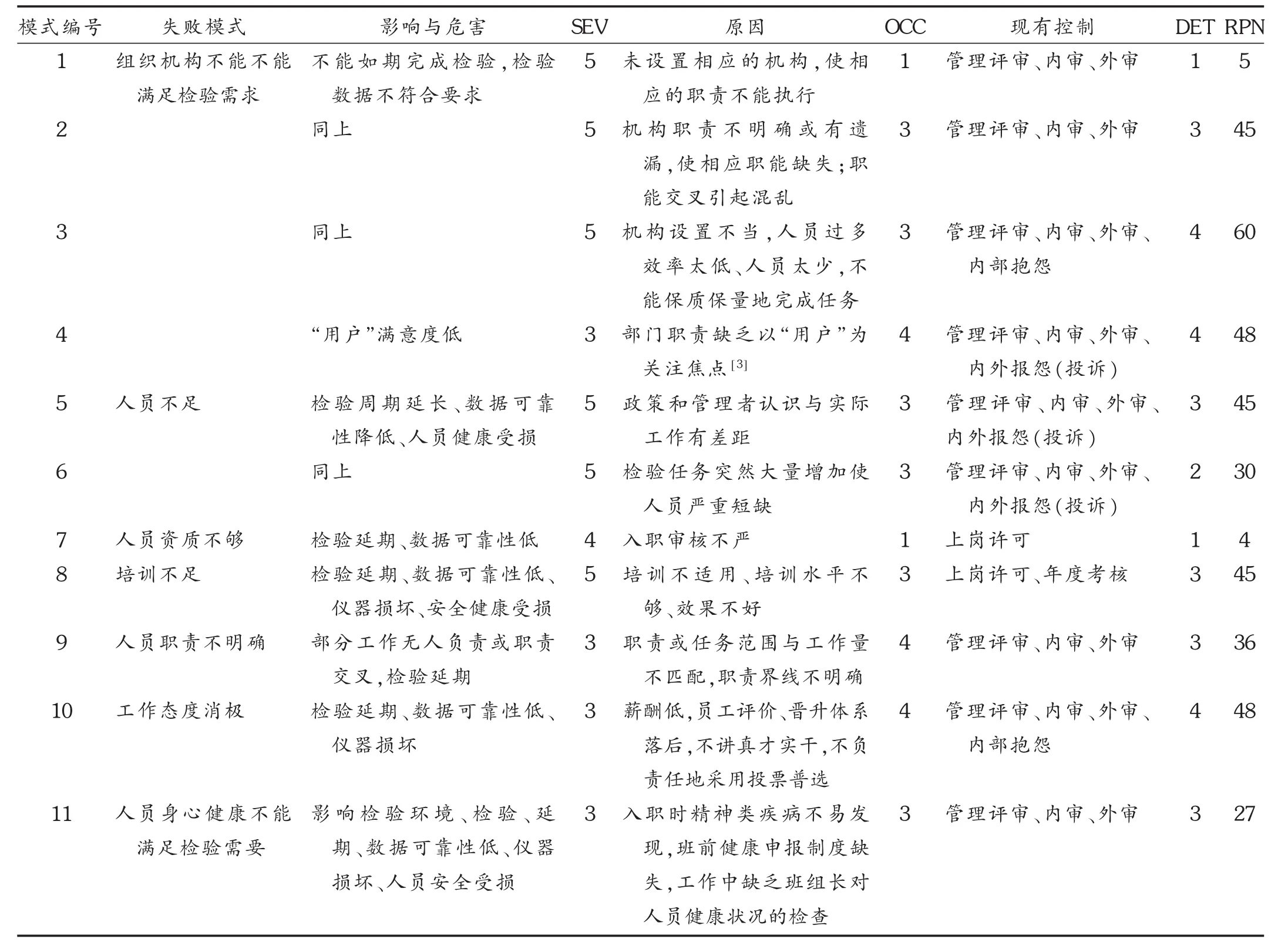
表4 “人”子系统中的FMEA分析评估

表5 “人”子系统中的FMEA分析控制
3 讨论
FMEA作为一种风险管理的工具,是重要的早期预防活动,可防止故障和错误的发生并阻止对客户造成损害[4]。FMEA对现已存在的药品检验系统可找出失败模式,并进行分析控制,提高药品检验单位的形象和竞争力,提高客户的满意度;也可用于设计、建造全新的实验室,系统变更或设计一个新的流程时,找出潜在的失败模式,并寻求解决控制的方法,选择具有更高可靠性和安全性的过程或服务,使风险得以削弱到大家能接受的程度,让技术服务在提供前就趋于完美。FMEA可为药品检验管理体系的持续改进提供依据和相应措施,为药品检验实验室的管理体系提供全新、科学、有力的工具和方法,对药品检验实验室的管理必将产生深远影响。
对导致整个系统或系统主要功能发生失败的部件(子系统)进行FMEA分析控制非常有效。药品检验系统非常复杂,具有多种功能,且由不同的子系统组成,需要分析大量详细的系统信息、很多可能的工作模式,进行FMEA有较多困难且烦琐,有待继续利用FMEA对其他子系统逐步进行评价控制研究。
[1]国家食品药品监督管理局药品认证中心.药品GMP指南·口服固体制剂分册[M].北京:中国医药科技出版社,2011:4-8.
[2]GB/T7826-2012/IEC60812:2006.系统可靠性分析技术失效模式和影响分析(FMEA)程序[S].
[3]李 钧,李志宁.制药质量体系及GMP的实施[M].北京:化学工业出版社,2012:58.
[4]Stamatis MH.失效模式影响分析FMEA从理论到实践[M].第2版.北京:国防工业出版社,2005:5-23,157.
R954
A
1006-4931(2016)04-0015-04
詹宇杰,主管药师,研究方向为药品检验及质量控制,(电话)023-86072759(电子信箱)zhan1226@qq.com。
2015-08-14;
2015-10-19)
