蚤休薯蓣皂苷联合顺铂抑制小鼠移植瘤生长及转移
2016-12-25,,,,,
,,,,,
(粤北人民医院呼吸内科,广东 韶关 512026)
·基础医学·
蚤休薯蓣皂苷联合顺铂抑制小鼠移植瘤生长及转移
邓日强,程江涛,张宏华,杨印楼,刘清毅,谢斌
(粤北人民医院呼吸内科,广东 韶关 512026)
目的探讨蚤休薯蓣皂苷(RD)联合顺铂对小鼠Lewis肺癌皮下移植瘤生长与转移的抑制作用。方法40只C57BL小鼠皮下接种Lewis肺癌细胞建立肺腺癌移植瘤模型,随机均分成对照组、RD组、顺铂组及RD联合顺铂组,从接种后第4 天开始给予生理盐水或相应药物干预,于接种后第29 天处死,通过免疫组化检测皮下移植瘤组织CD34表达,荧光实时定量PCR检测皮下移植瘤组织血管内皮生长因子(VEGF) mRNA表达,Western blotting测定皮下移植瘤组织 VEGF、Bcl-2、Bax蛋白表达。结果RD联合顺铂组抑瘤率、肺表面结节转移抑制率高于RD组与顺铂组(P<0.01),Q值为1.01;RD联合顺铂组上述指标改善程度优于单独用药组(P<0.01),但RD组与顺铂组相比,差异无显著性(P>0.05)。结论RD联合顺铂对小鼠Lewis肺癌皮下移植瘤生长与转移有相加抑制作用,其机制可能与拮抗肿瘤血管生成和诱导肿瘤细胞凋亡有关。
蚤休薯蓣皂苷; 顺铂; Lewis肺癌; 血管内皮生长因子; 凋亡
早期肺癌的治疗以手术为主,辅以化疗、放疗,但大多数患者疾病发作时已接近中期或晚期,容易错失最优医治时段[1]。近年来,从中药及天然植物中提取高效低毒的抗肿瘤有效成分已成为国内外抗肿瘤新药开发的一条新途径,具有重要的临床意义。蚤休系百合科多年生草本植物蚤休及其同属植物的根茎,我国野生资源十分丰富[2-3]。蚤休的主要化学成分为蚤休皂苷(重楼皂苷),有抗炎、肝保护、抗氧化等多种药理活性[4]。近年研究发现,蚤休皂苷也有较强的抗胶质瘤[5]、皮肤癌[6]、结肠癌[7]、乳腺癌[8]作用。本文立足于RD联合顺铂用药的层面,探究小鼠Lewis肺癌皮下移植瘤生长、转移过程中的分子抑制机理,期望为肺癌的临床治疗提供一种新的化疗药物。
1 材料与方法
1.1动物、药品与主要试剂Lewis肺癌(鼠源)荷瘤种鼠2只 和 C57BL小鼠40只(雌雄各半)购于中国医学科学院实验动物研究所,合格证号:SCXK京119-0007,其中C57BL小鼠体质量为20±2 g,鼠龄4~5周,所有小鼠饲养于南华大学实验动物学部SPF环境中。RD、顺铂分别购于天津马克生物技术有限公司(生产批号:980216)、江苏豪生药业股份有限公司(生产批号:040605)。原位切口末端标记法(terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling,TUNEL)凋亡检测试剂盒与山羊抗兔 IgG购自武汉博士德生物工程有限公司。Trizol试剂和PVDF膜(美国Invitrogen公司)、逆转录试剂盒(美国Promega公司)、PCR扩增试剂盒(上海生工生物工程公司)、SYBR Green Real Time PCR Master Mix(日本 Toyobo公司)系上述公司产品。兔抗小鼠CD34、VEGF、Bcl-2、Bax、β-actin单克隆抗体由美国Santa Cruz 公司提供。
1.2肺腺癌移植瘤模型的制备按文献[9]报道的方法构建肺腺癌移植瘤的药学模型,流程为:首先以脱颈椎致死的方法处死二只接受过Lewis肺癌荷瘤分子接种的小鼠,坚持无菌标准处理小鼠尸体,分离出肿瘤组织,并去除瘤体表层结缔、坏死血管及相关病变组织,借助生理盐水清洗瘤体,然后实施剪碎处理,接着将其放在匀浆器内,按1 g肿瘤组织,3 mL生理盐水的比例添加生理盐水,研磨肿瘤组织成为细胞悬液,然后过360目钢网,制成单细胞性质的悬浮液,为使细胞密度达到1×107/mL,需要滴入部分生理盐水。取出单细胞性质的悬浮液0.2 mL,然后接种于每只C57BL小鼠的右腋皮下,每只0.2 mL,建立小鼠皮下移植瘤动物模型。
1.3实验分组与给药接种Lewis肺癌的C57BL小鼠仍然在SPF级环境下饲养,所有小鼠皮下组织的移植部位已经生成瘤,然后将其划分作四组,分别是RD联合顺铂组、顺铂组、RD组、对照组,每组10只。从接种后第4 天开始给药,其中对照组予生理盐水0.2 mL 腹腔注射,1次/天;RD组:将5 mg/kg RD溶入到生理盐水(0.2 mL)里,并实施注射到腹腔内,每日1次;RD联合顺铂组:RD、顺铂按上述方法给药。给药时间共计26天,待给药第29 天时,将各组小鼠处死,以作各种指标的检测所用。顺铂组:在生理盐水(0.2 mL)里滴入顺铂2 mg/kg,并在实施接种之后的第5天、第12天、第19天分别注入一次,其他天数用生理盐水进行注射。
1.4基础检测在实施接种的前后一段时间内,每间隔2 天测量一次小鼠体重指标,并视体重起伏情况调改用药剂量。实施接种以后,每间隔2天测量小鼠皮下组织的肿瘤长径最大值与最小值,分别记作a、b。然后推算出肿瘤的体积值(V=a×b2/2),制出肿瘤的生长变动曲线。在第29 天时,将小鼠处死,彻底分离出肿瘤,并实施称重,推算出抑瘤率。抑瘤率=(1-各治疗组瘤的平均质量/对照组瘤的平均质量)×100%。为了评价两药联用的效果,根据金氏公式计算Q值,Q值=E(A+B)/(EA+EB-EA×EB),这一公式中的EA代表RD组抑瘤率、EB代表顺铂组抑瘤率、E(A+B)代表RD联合顺铂组抑瘤率,当Q值<0.85为拮抗,介于0.85~1.15之间为相加,>1.15为协同。然后将瘤体分为两部分,一部分放入中性甲醛(浓度是10%)中,并行固定、石蜡包裹等处理,接着切成5 μm厚的薄切片,施行免疫性染色与凋亡处理检测;另一部分迅速放入液氮中冻存,再转移至-70 ℃冰箱保存,用于荧光实时定量PCR和Western blotting检测。之后剖开小鼠胸部,查看其双肺表层肿瘤的转移迹象,并对表层转移的结节进行计数,算出这些结节转移率或抑制率,公式是:肺部表层结节的转移率(或抑制率)=(1-各施药组转移平均结节数量/对照组转移平均结节数量)×100%。
1.5免疫性染色处理与监测选择免疫性SABC方法对皮下移植瘤体组织(CD34)进行表达,进而精确推算出微血管的密度值(microvessel density,MVD),用磷酸盐缓冲液(phosphate buffered saline,PBS)替换一抗,并将其当作阴性的具体对照。判定MVD的标准为:不靠近肿瘤的细胞组织、微型血管、结缔组织系统、且体现为棕黄色的CD34染色单皮细胞组织相互串计成一个血管,该血管肌层厚度较大。遵照MVD的计数标准或参考weidner[10]法进行计数,先于低倍镜之下扫测切片的整体情况,然后在浸润区内挑选内皮细胞显色清楚的肿瘤,要求背景视野效果良好,且处于四个微血管最为密集的视野区内,接着于高倍镜的视野计数范围中对全部显色微血管进行计数,测量四个微血管最为密集视野区的数量结果,都记作此切片微血管的实际数量值。
1.6肿瘤细胞的凋亡检测以TUNEL检测法探究肿瘤细胞的实际凋亡状况,遵照试剂盒的操作指南开展相应操作,并将已经确证的阳性切片当作对照。鉴别结果:若细胞核内可见棕黄色的小颗粒,鉴别为阳性细胞,选取阳性细胞最为密集的显色区,摒除坏死区域,各张检测切片的计数相当于10个高倍视野里凋亡阳性的细胞核数及总细胞核数,凋亡指数(apoptosis index,AI)=凋亡阳性的细胞核数/总细胞核数×100%。
1.7荧光实时定量PCR 运用Trizol试剂提取皮下移植瘤组织总RNA,然后逆转录成cDNA。由上海生工生物工程公司合成VEGF、GAPDH引物,VEGF引物序列:5′-AGACAATGGGATGAAAGG-3′(sense),5′-AAGCCAAAGGTCTGTTCC -3′ (antisense),扩增产物长度554 bp;引物序列(GAPDH)包括:5′-GTCTGGGATGGAAATTGTGA-3′(antisense)、5′-CTGCACCACCAACTGCTT-3′(sense),扩增产物长度660 bp。在Roach480荧光实时定量PCR仪上进行PCR反应,反应条件:94 ℃预变性10 min,94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸2 min,总共35个循环。VEGF mRNA表达水平用ΔΔCt值法定量。
1.8 Western blotting 用蛋白裂解液释放出皮下移植瘤内包含的蛋白质组织,进而滴入一定量的5×SDS缓冲溶液、β-巯基乙醇(密度是10%),实施10 min的100 ℃煮沸处理后,进行SDS-PAGE电泳操作,使电流移动到PVDF膜之上,放入5%的脱脂牛奶,然后将其放在室温环境下封闭处理4 h,把1∶500稀释的兔抗小鼠VEGF、Bcl-2、Bax、β-actin分别滴入一抗,4 ℃反应过夜,PBS洗涤后,加入辣根过氧化物酶标记的山羊抗兔IgG(1∶2 500),37 ℃孵育1 h,利用化学发光法分析各产物积分光密度值,计算VEGF、Bcl-2、Bax蛋白相对量。目标蛋白表达水平=目标蛋白积分光密度值/β-actin积分光密度值。
1.9统计学方法文中全部计量资料及相关数据以均数±标准差进行表示,按照数据的类别选用t检验、q检验、多样本均数间多重对比方差分析等方法,小型样本资料使用Fisher确切概率法进行计数,各类数据使用SPSS 10.0软件处理,P<0.05为差异有显著性。
2 结 果
2.1小鼠皮下移植瘤施予RD、顺铂后的生长情况皮下接种Lewis肺癌之后1~4天内,成瘤率是 100%,且移植生成的肿瘤外观较接近,各组皮下移植肿瘤组织的体积有增大趋势,局部体现为结节状的生长态势。在第20~30天内,对照组的移植肿瘤呈现出迅速生长情况,且生长速度显著快过其余三组,各组当中最慢的是RD联合顺铂组。对小鼠尸体进行解剖,查看肿瘤情况,可见肿瘤质地比较硬,外面有包膜,部分呈侵入性生长,与周围组织融合,表面有血管生长分布,以对照组最为明显。如表1所示,与对照组比较,RD组、顺铂组及RD联合顺铂组肿瘤体积、肿瘤质量明显降低(P<0.01),RD联合顺铂组肿瘤体积、肿瘤质量亦低于RD组、顺铂组(P<0.01),但RD组与顺铂组相比,差异无显著性(P>0.05);RD联合顺铂组抑瘤率明显高于RD组、顺铂组(P<0.01),但RD组抑瘤率与顺铂组比较差异无显著性(P<0.05)。
表1各组肿瘤体积、肿瘤质量及抑瘤率比较

组别n肿瘤体积(cm3)肿瘤质量(g)抑瘤率(%)对照组106.69±1.546.01±1.090±0RD组104.15±0.79ab3.61±0.57ab39.42±5.49a顺铂组103.84±0.68ab3.25±0.51ab45.47±6.18aRD联合顺铂组102.16±0.45b1.92±0.36b67.95±8.94
与RD联合顺铂组比较,a:P<0.01;与对照组比较,b:P<0.01
2.2 RD与顺铂联合用药效果评价根据各用药组的抑瘤率,应用金氏公式计算RD联合顺铂组的Q值,Q值为1.01,介于0.85与1.15之间,即RD与顺铂联用对小鼠Lewis肺癌有相加抑制作用。
2.3 RD、顺铂对皮下移植瘤肺转移的影响由表2可知,RD组、顺铂组及RD联合顺铂组肺表面转移结节数较对照组减少(P< 0.01),与RD组、顺铂组比较,RD联合顺铂组肺表面转移结节数降低,肺表面结节转移抑制率则升高,差异均有显著性(P<0.01),但RD组与顺铂组相比,肺表面转移结节数、肺表面结节转移抑制率均无明显变化(P>0.05)。
表2各组肺表面转移结节数、肺表面结节转移抑制率及MVD比较

组别n肺表面转移结节数(个)肺表面结节转移抑制率(%)MVD对照组1013.69±3.740±024.15±4.18RD组107.42±1.69ab45.78±6.49a13.29±2.45ab顺铂组106.23±1.27ab54.45±7.28a11.56±2.17abRD联合顺铂组102.92±0.56b78.67±9.356.92±1.38b
与RD联合顺铂组比较,a:P<0.01;与对照组比较,b:P<0.01
2.4 RD、顺铂对皮下移植瘤组织MVD的影响免疫组化染色显示(图1),所有小鼠皮下移植瘤组织内均有CD34表达,内皮细胞被染成棕黄色。对照组皮下移植瘤组织MVD最高,予RD、顺铂或两药联合处理后,MVD较对照组明显下降(P<0.01),此外,RD联合顺铂组MVD低于各单独用药组(P<0.01),但RD组与顺铂组比较,差异无显著性(P>0.05),见表2。
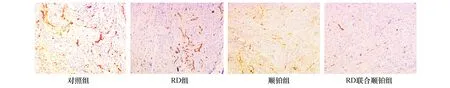
图1 各组皮下移植瘤CD34表达(SABC×100)
2.5 RD、顺铂对皮下移植瘤组织VEGF mRNA与蛋白表达的影响为了进一步揭示RD联合顺铂拮抗Lewis肺癌新生血管形成的分子机制,运用荧光实时定量PCR、Western blotting检测各组皮下移植瘤组织VEGF mRNA与蛋白表达,结果显示(图2、3),对照组VEGF mRNA与蛋白表达水平最高,RD联合顺铂组蛋白表现水平和VEGF mRNA显示为最低,同对照组比较,施药组蛋白表现水平和VEGF mRNA明显降低(P<0.01),RD联合顺铂组与RD组、顺铂组比较,VEGF mRNA与蛋白表达下调(P<0.01),但RD组与顺铂组相比,差异无显著性(P>0.05)。
2.6 Lewis肺癌细胞施予RD、顺铂后的凋亡情况
凋亡细胞核是棕黄色部分,没有凋亡细胞核是蓝绿色部分(图4)。对照组肿瘤细胞凋亡最少,RD联合顺铂组肿瘤细胞凋亡最多,各用药组AI较对照组明显增加(P<0.01),而且RD联合顺铂组AI高于RD组、顺铂组,但RD组AI与顺铂组无区别(P>0.05,图5)。
2.7 RD、顺铂对皮下移植瘤组织Bcl-2、Bax蛋白表达的影响为了初步阐明RD联合顺铂诱导Lewis肺癌细胞凋亡的机理,运用Western blotting检测皮下移植瘤组织Bcl-2、Bax蛋白的表达,图6显示,各施药组Bcl-2蛋白表达都低对照组(P<0.01),Bax蛋白表达高于对照组(P<0.01);与单独用药组相比,RD联合顺铂组Bcl-2蛋白表达水平减少(P<0.01),Bax蛋白表达水平则增加(P<0.01),但RD组与顺铂组比较,差异无显著性(P>0.05)。
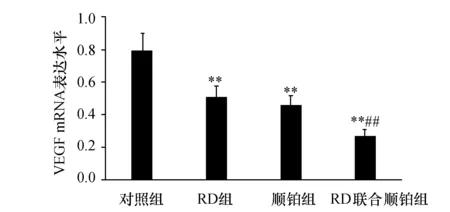
图2 各组皮下移植瘤组织VEGF mRNA表达 与对照组比较,**P<0.01;与RD组、顺铂组比较,##P<0.01
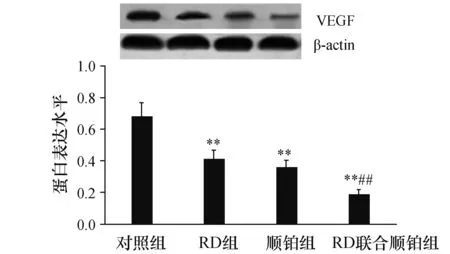
图3 各组皮下移植瘤组织VEGF蛋白表达 与对照组比较,**P<0.01;与RD组、顺铂组比较,##P<0.01
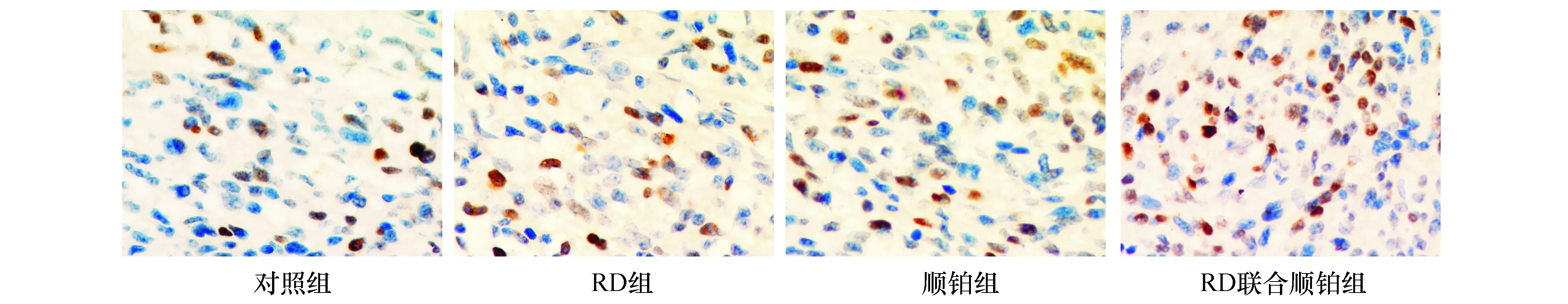
图4 各组Lewis肺癌细胞TUNEL染色(×400)
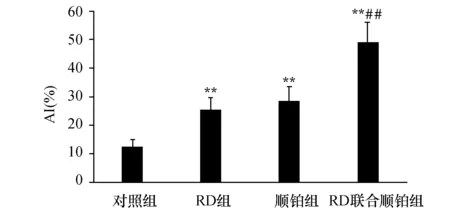
图5 各组Lewis肺癌细胞AI比较 与对照组比较,**P<0.01;与RD组、顺铂组比较,##P<0.01
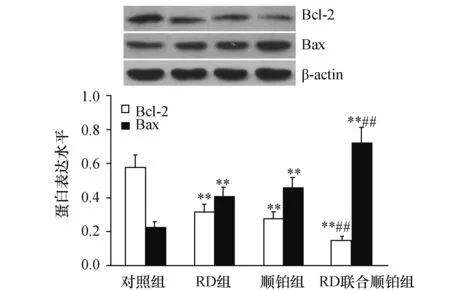
图6 各组皮下移植瘤组织Bcl-2、Bax蛋白表达 与对照组比较,**P<0.01;与RD组、顺铂组比较,##P<0.01
3 讨 论
临床中使用蚤休的历史较长,其兼具消肿镇痛、清火消毒、定惊疏肝等药效,且该药作为云南白药中的一种重要成分,常被运用到痈肿、剧毒、动物咬伤、咽喉部位肿痛、抽搐惊风等病症的药物治疗中。蚤休含有脂肪酸酯、多糖、蚤休皂苷及黄酮类药等多种化学成分,但80%为蚤休皂苷。王震等[11]用重楼皂苷VII处理人肺腺癌 A549细胞,发现重楼皂苷VII呈浓度与时间依赖性抑制肿瘤细胞增殖。另有研究证实,重楼皂苷I通过诱导人肺腺癌 A549细胞凋亡产生放射增敏作用[12]。作为从蚤休皂苷中提取的主要单体活性成分,本研究将RD和/或广谱抗癌药顺铂应用于Lewis肺癌皮下移植瘤小鼠,发现各用药组肿瘤体积、肿瘤质量、肺表面转移结节数明显降低,以RD联合顺铂组效果最显著,而且RD联合顺铂组抑瘤率、肺表面结节转移抑制率高于RD组、顺铂组,应用金氏公式评价两药联用的效果,Q值介于0.85与1.15之间,提示 RD与顺铂联用对小鼠Lewis肺癌皮下移植瘤的生长与转移有相加抑制作用。
血管新生指在原有血管的基础上已分化的血管内皮细胞发生增生、迁移,并以套叠或芽生的方式形成新的毛细血管的过程,这一过程受到多种因素的调控,其中VEGF是最重要的血管生长因子,可使血管中的内皮细胞出现特异性迁移、分裂及增殖,进而生成微型血管,大幅度增强了血管的通透性[13-14]。血管新生在实体瘤的生长与转移中起关键作用,抑制新生血管的形成已成为抗肿瘤治疗的重要策略[15]。已有研究证实,在缺氧条件下,重楼皂苷I明显下调人永生化角质形成细胞VEGF表达[16]。本研究中,RD组、顺铂组、RD联合顺铂组MVD及VEGF mRNA与蛋白表达水平较对照组降低,且RD联合顺铂组上述指标低于RD组、顺铂组,这些结果表明,RD、顺铂同时用到体内,可以降低VEGF的表达活性,减缓新生肿瘤的生成速度,达到抑制肺癌蔓延生长及转移的效果。
凋亡又称为I型程序化细胞死亡,指在多种基因调控下发生的细胞主动死亡过程。肿瘤的发生、发展不仅是由于肿瘤细胞过度增殖,还与肿瘤细胞凋亡过少有关,细胞凋亡对肿瘤进展起到负调控作用。Bcl-2、Bax是最重要的细胞凋亡调控因子,其中Bcl-2抑制细胞凋亡,Bax促进细胞凋亡。最近,姜福琼等[17]用重楼皂苷II处理A375人黑素瘤细胞,导致凋亡率显著增加。江皓等[18]报道,重楼皂苷I通过下调Bcl-2表达及上调Bax表达诱导胰腺癌 PANC-1 细胞凋亡。另有研究表明,重楼皂苷Ⅶ与顺铂联用能有效促进卵巢癌SKOV3细胞凋亡,其凋亡是通过内质网应激激活caspase途径实现的[19]。本实验发现,各用药组AI、Bax表达水平较对照组增加,而Bcl-2表达水平较对照组降低;与RD组、顺铂组相比,RD联合顺铂组AI、Bax表达水平进一步增加,Bcl-2表达水平进一步降低,表明RD联合顺铂经减少Bcl-2/Bax比例促进肺癌细胞凋亡,这也是两药联用发挥抗肺癌作用的重要机制。
综上所述,以RD影响Lewis皮下移植肺癌瘤的生长和转移情况,可取得很好的抑制效果,同时增用顺铂,能够增强抑制药效。此外,该种药用机理同阻碍肿瘤血管生长、加快肿瘤细胞凋亡有较大联系性,这一结论为RD作为抗肿瘤药物应用于肺癌治疗提供了理论基础与实验依据,但其抗肺癌机制仍需要进一步研究。
[1] Siegel R,Ward E,Brawley O,et al.Cancer statistics,2011:the impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer J Clin,2011,61(4):212-236.
[2] 张星星,童佳兵,杨程.肺癌化疗毒副反应中西医探讨[J].临床肺科杂志,2016,21(1):152-155.
[3] 刘单,邓述恺.铂类药物与肺癌化疗的临床研究进展[J].西南军医,2015,17(1):62-65.
[4] 何含杰,章怀云,陈丽莉,等.重楼皂苷的药理作用和临床应用研究进展[J].中药材,2014,37(3):527-530.
[5] 郑彬,王穗暖,屈洪涛,等.重楼皂苷Ⅰ与重楼皂苷Ⅱ对胶质瘤细胞U251的抑制作用及其机制研究[J].中华神经医学杂志,2013,12(12):1220-1223.
[6] 姜福琼,王晓琼,刘馨,等.重楼皂苷Ⅱ对人皮肤鳞状细胞癌细胞 A431 增殖的影响[J].昆明医科大学学报,2015,36(12):21-24.
[7] 李宇华,孙阳,樊磊,等.重楼皂苷VI抑制结肠癌 LoVo细胞转移的作用及机制研究[J].华南国防医学杂志,2015,29(8):571-574.
[8] 胡炜彦,李菊,贺智勇,等.重楼皂苷Ⅰ对人乳腺癌细胞 MCF-7 体内外生长的抑制作用[J].中成药,2015,37(7):1582-1585.
[9] 贺兼斌,张贻秋,向志,等.苏拉明联合人参皂苷 Rg3抑制肺腺癌小鼠移植瘤生长的作用[J].天津医药,2013,41(9):887-891.
[10] Weidner N.Tumor angiogenesis:review of current application in tumor prognosis[J].Semin Diagn pathol,1999,10(4):302-313.
[11] 王震,李亚荣,郝杰,等.重楼皂苷Ⅶ对耐顺铂人肺腺癌 A549 /DDP 细胞增殖的抑制作用[J].中国老年学杂志,2013,33(1):145-147.
[12] 赵鹏军,冯建国,马胜林.重楼皂苷Ⅰ对肺腺癌 A549 细胞系放射增敏作用研究[J].肿瘤学杂志,2012,18(2):108-110.
[13] Marina ME,Roman II,Constantin AM,et al.VEGF involvement in psoriasis[J].Clujul Med,2015,88(3):247-252.
[14] Weathers SP,de Groot J.VEGF Manipulation in Glioblastoma[J].Oncology (Williston Park),2015,29(10):720-727.
[15] Hall RD,Le TM,Haggstrom DE,et al.Angiogenesis inhibition as a therapeutic strategy in non-small cell lung cancer (NSCLC)[J].Transl Lung Cancer Res,2015,4(5):515-523.
[16] 龙剑文,皮先明,王玉英,等.重楼皂苷Ⅰ对缺氧诱导 HaCaT 细胞 VEGF表达的影响[J].中国皮肤性病学杂志,2015,29(9):891-894.
[17] 姜福琼,邓丹琪,王剑松,等.重楼皂苷Ⅱ对 A375 人黑素瘤细胞增殖和凋亡的影响[J].皮肤病与性病,2015,37(3):125-128.
[18] 江皓,赵鹏军,马胜林.重楼皂苷Ⅰ通过 PI3K/Akt 途径诱导胰腺癌PANC-1 细胞凋亡的研究[J].肿瘤学杂志,2014,20(2):127-130.
[19] 张嘉玲,郑长军,杨瑞琦,等.重楼皂苷Ⅶ联合顺铂通过内质网应激诱导卵巢癌细胞凋亡[J].中国实验诊断学,2015,19(1):6-9.
InhibitoryEffectsofRhizomeDioscinCombinedwithCisplatinonSubcutaneousTransplantedTumorGrowthandMetastasisofLewisLungCarcinomainMice
DENG Riqiang,CHENG Jiangtao,ZHANG Honghua,et al
(DepartmentofRespiratoryMedicine,theYueBeiPeople’sHospital,Shaoguan,Guangdong512026,China)
ObjectiveTo study the fleas Hugh yam saponins combined cisplatin on Lewis lung carcinoma in mice subcutaneous transplantation tumor growth and metastasis inhibition.Methods40 C57BL mice subcutaneously vaccinated Lewis lung cancer cell adenocarcinoma of lung transplantation tumor model is set up,and randomly divided into control group,the RD group,cisplatin group and RD with cisplatin group,since 4 days after inoculation to saline or corresponding drug intervention,29 days after inoculation executed by subcutaneous transplantation tumor tissue expression of CD34 immunohistochemical detection,real-time fluorescent quantitative PCR detection of subcutaneous transplantation tumor tissue vascular endothelial growth factor (VEGF) mRNA expression,Western blotting determination of subcutaneous transplantation tumor tissue VEGF,Bcl-2,Bax protein expression.ResultsThe inhibitory rate and lung surface nodal metastasis inhibition rate of RD with cisplatin group were higher than the RD and cisplatin group (P<0.01),with Q value of 1.01;RD with cisplatin group improved the index,which was better than the single drug group (P<0.01),but the RD group compared with cisplatin group,had no significant difference (P>0.05).ConclusionCombination of RD and cisplatin has an additive inhibitory effect on subcutaneous transplanted tumor growth and metastasis of Lewis lung carcinoma in mice,which is involved in blockade of angiogenesis and induction of tumor cell apoptosis.
rhizome dioscin; cisplatin; Lewis lung carcinoma; vascular endothelial growth factor; apoptosis
10.15972/j.cnki.43-1509/r.2016.05.006
2016-03-16;
2016-08-18
广东省韶关市卫生局立项编号Y15023;韶关市卫计局项目.
R734.2
A
蒋湘莲)
