FGF-2上调Survivin蛋白的表达拮抗心肌细胞凋亡
2016-12-24利军
,,2#, ,,,, ,利军,3, ,,, ,*
(1.南华大学心血管疾病研究所 动脉硬化学湖南省重点实验室,湖南 衡阳 421001;2.南华大学附属南华医院检验科;3.南华大学儿科学院 湖南省儿童医院科教科)
·基础医学·
FGF-2上调Survivin蛋白的表达拮抗心肌细胞凋亡
李国华1,刘米华1,2#,彭娟1,肖卫晋1,屈顺林1,唐之晗1,郭芳1,彭利军1,3,任重1,危当恒1,刘录山1,王佐1,姜志胜1*
(1.南华大学心血管疾病研究所 动脉硬化学湖南省重点实验室,湖南 衡阳 421001;2.南华大学附属南华医院检验科;3.南华大学儿科学院 湖南省儿童医院科教科)
目的探讨成纤维细胞生长因子-2(FGF-2)拮抗心肌细胞凋亡的作用机制。方法以H9c2大鼠心肌细胞作为实验对象,用无血清培养基同步化培养24小时,心肌细胞随机分为正常组(Control)、缺氧/复氧(H/R)组和H/R+FGF-2组。采用CCK-8比色法检测心肌细胞存活率,Hoechst染色和流式细胞术检测心肌细胞凋亡。采用Western blot检测生存素(Survivin)蛋白的表达。结果与正常组相比,H/R明显抑制心肌细胞活力,诱导心肌细胞凋亡(均P<0.01);与H/R组相比,FGF-2显著改善H/R心肌细胞活力,拮抗H/R心肌细胞凋亡,同时上调Survivin蛋白的表达(均P<0.05)。结论FGF-2拮抗心肌细胞凋亡的作用与其上调Survivin蛋白表达有关。
成纤维细胞生长因子-2; 细胞凋亡; 生存素
成纤维细胞生长因子-2(Fibroblast growth factor-2,FGF-2)是广泛分布在体内各个组织的多功能生长因子,具有极强的促有丝分裂作用,能促进细胞增殖、分化和迁移,具有强大的促血管新生作用。本课题组和国外其他学者的研究都表明,FGF-2是一种重要的内源性细胞保护物质,具有明显的心肌保护作用,能够拮抗心肌细胞凋亡[1-4]。FGF-2拮抗心肌细胞凋亡的作用主要与其结合FGF受体1(FGFR1),激活蛋白激酶C(protein kinase C,PKC)、细胞外信号调节蛋白激酶(extracellular-signal regulated protein kinase,ERKs)和蛋白激酶B(protein kinase B,PKB/Akt),抑制c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和蛋白激酶p38 (p38MAPK),促进NO、Bcl-2和间隙连接蛋白43(Connexin 43,CX43)等蛋白表达,抑制Bax、Bim和p53等蛋白表达相关[2,4,5]。然而,FGF-2抑制心肌细胞凋亡的机制仍未完全阐明。
生存素(Survivin)是凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族中最小成员,是目前发现的效应最强的抑凋亡基因之一,具有调控细胞周期,抑制细胞凋亡,促进细胞增殖,促进血管形成等功能,在肿瘤的发生、发展中扮演重要角色[6-7]。近期研究表明,Survivin在心血管疾病中也扮演着重要的角色,主要发挥抑制细胞凋亡,促进损伤修复及重构,促血管新生和细胞增殖等作用[8]。研究发现,缺血预处理(Ischemic preconditioning,IPC)[9-10]、阿片受体激动剂[11]、胰岛素[12-13]、右丙亚胺(Dexrazoxane,DRZ)[14]均可上调心肌细胞Survivin蛋白的表达,抑制心肌细胞凋亡。但是Survivin是否在缺氧/复氧(hypoxia/reoxygenation,H/R)心肌细胞内表达,以及FGF-2对H/R心肌细胞中Survivin表达的影响及意义,尚不明确。本研究以H9c2大鼠心肌细胞为研究对象,初步探讨Survivin是否在FGF-2拮抗H/R心肌细胞凋亡中发挥作用,为缺血性心脏病的治疗提供新思路和新的干预环节。
1 材料与方法
1.1药物与试剂H9c2大鼠心肌细胞系购于中国科学院上海生命科学研究院细胞资源中心;DMEM培养基和胎牛血清为美国HyClone公司;Recombinant Rat FGF-2购于美国PeproTech公司;CCK-8试剂盒为广州奕源生物科技有限公司;胰蛋白酶、Hoechst33258凋亡检测试剂盒、兔抗大鼠Survivin多克隆抗体和辣根过氧化物酶标记羊抗兔二抗均为江苏碧云天生物技术研究所;BCA蛋白定量试剂盒和兔抗大鼠β-actin多克隆抗体均为北京康为世纪生物科技有限公司;FITC Annexin V Apoptosis Detection KitI购于美国BD pharmingen公司;其它试剂均为国产分析纯。
1.2心肌细胞的培养与实验分组H9c2大鼠心肌细胞接种于含12%胎牛血清的DMEM培养基,放在37 ℃、5% CO2的培养箱中培养。细胞用胰蛋白酶消化传代、收集,取生长状态良好的心肌细胞进行实验。每次实验前用无血清培养基同步化培养24小时,再加药物预处理。心肌细胞随机分为:正常组(Control);H/R组;H/R+FGF-2组,心肌细胞预孵育10 ng/mL FGF-2 30分钟,缺氧90分钟,复氧120分钟。
1.3心肌细胞H/R模型的建立根据文献所报道的方法,建立心肌细胞H/R损伤模型:同步化的心肌细胞,更换为无糖和无血清的Hanks’平衡盐溶液(1.3 mM CaCl2,5 mM KCl,0.3 mM KH2PO4,0.5 mM MgCl2, 0.4 mM MgSO4,69 mM NaCl,4 mM NaHCO3和0.3 mM Na2HPO4),Hanks’平衡盐溶液预先用95% N2~5% CO2饱和,将培养瓶或培养板置于持续95%N2~5% CO2平衡的缺氧孵育容器中(O2浓度≤1%),37 ℃,90分钟后,更换为预平衡(37 ℃、95% O2~5% CO2)的无血清DMEM培养基,放入37 ℃、5% CO2的培养箱中培养120分钟,结束实验。
1.4 CCK-8比色法检测心肌细胞存活率根据CCK-8试剂盒说明书,将H9c2大鼠心肌细胞制成细胞悬液,计数,接种于96孔培养板中,100 μL/孔,每孔细胞数大于1000个,在37 ℃、5% CO2的培养箱中培养过夜或大于5个小时。当细胞生长到培养孔的70%~80% 面积时,加入不同的处理因素,每个处理因素至少设3个复孔和1个空白孔。终止处理后,每孔加10μlCCK-8溶液,避免产生气泡,37C 孵育1.5小时,用酶标仪(λ= 450 nm )测定各孔的吸光度(OD)。取3孔OD值的平均数,按公式计算细胞存活率,细胞存活率(%)=(处理组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%,至少重复3次。
1.5 Hoechst染色观察心肌细胞凋亡将心肌细胞悬浮液接种于6孔板内,待细胞贴壁后,按实验设计给予不同药物处理,实验结束后,弃去培养液。PBS清洗3遍,每次3~5分钟,加入4%多聚甲醛固定细胞15分钟,弃去固定液,用PBS清洗3遍,Hoechst33258染色液染色20分钟,去离子水冲洗3遍,每次3~5分钟。在荧光显微镜下,以紫外光340 nm波长激发,观察并摄片。
1.6流式细胞术检测心肌细胞凋亡率取生长状态良好的心肌细胞,以2×105个/mL的细胞密度接种于50 mL的培养瓶,放在37 ℃、5% CO2的培养箱中培养,待细胞长至70%~80%融合状态时,更换为含0.1%胎牛血清的DMEM培养基同步化培养24小时,再按实验分组加入不同的处理因素继续孵育,最后收集细胞。
PBS液清洗1次后,根据美国BD pharmingen公司的FITC Annexin V Apoptosis Detection KitI说明书,采用FITC-Annexin V/PI双染色,结合流式细胞仪,检测心肌细胞凋亡率。
1.7 Western blot检测蛋白表达按照哺乳动物蛋白抽提试剂盒说明书提取细胞总蛋白,利用BCA 蛋白定量试剂盒进行蛋白定量;在蛋白上清溶液加入SDS-PAGE蛋白上样缓冲液,在100℃沸水,加热10分钟,使蛋白质变性;采用12.5%SDS聚丙烯酰胺凝胶电泳1.5小时,接着220 mA电流转膜2小时,使蛋白由凝胶转移至PVDF膜;含5%脱脂奶粉的TBST封闭2 h;用含有抗Survivin(1∶1000)、β-actin(1∶2000)一抗的 TBST溶液,4℃孵育过夜,TBST洗涤3次;加入辣根过氧化物酶标记羊抗兔二抗 (1:1000),室温孵育2小时,TBST洗涤3次;用ECL化学发光剂进行曝光显影,采用完全自动的化学发光图像拍摄和分析系统,摄像和分析目的蛋白和内参蛋白的灰度值。

2 结 果
2.1 FGF-2对H/R心肌细胞活力的影响心肌
细胞活力变化如图1所示,H/R显著抑制心肌细胞活力,与正常组(96.0±2.8%)相比,差异具有显著性(P<0.01)。H/R+FGF-2组(89.0±3.0%)心肌细胞活力明显增强,与H/R组(81.3±2.6%)相比,差异具有显著性(P<0.05)。以上结果提示FGF-2能明显改善H/R心肌细胞的活力。
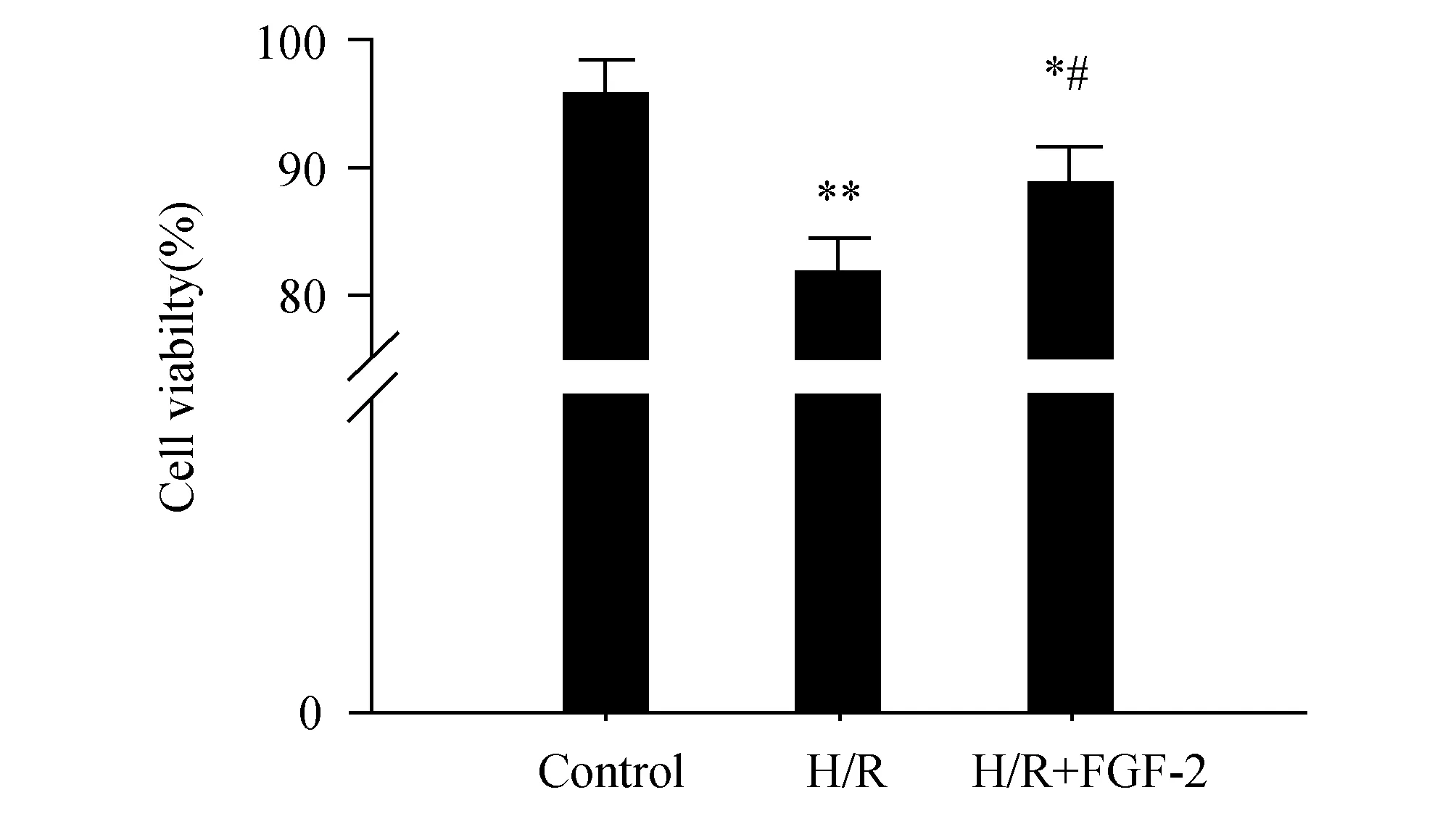
图1 FGF-2改善H/R心肌细胞的活力 与Control比较,*:P<0.05,**:P<0.01;与H/R比较,#:P<0.05,n=3
2.2 FGF-2对H/R心肌细胞凋亡的影响首先采用Hoechst染色,观察H9c2心肌细胞凋亡的核形态变化(图2)。Hoechst染色后,正常心肌细胞的细胞核大小形态较为均一,多呈圆形或椭圆形,形态清晰完整,荧光染色呈匀质状,而凋亡细胞的细胞核染色较亮,核浓染,核固缩,或呈半月形和圆形凝聚。正常组存在少量心肌细胞凋亡,H/R可诱导心肌细胞凋亡,与正常组相比,H/R组凋亡细胞数明显增多,但加入FGF-2预孵育后,H/R所诱导心肌细胞凋亡数明显减少。
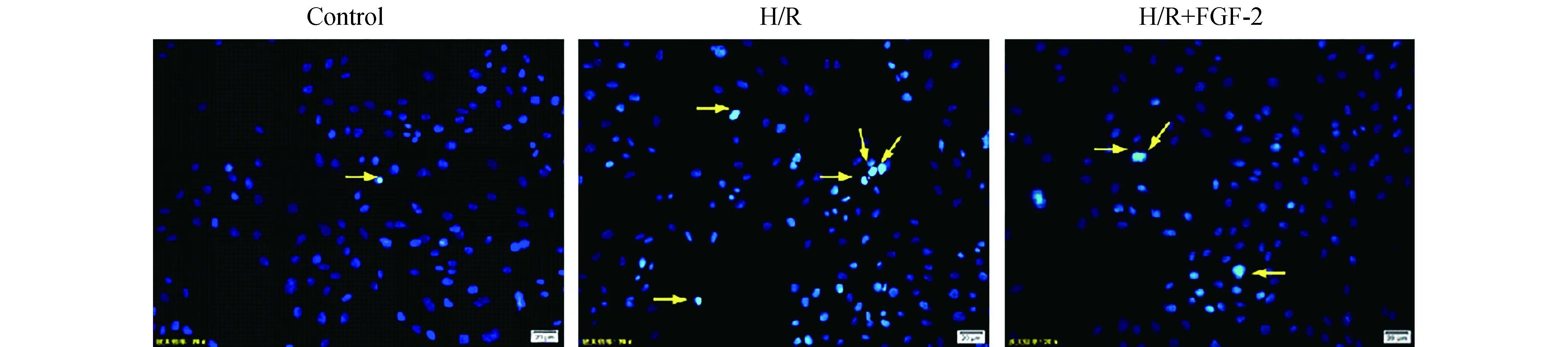
图2 FGF-2对H/R心肌细胞凋亡的影响 (200×)
进一步采用FITC-Annexin V/PI双染色流式细胞术,检测各组心肌细胞的凋亡率。流式细胞术结果如图3所示,正常组心肌细胞凋亡率为3.1±0.8%。H/R组心肌细胞凋亡率为13.6±1.4%,与正常组相比,差异具有显著性(P<0.01)。H/R+FGF-2组心肌细胞凋亡率降低至7.5±1.2%,与H/R组相比,差异具有显著性(P<0.05)。此结果与Hoechst染色的结果吻合。以上结果说明FGF-2明显拮抗H/R所诱导的心肌细胞凋亡。
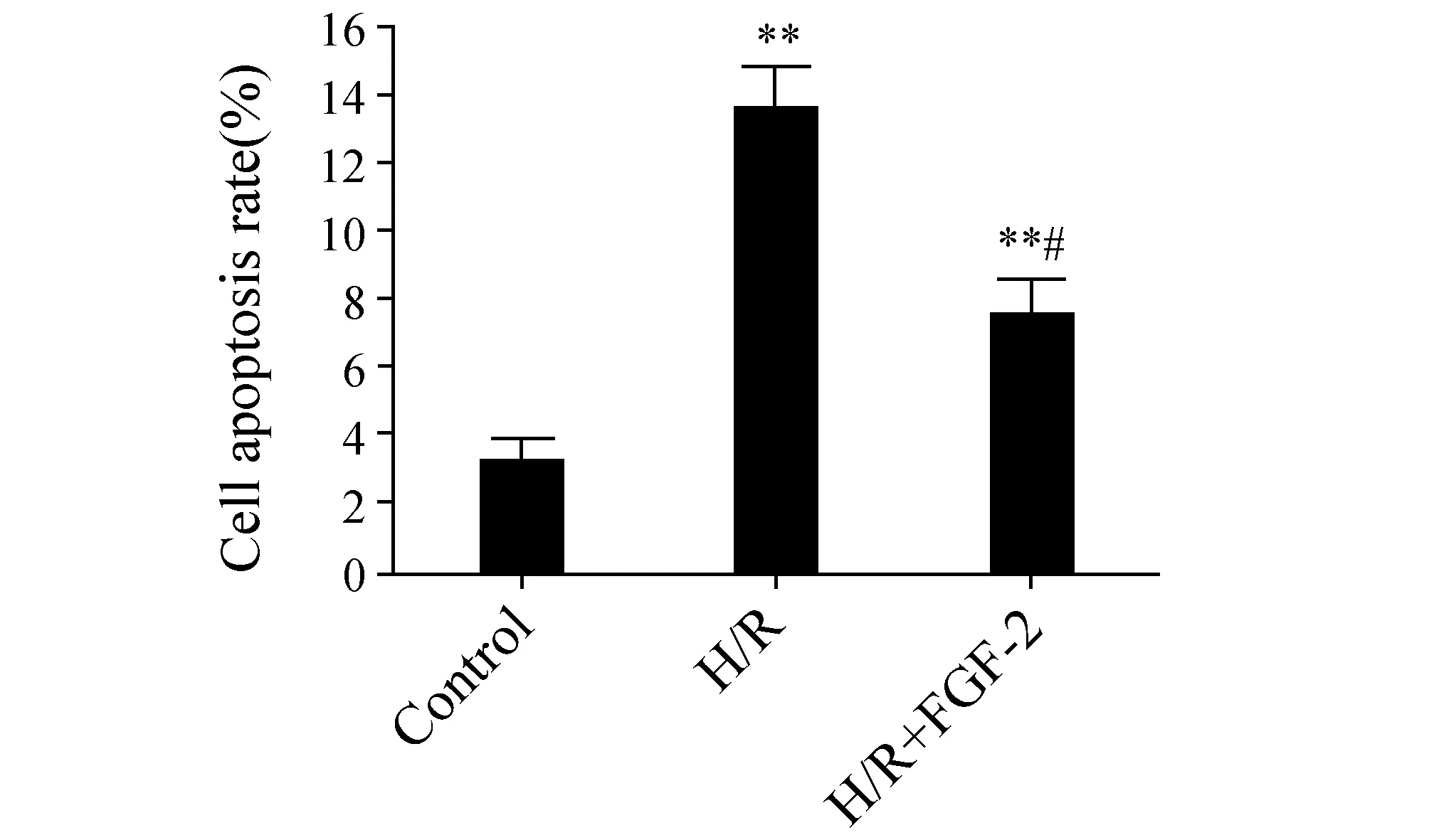
图3 FGF-2抑制H/R心肌细胞的凋亡 与Control比较,**:P<0.01;与H/R比较,#:P<0.05,n=3
2.3 FGF-2对H/R心肌细胞Survivin蛋白表达的影响Survivin是一个抗凋亡蛋白,从图4可以看出,H/R对心肌细胞Survivin蛋白表达不会造成什么影响,与正常组相比,差异无统计学意义(P>0.05)。但在H/R的基础上加入FGF-2后,Survivin蛋白表达明显增加,与H/R组相比,差异具有显著性(P<0.01),这提示FGF-2能促进H/R心肌细胞Survivin蛋白的表达。
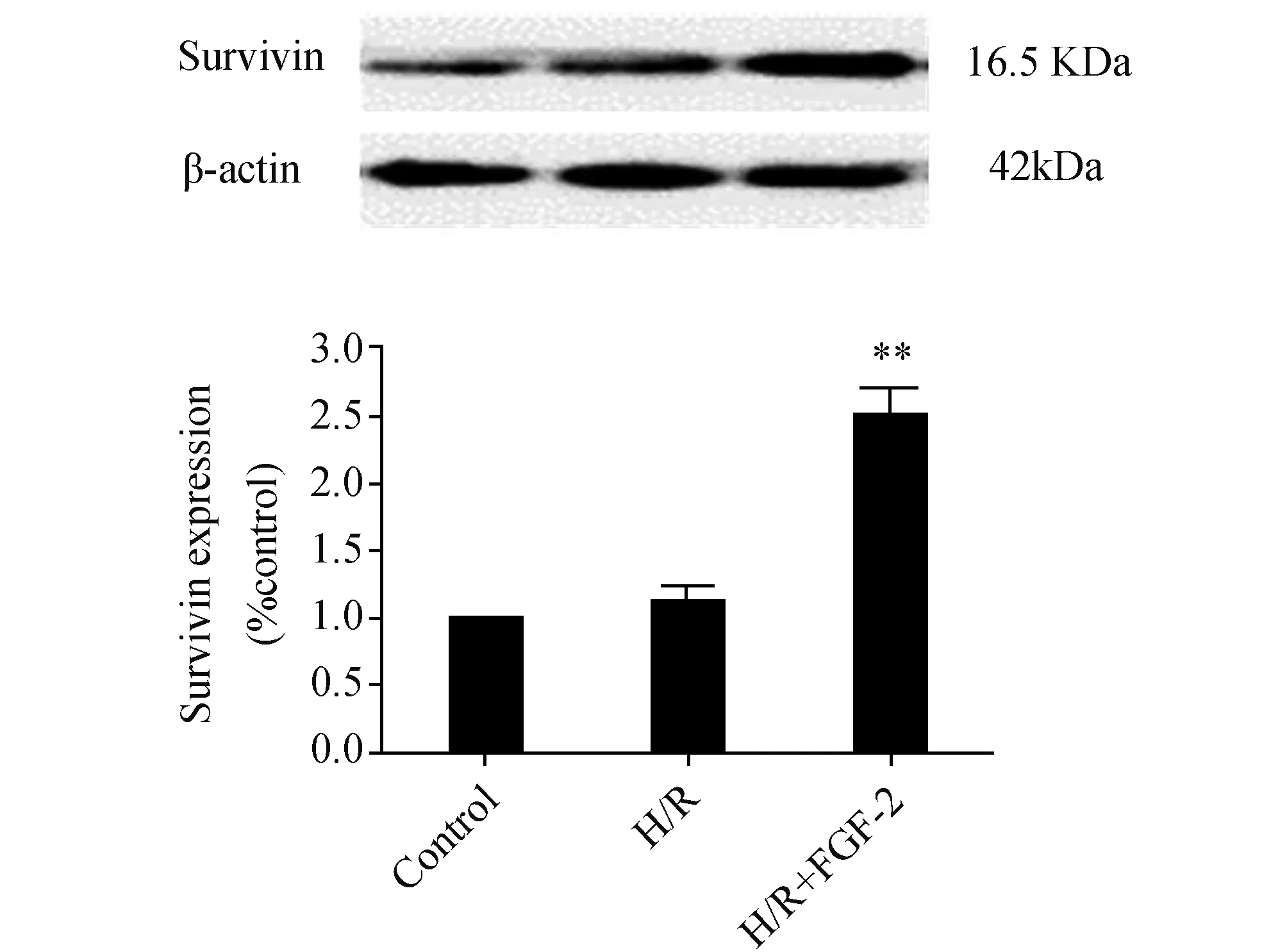
图4 FGF-2促进H/R心肌细胞Survivin蛋白的表达 与H/R比较,**:P<0.01,n=3
3 讨 论
缺血性心脏病已成为严重威胁人类健康的常见病、多发病。尽量缩短组织缺血时间,及时有效的恢复心肌血液供应是挽救缺血性心脏病的最有效办法。但是再灌注治疗不可避免的会给心肌带来缺血再灌注损伤(ischemia reperfusion injury,IRI)。心肌IRI的机制复杂,而心肌细胞凋亡是其主要病理机制之一[15]。
本课题组前期研究[1]发现,FGF-2可以减少大鼠离体再灌注心脏细胞色素C(cytochrome c)的释放,提示FGF-2很可能具有抗心肌细胞凋亡作用。本实验采用H9c2大鼠心肌细胞缺氧/复氧损伤模型,缺氧90分钟,复氧120分钟,采用Hoechst染色及FITC-Annexin V/PI双染色流式细胞术,发现FGF-2显著降低心肌细胞凋亡率。本课题组[2]最近研究发现FGF-2拮抗H2O2所诱导的H9c2心肌细胞凋亡。Iwai-Kanai,等[16]发现FGF-2可以拮抗LPS或H2O2所诱导的心肌细胞凋亡。Wang等[17]发现FGF-2可以对抗阿霉素所诱导的心肌细胞凋亡。Wang,等[5]发现FGF-2可以拮抗过氧化氢叔丁醇(tert-Butyl hydroperoxide solution,TBHP)所诱导的心肌细胞凋亡。这些结果表明FGF-2具有抗心肌细胞凋亡作用。
Survivin是分子量最小的IAP成员,其基因位于染色体17q25,可编码产生由142个氨基酸组成的胞浆蛋白,分子量约为16.5kD。它主要表达于胚胎组织和肿瘤组织,而在终末分化成熟的正常成人组织中无表达或低表达。但是Santini[18]等人采用免疫组化检测急性心肌梗死患者的心肌组织,发现Survivin在远离梗死部位心肌的表达比梗死周围心肌表达的比例高,并且高于正常对照。Survivin的表达与心肌凋亡和心室重构呈负性相关,并且Survivin的表达与受威胁心肌的存活相关,并预示急性心肌梗死后良性重构的发生。有研究发现,在充血性心衰患者,心肌细胞Survivin蛋白的表达与细胞大小和DNA含量相关,并且在减轻心脏负荷后表达明显下降,提示Survivin蛋白很可能减轻心室肥厚的发生[19]。在自发性高血压大鼠,Survivin蛋白表达指数与心肌凋亡和不良性心肌重构呈负相关,提示Survivin很可能抑制心肌细胞凋亡,改善不良性心肌重构[20]。本实验采用Western blot方法观察FGF-2对H/R心肌细胞Survivin蛋白表达的影响,发现FGF-2能促进H/R心肌细胞Survivin蛋白的表达。
Survivin可以拮抗心肌细胞凋亡,发挥心肌保护作用。研究发现,IPC可以通过激活PI3k-Akt-GSK-3β-β-catenin信号通路,上调Survivin、Bcl-2和VEGF的表达,促进心肌梗死后大鼠血管新生,拮抗大鼠心肌细胞凋亡[10];当沉默β-catenin表达后,IPC对缺血大鼠心脏心功能的改善作用及对心肌细胞凋亡的抑制作用被消弱,这很可能与Survivin、Bcl-2和VEGF蛋白表达受抑制有关[9]。阿片受体激动剂吗啡和δ阿片受体激动剂DADLE均能通过激活MEK1/2-ERK1/2信号通路,上调Survivin蛋白的表达,拮抗饥饿所诱导的原代大鼠心肌细胞凋亡[11]。胰岛素可以通过激活PI3K-Akt-mTOR信号通路,上调大鼠缺血/再灌注心肌Survivin蛋白的表达,拮抗心肌细胞凋亡和缩小心肌梗死面积,通过上调H/R心肌细胞Survivin蛋白表达,拮抗原代大鼠心肌细胞凋亡[12];胰岛素可以通过激活PI3K-Akt-mTORC1信号通路,阻止转录因子Sp1的降解,促进心肌细胞Survivin蛋白的表达,抑制心肌细胞凋亡,拮抗阿霉素对心肌细胞的毒性[13]。DRZ通过增加HIF-1a和HIF-2a的表达及增强其转录活性,促进Survivin、Mcl-1和HO蛋白的表达,拮抗阿霉素对H9c2心肌细胞的毒性[14]。因此,以上研究表明FGF-2通过上调Survivin蛋白的表达,改善H/R心肌细胞活力,拮抗H/R心肌细胞凋亡。本课题组[2]最近研究发现FGF-2可拮抗氧化应激引起的H9c2心肌细胞凋亡,其机制与激活PI3K-Akt-FoxO3a信号通路有关。所以我们推测FGF-2很可能通过激活PI3K-Akt信号通路,上调Survivin蛋白的表达,拮抗H/R心肌细胞凋亡,这需要下一步研究证实。
总之,本实验结果表明,FGF-2拮抗心肌细胞凋亡的作用与其上调Survivin蛋白表达有关。这进一步充实了FGF-2拮抗心肌细胞凋亡,发挥心肌保护作用的作用机制,可为缺血性心脏病的防疗提供新思路。
[1] Jiang ZS,Srisakuldee W,Soulet F,et al.Non-angiogenic FGF-2 protects the ischemic heart from injury,in the presence or absence of reperfusion[J].Cardiovasc Res,2004,62(1):154-166.
[2] Liu MH,Li GH,Peng LJ,et al.PI3K/Akt/FoxO3a signaling mediates cardioprotection of FGF-2 against hydrogen peroxide-induced apoptosis in H9c2 cells[J].Mol Cell Biochem,2016.
[3] Beenken A,Mohammadi M.The FGF family:biology,pathophysiology and therapy[J].Nat Rev Drug Discov,2009,8(3):235-253.
[4] Ornitz DM,Itoh N.The Fibroblast Growth Factor signaling pathway[J].Wiley Interdiscip Rev Dev Biol,2015,4(3):215-266.
[5] Wang Z,Wang Y,Ye J,et al.bFGF attenuates endoplasmic reticulum stress and mitochondrial injury on myocardial ischaemia/reperfusion via activation of PI3K/Akt/ERK1/2 pathway[J].J Cell Mol Med,2015,19(3):595-607.
[6] Gyrd-Hansen M,Meier P.IAPs:from caspase inhibitors to modulators of NF-kappaB,inflammation and cancer[J].Nat Rev Cancer,2010,10(8):561-574.
[7] Chen X,Duan N,Zhang C,et al.Survivin and tumorigenesis:molecular mechanisms and therapeutic strategies[J].J Cancer,2016,7(3):314-323.
[8] Levkau B.Survivin signalling in the heart[J].J Mol Cell Cardiol,2011,50(1):6-8.
[9] Thirunavukkarasu M,Han Z,Zhan L,et al.Adeno-sh-beta-catenin abolishes ischemic preconditioning-mediated cardioprotection by downregulation of its target genes VEGF,Bcl-2,and survivin in ischemic rat myocardium[J].Antioxid Redox Signal,2008,10(8):1475-1484.
[10] Kaga S,Zhan L,Altaf E,et al.Glycogen synthase kinase-3beta/beta-catenin promotes angiogenic and anti-apoptotic signaling through the induction of VEGF,Bcl-2 and survivin expression in rat ischemic preconditioned myocardium[J].J Mol Cell Cardiol,2006,40(1):138-147.
[11] Yao LL,Wang YG,Cai WJ,et al.Survivin mediates the anti-apoptotic effect of delta-opioid receptor stimulation in cardiomyocytes[J].J Cell Sci,2007,120(Pt 5):895-907.
[12] Si R,Tao L,Zhang HF,et al.Survivin:a novel player in insulin cardioprotection against myocardial ischemia/reperfusion injury[J].J Mol Cell Cardiol,2011,50(1):16-24.
[13] Lee BS,Oh J,Kang SK,et al.Insulin Protects Cardiac Myocytes from Doxorubicin Toxicity by Sp1-Mediated Transactivation of Survivin[J].PLoS One,2015,10(8):e0135438.
[14] Spagnuolo RD,Recalcati S,Tacchini L,et al.Role of hypoxia-inducible factors in the dexrazoxane-mediated protection of cardiomyocytes from doxorubicin-induced toxicity[J].Br J Pharmacol,2011,163(2):299-312.
[15] Sanada S,Komuro I,Kitakaze M.Pathophysiology of myocardial reperfusion injury:preconditioning,postconditioning,and translational aspects of protective measures[J].Am J Physiol Heart Circ Physiol,2011,301(5):H1723-1741.
[16] Iwai-Kanai E,Hasegawa K,Fujita M,et al.Basic fibroblast growth factor protects cardiac myocytes from iNOS-mediated apoptosis[J].J Cell Physiol,2002,190(1):54-62.
[17] Wang J,Nachtigal MW,Kardami E,et al.FGF-2 protects cardiomyocytes from doxorubicin damage via protein kinase C-dependent effects on efflux transporters[J].Cardiovasc Res,2013,98(1):56-63.
[18] Santini D,Abbate A,Scarpa S,et al.Surviving acute myocardial infarction:survivin expression in viable cardiomyocytes after infarction[J].J Clin Pathol,2004,57(12):1321-1324.
[19] Wohlschlaeger J,Meier B,Schmitz KJ,et al.Cardiomyocyte survivin protein expression is associated with cell size and DNA content in the failing human heart and is reversibly regulated after ventricular unloading[J].J Heart Lung Transplant,2010,29(11):1286-1292.
[20] Abbate A,Scarpa S,Santini D,et al.Myocardial expression of survivin,an apoptosis inhibitor,in aging and heart failure.An experimental study in the spontaneously hypertensive rat[J].Int J Cardiol,2006,111(3):371-376.
FGF-2InhibitsCardiomyocytesApoptosisInducedbyHypoxia/reoxygenationviaUpregulatingtheExpressionofSurvivininH9c2cells
LI Guohua,LIU Mihua,PENG Juan,et al
(InstituteofCardiovascularDisease,KeyLabforArteriosclerologyofHunanProvince,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo investigate the mechanism of FGF-2’s fighting against H9c2 cardiomyocytes apoptosis induced by Hypoxia/reoxygenation(H/R).MethodsH9c2 cardiomyocytes was employed as the experimental object,cells were incubated by free serum for 24 h for synchronous cell cycle,then,H9c2 cardiomyocytes were randomly divided into 3 groups:Normal group(Control),H/R group, H/R+FGF-2 group.The viability of cardiomyocytes was measured by CCK-8.The apoptosis rate of cardiomyocytes was detected by Hoechst and Armexin-V/PI assays with flow cytometry.Survivin expression were analyzed by western Blot.ResultsCompared to the Contrd group,H/R significantly decreased the viability of cardiomyocytes and induced cardiomyocytes apoptosis(P<0.01).Treatment with FGF-2 for H/R significantly increased the viability of cardiomyocytes subjected to H/R,suppressed cardiomyocytes apoptosis induced by H/R and up-regulated the expression of Survivin (P<0.05).ConclusionFGF-2 inhibits cardiomyocytes apoptosis induced by H/R in H9c2 cells,which the mechanism may be related to the up-regulation of Survivin expression.
fibroblast growth factors-2; apoptosis; survivin
10.15972/j.cnki.43-1509/r.2016.04.006
2016-05-08;
2016-06-29
国家自然科学基金项目(81470435、81541005)、湖南省卫生厅科研计划课题(B2011-041).
*通讯作者,E-mail:zsjianglab@aliyun.com.
#同为第一作者
R541
A
秦旭平)
