采用人肿瘤类器官研究阻断Wnt信号治疗大肠癌的可行性
2016-12-21查娟民林倩李华善何伟奇
查娟民+林倩+李华善++何伟奇

[摘要] 目的 建立和优化大肠癌患者肿瘤类器官培养体系,为研究阻断Wnt信号治疗大肠癌提供新模型。 方法 选择大肠癌患者18例,收集癌组织及癌旁组织配对标本。采用定量PCR测定癌组织和癌旁组织Wnt3 mRNA和肠干细胞标记分子Lgr5、Ascl2的表达水平。术中采集肿瘤组织,使用类器官培养基培养肿瘤类器官。使用Wnt信号抑制剂IWP-2处理肿瘤类器官,观察IWP-2对肿瘤类器官形态、生长等的影响。 结果 定量PCR表明,与癌旁组织相比,肿瘤组织中的Wnt3表达水平较高[分别为(1.00±0.08)和(2.99±0.27),P<0.01]。癌旁组织和肿瘤组织Lgr5 [分别为(1.00±0.05)和(5.63±1.80),P<0.01)]、Ascl2[分别为(1.00±0.39)和(4.03±0.33),P<0.05]的表达水平也较高。IWP-2处理可显著抑制肿瘤类器官生长[未处理和处理后类器官面积分别为(10.02±1.34)×104 m2和(2.97±0.62)×104 m2,P<0.01]。 结论 Wnt信号通路激活和大肠癌发生密切相关,抑制Wnt信号可有效抑制肿瘤细胞生长,可能是治疗大肠癌的一种有效方法。肿瘤类器官可以作为筛选大肠癌治疗药物的一种模型。
[关键词] 大肠癌;类器官;Wnt信号;抑制剂
[中图分类号] R735.3 [文献标识码] A [文章编号] 1673-9701(2016)27-0005-04
Wnt/β-catenin信号通路是调控肠上皮干细胞(intestinal stem cell,ISC)增殖和分化的关键信号[1,2]。结直肠肿瘤是目前常见的恶性肿瘤之一。肠上皮细胞(intestinal epithelial cell,IEC)转变为肠癌细胞和一系列促癌因子的激活和抑癌因子失活密切相关。肠癌发生的促发大多由Wnt信号通路的关键蛋白APC和β-catenin的突变引起,此信号通路突变后导致β-catenin的稳定和随后的β-catenin/Tcf复合物的持续转录激活,激发了干细胞的增殖和转化,导致腺瘤的发生[1,3,4]。Wnt信号通路的激活刺激肠干细胞因子的表达,促进肠干细胞增殖和癌变,是大肠癌发生的关键原因,也可能是有效治疗大肠癌的靶点[5,6]。然而目前对大肠癌的研究多采用体外细胞系培养或者小鼠模型,缺乏原代培养的大肠癌模型。本研究检测了癌组织和癌旁组织Wnt3和肠干细胞标记分子Lgr5、Ascl2的表达水平,证实了肠癌组织中Wnt信号通路相关分子Wnt3表达上升,提示肠癌组织中Wnt信号活化。干细胞标记分子Lgr5和Ascl2表达上升。Wnt/β-catenin信号通路,促进了肠上皮细胞的增殖和癌变。本研究建立了结肠肿瘤患者结肠类器官(organoids)培养体系,将对大肠癌患者的肿瘤组织进行长期培养,并且与患者组织高度相似。使用Wnt信号抑制剂IWP-2处理结肠肿瘤类器官,本研究进一步发现IWP-2可抑制大肠癌类器官的生长。Wnt信号抑制剂有治疗大肠癌的潜能。本研究利用大肠癌类器官,探讨了阻断Wnt信号通路治疗结直肠肿瘤的可行性,大肠癌类器官可以作为一个研究大肠癌发生机制、筛选治疗大肠癌药物的模型,为今后推动临床预防和治疗大肠癌提供理论依据。
1 资料与方法
1.1 一般资料
选择苏州大学附属第一医院2015年1月~2016年1月收治的大肠癌患者18例,年龄30~78岁(中位数50岁)。收集癌组织和癌旁组织各18份。
1.2 患者组织中基因表达检测
收集大肠癌患者癌组织和癌旁正常组织,使用TRIzol(Invitrogen)提取总RNA,逆转录合成cDNA(iScriptTM cDNA Synthesis Kit,Bio-Rad,体系为5×iScript Reaction Mix,4 μl;iScript Reverse Transcriptase,1 μL; RNA template,1 μL;H2O,14 μL。实时荧光定量PCR反应体系如下:2×SYBR Green PCR Master Mix, 12.5 μL;引物,2.0 μL;cDNA template,1.0 μL;灭菌水,9.5 μL;共25 μL。反应条件为:95℃ 30 s,55℃ 30 s,72℃ 60 s,40个循环(Thermo Fisher,4309155)。采用GAPDH作为内参和Comparative Delta-delta Ct法对目的基因进行相对定量。所用实时定量PCR仪为CFX96(Bio-rad),所用试剂SYBR Green Realtime PCR Master Mix购自Toyobo。GAPDH,forward primer:5-GGA GCG AGA TCC CTC CAA AAT-3,reverse primer:5-GGC TGT TGT CAT ACT TCT CAT GG-3。Wnt3,forward primer: 5-CTC GCT GGC TAC CCA ATT TG-3,reverse primer:5-AGG CTG TCA TCT ATG GTG GTG-3。Lgr5,forward primer:5-CTC CCA GGT CTG GTG TGT TG-3,reverse primer:5- GAG GTC TAG GTA GGA GGT GAA G-3。Ascl2,forward primer:5-CCC TCC AGC AGC TCA AGT TA-3,reverse primer:5-GGC ACC AAC ACT TGG AGA TT-3。
1.3 大肠癌肿瘤组织的分离
对苏州大学附属第一医院大肠癌患者,术中开腹后取1~2 cm肠段,投入含有青霉素和链霉素的PBS(不含Ca2+、Mg2+)缓冲液中,迅速带回实验室进行操作。纵向切开肠管,经过反复漂洗后,再横向切成约1.0 cm×1.0 cm的小块。组织黏膜层朝上,用大头针固定在有机硅树脂包被的培养皿上。加上4°C预冷Ca2+、Mg2+螯合溶液(含有2 mM EDTA的PBS),将整个培养皿置于冰上,摇动30 min。将螯合溶液换成PBS之后,在体视镜下,用手术镊将黏膜层从黏膜下层和连接组织轻轻刮离。小心将分离出来的黏膜层移到50 mL离心管,150 g,4°C 离心5 min,弃上清后用5 mL PBS重悬,轻轻吹打几次。取20 μL溶液到载玻片上,在显微镜下观察计算个数。
1.4 大肠癌肿瘤类器官立体培养
将含有大肠癌组织的溶液150 g,4°C 离心10 min,弃上清,再用基质胶(Matrigel,Basement Membrane Matrix)重悬[(200~500)个小组织块/50 μL Matrigel)]。将含有肿瘤组织的Matrigel滴于未加培养基的空白24孔板正中间,每孔50 μL。将24孔板放入37°C培养箱中。30 min后等Matrigel聚合成固态(Matrigel 4℃时为液态,室温下发生聚合而转变为固态),取出,加入含有多种生长因子的人类器官培养基(基础培养基组成:Advanced DMEM/F12,加入2 mM glutamine,10 mM HEPES,100 U/mL penicillin,100 g/mL streptomycin,2.5 μg/mL Fungizone,1×N2 supplement,1×B27 supplement。使用前添加:100 ng/mL Wnt3a,250 ng/mL R-spondin 1,100 ng/mL Noggin,50 ng/mL EGF,500 nM A-83-01,10 μM SB202190,10 nM[Leu]15-Gastrin 1, 1 mM N-Acetylcysteine 和10 mM Nicotinamide)。Matrigel购自BD Biosciences,培养基购自Invitrogen,生长因子购自PeproTech和R & D。
每2~3 d换液,大约1周后进行传代。传代时将培养板置于生物安全柜中冰盒上,吸去培养基。加入1 mL含预冷的PBS,反复吹打直至肉眼看不见块状胶体。转入15 mL离心管中,150G 离心5 min,弃上清。将细胞团用Matrigel重悬后,加到新的24孔培养板中。待Matrigel固化后,加入类器官培养基。
1.5统计学方法
采用SPSS 19.0软件对数据进行分析,计量资料以(x±s)表示,对定量PCR数值进行t检验。P<0.05为差异有统计学意义。
2 结果
2.1大肠癌肿瘤组织中Wnt3和肠干细胞因子Lgr5、Ascl2的表达
定量PCR结果表明,与癌旁组织相比,肿瘤组织Wnt3表达水平较高[分别为(1.00±0.08)和(2.99±0.27),P<0.01;图1A],肠干细胞因子Lgr5[分别为(1.00±0.05)和(5.63±1.80),P<0.01;图1B] 和Ascl2[分别为(1.00±0.39)和(4.03±0.33),P<0.05;图1C]的表达水平也较高。
2.2 大肠癌肿瘤类器官的培养
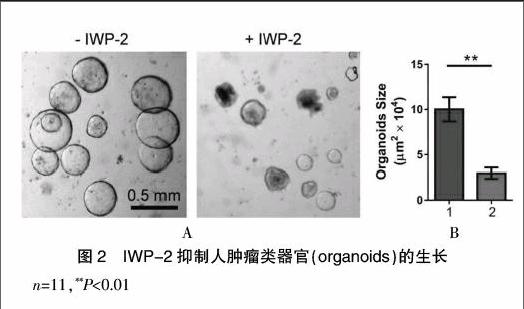
大肠癌组织经分离后在Matrigel中立体培养,第2天可见球形细胞团。3~4 d后迅速长大。Matrigel给予培养类器官空间支撑,使其能够立体生长(图2A)。
2.3 Wnt信号抑制剂IWP-2处理抑制结肠肿瘤类器官生长
Wnt信号通路抑制剂IWP-2处理可显著抑制肿瘤类器官生长[未处理的类器官面积:(10.02±1.34)× 104 m2;处理后的类器官面积:(2.97±0.62)×104 m2,P< 0.01)]。见图2B。
3 讨论
肠道的内壁是一层连续的肠上皮细胞。肠干细胞表达Wnt富含亮氨酸拉链的G蛋白偶联受体5(leucine-rich repeat-containing G-protein coupled receptor 5,Lgr5),分布在隐窝底部,与潘氏细胞交错排列,处于快速增殖状态,产生的子细胞可分化为各种特异的上皮细胞[7-9]。分化后的肠上皮细胞沿着隐窝-绒毛轴向上迁移。Wnt/β-catenin信号通路是调控肠上皮干细胞增殖和分化的关键信号[1,4]。
在正常肠上皮细胞中,分泌性的frizzled相关蛋白(ssecreted frizzled-related proteins,SFRP)与Wnt竞争性地同Wnt受体Frizzled结合,从而拮抗Wnt信号[9]。当Wnt信号失活,腺瘤息肉病基因(adenomatous polyposis coli,APC)复合物磷酸化β-catenin,导致β-catenin降解,阻止了β-catenin的核内聚集,从而不能激活转录因子(transcription factor 4,Tcf4)[1]。
Fearon和Vogelstein于1990年提出肠癌发生的经典分子模型。大部分肠癌来自于原先存在的腺瘤的恶变[10]。肠癌发生的促发大多由Wnt信号通路的关键蛋白APC和β-catenin的突变引起,此信号通路突变后导致β-catenin的稳定和随后的β-catenin/Tcf复合物的持续转录激活,激发了干细胞的增殖和转化,导致腺瘤的发生[11]。
本研究发现和正常肠上皮组织相比,大肠癌肿瘤组织中Wnt信号相关分子Wnt3表达上升,提示肠癌组织中Wnt信号活化。干细胞标记分子Lgr5和Ascl2表达上升,证实Wnt/β-catenin信号通路,促进了肠上皮细胞的增殖和去分化,可能和肠上皮的癌变相关。因此,抑制Wnt信号具有治疗大肠癌的潜能。
作为一种成体干细胞,肠干细胞具有自我更新与分化潜能,因此可以将其分离出体内并进行体外立体培养,模拟发育和疾病过程,并用于进一步的科学研究。近年来新建立起一种肠上皮细胞体外立体培养方法[12-14],采用这种培养方式,分离出来的肠上皮干细胞,可在体外生长形成类似于绒毛-隐窝单元的类器官(organoids)。组成Organoid培养体系的关键因素包括:(1)富含层粘连蛋白的Matrigel。(2)培养基中的信号分子组合。包括与表皮细胞增殖密切相关的表皮生长因子(EGF);Wnt信号激动剂R-spondin;BMP信号抑制子Noggin。这三种信号分子共同营造的环境与体内肠隐窝中的情况十分相似[12]。
大肠癌严重威胁着人类健康,其发生主要是因为肠道上皮细胞的功能异常。与细胞系相比,大肠癌类器官体外立体培养更接近人体内的真实情况。另外,体外培养体系相对简单可控,周期短,可大大加速相关研究的进展。本研究成功建立了大肠癌类器官培养体系。这一培养体系的建立对肠道干细胞和大肠癌研究的推动作用不言而喻。
使用Wnt信号抑制剂IWP-2[15,16],处理结肠肿瘤类器官,本研究进一步发现IWP-2可抑制大肠癌类器官的生长。由于抑制Wnt信号通路具有治疗结肠癌的潜能。本研究还尝试用Wnt信号抑制剂IWP-2处理结肠肿瘤类器官,本研究发现IWP-2可抑制大肠癌类器官的生长。本研究还设想通过大肠癌类器官培养体系为基础,高效筛选鉴别Wnt信号通路的小分子抑制剂,为研究大肠癌的发生机制、推动临床预防和治疗大肠癌提供证据。
[参考文献]
[1] Clevers H,Loh KM,Nusse R. Stem cell signaling. An integral program for tissue renewal and regeneration:Wnt signaling and stem cell control[J]. Science,2014,346(6205):1248012.
[2] Miyoshi H,Stappenbeck TS. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture[J]. Nat Protoc,2013,8(12):2471-2482.
[3] Harada N,Tamai Y,Ishikawa T,et al. Intestinal polyposis in mice with a dominant stable mutation of the beta-catenin gene[J]. EMBO J,1999,18(21):5931-5942.
[4] Schuijers J,Mokry M,Hatzis P,et al. Wnt-induced transcriptional activation is exclusively mediated by TCF/LEF[J]. EMBO J,2014,33(2):146-156.
[5] Peters U,Jiao S,Schumacher FR,et al. Identification of genetic susceptibility loci for colorectal tumors in a genome-wide meta-analysis[J]. Gastroenterology,2013, 144(4):799-807.
[6] Zeki SS,Graham TA,Wright NA. Stem cells and their implications for colorectal cancer[J]. Nat Rev Gastroenterol Hepatol,2011,8(2):90-100.
[7] de Lau W, Peng WC, Gros P, et al. The R-spondin/Lgr5/Rnf43 module:Regulator of Wnt signal strength[J]. Genes Dev,2014,28(4):305-316.
[8] Koo BK,Clevers H. Stem cells marked by the R-spondin receptor LGR5[J]. Gastroenterology,2014,147(2):289-302.
[9] Novellasdemunt L,Antas P,Li VS. Targeting Wnt signaling in colorectal cancer. A review in the theme:Cell signaling:Proteins,pathways and mechanisms[J]. Am J Physiol Cell Physiol,2015,309(8):C511-521.
[10] Fearon ER,Vogelstein B. A genetic model for colorectal tumorigenesis[J]. Cell,1990, 61(5):759-767.
[11] Schwitalla S,Fingerle AA,Cammareri P,et al. Intestinal tumorigenesis initiated by dedifferentiation and acquisition of stem-cell-like properties[J]. Cell,2013,152(1-2):25-38.
[12] Sato T,Vries RG,Snippert HJ,et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[J]. Nature,2009,459(7244):262-265.
[13] Sato T,Stange DE,Ferrante M,et al. Long-term expansion of epithelial organoids from human colon,adenoma,adenocarcinoma,and Barretts epithelium[J]. Gastroenterology,2011,141(5):1762-1772.
[14] Clevers H. Modeling development and disease with organoids[J]. Cell,2016,165(7):1586-1597.
[15] Chen B,Dodge ME,Tang W,et al. Small molecule-mediated disruption of Wnt-dependent signaling in tissue regeneration and cancer[J]. Nat Chem Biol,2009,5(2):100-107.
[16] Yin X,Farin HF,van Es JH,et al. Niche-independent high-purity cultures of Lgr5+ intestinal stem cells and their progeny[J]. Nat Methods,2014,11(1):106-112.
(收稿日期:2016-04-26)
