不同作用条件对纳米二氧化钛光催化抑菌效果的影响
2016-12-21王佳媚章建浩
王佳媚,章建浩
(1.海南大学 食品学院,海南 海口 570228;2.南京农业大学 食品科技学院,江苏 南京 210095;3.江苏省常熟市屹浩食品包装材料科技有限公司,江苏 常熟 215500)
不同作用条件对纳米二氧化钛光催化抑菌效果的影响
王佳媚1,章建浩2,3*
(1.海南大学 食品学院,海南 海口 570228;2.南京农业大学 食品科技学院,江苏 南京 210095;3.江苏省常熟市屹浩食品包装材料科技有限公司,江苏 常熟 215500)
研究了不同作用条件对纳米二氧化钛光催化抑菌效果的影响。结果显示:当纳米二氧化钛浓度增加时其对大肠杆菌(Escherichiacoli)和铜绿假单胞菌(Pseudomonasaerginosa)的抑菌作用呈先升高后降低的趋势,最佳浓度值为0.4 g/L;光照强度越高,初始菌液浓度越低,纳米二氧化钛的光催化抑菌效果越好;在相同实验条件下,纳米二氧化钛对大肠杆菌的抑菌效果优于对铜绿假单胞菌的抑菌效果。
纳米二氧化钛;光催化;大肠杆菌;铜绿假单胞菌;抑菌效果
目前,纳米抗菌包装是国际上抗菌包装研究的热点[1-4],多种金属氧化物成为研究的热点材料,如纳米二氧化钛[1]、ZnO[5]、CuO[6]。纳米二氧化钛的存在形式有锐钛型、金红石型和板钛型,前两者的存在形态非常稳定,是被研究最多的两种形式。纳米二氧化钛经紫外光照射后,电子发生跃迁,并进一步生成活性自由基,从而具有氧化及抑菌活性。
纳米二氧化钛与薄膜材料结合制得复合膜,已经被证明对果蔬等产品中的微生物具有抑菌作用。用纳米二氧化钛与PVC混合,研制出的复合膜可有效延长富士苹果的保存期[7]。将二氧化钛或纳米氧化硅粒子的复合保鲜液涂抹在枇杷表面,有效减少了腐败率[8]。Chawengkijwanich C等[1]研究发现纳米二氧化钛涂膜包装材料在处理180 min后使大肠杆菌的数量减少3 cfu/mL,其抑菌效果取决于UVA强度、光源种类等因素,与粒子的大小无关。二氧化钛作为一种安全、无毒、低价、容易制得的物质,其光催化抑菌活性受到广泛关注,在抗菌包装材料中具有一定的应用价值。
关于纳米二氧化钛在不同作用条件下,对鸡肉源微生物的光催化抑菌作用的研究很少。本文以UVA光照强度、二氧化钛浓度、细菌浓度等为主要影响因素,研究了不同作用条件对纳米二氧化钛光催化抑菌效果的影响。
1 材料与方法
1.1 纳米二氧化钛光催化抑菌反应装置
光催化抑菌反应实验采用自制光催化装置在密闭箱体中进行。反应装置主要由磁力搅拌器、紫外灯和无菌烧杯组成。将反应溶液和催化剂加入无菌烧杯中,再将无菌烧杯放在磁力搅拌器上,用紫外灯(UVA)从上面垂直照射,光照强度根据实验需要进行设定调节。使用数显照度计直接测定光照强度。
1.2 反应菌液制备
用接种环分别挑取少量大肠杆菌(Escherichiacoli)K12和铜绿假单胞菌(Pseudomonasaerginosa)菌落,接种至无菌胰蛋白大豆肉汤(TSB)中,分别在适宜温度下摇瓶培养24 h。取培养好的新鲜菌液50 mL,以5000g的转速离心10 min,去掉上层液体培养基,用无菌PBS清洗菌体两次,保证彻底除去培养基。再使用50 mL无菌PBS重新悬浮细菌体,所得菌悬液备用。
1.3 光催化抑菌实验
用无菌蒸馏水将纳米二氧化钛配制成所需浓度的悬浮液;取45 mL纳米二氧化钛悬浮液与5 mL菌悬液至250 mL无菌烧杯中,然后将烧杯放在磁力搅拌器上,置于紫外灯下照射处理,处理过程中持续搅拌,每隔一段时间取样检测。
1.4 细菌菌落计数方法
对取出的样品用无菌PBS溶液进行10倍系列梯度稀释,选择相邻的3个梯度进行计数培养,计算菌落数量,观察其变化。
分别取100 μL系列浓度的稀释菌液在胰蛋白大豆培养基(TSA)上进行涂布;将涂布均匀的平板置于适宜温度下培养一定时间(铜绿假单胞菌在25 ℃下培养48 h,大肠杆菌K12在37 ℃下培养24 h),然后对平板上的菌落进行计数。
1.5 数据分析
计算各处理多次重复实验数据的平均值,使用Origin 9.0进行作图和数据分析,使用SAS 8.2进行方差分析(ANOVA)及多方差检验(Tukey’s multiple range test,P<0.05)。
2 结果与分析
2.1 纳米二氧化钛浓度对大肠杆菌和铜绿假单胞菌的光催化抑菌效果的影响
由图1可见:纳米二氧化钛对大肠杆菌和铜绿假单胞菌的光催化抑菌作用趋势是基本一致的,在同一浓度下随着照射时间的延长,纳米二氧化钛对两种细菌的抑制效果均逐渐增强,活菌的浓度逐渐降低;在相同的照射时间条件下,不同浓度的二氧化钛对两种细菌的抑制作用均表现为0.4 g/L处理>0.8 g/L处理>0.2 g/L处理>对照(CK)。但在相同浓度、相同照射时间条件下,纳米二氧化钛对大肠杆菌的光催化抑菌效果要强于对铜绿假单胞菌的抑菌效果,例如在照射150 min时,0.4 g/L的纳米二氧化钛导致大肠杆菌的活菌数量比值(C/C0)低于10-4,而引起的铜绿假单胞菌的C/C0值低于10-3。总之,0.4 g/L的纳米二氧化钛在照射处理150 min时对两种细菌均具有最好的抑制效果。
多重差异比较结果表明:不同浓度的纳米二氧化钛对大肠杆菌的抑制作用均显著强于对照的(P<0.05);在照射30 min时不同纳米二氧化钛浓度处理间对大肠杆菌的抑制作用差异不显著;在照射60~90 min时,0.2 g/L的纳米二氧化钛对大肠杆菌的抑制作用显著低于0.4 g/L和0.8 g/L的(P<0.05);在照射120~150 min时,0.4 g/L和0.8 g/L处理间的抑制作用差异不明显,但两者都显著强于0.2 g/L处理和对照的。不同浓度的纳米二氧化钛对铜绿假单胞菌的抑制作用在照射30 min时无显著差异;在照射60~150 min过程中, 0.2 g/L纳米二氧化钛的抑菌作用显著低于0.4 g/L和0.8 g/L处理的(P<0.05)。
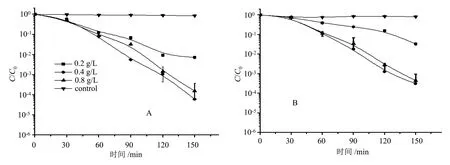
A:大肠杆菌; B:铜绿假单胞菌。光照强度为800 μW/cm2,菌液初始浓度为108 cfu/mL。
2.2 光照强度对大肠杆菌和铜绿假单胞菌的光催化抑菌效果的影响
图2显示在不同光照强度下纳米二氧化钛对铜绿假单胞菌的抑制作用趋势与大肠杆菌相似,都随着光照强度的升高而增大。在照射30 min之内纳米二氧化钛对两种细菌的抑制作用均较弱;此后随着照射时间的延长,其抑制作用明显加强;当光照强度为600 μW/cm2时,经纳米二氧化钛作用150 min后大肠杆菌和铜绿假单胞菌的活菌数量比值均下降至10-2左右。
当光照强度为600 μW/cm2时, 0.4 g/L的纳米二氧化钛对大肠杆菌和铜绿假单胞菌的抑制作用均显著(P<0.05)低于高强度处理组的;当光照强度为1000 μW/cm2时,照射150 min时大肠杆菌和铜绿假单胞菌的活菌数量比值分别为10-5和10-4左右,而当光照强度为800 μW/cm2时,大肠杆菌和铜绿假单胞菌的活菌数量比值分别为10-4和10-3左右。

A:大肠杆菌; B:铜绿假单胞菌。二氧化钛浓度为0.4 g/L,菌液初始浓度为108 cfu/mL。
2.3 菌液初始浓度对大肠杆菌和铜绿假单胞菌的光催化抑菌效果的影响
从图3可以看出:当菌液初始浓度为108cfu/mL时,纳米二氧化钛对大肠杆菌和铜绿假单胞菌的抑制作用趋势一致,在照射150 min内细菌浓度几乎呈直线下降,其中大肠杆菌的浓度最终下降至104cfu/mL左右,而铜绿假单胞菌的浓度仅降至106cfu/mL左右。当菌液初始浓度为107cfu/mL时,大肠杆菌的浓度在照射150 min时降至102cfu/mL左右,而铜绿假单胞菌的浓度在前120 min呈快速降低,在120 min后下降速率明显减弱,在150 min时浓度降至103cfu/mL左右;当菌液初始浓度为106cfu/mL时,大肠杆菌的浓度迅速降低,在120 min后浓度低于102cfu/mL,而铜绿假单胞菌的浓度变化类似于菌液初始浓度为107cfu/mL时的,在150 min时浓度下降至102cfu/mL左右。上述结果表明,菌液初始浓度越低,0.4 g/L的纳米二氧化钛对大肠杆菌和铜绿假单胞菌的抑制作用越强。
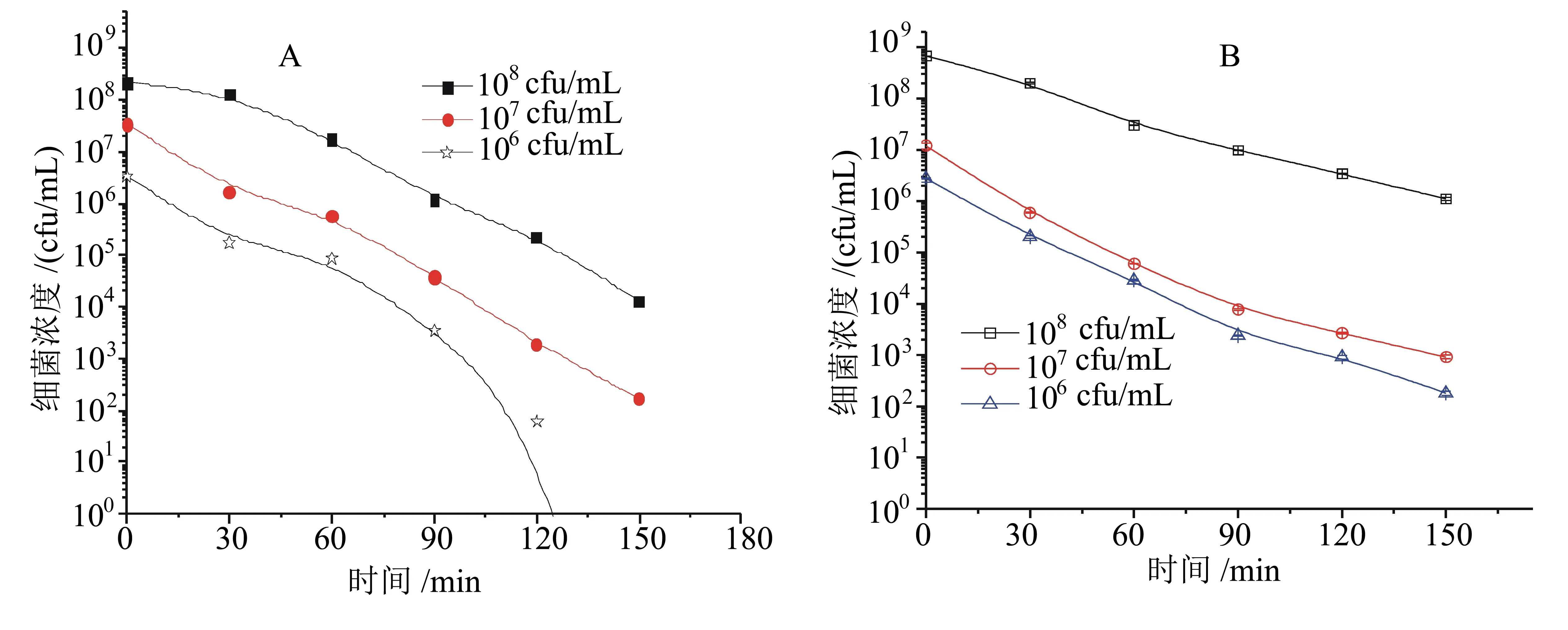
A:大肠杆菌; B:铜绿假单胞菌。光照强度为800 μW/cm2,二氧化钛浓度为0.4 g/L。
3 讨论
3.1 纳米二氧化钛浓度对其光催化抑菌作用的影响
本实验发现,纳米二氧化钛对大肠杆菌和铜绿假单胞菌产生相同的抑菌效果所需时间相近,对大肠杆菌的抑制速度比铜绿假单胞菌快30 min。此结果与之前的报道[9-10]相似。纳米二氧化钛的作用浓度有最适值,即在一定浓度范围内随着二氧化钛浓度的增加,其对细菌的作用增强,当超过某一浓度时,作用减弱。本研究中二氧化钛的适宜浓度为0.4 g/L。这与Grieken等[9]报道的结果一致,他们发现:纳米二氧化钛悬浮液在0.02~0.50 g/L浓度范围内,随着浓度增加,纳米二氧化钛对微生物的抑制作用增强;纳米二氧化钛悬浮液在低浓度 (0.05 g/L)下抑制102cfu/mL大肠杆菌生长需要240 min;而当浓度为0.20 g/L时,其抑制106cfu/mL大肠杆菌生长仅需180 min。光催化抑菌作用的催化剂适宜浓度与实验条件(照射灯的类型、反应器形状)等有关,而与所用的目标菌种关系不大[11]。因为光催化反应过程比较复杂,反应过程中的影响因素较多,任一个因素的变化都可能会导致实验结果不同。
当纳米二氧化钛浓度增加时,反应体系中的二氧化钛分子数量增多,吸收的光子数量增加,产生的自由基数量增加,从而可以提高抑菌效果。当二氧化钛浓度过高时,会产生屏蔽效应[12]。高浓度的纳米二氧化钛在细菌体表面形成大面覆盖阴影,阻碍光线通过;此外,产生的活性电子——空穴对在短时间内不能与微生物作用,就会自动结合[12]。另外,过低浓度的纳米二氧化钛不足以吸收全部光子,产生的自由基数量有限,因而抑菌效果差。
3.2 光照强度对纳米二氧化钛抑菌作用的影响
光照强度影响整个光催化过程中纳米二氧化钛的抑菌效果,随着光照强度的增加抑菌效果增加[13]。当光照强度降低时,导致纳米二氧化钛表面产生的自由基数量减少,对细菌的抑制效果降低。Rincón等[13]认为抑菌率随催化剂用量的增加而增加,当光照强度为1000 W/m2时,增加纳米二氧化钛用量会影响光催化抑菌效果,因为抑菌作用需要足够时间才能达到效果,并非菌体受到自由基攻击之后立即达到抑菌效果。
本实验结果表明,当光照强度增大时,纳米二氧化钛对细菌的抑制作用增强。这与之前关于二氧化钛在水溶液中对大肠杆菌和E.faecalis抑制的报道结果[9]一致。当光照强度升高时,可利用的光能增大,纳米二氧化钛可吸收的光子增多,产生的自由基数量增多[14],从而增强对细菌的抑制效果。这可能也与光催化抑菌活性和氢氧自由基浓度间的线性关系有关[15]。在本研究中光照强度对两种菌种的光催化作用影响趋势一致,这可能与大肠杆菌和铜绿假单胞菌同属G-菌、两者的细胞结构相同有关。
3.3 菌液初始浓度对纳米二氧化钛抑菌作用的影响
在本实验中,随着菌液初始浓度的增大,纳米二氧化钛对细菌产生相同抑制效果所需的时间增加。此结果与相关文献报道的结果[16-18]一致。图3中高浓度与低浓度处理间细菌浓度变化曲线的斜率无显著差异,说明反应速率常数随菌液初始浓度的增加而减低。Grieken等[9]认为光催化抑菌的反应动力学常数与催化剂浓度和光照能量有关,但是反应速率与菌液初始浓度相关。
细菌的生长速度也会影响纳米材料对细菌的光催化效果。生长速度快的细菌相对于生长速率慢的菌株而言可能对纳米材料更敏感[19]。生长速率慢的细菌对纳米粒子有较高的耐性,可能与其“抗压基因”的表达有关[20]。因此,纳米材料的抑菌作用随使用菌株的不同而存在差异。
4 结论
纳米二氧化钛对大肠杆菌和铜绿假单胞菌均具有良好的光催化抑菌效果,在相同条件下对两种细菌的作用趋势一致,但对大肠杆菌的抑制作用强于对铜绿假单胞菌的。纳米二氧化钛浓度增加对大肠杆菌和铜绿假单胞菌的抑菌作用均呈先升高后降低的趋势,最佳浓度值为0.4 g/L。光照强度越高,菌液初始浓度越低,越有利于增强二氧化钛的抑菌效果。
[1] Chawengkijwanich C, Hayata Y. Development of TiO2powder-coated food packaging film and its ability to inactivateEscherichiacoliin vitro and in actual tests [J]. Int J Food Microbiol, 2008, 123(3): 288-292.
[2] Paola A. Review of antimicrobial food packaging [J]. Innovative Food Science & Emerging Technologies, 2002(3): 113-126.
[3] Avelina F, Elsa L. Cellulose-silver nanoparticle hybrid materials to control spoilage-related microflora in absorbent pads located in trays of fresh-cut melon [J]. International Journal of Food Microbiology, 2010, 142: 222-228.
[4] Jin T. Inactivation of salmonella in liquid egg albumen by antimicrobial bottle coatings infused with allyl isothiocyanate, nisin and zinc oxide nanoparticles [J]. Journal of Applied Microbiology, 2011, 110: 704-712.
[5] Li X. Antimicrobial activities of ZnO powder-coated PVC film to inactivate food pathogens [J]. International Journal of Food Science & Technology, 2009, 44(11): 2161-2168.
[7] 陈丽,李喜宏,胡云峰,等.富士苹果PVC/TiO2纳米涂膜保鲜研究[J].食品科学,2001,22(7):74-76.
[8] 贾丽蓉,夏娟,胡秋辉.食品包装纳米材料对酱牛肉保鲜品质的影响[J].食品科学,2008,29(5):461-464.
[9] Van Grieken R. Comparison between the photocatalytic inactivation of Gram-positiveE.faecalisand Gram-negativeE.colifaecal contamination indicator microorganisms [J]. Applied Catalysis B: Environmental, 2010, 100(1-2): 212-220.
[10] Manjón F. On the factors influencing the performance of solar reactors for water disinfection with photosensitized singlet oxygen [J]. Environmental Science & Technology, 2007, 42(1): 301-307.
[11] Marugán J. Analogies and differences between photocatalytic oxidation of chemicals and photocatalytic inactivation of microorganisms [J]. Water Res, 2010, 44(3): 789-796.
[12] Marugán J. Kinetics of the photocatalytic disinfection ofEscherichiacolisuspensions [J]. Applied Catalysis B: Environmental, 2008, 82(1-2): 27-36.
[13] Rincón A G, Pulgarin C. Photocatalytical inactivation ofE.coli: effect of (continuous-intermittent) light intensity and of (suspended-fixed) TiO2concentration [J]. Applied Catalysis B: Environmental, 2003, 44(3): 263-284.
[14] Maness P C. Bactericidal activity of photocatalytic TiO2reaction: toward an understanding of its killing mechanism [J]. Applied and Environmental Microbiology, 1999, 65(9): 4094-4098.
[15] Min C, Wonyong C, Jeyong Y. Linear correlation between inactivation ofE.coliand OH radical concentration in TiO2photocatalytic disinfection [J]. Water Research, 2004, 38: 1069-1077.
[16] Gomes A I, Vilar V J, Boaventura R A. Synthetic and natural waters disinfection using natural solar radiation in a pilot plant with CPCs [J]. Catalysis Today, 2009, 144(1): 55-61.
[17] Cohen-Yaniv V, Narkis N, Armon R. Photocatalytic inactivation ofFlavobacteriumandE.coliin water by a continuous stirred tank reactor (CSTR) fed with suspended/immobilised TiO2medium [J]. Water Science and Technology, 2008, 58(1): 247.
[18] Dunlop P. The photocatalytic removal of bacterial pollutants from drinking water [J]. Journal of Photochemistry and Photobiology A: Chemistry, 2002, 148(1): 355-363.
[19] Mah T, O’Toole G A. Mechanism of biofilm resistance to antimicrobial agents [J]. Trends in Microbiology, 2001, 9(1): 34-39.
[20] Lu C, Brauer M J, Botstein D. Slow growth induces heat-shock resistance in normal and respiratory-deficient yeast [J]. Molecular Biology of Cell, 2009, 20(3): 891-903.
(责任编辑:黄荣华)
Photocatalytic Disinfection Effect of Nano-TiO2on Bacteria under Different Conditions
WANG Jia-mei1, ZHANG Jian-hao2,3*
(1. College of Food Science and Technology, Hainan University, Haikou 570228, China; 2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 3. Changshu Yihao Food Packaging Material Technology Limited Company in Jiangsu Province, Changshu 215500, China)
The photocatalytic disinfection effect of nano-TiO2on 2 species of bacteria under different conditions was researched. The results indicated that the disinfection effect of nano-TiO2on bothEscherichiacoliandPseudomonasaerginosawas increased first and then decreased when the concentration of nano-TiO2was increased, and it showed the best disinfection effect at 0.4 g/L. To increase the light intensity, and to reduce the initial concentration of bacteria were helpful to increasing the disinfection effect of nano-TiO2. Under the same conditions, nano-TiO2had a better photocatalytic disinfection effect onE.colithanP.aerginosa.
Nano-TiO2; Photocatalysis;E.coli;P.aerginosa; Disinfection effect
2016-06-02
海南大学科研启动基金项目(kyqd1560);国家中小企业创新基金项目(JSA9ED6Q);江苏省农业科技自主创新资金项目(C X(15)1049);江苏省国际合作项目(BZ2014034);国家科技支撑计划项目“纳米涂膜保鲜包装材料的研究与开发”(2015 BAD16B05-05)。
王佳媚(1984─),女,讲师,主要从事肉类加工与贮藏保鲜方向的研究。*通讯作者:章建浩。
TQ134.11
A
1001-8581(2016)11-0054-05
