禾谷类作物小孢子脱分化的生理生化机制
2016-12-20王学华
戴 力,王学华
(湖南农业大学农学院,长沙 410128)
禾谷类作物小孢子脱分化的生理生化机制
戴 力,王学华*
(湖南农业大学农学院,长沙 410128)
禾谷类作物小孢子脱分化是小孢子细胞外环境变化导致内环境改变,从而诱导代谢酶活性、代谢途径以及调控基因表达的变化,最终脱离原有分化状态发生发育途径改变的过程。经各种胁迫预处理后,离体小孢子内发生了饥饿作用、内源激素变化和抗氧化胁迫等一系列生理过程,使得正常发育的结构和信息被破坏或消除,细胞质发生重组,营养核去抑制化,最终实现脱分化。这一过程牵涉到复杂的生理与遗传调控,其中起关键作用的酶和基因主要有:蛋白质水解酶、乙烯和生长素作用相关酶类、氧化还原系统或抗胁迫系统相关酶类、花粉特异蛋白和细胞分裂周期相关蛋白,以及它们的调控基因。对它们进行一定的人为调控可有效地促进禾谷类作物小孢子脱分化和胚胎诱导。
禾谷类作物;小孢子;脱分化;生理机制;遗传模式;生化机制
作为禾谷类作物新品种培育和种质资源改良创新的重要技术,禾谷类小孢子培养技术的研究在近年来取得了较大的进展,然而其仍无法大规模应用于科研和生产实践。究其原因,主要是因为禾谷类小孢子胚胎诱导过程生理生化机制的复杂性,从而使得影响其培养体系建成的因素呈现出多样性。当大部分影响因素的作用机理未能明确时,便难以对其诱导和培养过程进行有效的人为调控,因此也就无法根据人类的意愿去进行大规模应用。
小孢子培养又称为小孢子胚胎诱导或单雄生殖,它是具有一定分化程度的花粉细胞经过脱分化和再分化形成完整的单倍体花粉植株的过程。小孢子从花药中分离出来后,具有较强生活力的活力小孢子会在一系列的环境刺激和自身生理生化机制的作用下脱分化变为具有持续分裂能力的胚性小孢子,胚性小孢子分裂得到愈伤组织并在各种理化环境及营养激素因素的诱导下转变为能够实现再分化获得植物器官或胚状体的胚性愈伤组织,之后进一步培育获得独立花粉植株;与此同时那些非活力小孢子、非胚性小孢子和愈伤组织则会相继发生细胞凋亡而消失。因此,脱分化后获得胚性小孢子以及诱导获得胚性愈伤组织是禾谷类小孢子培养过程中的两个关键环节,同时也是有机体生理生化等代谢机制最为复杂的阶段。尤其是脱分化过程,它直接决定了后续诱导过程的有效性,并且其机制也是相对最复杂的。本文在前人的研究基础上对禾谷类作物小孢子脱分化及进一步培养获得愈伤组织(包括胚性和非胚性两种)过程的生理生化及遗传机制进行归纳总结和讨论,希望能够有助于促进小孢子培养技术的发展。
1 禾谷类作物小孢子脱分化的生理机制
小孢子脱分化是指小孢子离体后在各种环境因素(包括物理环境、营养环境和信号环境如激素环境等)的作用下获得愈伤组织诱导潜力的过程。小孢子离体前后,在化学杀雄剂、低温、高温、甘露醇等不同胁迫处理下,细胞内部会发生一系列生理变化,如水解酶活性增加,合成酶活性降低,核酸、蛋白质和糖类等含量减少,线粒体退化,细胞自我吞噬作用,内源激素含量变化,以及氧化胁迫和细胞程序性死亡等,从而使得小孢子内部发生细胞质重组和营养核分裂去抑制作用,最终导致细胞脱分化。笔者根据前人众多研究[1~11]总结归纳出其具体生理代谢机制网络如图1所示。
2 禾谷类作物小孢子脱分化的遗传机制
植物花粉培养能力(简称花培能力)主要包括胚胎发生能力和植株再生能力,两者受供体基因型影响很大,且彼此的遗传作用机制相互独立互不影响[12]。而小孢子脱分化是胚胎发生能力获得的最关键环节,两者在某种程度上甚至可以等同。
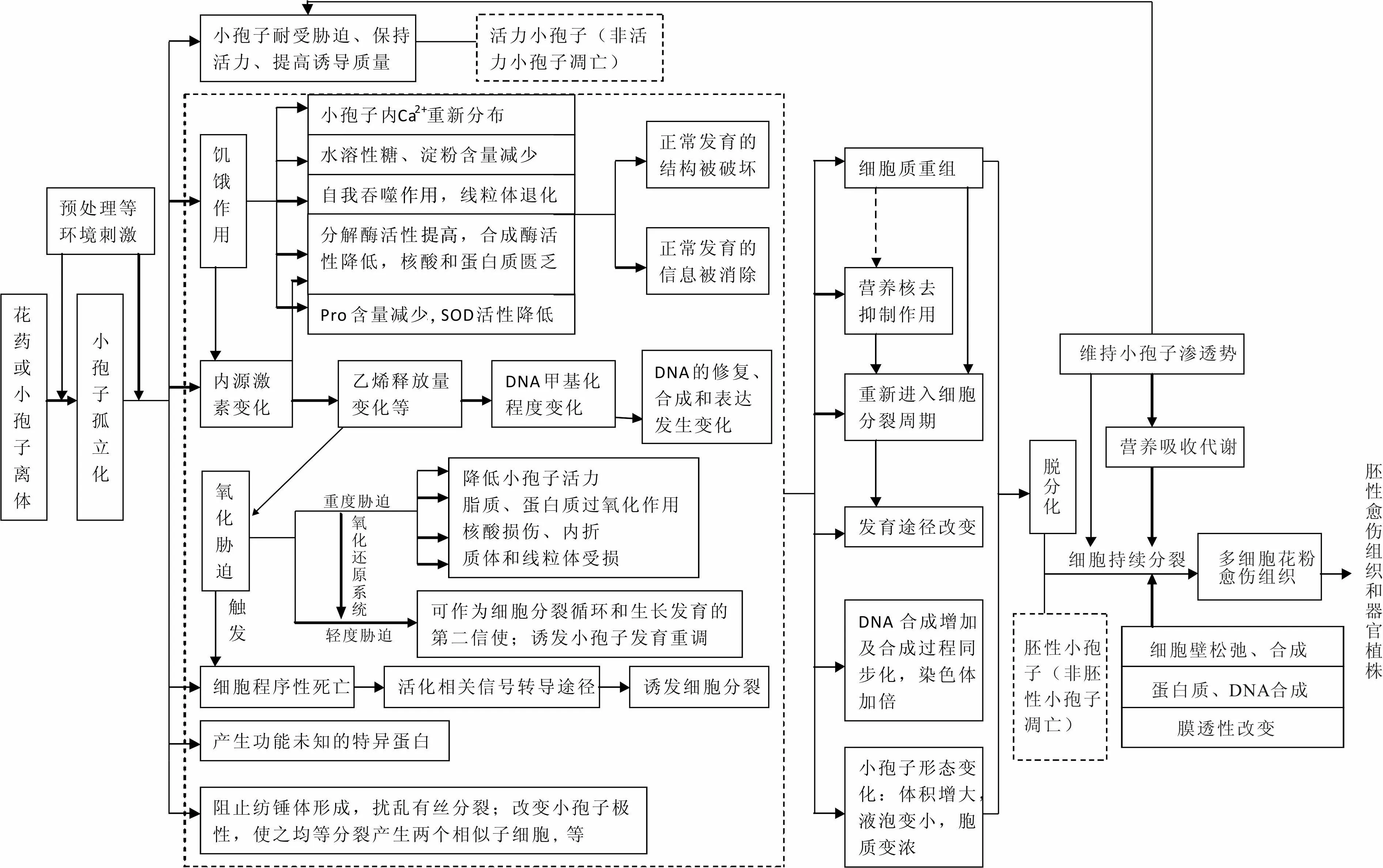
图1 禾谷类作物小孢子脱分化的生理机制
众多研究表明,当外界条件一致时,同一作物的不同基因型小孢子之间就会表现出遗传差异。对玉米[13]、水稻[14]、大麦[15]和小黑麦[16]等禾谷类作物花粉培养能力遗传机制的研究发现,该性状是由多基因控制的数量遗传性状,其遗传模式复杂且不一致(表1)。

表1 几种主要禾谷类作物的花培能力遗传模式Table 1 Genetic models of microspore culture ability of several main cereal crops
由表1可知,禾谷类作物花粉的培养能力都受到基因的加性效应的影响,且以此为主;大部分作物还受到显性效应的影响;而对于某些作物而言互作效应也是不可忽视的,如水稻。另外,针对小黑麦的相关遗传特性,孙娜等[16]提出在高广义遗传力(GCA)基础上进行高狭义遗传力(SCA)配组,通过杂交可以选育出高花培能力的基因型。至于其他禾谷类作物是否也有相似的高花培能力基因型的选育方法,还有待于更多的遗传研究。
然而,对于小孢子培养能力这类多基因控制的复杂性状,其基因调控网络往往呈现为“模块化”的特性,通常是由主效基因和上下游基因及其相互作用的调控基因组合成一个功能单元,作为一个整体承担相关功能的发挥和目标性状的形成。因此就当前对于1~3个基因能够起到很好改良作用的转基因育种和常规育种技术而言,能够对花粉培养能力起到的改良作用是相当有限的。相比较而言,当前最新提出的一种新一代生物育种技术——分子模块设计育种技术[17]则能够很好地改良此性状,因为该技术对多基因性状的改良是针对于“模块化”的整个功能单元而并非单一基因而进行的。不过这一育种技术要应用到小孢子培养能力性状的改良中,则还需要首先对控制胚胎发生能力和植株再生能力的关键生理代谢过程、关键酶和关键基因及其上下游和调控相关基因拥有一定的了解。而这还有待于更多的研究者去探索。
此外,孙海鹏等[15]研究发现,不同花培能力大麦出愈率的明显区别表现在多核花粉形成之后,而在此之前不同基因型间并无显著差异;故其推测:不同基因型之间胚胎发生能力的差异很有可能是由其多核花粉成愈能力决定的,而非由小孢子脱分化启动能力控制,且可能与新细胞壁的合成能力有关。孙敬三等[18]和周嫦等[19]也认为,多核花粉形成后,新细胞壁不能形成或不能及时形成是雄核发育失败的原因之一。然而关于新细胞壁的形成与脱分化之间它们对花培的影响哪一个更重要或者一样重要目前尚无直接的研究结果以做定论。笔者认为两者的重要性对于小孢子培养来说都是非常显著的,可能脱分化要较细胞壁的形成更重要,因为它是小孢子发育途径转变的基础。
3 禾谷类作物小孢子脱分化的生化机制
从分子生物学的角度看,花培能力遗传模式的复杂可能与参与调控的基因数目和种类众多有关。据报道有成百上千个不同种类的基因参与其中[20,21],它们的表达或上调或下降,且在不同作物、不同基因型中的表达又各有差别。近年来,对小孢子胚胎诱导分子机制的研究不断增多,且主要集中在对关键环节机制的探讨,比如:小孢子胁迫前处理、花粉脱分化、发育途径转变以及白化苗的形成等;其中涉及到的基因种类众多,包括形态特征、信号转导、细胞命运决定、细胞壁变化、细胞保护、防御和毒性及胁迫反应、新陈代谢、转录翻译调控、蛋白质降解、质体发育以及物质转运等相关基因[22]。这里主要对在小孢子脱分化和愈伤组织形成过程中已知的几个重要生理过程的重要调控基因及其调控机制进行归纳探讨。主要包括如下几个方面:
3.1 外界逆境胁迫耐受基因
外界的逆境胁迫可以使花粉中的小孢子孤立化,并诱导其细胞内发生各种生理生化代谢反应,从而实现脱分化,同时也能够提高小孢子的诱导质量。对于能够在胁迫中存活下来并继续分裂得到愈伤组织的小孢子而言,其自身的逆境胁迫耐受机制起到了十分重要的作用;其机制受到各种耐受相关基因的调控。当前发现的胁迫耐受相关基因主要有PR蛋白基因、氧化胁迫相关蛋白基因、热激蛋白基因、抗氧化胁迫和解毒蛋白基因等,它们被发现在受到甘露醇预处理的小孢子中发生表达[23]。由于氧化胁迫与抗氧化胁迫的特殊性,后面将对其进行单独讨论,这里主要讨论与外界胁迫因素应对相关的基因,如PR蛋白基因和热激蛋白基因等。
PR蛋白包括两种葡聚糖内切β-1,3-葡萄糖苷酶,三种甘露醇脱氢酶(ELI1、2和3)以及一种类渗透蛋白(osmotin-like protein)。β-1,3-葡萄糖苷酶按照其作用方式和产物可分为内切、端解和葡萄糖苷酶,是纤维素酶系的组成部分,其功能是分解细胞壁糖类,在细胞分裂、小孢子发生及细胞壁生物合成等很多方面具有重要作用。在植物体内,β-1,3-葡萄糖苷酶基因的表达能够被热处理、机械处理以及乙酰水杨酸钠和多聚腺苷酸等100多种化学物质所诱导[24]。因此笔者推测,在小孢子培养过程中该蛋白可能被高温预处理或机械分离小孢子过程所诱导,然后通过影响细胞壁的形成或小孢子细胞的分裂来作用于小孢子的脱分化过程。它可能是小孢子脱分化的促进或保障性因素而非诱导性因素。
此外有研究表明,β-1,3-葡萄糖苷酶基因和甘露醇脱氢酶基因在小孢子胚胎发育的两个阶段特异性表达,并且它们在高诱导系中的最高表达时期为脱分化时期。可见其对于小孢子脱分化的重要性。同时推测其作用可能不仅限于逆境胁迫的耐受,也许与小孢子发育途径的改变存在着某些关系。
与小孢子胚胎诱导相关的热激蛋白(HSPs)主要是HSP70和HSP81-2,它们可能在提高小孢子胁迫耐受性能的同时间接参与孢子体途径的转化[25]。Sánchez-Díaz等[22]也发现,热激蛋白基因与小麦小孢子发育程序重调及早期胚胎诱导相关。HSP70主要作为分子伴侣参与蛋白质的折叠、装配、转运等,并能恢复或加速清除细胞内变性的蛋白质而稳定细胞结构,参与细胞保护;其中的一些还能被除高温胁迫外的其他条件所诱导,如水分、低温和盐胁迫等[26,27]。此外,Muoz-Amatriaín等[21]还发现,它们的表达对最终的绿苗产量也有着重要的作用。
笔者认为外界逆境胁迫相关基因可能主要通过两个方面的作用来影响小孢子的脱分化和小孢子胚胎的诱导:提高小孢子的逆境耐受能力来提高活力小孢子数目和诱导小孢子发生发育途径的改变来提高胚性小孢子数目。因此,如何挖掘和利用外界胁迫、胁迫相关基因或蛋白以及小孢子脱分化或胚胎诱导之间的关系,提升小孢子脱分化效率和胚胎诱导率,还有待于更多的研究探索。
3.2 饥饿作用相关基因
小孢子内的饥饿作用是在离体或胁迫作用下诱导发生的,其中牵涉到一系列的酶和蛋白质及其调控基因。当前已经发现的调控基因主要包括糖类和脂质退化和转运相关基因、产能相关蛋白的基因、蛋白质水解相关基因以及氨基酸分解中氨再吸收过程相关基因。它们很可能是小孢子脱分化过程的关键诱导因素。
糖类和脂质的退化和转运相关基因主要有β-D-木糖酶基因、α-半乳糖苷酶基因、脂肪酶基因和蔗糖转运蛋白基因等[21]。能够产生相关蛋白的基因则包括两种氧化还原酶基因和一种质子依赖的寡肽转运蛋白基因。Muoz-Amatriaín等[20]发现,高胚胎诱导品种在小孢子胚胎诱导过程中具有活跃的糖类和脂质的降解代谢,这有利于蔗糖含量的增加。
蛋白质水解相关基因主要是天冬氨酸蛋白酶、枯草杆菌蛋白酶和26S蛋白酶体调节亚基的编码基因。较多研究发现,单雄生殖过程中,小孢子经胁迫处理后其内部会出现一种全面的蛋白质水平下调的现象,蛋白质组学方法证明,此时小孢子内部发生了蛋白质磷酸化和糖基化等一系列的改变[28]。从而有假说认为,花粉特异蛋白的下调和蛋白质分解的增加可能在小孢子脱分化过程中起到重要作用。而进一步的研究则充分证明了这一点。它们发现,蛋白质水解基因的诱发与小孢子胚胎的诱导潜力息息相关[29],并且还能影响最终的绿苗产量[21]。此外,Harada等[30]早在1986年便发现,阻碍花粉特异基因的转录有利于单雄生殖的起始。这可能与花粉特异蛋白的合成量下调有关。
在植物细胞中,营养饥饿或匮乏会导致“饥饿基因”的活跃转录,而它们的转录产物与细胞组成成分的降解和营养物质的再活化密切相关。饥饿期间,与碳水化合物再活化相关基因表达上调,同时氮素循环相关酶的活性也相应增强。氮素循环牵涉到相关蛋白质的降解,这一过程包括多种不同类型的植物蛋白酶和泛素-26S蛋白酶体途径。对体细胞胚胎诱导的研究发现,细胞脱分化时总是伴随着蛋白酶基因和泛素-26S蛋白酶体途径相关蛋白基因的增量表达。另外,对大麦小孢子胚胎诱导的研究也发现,其诱导潜力与半胱氨酸蛋白酶1的前体、天冬氨酸蛋白酶、金属蛋白酶FtsH和一个泛素-26S调控微粒的编码基因的表达水平具有一定的相关性[31]。这些结果表明,蔗糖耗尽时蛋白质降解对于氮素的迁移和小孢子的脱分化具有重要作用,这一过程一方面可能导致与先前分化状态相关的蛋白质的选择性破坏,另一方面可能还有利于新物质的合成,从而使得小孢子的发育途径发生改变。
碳水化合物再活化及氮素循环除与糖类、脂质和蛋白质的水解有关外,还与氨基酸的分解过程密切相关。氨基酸分解中的氨再吸收过程则与小孢子的饥饿作用及脱分化之间存在着一定的联系。这一过程相关基因主要包括谷氨酰胺合成酶(GS2)基因、天门冬酰胺合成酶(AS)基因和与芳香族氨基酸相关的shikimate激酶基因[21]。
上述研究结果综合说明了小孢子饥饿作用对单雄生殖的诱导作用。然而也有研究发现,在某些低小孢子胚胎诱导系也出现了蛋白质水解和氨基酸异化作用增强的现象[21]。因此笔者认为,“饥饿”对小孢子脱分化的促进作用与“饥饿过程”相比,可能“饥饿程度”对其影响更大。轻度饥饿或蛋白质水解可能并不足以完全消除花粉特异蛋白,从而仍无法成功诱导小孢子发生脱分化;而过度的蛋白质水解却又可能会导致基本代谢体系的破坏,从而导致小孢子细胞死亡或活力下降,也不利于小孢子胚胎的诱导;可能只有适度的蛋白质水解程度才能较好地促进小孢子单雄生殖的诱导。这也许从另一个角度体现了小孢子胚胎诱导的复杂性。
因此,对于饥饿作用促进小孢子脱分化的机制,可做出如下解释:糖类和脂质的降解是细胞自身在营养缺乏条件下的一种求生机制,它的结果一方面是维持了细胞基本的生命代谢过程,保证小孢子的生活力;另一方面也为下一步的蛋白质水解过程奠定了基础。即当前两种能量储存物质几乎消耗殆尽时,细胞便只能通过进一步水解代谢蛋白质以提供维持基本生命过程所需要的能量,而相对于维持基本结构与代谢的蛋白质而言,小孢子的分化状态维持相关蛋白则成为“冗余蛋白”或“冗余能耗”,因此首先被分解消耗,如果在这类“冗余”蛋白被消耗完时细胞能够从外界获取一定的营养或能量支持,终止蛋白质水解的进一步继续,小孢子细胞则会在此时发生脱分化,进行细胞分裂与繁殖。否则,便会导致基本代谢蛋白和体系的破坏,从而降低细胞的生活力甚至发生细胞死亡。
另外,培养早期脂肪转运蛋白(ECLTP)基因被认为与大麦小孢子发育途径转变有关[22]。ECLTP是一种非特异性脂肪转运蛋白,其同源物脂肪转运蛋白群(LTPs)能于离体培养下在薄膜片段之间转运脂肪,且在不同时间、组织和细胞类型中的表达可能不同[32]。ECLTP对于小孢子脱分化的具体作用当前仍不清楚,只知道其表达图式与胡萝卜的LTP cDNA EP2(胚胎诱导蛋白2)相似。EP2是胡萝卜体胚诱导体系中胚胎诱导蛋白的标记,被认为与利用角质单体进行角质合成的活动有关[32]。
3.3 内源激素变化相关基因
植物激素作为一类重要的信号物质,其在细胞的生长发育与生理代谢中起到非常重要的调控作用,并且在不同的生理过程中,起主要作用的激素类型各有不同。众多研究表明,在几类植物激素中,生长素和乙烯对小孢子脱分化过程的调控起到了主要作用,而且其二者既可以单独作用于小孢子的发育途径改变,也能够通过相互作用来调控小孢子的分化状态。根据前人对体胚或小孢子胚胎诱导的研究,笔者推测它们之间可能存在着如下关系:
机械创伤、外源激素(如生长素等)作用和其他一些生物或非生物胁迫可诱导小孢子内部乙烯合成关键酶ACS基因的表达,合成大量的乙烯,过量的乙烯一方面通过影响DNA甲基化酶基因的表达和酶活性使DNA的甲基化发生变化[33],从而调控与小孢子脱分化相关基因的转录活性;另一方面过量的乙烯通过干扰由YUC基因介导的生长素区域性合成来破坏生长素信号的极性分布,从而破坏细胞的极性,促使细胞实现脱分化,而这在胚胎形成后期却表现为阻碍胚胎的形成[34]。此外有研究发现,ETO1基因发生突变会引起乙烯的过量合成;乙烯响应基因CTR1突变也会明显降低YUC基因的表达,干扰生长素的极性分布,从而有利于胚性愈伤组织的形成,但不利于体胚的分化[34]。
体胚诱导的研究表明,IAA的合成有利于胚性细胞的产生[35]。研究发现[34,35],在生长素缺失的情况下,生长素响应因子(ARFs)会被转录抑制因子AUX/IAA蛋白结合而使其活性受到抑制,从而无法调节生长素响应基因的表达;而当生长素出现时,生长素会促使泛素与AUX/IAA蛋白结合,使之发生降解而释放出具有活性的ARF蛋白。ARF蛋白一方面与生长素应答因子AuxRE结合,调节生长素响应基因的表达,另一方面ARF基因MP可直接激活PIN1基因的转录,而其产物PIN蛋白的极性定位则可决定生长素的极性运输与梯度分布,从而促进WUS基因的表达。与LEC2等基因一样,WUS基因是胚胎形成过程中的一种转录调控相关基因,它们主要通过功能缺失突变或过量表达的方式来调控遗传物质的转录过程,从而促进体细胞向胚性细胞转变[36]。LEC2基因可以直接调控生长素合成基因YUC4的表达,同时还激活了生长素响应基因的表达,从而激活了生长素信号途径[37]。
此外,增加培养基中外源生长素的浓度也可以增加乙烯合成关键酶基因ACS(ACS2、6、8)的转录水平,从而使乙烯的合成增加[35]。乙烯也可以通过诱导邻氨基苯甲酸合成酶的α亚基相关基因(ASA1、WEI2和TIR7)和β亚基相关基因(ASB1和WEI7)的表达,来影响催化色氨酸合成的第一个关键步骤,从而影响生长素的合成[34]。
3.4 氧化胁迫相关基因
氧化胁迫是由于外界胁迫所引发的一种细胞内部环境的恶化,它在小孢子脱分化及其胚胎的诱导过程中起到了非常关键的作用。重度氧化胁迫能够降低小孢子活力,使脂质和蛋白质发生过氧化作用,导致核酸损伤、内折以及质体和线粒体受损,不利于小孢子的成活和脱分化。而轻度氧化胁迫则可作为细胞分裂循环和生长发育的第二信使,并诱发小孢子发育重调。而有机体内部的抗氧化胁迫和解毒蛋白则可以减轻氧化胁迫的危害程度,保护细胞活力,促进小孢子的发育重调。
抗氧化胁迫和解毒蛋白主要包括NAD(P)H:苯醌还原酶(NQR)、细胞色素P450核黄素合成蛋白ribA和谷胱甘肽S-转移酶(GST)[22]。其中研究较多的是培养早期谷胱甘肽S-转移酶(ECGST)基因(主要有GSTF2和GSTA2),它可能在保护被培养的小孢子免受氧化胁迫危害中起到重要作用[32]。GSTF2编码一种φ(F)类谷胱甘肽S-转移酶,GSTA2则编码一种病原菌诱导谷胱甘肽S-转移酶[22]。研究发现,GST基因的上调在小孢子胚胎诱导不同阶段都有发现[23]。GSTF2和GSTA2在小孢子获得“星状”结构或经历第一次分裂时发生表达[22]。在小麦和小黑麦的花粉培养中,GSTF2分别在培养开始后的第5和第4天,即小孢子胚胎诱导的早期开始表达,在小黑麦小孢子胚胎低和高诱导系中其最高表达时期分别在第4天和第8天;而其同类物GSTA2在小黑麦上述两个诱导系中的最高表达时期都在第8天[8,22];且在大麦和小黑麦中,经胁迫诱导后GSTs基因的表达会发生上调[8,21~23]。Zur等[8]认为,GSTs的高水平表达对于离体培养的前8 d尤为重要,它可能与最初的多细胞结构形成有关;并猜想GSTs这一能够催化谷胱甘肽(GSH)结合到各种底物上,并具有GSH依赖性过氧化物酶功能的酶,在雄配子体发育途径的更高阶段中起到重要的作用。也有研究者认为,GST的诱导表达与生长活跃阶段的发育中的胚胎免受胁迫危害有关,与单雄生殖潜力的获得无关[28,32]。而Sánchez-Díaz等[22]则认为该基因与大麦小孢子发育程序重调阶段有关。
此外,还有一种表达合成一类被称为植物防御素或δ-硫堇蛋白的小分子富半胱氨酸蛋白家族的基因——Tad1[8],有研究认为,在各种胚胎诱导体系中,它是小孢子来源胚胎发生程序所特有的[22]。
3.5 细胞周期相关基因
对于小孢子脱分化而言,其最重要的标志就是细胞重新进入分裂周期,它几乎可以等同于脱分化本身。植物细胞分裂周期受到细胞周期蛋白依赖激酶(CDKs)和其相关基因的特异性调控以及在亚细胞结构中的定位调控,CDKs相应地受到细胞周期蛋白、CDK活化激酶和抑制激酶以及几种CDK抑制剂的调控。研究发现这些调节器中很大一部分的半衰期都受到泛素-26S蛋白酶体途径的影响,使蛋白质降解与植物细胞周期调控相联系。而在正常花粉发育过程中,细胞周期的调控是稳定进行的;小孢子细胞进行不对称分裂之后,营养细胞滞留在细胞周期的G1阶段,同时生殖细胞发展到有丝分裂并进一步分裂形成两个精细胞。通过胁迫诱导的单雄生殖能够克服营养细胞的这种发育调控性细胞周期停滞,从而使得胁迫处理时的营养细胞能够重新进入S阶段,并在此后的培养过程中进入到G2/M转化期。据此推测,泛素途径组成成分的诱发和蛋白酶基因的表达可能与小孢子胚胎诱导潜力获得期间的有丝分裂调控有关[31]。其他研究也发现,在体胚诱导的成胚潜力获得期间,蛋白酶基因在细胞分裂相关基因之前活化,这似乎能够在某种程度上证明上述推测的合理性。
此外,FBL17基因和RBR基因也可能与小孢子的脱分化有关。FBL17表达产物能够降解细胞分裂周期抑制因子KRP6和KRP7,从而激活CDKA,使DNA合成得以发生[38]。至于其能否促进小孢子的脱分化,还有待于直接的验证。另有研究发现,防止细胞过度增殖的RBR基因发生突变后,由小孢子分裂而来的营养细胞也能够进行再分裂,而通常情况下,营养细胞是停止继续分裂的[38]。故推测,RBR的表达可能会阻碍小孢子的脱分化。而能否通过认为调控使之发生表达缺少从而促进分化小孢子重新进入细胞周期,也还有待于研究。
4 研究展望
禾谷类作物小孢子脱分化是一定外界条件诱导小孢子内部生理代谢和基因表达发生改变,脱离原有分化状态之后发生发育途径改变的过程。小孢子细胞外环境的变化导致内环境的改变,主要包括营养环境和信号环境或激素环境,从而进一步诱导代谢酶活性、代谢途径以及调控基因表达的变化。因此,要对小孢子脱分化过程进行有效的人为调控,则可能需要从如下几方面入手:
(1)为细胞脱分化的发生提供适当的外部营养、激素和物理环境。因此,首先便需要对内部环境对外部环境变化的响应机制具有准确的了解,比如高温、低温、渗透胁迫以及化学药剂等如何影响禾谷类小孢子细胞内部的营养和激素代谢,它们与小孢子脱分化之间有什么联系等。
(2)促进或抑制关键功能蛋白作用和酶类的活性。在小孢子脱分化的代谢系统中,具有可调控性的关键酶可能主要是激素作用相关的酶和氧化还原系统或抗胁迫系统相关的酶。前者主要包括:乙烯合成关键酶1-氨基环丙烷-1-羧酸合成酶ACS和IAA合成关键酶黄素氮加氧酶家族YUCCA蛋白,以及与生长素运输和极性分布相关的生长素外运载体PIN蛋白和与生长素响应相关的生长素受体蛋白TIR1和ABP1;后者主要包括热激蛋白HSP和谷胱甘肽S-转移酶。对于这些关键代谢酶或功能蛋白,它们的活性或作用如何影响小孢子的脱分化过程还有待进一步的明确,同时如何对其进行人为调控从而影响细胞的脱分化也还需要更多的探索。此外,植物蛋白酶和泛素-26S蛋白酶体活性的可调控性对于小孢子脱分化研究而言可能也具有较大价值。
(3)对关键调控基因或“基因模块”进行表达调控和遗传改良。表达调控主要是对某些基因进行人为处理使之发生过量或沉默表达。在小孢子脱分化中,对花粉特异蛋白基因和细胞分裂抑制调控基因的表达进行人为干扰可能有利于脱分化的进行;特别是花粉特异蛋白基因,它的表达结果使小孢子细胞维持在分化状态,可能是通过控制细胞内环境(包括营养和信号环境)状态来控制代谢基因的表达来实现的,它就行一个“总开关”控制着下游各种与分化和脱分化相关的代谢途径和网络,而细胞分裂抑制调控基因可能就是它下游代谢支路中的另一个比较重要的“开关”,控制着细胞的分裂状况。因此对它们进行抑制表达,也许可以很好地促进小孢子的脱分化。根据系统论的观点,如果将整个脱分化代谢网络看成一个整体或“功能模块”的话,那么其下的饥饿作用代谢、内源激素代谢、氧化胁迫和抗氧化胁迫代谢等则均为组成这一整体的“部分”,它们各自也是一个“亚功能模块”或“功能单元”,因此其各自的基因调控网络也可以看成一个相对独立的“基因模块”,所以对以关键酶或蛋白的关键调控基因为重点的“基因模块”进行遗传改良可能对于小孢子脱分化的促进效果要更优于对单独某个或几个基因进行改良。因此对于这几个“功能单元”内部的代谢和调控机制进行相对独立的“点”、“线”和“面”的研究,然后再将之相互联系起来,以探讨其对小孢子脱分化的作用,则显得尤为必要。其中对抗胁迫系统和氧化还原系统的遗传改良效果较“功能单元”而言可能要相对较好。
[1] 李文泽,宋子红,景健康,等.在大麦花药—花粉培养中甘露醇预处理机理的研究[J].科学通报,1995,14(40):1344.
[2] 李文泽,胡 含.预处理在禾谷类花药—花粉培养中的应用[J].遗传,1995,17(增刊):9-12.
[3] 李文泽,胡 含.在花药花粉培养中预处理的作用机理[J].遗传,1995,17(增刊):13-18.
[4] 李文泽,胡 含.预处理过程中大麦花药蛋白质变化的研究[J].莱阳农学院学报,1995,12(1):6-10.
[5] 滕海涛,鲁守平,赵邦青,等.植物花药培养预处理及其生理生化变化规律[J].河北农业科学,2008,12 (10):46-49,59.
[6] 许智宏,Sunderland N.大麦花粉在低温预处理及培养中DNA含量的显微光度测定[J].植物学通报,1986,12(1):140-147.
[7] Zur I,Ewa D,Elzbieta G,et al.Stress-related variation in antioxidative enzymes activity and cell metabolism efficiency associated with embryogenesis induction in isolated microspore culture of triticale (×Triticosecale Wittm.)[J].Plant Cell Rep,2009,28(8):1279-1287.
[8] Zur I,Ewa D,Monika K,et al.Antioxidant activity and ROS tolerance in triticale ( Triticosecale Wittm.) anthers affect the efficiency of microspore embryogenesis[J].Plant Cell Tiss Organ Cult,2014,119:79-94.
[9] Tuteja N,Peter SL,Gill SS,et al.Salinity stress:a major constraint in crop production[A].In:Tuteja N,Gill SS,Tiburcio AF,et al.Improving Crop Resistance to Abiotic Stress[C].Weinheim:Wiley-Blackwell,2012.71-96.
[10]Varnier AL,Jacquard C,Clement C.Programmed cell death and microspore embryogenesis[A].In:Touraev A,Forster BP,Jain SM.Advances in Haploid Production in Higher Plants[C].Dortrecht:Springer,2009.147-154.
[11]Muhammad A,François E,Aakash G,et al.Organelle antioxidants improve microspore embryogenesis in wheat and triticale[J].In Vitro Cell Dev Biol Plant,2013,49:489-497.
[12]赵永钦,吴新新,李 蔚,等.禾本科牧草和草坪草雄核发育与单倍体育种研究进展[J].植物学报,2012,47:87-99.
[13]宋建成,姜丽君,王启柏,等.玉米花药培养能力的遗传分析[J].玉米科学,1997,2(4):14- 15,36.
[14]何 平,李晶昭,朱立煌.影响水稻花药培养力的数量性状基因座位间的互作[J].遗传学报,1999,26 (5):524-528.
[15]孙海鹏,路铁刚,孙敬三.大麦雄核发育的基因型效应及相关的RAPD标记[J].植物学报,2000,42 (7):736-740.
[16]孙 娜,石培春,魏凌基,等.小黑麦花药培养力的遗传模式分析[J].麦类作物学报,2009,29(3):374-379.
[17]薛勇彪,段子渊,种 康,等.面向未来的新一代生物育种技术——分子模块设计育种[J].现代农业,2013,28(3):308-314.
[18]孙敬三,朱至清,王敬驹.黑麦花药培养及其雄核发育[J].植物学报,1978,20:210-214.
[19]周 嫦,杨弘远.大麦的花药培养与雄核发育[J].植物学报,1980,22:211-215.
[22]Sánchez-Díaz RA,Castillo AM,Vallés MP.Microspore embryogenesis in wheat:new markers genes for early,middle and late stages of embryo development[J].Plant Reprod,2013,doi:10.1007/s00497-013-0225-8.
[24]何江峰,韩 冰,赵宏鑫.植物β-1,3-葡聚糖酶研究进展[J].内蒙古农业科技,2006 (5):21-25.
[25]Seguí-Simarro JM,Nuez F.How microspores transform into haploid embryos:changes associated with embryogenesis induction and microspore-derived embryogenesis[J].Physiol Plantarum,2008,134:1-12.
[26]黄 芬,何彰华,李 存,等.热激蛋白70的研究进展[J].生物技术通讯,2011,22 (6):883-886.
[27]杜晓华,黄伶俐,刘会超.植物热激蛋白70(HSP70)研究进展[J].河南科技学院学报,2014,42(3):1-5.
[28]Maraschin SF,De Priester W,Spaink HP,et al.Androgenic switch:an example of plant embryogenesis from the male gametophyte perspective[J].J Exp Bot,2005,56:1711-1726.
[29]Maraschin SF,Caspers M,Potokina E,et al.cDNA array analysis of stress-induced gene expression in barley androgenesis[J].Physiol Plant,2006,127:535-550.
[30]Harada H,Kyo M,Immamura J.Induction of embryogenesis and regulation of the developmental pathway in immature pollen of Nicotiana species[J].Current Topics in Developmental Biology,1986,20:397-408.
[31]Maraschin SF,Caspers M,Potokina E,et al.Androgenic switch inbarley microspores.II.cDNA array analysis of stress-induced gene expression in barley androgenesis[D].The Netherlands:Leiden University PhD Thesis,2005.
[32]Vrinten PL,Nakamura T,Kasha1 KJ.Characterization of cDNAs expressed in the early stages of microspore embryogenesis in barley (HordeumvulgareL)[J].Plant Molecular Biology,1999,41:455-463.
[33]邱正明.红菜薹的小孢子培养及其应用与表观遗传学初步研究[D].武汉:武汉大学博士学位论文,2010.
[34]白 波.乙烯调控的生长素合成控制体细胞胚胎发生的分子机理[D].泰安:山东农业大学博士学位论文,2013.
[35]苏英华.拟南芥体细胞胚胎发生的机理研究[D].泰安:山东农业大学博士学位论文,2008.
[36]王 燕.大白菜小孢子早期胚胎发生相关基因的表达分析[D].北京:中国农业大学博士学位论文,2014.
[37]王兴春,李 宏,王 敏,等.植物体细胞胚胎发生的调控网络[J].生物工程学报,2010,26(2):141-146
[38]黄学林.植物发育生物学[M].北京:科学出版社,2012.
欢迎订阅2017年《植物保护》杂志
《植物保护》创刊于1963年,是由中国科协主管,中国植物保护学会和中国农业科学院植物保护研究所主办的学术类刊物。全国中文核心期刊、中国科技核心期刊、RCCSE中国核心学术期刊、中国农业核心期刊,已被中国科学引文数据库(CSCD)、中国知网、万方、维普、龙源期刊网、超星等各大数据库收录。
报道内容:有关植物病理、农林业昆虫、杂草及鼠害等农作物有害生物、植物检疫、农药等植物保护各学科原创研究性论文和具有创新性、实用性技术成果文章。
读者对象:农林业科研院所研究人员、高等院校相关专业教师及研究生、各级植保科技人员、农药研究与生产人员、植物医生、农技干部等。
发行订阅:双月刊,大16开,铜版纸印刷,200页,35元/期,210元/年。国内邮发代号 2-483,全国各地邮局均可订阅。直接在本刊编辑部订阅,全年189元,若需挂号,每期另加3元。
联系方式:北京市海淀区圆明园西路2号中国农科院植保所《植物保护》编辑部,邮编 100193;电话:010-62819059(兼传真);Email:zwbh1963@263.net;网址:http://www.plantprotection.ac.cn。
Physiology and Biochemical Mechanism of Microspore Dedifferentiation in Cereal Crops
DAI Li,WANG Xuehua*
(College of Agronomy,Hunan Agriculture University,Changsha,Hunan 410128,China)
Microspore dedifferentiation of cereal crops is a process that with the changing of the extracellular environment,the intracellular environment altered,thus inducing the activity of metabolic enzymes,the metabolic pathway and the regulator gene expression to change,finally breaking away from the original state of differentiation and altering developmental way.After various stress pretreatments,a series of physiological events occurred in the isolated microspores,such as starvation effect,endogenous hormone changes,antioxidant stress,which made the structure and information of the normal development destroyed or elimilated,the cytoplasm restructured,and the division of the vegetative nucleus derepressed,and ultimately realizes the dedifferentiation.This process involves complex physiological and genetic regulation,and in which have many key enzymes and genes which have great effects in the microspore dedifferentiation,for example,the protein hydrolases,ethylene and auxin role related enzymes,oxidation-reduction system or anti-stress system related enzymes,pollen specific proteins,cell division related proteins,and their regulator genes.And making some artificial regulation to them may be able to promote the microspore dedifferentiation and embryo induction in cereal crops effectually.
cereal crops;microspore;dedifferentiation;physiology mechanism;genetic model;biochemical mechanism
2016-05-17
戴 力(1992-),男,硕士研究生,Email:14789935821@163.com。*通信作者:王学华,教授,博士生导师,从事作物栽培与耕作学研究,Email:13873160151@163.com。
国家科技支撑计划(2013BAD07B11)。
Q943.1
A
1001-5280(2016)05-0585-09
10.16848/j.cnki.issn.1001-5280.2016.05.24
