基于线粒体DNA D-loop的都柳江鲇形目两种经济鱼类种群遗传多样性研究
2016-12-19代应贵袁振兴孙际佳
刘 伟,代应贵,袁振兴,孙际佳,刘 丽
( 1. 贵州大学 动物科学学院,贵州 贵阳 550025; 2. 贵州大学 特种水产研究所,贵州 贵阳 550025;3. 华南农业大学 动物科学学院,广东 广州 510642 )
基于线粒体DNA D-loop的都柳江鲇形目两种经济鱼类种群遗传多样性研究
刘 伟1,2,代应贵1,2,袁振兴1,2,孙际佳3,刘 丽3
( 1. 贵州大学 动物科学学院,贵州 贵阳 550025; 2. 贵州大学 特种水产研究所,贵州 贵阳 550025;3. 华南农业大学 动物科学学院,广东 广州 510642 )
以采自贵州都柳江的鲇鱼、斑鳠各39尾个体为样品,采用PCR和DNA测序技术,研究了这两种鱼类线粒体DNA D-loop的结构和种群遗传多样性。获得了鲇鱼、斑鳠D-loop 5′端长度分别为544~545 bp、546~547 bp的DNA序列,并分别检测到58、15个变异位点。同时,识别了该2种鱼类D-loop终止序列区和中央保守区的核心序列,在中央保守区之后均有一个Poly-T结构。都柳江鲇鱼、斑鳠种群D-loop序列中,分别有51、12个多态位点,并分别定义了11、8种单倍型。都柳江鲇鱼、斑鳠种群单倍型多样性指数、核苷酸多样性指数和平均核苷酸差异数分别为 0.772、0.02301、12.451和0.331、0.00131、0.714。目前,都柳江鲇鱼种群遗传多样性较为丰富,具有良好的种质价值和保护前景; 斑鳠种群遗传多样性贫乏,保护和恢复该种群的数量和遗传多样性刻不容缓。
都柳江;鲇鱼;斑鳠;D-loop;遗传多样性
都柳江属珠江水系,发源于贵州独山县,流经贵州境内三都县、榕江县和从江县,全长360 km,为柳江的源流河段[1]。鲇鱼(Silurusasotus)、斑鳠(Mystusguttatus)分别隶属于鲇形目鲇科、鲿科,其中鲇鱼广泛分布于我国各大水系(除青藏高原及新疆外),斑鳠分布于珠江、元江及钱塘江等水系[2]。这两种鱼类均为我国重要淡水经济鱼类,深受当地消费者喜爱[2-3]。近年来,由于过度的捕捞、坏境污染等因素的影响,这两种鱼类野生资源遭到了一定程度的破坏。为了更好地保护和利用其资源,开展这两种鱼类种群遗传多样性研究具有重要意义。近年来,已有国内学者分别采用RAPD[4]、Cyt b基因[5]、微卫星DNA[6]等分子标记研究了鲇鱼不同种群的遗传多样性。有关斑鳠种群遗传多样的研究报道甚少,仅见陈赛等[7]利用同工酶标记对珠江水系西江斑鳠种群遗传多样性的研究。迄今为止,尚无贵州都柳江鲇鱼、斑鳠种群遗传多样性的研究报道。
在进行物种遗传分化及遗传多样性研究时,DNA序列分析比其他分子标记如RELP、RAPD等更为直接和可靠[8]。线粒体DNA因其具有分子小、结构简单、多态性高及母系遗传等特点而常被用作遗传多样性研究的分子标记[9]。线粒体DNA D-loop,又称线粒体DNA控制区,是mtDNA的非编码区,不受自然选择压力的影响,具有较高的突变积累,适用于进行种内、种群或个体间遗传多样性的研究[10]。本文拟对贵州境内都柳江鲇鱼、斑鳠种群mtDNA D-loop序列进行测序分析,研究该序列的结构特征和种群遗传多样性,以期为开展都柳江鲇形目这两种经济鱼类种质资源的利用及保护提供科学依据。
1 材料与方法
1.1 试验材料
试验所用鲇鱼、斑鳠各39尾鲜活个体,于2014年8月至10月,分别采自贵州都柳江干流上、中、下游的独山、三都、榕江、从江。每尾活鱼取肌肉3~5 g用乙醇固定,带回实验室后于冰箱-20 ℃保存,备用。
1.2 DNA模板制备
基因组DNA的提取采用北京天根生化科技有限公司提供的DNA提取试剂盒,并参照其提供的方法提取DNA,用1%的琼脂糖凝胶电泳检测所提取DNA的质量和纯度,于冰箱-20 ℃储存、备用。
1.3 D-loop PCR扩增及序列测定
扩增鲇鱼、斑鳠D-loop的引物由上海生物工程有限公司合成,引物序列分别为:D-loop-F: 5′-ACCCCTGGCTCCCAAAGC-3′ 和D-loop-R: 5′-ATCTTAGCATCTTCAGTG-3′[11-12]。
1.4 数据处理
对测得序列进行Blastn在线同源性检测,确定序列的边界及长度,并用SeqMan软件进行比对,辅以人工校对。采用DnsSP(version 5.10)软件计算遗传多样性参数。用MEGA 5.0软件统计序列的碱基含量并用Kimura双参数法计算遗传距离。分别以GenBank中大口鲇(S.meridionalis)mtDNA D-loop同源序列(登录号:NC_014866.1)、大鳍鳠(M.macropterus)mtDNA D-loop同源序列(登录号:NC_019592.1)作为外类群,构建都柳江鲇鱼、斑鳠种群的邻接系统树。采用刘焕章等[13-15]的方法进行鲇鱼、斑鳠D-loop的结构分析。
2 结 果
2.1 都柳江鲇鱼、斑鳠种群的mtDNA D-loop序列碱基组成及多态性
PCR扩增产物经单向测序,再去除所获序列测序峰图中两端波峰混乱的序列后,得到了都柳江鲇鱼、斑鳠各39尾个体mtDNA D-loop 5′端长度分别为544~545 bp、546~547 bp 的DNA序列,用于其各自种群遗传多样性的研究。结果显示,都柳江鲇鱼、斑鳠种群D-loop序列碱基组成相似,且均表现为A+T占碱基总数的比例显著高于G+C的比例,并均以A所占比例最高、以G所占比例最低,具有明显的碱基偏倚性(表1)。同时,该两个种群所获D-loop序列末端均有一个poly-T结构。

表1 都柳江鲇鱼、斑鳠种群mtDNA D-loop碱基组成(n=39) %
都柳江鲇鱼种群39尾个体mtDNA D-loop序列长度为544~545 bp,有变异位点58个,变异位点数占分析序列长度的10.64%~10.66%(表2)。其中,有51个简约信息位点(含2个简约信息位点同时存在缺失:206 nt位点为T→C转换同时存在缺失T,536 nt位点为A→T颠换同时存在缺失A)、2个单一变异位点、4个插入位点(135 nt、213 nt、246 nt位点插入A,202 nt位点插入C)和3个缺失位点(177 nt位点缺失A,206 nt位点缺失T,536 nt位点缺失A)。可见,该序列共有51个多态位点。同时,该序列含有47个转换位点和7个颠换位点, 其中1 个位点同时存在转换与颠换(244 nt,简约信息位点:C→T、C→A),平均转颠换比为6.71。
都柳江斑鳠种群39个个体mtDNA D-loop基因序列长度为546~547 bp,共有15个变异位点,变异位点数占分析序列长度的2.74%~2.75%(表3)。其中含1个简约信息位点、11个单一变异位点、2个插入位点(20 nt位点插入A、44 nt位点插入T)和1个缺失位点(52 nt位点缺失C),共有12个多态位点。该序列含有11个转换位点和2个颠换位点,其中一个位点同时存在转换和颠换(111 nt,单一变异位点:G→A、G→C),平均转颠换比约为5.5。
不计插入或缺失位点,都柳江鲇鱼、斑鳠种群分别定义了11、8个单倍型(表2、3)。在鲇鱼种群11个单倍型中,单倍型1 (Hap_1) 个体数最多、达18个,为优势单倍型。在斑鳠种群8个单倍型中,单倍型2 (Hap_2)占个体数最多、达31个,其余单倍型均为一个个体。

表2 都柳江鲇鱼种群mtDNA D-loop的多态位点及单倍型
注: 圆点(.)表示与 Hap_1 相同的碱基.表3同.
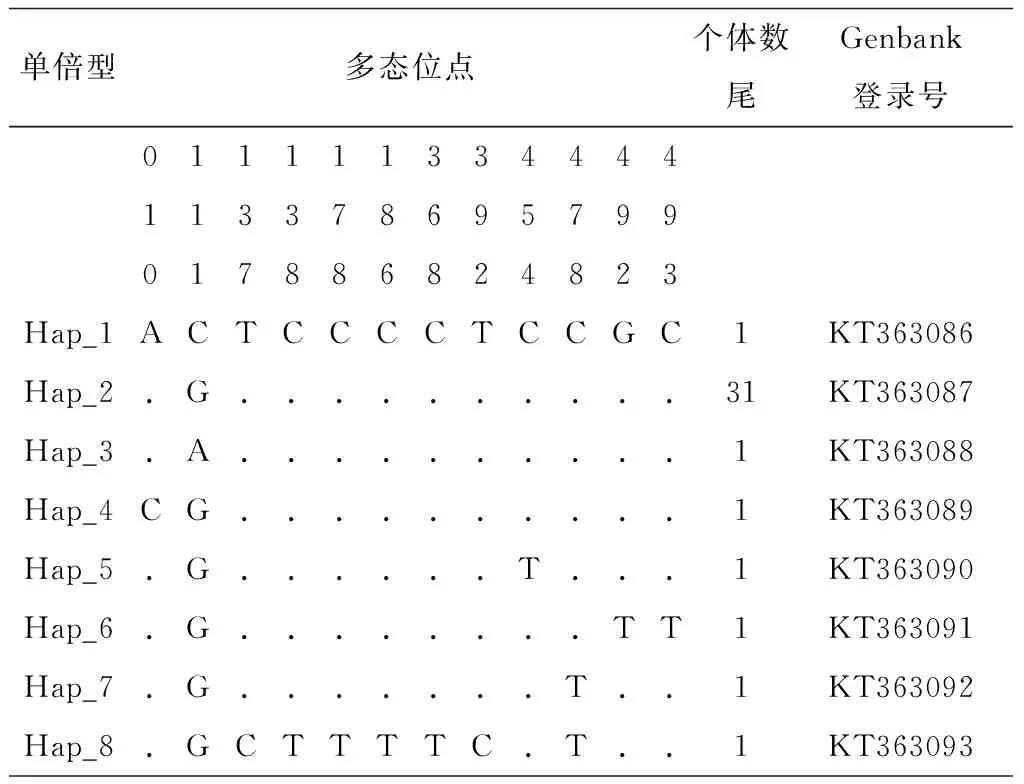
表3 都柳江斑鳠种群mtDNA D-loop的多态位点及单倍型
2.2 都柳江鲇鱼、斑鳠mtDNA D-loop的结构
采用刘焕章等[13-15]的方法,识别了都柳江鲇鱼、斑鳠D-loop终止序列区和中央保守区,但未能识别保守序列区。
2.2.1 鲇鱼mtDNA D-loop的结构
在都柳江鲇鱼种群mtDNA D-loop序列中,识别了终止序列区2个终止相关序列,分别为ETAS1(TACATAATATGCATAA-CTGG,“-”表示发生变异的碱基,下同)和ETAS2(-ACATATTATGTATAATAT)(图1)。在终止序列区共有7个核心序列(TACAT)和1个与核心序列互补的序列(ATGTA)。终止序列区长度为250~251 bp,含有38个变异位点,变异率为15.14%~15.20%。同时,还识别了中央保守区的CSB-F、CSB-E、CSB-D等核心序列,分别为ATGTTTAGTAGTGAGAGACCATCAACC、TCAGGGACAAAACTTGTGGGGGT、TATTACTGGCATC
TGGTTCCTATTTCA,其中CSB-E包含GTGGG-box。中央保守区序列长251~252 bp,含17个变异位点,变异率为6.75%~6.77%。在CSB-D后有一个poly-T结构(TATTTTTTTTTTT)。
2.2.2 斑鳠mtDNA D-loop的结构
在都柳江斑鳠mtDNA D-loop序列中,识别了终止序列区(ETAS)1个终止相关序列:TACATAATATGTATAATAT(图2)。在终止序列区,有6个核心序列(TACAT)和1个与其反向互补的序列(ATGTA)。终止序列区长232~233 bp,共有9个变异位点,变异率3.86%~3.88%。此外,还识别了中央保守区3个核心序列,即CSB-F(ATGTAGTAAGAAACCAGCAACCCTCAATA)、CSB-E(TCAGGGACAA-AATTGTGAGGGTT)、CSB-D(TATTACTGGCATCTGGTTCCTAT)。中央保守区序列长度为252 bp,含有6个变异位点,变异率2.38%。在CSB-D后也存在一个poly-T结构(TATTTTTTTTTTTT)。

图1 都柳江鲇鱼mtDNA D-loop部分序列

图2 都柳江斑鳠mtDNA D-loop部分序列
2.3 都柳江鲇鱼、斑鳠种群的遗传多样性及种群遗传结构
用DnaSP 5.10软件对都柳江鲇鱼、斑鳠种群mtDNA D-loop的遗传多样性进行了分析。结果表明,鲇鱼种群各项遗传多样性指数均明显高于斑鳠种群(表4)。

表4 都柳江鲇鱼、斑鳠种群mtDNA遗传多样性指数
应用MEGA 5.0 软件的Kimura 双参数模型计算都柳江鲇鱼、斑鳠种群单倍型之间的遗传距离。结果显示,鲇鱼种群11个单倍型之间的遗传距离为0.0019~0.0837,平均遗传距离为0.0343;斑鳠种群8个单倍型之间的遗传距离为0.0018~0.0167,平均遗传距离为0.0063。可见,鲇鱼种群单倍型之间的平均遗传距离明显大于斑鳠种群。
构建的邻接系统树表明,鲇鱼11个单倍型聚为两分支(Gp1和Gp2),其中Gp1包括9个单倍型,置信值为99,代表34个个体,为优势分支;Gp2包括2个单倍型,代表5个个体,该分支置信值高达100(图3)。2个分支间平均遗传距离为0.0745。斑鳠8个单倍型分为两支,其中一支由7个单倍型组成,代表38个个体,置信值为82;另一支仅1个单倍型Hap_8,代表一个个体(图4)。
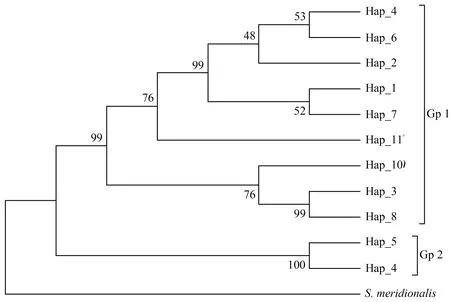
图3 基于都柳江鲇鱼种群mtDNA单倍型间遗传距离构建的邻接系统树注:分支处的数字为Bootstrap值,重复次数为1000次;Hap_1~Hap_11代表不同的单倍型.

图4 基于都柳江斑鳠种群mtDNA单倍型间遗传距离构建的邻接系统树注:分支处的数字为Bootstrap值,重复次数为1000次;Hap_1~Hap_8代表不同的单倍型.
3 讨 论
3.1 都柳江鲇鱼、斑鳠种群mtDNA D-loop的序列变异
线粒体DNA D-loop区为非编码区,不受自然选择压力的影响,存在较多的突变如碱基替换、缺失、插入及串联重复等,是mtDNA中变异最多的区域[16]。本研究测定了都柳江鲇鱼种群、斑鳠种群mtDNA D-loop部分序列,分别存在58、15个变异位点,变异类型包括碱基替换、插入和缺失,并存在同一位点同时发生转换和颠换、缺失和转换或缺失和颠换的现象。都柳江鲇鱼、斑鳠种群D-loop碱基转颠换比值分别为6.71、5.5,转换频率均大于颠换频率,这与脊椎动物DNA中发生转换的频率通常高于颠换的规律[17]相符。
3.2 都柳江鲇鱼、斑鳠mtDNA D-loop的结构
鱼类mtDNA D-loop区结构较为复杂,一般可分为3个区域:终止序列区、中央保守区和保守序列区[14]。本研究识别了都柳江鲇鱼、斑鳠种群D-loop的终止序列区和中央保守区的3个核心序列(CSB-F、CSB-E、CSB-D)。与GenBank中鲇鱼(登录号:JX256247.1)、斑鳠(登录号:NC_023976.1)mtDNA D-loop全序列的比对表明,本研究中鲇鱼、斑鳠D-loop保守序列均应在其各自所获序列末端poly-T结构之后而已被去除,因而未能识别出其各自的保守序列。
都柳江鲇鱼、斑鳠种群D-loop终止序列区碱基变异率均高于其各自中央保守区的碱基变异率,可见终止序列区表现了较高的变异性。此外,本研究还识别了都柳江鲇鱼种群D-loop终止序列区的2个终止相关序列——ETAS1、ETAS2。同样,朱世华等[15, 18]在鲹科鱼类和斑点叉尾(Ictaluruspunctatus)控制区中也发现了2个ETAS序列。当鱼类mtDNA D-loop中存在多个终止相关序列时,刘焕章等[13]认为其中只有1个ETAS可行使功能,而其他ETAS只是复制的结果,不行使功能。都柳江斑鳠种群D-loop仅识别了1个ETAS,其核心识别序列与鳑鲏亚科鱼类[13]、鲿科鱼类[14]略有不同,与同属的大鳍鳠[19]则差异较大。此外,还识别了鲇鱼、斑鳠中央保守区3个核心序列(CSB-F、CSB-E、CSB-D)。其中,除鲇鱼的CSB-F与鲿科鱼类差异较大外,其他核心序列则与鲿科鱼类基本一致[13]。本研究中,在鲇鱼、斑鳠D-loop区CSB-D后均存在一个poly-T结构(TATTTTTTTTTTT),在中国野生香鱼(Plecoglossusaltivelis)[20]、大鳍鳠[21]和大口(Psettodeserumel)[22]中也发现了类似的结构,其功能尚不清楚,还有待研究。
3.3 都柳江鲇鱼、斑鳠种群的遗传多样性
本研究基于mtDNA D-loop序列,选取多态位点数、单倍型数、单倍型多样性指数、核苷酸多样性指数和平均核苷酸差异数等5个参数研究了都柳江鲇鱼、斑鳠种群的遗传多样性。其中,单倍型多样性指数和核苷酸多样性指数是衡量一个种群遗传多样性高低的2个重要指标。由于核苷酸多样性指数考虑了各单倍型在群体中所占的比例,因而较单倍型多样性指数更为可靠[23]。本研究测定了都柳江鲇鱼、斑鳠各39个个体mtDNA的D-loop序列,分别定义了11和8个单倍型。都柳江鲇鱼种群单倍型多样性指数、核苷酸多样性指数分别为0.772、0.02301,而斑鳠种群单倍型多样性指数、核苷酸多样性指数分别为0.331、0.00131。可见,都柳江鲇鱼种群遗传多样性高于斑鳠种群。
都柳江鲇鱼种群单倍型多样性指数略低于长江水系、珠江水系和黑龙江水系8个草鱼(Ctenopharyngodonidella)野生群体[24]、长江中游5个青鱼(Mylopharyngodonpiceus)群体[25]、长江中游湖泊黄颡鱼(Pelteobagrusfulvidraco)群体[26],但其核苷酸多样性指数均高于上述3种鱼类群体。而都柳江斑鳠种群单倍型多样性指数、核苷酸多样性指数均低于上述3种鱼类群体。此外,都柳江鲇鱼种群单倍型多样性指数、核苷酸多样性指数均显著高于同分布于都柳江的易危鱼类小口白甲鱼(Onychostomalini)种群[27],而都柳江斑鳠种群单倍型多样性指数略高于都柳江小口白甲鱼种群但核苷酸多样性指数则低于都柳江小口白甲鱼种群。因此,目前都柳江鲇鱼种群尚保存着较丰富的遗传多样性,而斑鳠种群遗传多样性则较为贫乏。鲇鱼、斑鳠均为我国的名优淡水经济鱼类,其中鲇鱼还为我国重要的养殖鱼类,斑鳠为极具驯养开发价值的野生鱼类。都柳江鲇鱼种群较高的遗传多样性,表明该种群具有良好的种质价值和较好的保护前景。都柳江斑鳠种群目前遗传多样性贫乏,保护和恢复该种群的数量和遗传多样性刻不容缓。
Grant等[28]认为,可以根据种群单倍型多样性指数和核苷酸多样性指数值推测该种群的历史,即单倍型多样性指数和核苷酸多样性指数较高的种群可能由一个大而稳定的种群经过长时间演化所产生或由两个不同系群的种群二次接触所形成,而单倍型多样性指数和核苷酸多样性指数较低的种群最近可能发生了瓶颈效应或奠基者效应。都柳江鲇鱼种群较高的单倍型多样性指数和核苷酸多样性指数,这表明该种群可能源于大而稳定的种群并且目前仍维持着较高的遗传多样性。斑鳠为西江“四大名鱼”之一[3],经济价值高,近年来因过度捕捞导致其种群数量急剧减少,进而降低了都柳江斑鳠种群单倍型多样性指数和核苷酸多样性指数,推测该种群近期可能发生了瓶颈效应。
[1] 伍律. 贵州鱼类志[M]. 贵阳: 贵州人民出版社,1989.
[2] 褚新洛,郑葆珊,戴定远,等. 中国动物志: 硬骨鱼纲鲇形目[M]. 北京:科学出版社,1999:77-87.
[3] 吴小明,周立斌,彭飞影. 斑鳠的含肉率及肌肉营养成分分析[J]. 水产科学,2010,29(7):425-428.
[4] 王朝明,邹桂伟,郑蓓蓓,等. 三种鲇遗传多样性的RAPD分析[J]. 淡水渔业,2005,35(4):14-17.
[5] 肖明松,崔峰,康健,等. 淮河野生鲇鱼线粒体cyt b基因的序列变异与遗传结构分析[J]. 动物学杂志,2013,48(1):75-86.
[6] 徐丹丹. 基于微卫星标记和线粒体cyt b基因序列的鲇遗传多样性研究[D]. 重庆:西南大学,2013.
[7] 陈赛,焦宗垚,朱新平,等. 西江野生斑鳠乳酸脱氢酶和酯酶同工酶的电泳研究[J]. 湛江海洋大学学报:自然科学版,2006,26(6):58-62.
[8] Buonnacorsi V P, Mcdowell J R, Graves J E. Reconciling patterns of interocean molecular variance from four classes of molecular markers in blue marlin (Makairanigricans) [J]. Mol Eco,2001,10(5):1179-1196.
[9] 郭新红,刘少军,刘巧,等. 鱼类线粒体DNA研究新进展[J]. 遗传学报,2004,31(9):983-1000.
[10] Thacker C E. Molecular phylogeny of the gobioid fishes (Teleostei:Perciformes:Gobioidei)[J]. Mol Phyl Evol,2003,26(3):354-368.
[11] Zeng Q,Wang Z,Peng Z. Mitochondrial genome ofSilurusasotus(Teleostei:Siluriformes)[J]. Mitochondrial DNA, 2011,22(5/6):162-164.
[12] Tian H,Que Y,Zhao N,et al. The complete mitochondrial genome of the spotted longbarbel catfish,Hemibagrusguttatus(Siluriformes, Bagridae)[J]. Mitochondrial DNA, 2016,27(1):467-468.
[13] 刘焕章. 鱼类线粒体控制区的结构和进化:以鳑鲏鱼类为例[J]. 自然科学进展,2002,12(3):266-270.
[14] 张燕,张鹗,何舜平. 中国鲿科鱼类线粒体DNA 控制区结构及其系统发育分析[J]. 水生生物学报,2003,27(5):463-467.
[15] 朱世华,郑文娟,邹记兴,等. 鲹科鱼类线粒体DNA控制区结构及系统发育关系[J]. 动物学研究,2007,28(6):606-614.
[16] Xiao Y S, Zhang Y, Gao T X, et al. Genetic diversity in the mtDNA control region and population structure in the small yellow croakerLarimichthyspolyactis[J]. African Journal of Biotechnology, 2009,85(4):303-314.
[17] Loftus R T, Machugh D E, Bradley D G, et al. Evidence for two independent domestications of cattle[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(7):2575-2761.
[18] 秦钦,许志强,边文冀,等. 斑点叉尾线粒体DNA控制区结构和群体遗传多样性分析[J].淡水渔业,2011,41(4):50-54.
[19] 魏刚,周丽,曾令江,等. 大鳍鳠线粒体控制区结构及其比较分析[J]. 西南大学学报:自然科学版,2015,37(1):46-52.
[20] 乐小亮. 中国野生香鱼遗传多样性分析[D]. 广州:暨南大学,2010.
[21] 周丽. 大鳍鳠遗传多样性及其线粒体控制区结构的研究[D]. 重庆:西南大学,2008.
[22] 张艳春,孔晓瑜,王忠明. 大口鳒线粒体DNA控制区结构和鲽形目鱼类的系统进化初步研究[J]. 热带海洋学报,2010,29(6):71-78.
[23] Zhou H,Li D Q,Zhang Y G,et al. Study on mitochondrial DNA genetic diversity of Tibetan antelope[J]. Yi Chuan,2006,28(3):299-305.
[24] 傅建军,王荣泉,沈玉帮,等. 我国草鱼野生群体D-Loop序列遗传变异分析[J]. 水生生物学报,2015,39(2):349-357.
[25] 杨宗英,汪登强,陈大庆,等. 基于mtDNA序列分析青鱼群体遗传结构[J]. 淡水渔业,2015,45(2):3-7.
[26] 刘朋朋,钟立强,潘建林,等. 基于线粒体DNA D-loop分析黄颡鱼五个淡水湖泊群体的遗传多样性[J]. 海洋与湖沼,2013,44(3):728-733.
[27] 代应贵,韩雪,张晓杰. 小口白甲鱼都柳江种群mtDNA D环的序列变异及遗传多样性[J].动物学杂志,2010,45(2):115-120.
[28] Grant W S,Bowen B W. Shallow population histories in deep evolutionary lineages of marine fishes: insights from sardines and anchovies and lessons for conservation[J]. The Journal of Heredity,1998,89(5):415-426.
GeneticDiversityof2EconomicallyImportantFishesinSiluriformesfromDuliuRiverBasedonmtDNAD-loopSequences
LIU Wei1, 2, DAI Yinggui1, 2, YUAN Zhenxing1, 2,SUN Jijia3, LIU Li3
( 1. College of Animal Sciences, Guizhou University, Guiyang 550025, China;2. Special Fisheries Research Institute, Guizhou University, Guiyang 550025,China;3. College of Animal Sciences, Agricultural University of South China, Guangzhou 510642, China )
The composition of mtDNA D-loop and genetic diversity were studied in 39 individuals of catfishesSilurusasotusandMystusguttatuscollected in the Guizhou section of Duliu River by the methods of PCR and DNA sequencing on the basis of sequences of mtDNA D-loop.There were 544—545 bp and 546—547 bp of D-loop sequences near the 5′ end of D-loop, including 58 variable loci inS.asotusand 15 variable loci inM.guttatus. The characteristic sequences were identified in the extended termination associated sequence and the central conserved domain and a poly-T next to the 3′ end of central conserved domain in the D-loop sequence in each of the two species.There were 51 and 12 polymorphic loci and 11 and 8 haplotypes in the populations ofS.asotusandM.guttatus, respectively.S.Asotushad haploidtype diversity of 0.772,nucleotide diversity of 0.02301,and average nucleotide differences of 12.451, andM.guttatushad haploidtype diversity of 0.331,nucleotide diversity of 0.00131,and verage nucleotide differences of 0.714 .The population ofS.asotusfrom the Duliu River showed abundant genetic diversity,good germplasm value and protection outlook. While the population ofM.guttatushad much low genetic diversity in the Duliu River. Therefore,it is urgent to protect and recover the genetic diversity ofM.guttatuspopulation from the Duliu River.
Duliu River;Silurusasotus;Mystusguttatus; D-loop; genetic diversity
S917
A
1003-1111(2016)04-0386-07
10.16378/j.cnki.1003-1111.2016.04.013
2015-09-11;
2016-01-12.
国家公益性行业(农业)科研专项(201303048);贵州省留学人员科技活动项目[黔人项目资助合同(2013)10].
刘伟(1992—),男,硕士研究生;研究方向:水产动物遗传育种与种质资源学.E-mail: 892913900@qq.com.通讯作者:代应贵(1968—),男,教授;研究方向:鱼类学、渔业资源与环境.E-mail: daiygui@163.com.
