凡纳滨对虾过氧化氢酶基因单核苷酸多态性及其与耐低溶氧性状的相关性
2016-12-17陈晓敏刘建勇张嘉晨袁瑞鹏钱佳慧
陈晓敏,刘建勇,张嘉晨,袁瑞鹏,钱佳慧
(广东海洋大学水产学院,广东 湛江 524025)
凡纳滨对虾过氧化氢酶基因单核苷酸多态性及其与耐低溶氧性状的相关性
陈晓敏,刘建勇,张嘉晨,袁瑞鹏,钱佳慧
(广东海洋大学水产学院,广东 湛江 524025)
采用直接测序法研究凡纳滨对虾(Litopenaeus vannamei) 过氧化氢酶(CAT)基因的单核苷酸多态性(SNP),并分析得到的基因型与凡纳滨对虾低溶氧耐受性状的关联性,寻找与凡纳滨对虾耐低溶氧性状相关的SNP标记。结果显示:在CAT基因外显子1第155碱基处发现1个SNP位点,为A→G颠换,表现为同义突变。在凡纳滨对虾群体中该位点等位基因A和G的频率分别为0.146和0.854,多态信息含量PⅠC值为0.218,属于低度多态性,群体在该基因座上符合哈温(Hardy-Weinberg)平衡(P>0.05)。关联分析表明,CAT基因SNP位点不同基因型与低溶氧耐受性状关联性有统计学意义(χ2=9.277,P=0.002),其中AG 型在应激耐受组中占优势地位(52.17%)。CAT基因多态性与凡纳滨对虾低溶氧耐受性相关,可作为影响凡纳滨对虾耐低溶氧性状的候选基因,为凡纳滨对虾选育提供分子遗传标记。
凡纳滨对虾;过氧化氢酶基因;单核苷酸多态性;耐低溶氧性状
凡纳滨对虾(Litopenaeus vannamei)也称南美白对虾,隶属于甲壳纲(Crustacea),十足目(Decapoda),对虾科(Penaeidae),滨对虾属(Litopenaeus),为广温广盐性热带虾类[1]。凡纳滨对虾有生长速度快、抗病能力强、适应高密度养殖等优点,是我国主要的对虾养殖对象[2]。近年来,凡纳滨对虾高密度养殖模式得到广泛推广;然而,因受季节性温度、盐度变化、水体生物呼吸代谢、有机物分解腐烂等影响,高密度养殖水体溶解氧(DO)降低,极易出现缺氧现象[3-5],进而影响对虾消化力、免疫力,易出现对细菌和病毒的敏感性高、生长缓慢、死亡率高等现象[6-7]。因此,利用遗传育种技术培育耐低溶氧的凡纳滨对虾新品种尤为重要。
动物遗传育种时可通过在动物功能基因中寻找一些可靠而有效的遗传标记来提高育种效率,对动物功能基因多态性的研究不仅有助于了解功能基因的作用机制,还可获得与经济性状相关联的分子遗传标记,运用于后续的遗传育种实践[8-9]。单核苷酸多态性(Single nucleotide polymorphisms,SNP)是指基因组序列中某一位置上碱基的变异,包括转换、颠换、插入、缺失等,可发生在DNA任意位置上[10]。与以扩增片段长度多态性(AFLP)为代表的第1代分子标记和以简单重复序列(SSR)为代表的第 2代分子标记相比,SNP作为第3代分子标记,具有数量巨大、分布广泛、遗传稳定性高、适用于大样本量检测分析、与基因功能相关等诸多优点,在分子标记辅助育种中应用更为广泛[11]。而分子标记辅助育种工作的前提是获得与经济性状相关基因的SNP位点[10,12]。在凡纳滨对虾分子标记辅助育种的研究中,不少学者利用SNP分子标记技术筛查到重要功能基因的SNPs。彭敏等[13]研究了2个不同品种凡纳滨对虾AMY基因的SNPs,共发现9个SNP位点。马宁等[14]在凡纳滨对虾组织蛋白酶 (CTSL) 基因多态性研究中,共筛选出20个SNP位点。Zeng等[15]研究了凡纳滨对虾Hsp70基因SNPs与抗病毒特性的相关性,发现Hsp70基因不同基因型对凡纳滨对虾的抗病性有显著影响。以上研究多集中于凡纳滨对虾生长、抗病等相关基因的多态性,未见与凡纳滨对虾耐低溶氧性状相关基因SNPs的研究报道。
过氧化氢酶 (Catalase,CAT) 在动物抗氧化防御中起关键作用,不仅可催化H2O2生成水和氧气,参与细胞内活性氧代谢,还可增强吞噬细胞的防御能力以及机体的免疫功能,并有效抑制脂质的过氧化作用,保护机体免受损害[16]。笔者采用直接测序法研究凡纳滨对虾低溶氧敏感组和耐受组CAT基因的多态性,旨在寻找与凡纳滨对虾耐低溶氧性状相关的SNPs,为凡纳滨对虾遗传育种提供分子依据。
1 材料与方法
1.1 材料
实验用对虾为广东海洋大学海洋生物研究基地养殖的第4代凡纳滨对虾,运至实验室暂养7 d以适应环境。耐低氧实验在注入60 L经沉淀、消毒自然海水的玻璃纤维桶中进行。随机挑取规格[体质量 (11.5±0.92) g ]、活力相同的对虾48尾,分别设计2个平行组,每组对虾24尾。因预实验得对虾低溶氧胁迫96 h的半致死浓度为0.9mg/L,将海水DO控制在0.80~1.00mg/L,每2 h测1次DO,每6 h统计凡纳滨对虾死亡数,直至胁迫96 h。将经 96 h低溶氧胁迫实验后死亡虾归入低溶氧应激敏感组,存活虾归入低溶氧应激耐受组,其中应激敏感组对虾为25尾,应激耐受组对虾为23尾。
1.2 基因组DNA提取
依动物基因组DNA抽提试剂盒说明书(上海生工生物公司)提取对虾基因组DNA,用10mg/mL琼脂糖凝胶电泳检测提取结果,用核酸定量仪测定DNA浓度和纯度,于–
20
℃条件下保存备用。
1.3 CAT基因的PCR扩增
利用Primer premier 5.0软件根据GenBank中凡纳滨对虾CAT基因序列(登录号JX162772.1)设计特异性引物(CAT-F:CCCGATAACCTGACC ACG;CAT-R:TTCCCAATCTCACTGAACAAAG),进行PCR扩增,扩增片段长度为530 bp。反应体系:10×PCR Buffer (Mg2+Plus) 5μL,dNTPs(2.5 mmol/L)5μL,上、下游引物 (10 μmol/L 各4μL,Taq酶 (TaKaRa公司) 0.5 u,基因组DNA模板2μL,补双蒸水至总体积为 50μL。扩增程序:95℃ 5min;95℃ 30 s,59℃ 30 s,72℃ 1min,40个循环;72℃ 10min;4℃下保存。
1.4 SNP位点的筛选
随机挑取低溶氧应激敏感组和应激耐受组各6尾凡纳滨对虾的基因组DNA作为模板进行PCR扩增,PCR产物经琼脂糖凝胶电泳检测后,送往上海生工生物公司进行双向测序。利用 DNAMan软件对测序结果进行序列比对,筛选CAT基因的SNP位点。筛查到SNP位点后,扩增其余36尾凡纳滨对虾基因组DNA,测产物序列。通过Chromas软件查看测序图谱,通过人工校对判断每尾凡纳滨对虾SNP位点的基因型,统计低溶氧应激敏感组与耐受组基因型和等位基因的个体数。
1.5 数据统计分析
1.5.1 遗传多样性计算 运用POPGENE 32软件计算SNP位点的基因型和等位基因频率、预期杂合度He、观测杂合度Ho、有效等位基因数Ne及Hardy-Weinberg平衡性等遗传参数。
1.5.2 多态信息含量 按照 Botetein[17]的计算公式估计SNP位点多态信息含量。其中,当PⅠC≤0.25时为低度多态;当0.25<PⅠC<0.5为时中度多态;当PⅠC≥0.5时为高度多态。
1.5.3 与耐低溶氧性状相关分析 利用 SPSS 19.0软件的χ2检验分析SNP位点的基因型与低溶氧耐受性之间的相关性,P<0.05为显著差异。
2 结果与分析
2.1 凡纳滨对虾CAT基因PCR扩增结果
PCR扩增得约520 bp的特异性条带,与原设计引物片段长度相符(图1)。
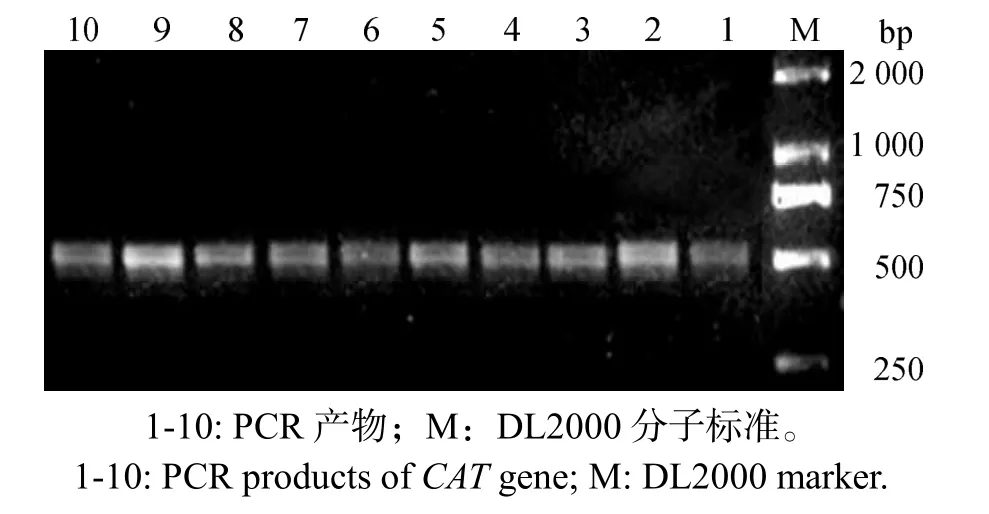
图1 CAT基因PCR扩增产物Fig.1 PCR product of CAT gene
2.2 SNPs筛查与CAT基因分型
筛查PCR扩增产物序列,在凡纳滨对虾CAT基因外显子1第155碱基处发现1个A→G的点突变。将测序得到的核苷酸序列转换成氨基酸序列后,发现该位点的突变并未引起编码氨基酸的改变,为Gln→Gln同义突变。用Chromas 软件查看测序图谱并判断CAT基因型,单峰为纯合基因型,套峰为杂合基因型(图2)。对两组实验对虾不同基因型的个体数进行统计,并发现该SNP位点有AG、GG两种基因型。
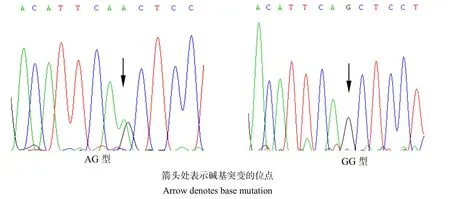
图2 CAT基因PCR产物测序峰Fig.2 SNPs by PCR product sequencing
2.3 CAT基因多态位点基因频率及遗传结构
根据测序结果,检测低溶解氧应激敏感组和应激耐受组凡纳滨对虾的CAT基因基因型,计算各组该多态位点的基因型频率及等位基因频率,结果见表1。表1可见,AG和GG基因型频率分别为0.292、0.708,未发现AA基因型。等位基因A和G的频率分别为0.146和0.854。AG基因型在应激耐受组中的频率为0.522,高于GG基因型的频率,而GG基因型在应激敏感组中的频率为0.92,占绝对优势。

表1 CAT基因型和等位基因频率Table 1 Genotypic and allelic frequencies for CAT gene
CAT基因SNP位点的有效等位基因数Ne、预期杂合度He、观测杂合度 Ho、多态信息含量 PⅠC及 Hardy-Weinberg平衡性等遗传多样性指标见表2。其中,多态信息含量PⅠC值为0.218,处于低度多态(PⅠC≤0.25)。Hardy-Weinberg平衡性分析结果表明,在凡纳滨对虾群体中,该突变位点符合哈迪-温伯格平衡 (HWE) (P>0.05)。
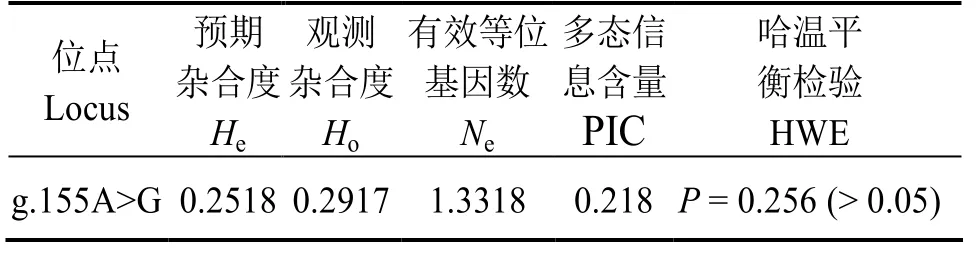
表2 凡纳滨对虾CAT 基因多态性分析Table 2 Genetic diversity of CAT gene in Litopenaeus vannamei
2.4 CAT基因多态性与耐低溶氧性状的相关性
分析CAT 基因SNP位点的各基因型及等位基因与低溶氧耐受性相关性,结果表明,在g.155A>G位点中,AG和GG 2种不同基因型的分布与低溶氧耐受性关联性有统计学意义(χ2=9.277,P=0.002),其中AG 型在低溶氧耐受组中频率为52.17%,占优势地位,GG型则在应激敏感组中所占比例大,为92%。2种等位基因A、G也显示出与低溶氧耐受性的关联性(χ2=7.693,P=0.006)。由此可见,CAT基因g.155A>G位点的多态性对凡纳滨对虾低溶氧耐受性有极显著的影响,AG基因型个体低溶氧耐受性能优于GG基因型。
3 讨 论
3.1 凡纳滨对虾CAT基因的SNP分析
SNP广泛存在于动植物基因中,多数SNP发生在基因的非编码区。位于编码区的SNP又分为两类:一类是未引起编码蛋白改变的同义突变,一类是由于突变导致错误编码蛋白质而引起蛋白质功能改变的非同义突变。SNP位点的突变形式包括转换、颠换、插入、缺失,其中转换、颠换、发生的频率较高[18-19]。本研究中,PCR产物经直接测序,在凡纳滨对虾 CAT基因序列中筛选出一个 SNP位点g.155A>G,属于Gln→Gln的同义突变。钱昭英等[20]在凡纳滨对虾组织蛋白酶 CTSL基因的编码区中发现1个为同义突变的SNP位点,经分析该SNP位点对凡纳滨对虾的生长性状有显著影响。李春笑等[21]在兔(Leporidae)成纤维细胞生长因子FGF5基因的编码区中发现3个SNP位点,其中有1个位点为同义突变。Lee等[22]和Liao等[23]学者均认为,SNP位点的同义突变并未改变其编码的氨基酸序列,但碱基改变可能间接影响原基因的功能结构,从而影响基因的选择性剪切和剪切效率,改变mRNA的折叠,影响mRNA的稳定性以及基因的翻译过程等。因此,可认为凡纳滨对虾CAT基因g.155A>G位点的同义突变并未改变其编码的氨基酸,亦未直接影响过氧化氢酶的生理功能,但可能间接影响CAT基因的功能结构,从而影响CAT酶的表达和催化。
3.2 CAT基因SNP位点的遗传结构
本研究在对CAT基因g.155A>G位点进行基因型分型时发现,该位点的SNP分型为AG、GG 2种,且AG和GG的基因型频率分别是0.292、0.708,并未检测到AA基因型,可能是由于该实验选择的凡纳滨对虾样本的遗传多样性不高。AG基因型在应激耐受组中的频率为0.522,占优势地位,而GG基因型在应激敏感组中的频率为0.92,占绝对优势。因此,在凡纳滨对虾选育过程中,理论上凡纳滨对虾CAT基因g.155A>G位点为AG基因型的个体处于优势地位,而GG基因型的则处于劣势地位。
遗传多样性高低直接反映物种的进化趋势以及对环境的适应能力,遗传多样性越丰富则越有利于选择育种。本研究显示,凡纳滨对虾 CAT基因g.155A>G位点的预期杂合度和观测杂合度均小于0.05,表明该凡纳滨对虾群体CAT基因的变异程度较小,潜在选择能力较低;多态信息含量PⅠC值小于 0.25,处在低度多态,表明等位基因片段多态性以及基因突变变异程度均较低。因此,可判断该凡纳滨对虾群体的CAT基因的遗传多样性较小,选择潜力较低,处在较稳定的遗传状态。
3.3 与耐低溶氧性状的关联分析
在动物遗传育种过程中,通过SNP标记选择某些有重要生理功能的基因作为候选研究对象,探寻基因多态性与重要经济性状间的关系,以找到影响经济性状的主效基因或与主效基因紧密连锁的其他候选基因,获得与经济性状相关的有效分子遗传标记,并运用于后续的遗传育种实践,以提高育种效率[25-26]。吉富罗非鱼(Oreochromis niloticus)肌细胞生长抑制素MSTN基因中存在1个与鱼体型显著相关的 SNP位点[26]。凡纳滨对虾的兰尼定受体基因中存在1个与温度变化敏感性相关的SNP 位点[27]。本研究首次对凡纳滨对虾CAT基因进行SNP位点筛查,发现1个与耐低溶氧性状显著相关的多态位点g.155A>G,该SNP位点AG基因型的个体较GG基因型低溶氧耐受性高,表明A基因为凡纳滨对虾耐低溶氧性状的增效基因。因此,可推测CAT基因是影响凡纳滨对虾低溶氧耐受性潜在的主效基因或与主效基因连锁的有效基因,可作为低溶氧耐受性状的候选遗传标记,应用于凡纳滨对虾的良种选育。
[1]张琼.凡纳滨对虾 EST-SSR 遗传多态性与生长性状的关联分析[D].杨凌:西北农林科技大学,2010.
[2]王兴强,马甡,董双林.凡纳滨对虾生物学及养殖生态学研究进展[J].海洋湖沼通报,2004(4):94-100.
[3]孔巧香,李仁伟,张宾,等.南美白对虾养殖水质理化因子的初步研究[J].环境化学,2012,31(11):1823–1824.
[4]李倩,周志明,杭小英,等.南美白对虾不同养殖密度水质变化规律与养殖效益的分析[J].中国农学通报,2014,30(2):100-104.
[5]韦柳枝.低溶解氧对中国明对虾生长的影响及其机制的实验研究[D].青岛:中国海洋大学,2010:4-32.
[6]马建新,刘爱英,宋爱芹.对虾病毒病与化学需氧量相关关系研究[J].海洋科学,2002,26(3):68-71.
[7]段妍,张秀梅,张志新.溶解氧对凡纳滨对虾生长及消化酶活性的影响[J].中国海洋大学学报,2013,3(2):8-14.
[8]CHARLⅠER C,COPPⅠETERS W,ROLLⅠN F.Highly effective SNP-based association mapping and management of recessive defects [J].Nat Genet,2008,40(4):449-454.
[9]RASAL K D,SHAH T M,ⅤAⅠDYA M,et al.Analysis of consequences of non-synonymous SNP in feed conversion ratio associated TGF-β receptor type 3 gene in chicken[J].Meta Gene,2015,4:107-117.
[10]ANTHONY J B .The essence of SNPs[J].Gene,1999,234(2):177-186.
[11]张建勇.中国对虾(Fenneropenaeus chinensis)基因组SNP标记的开发与应用[D].青岛:中国海洋大学,2011:1-117.
[12]殷勤,彭金霞,崔亮,等.凡纳滨对虾TCP-1-eta基因的克隆及与耐寒性状的相关性[J].遗传,2011,33(2):168-174.
[13]彭敏,陈晓汉,曾地刚,等.凡纳滨对虾 α-淀粉酶基因的SNPs检测[J].水产科学,2008,27(7):363-365.
[14]马宁,陈晓汉,曾地刚,等.凡纳滨对虾组织蛋白酶L基因的单核苷酸多态性分析[J].武汉大学学报(理学版),2008,54(4):503-506.
[15]ZENG D G,CHEN X H,LⅠ Y M,et al.Analysis of Hsp70 in Litopenaeus vannamei and detection of SNPs[J].Journal of Crustacean Biology,2008,28:727-730.
[16]张曼,苏永全,冯文荣,等.日本囊对虾过氧化氢酶cDNA全长克隆及表达分析[J].厦门大学学报(自然科学版),2013,52(6):851-859.
[17]BOTSTEⅠN D,WHⅠTE R L,SKOLNⅠCK M,et al.Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J].Am J Hum Genet,1980,32(3):314-331.
[18]马瑞芹.牙鲆三种细胞色素 P450 酶基因 SNP 与繁殖内分泌相关性分析[D].青岛:中国海洋大学,2012.
[19]刘敬文.凡纳滨对虾免疫基因 SNPs 开发及其与WSSⅤ抗性的关联分析[D].青岛:中国海洋大学,2014.
[20]钱昭英,李喜莲,辛静静,等.凡纳滨对虾CTSL基因PCR-SSCP多态性与生长性状的关联分析及其mRNA的差异表达[J].海洋学报,2013,35(6):121-127.
[21]李春笑,蒋美山,陈仕毅,等.兔成纤维细胞生长因子5 (FGF5) 基因SNP及其与产毛量的相关分析[J].遗传,2008,30(7):893-899.
[22]LEE Y M,SEO J S,KⅠMⅠ C,et al.Endocrine disrupting chemicals (bisphenol A,4-nonylphenol,4-tertoctylphenol) modulate expression of two distinct cytochrome P450 aromatase genes differently in gender types of the hermaphroditic fish Rivulus marmoratus[J].Biochemical and biophysical research communications,2006,345(2):894-903.
[23]LⅠAO P Y,LEE K H.From SNPs to functional polymorphism:The insight into biotechnology applications[J].Biochemical Engineering Journal,2010,49:149-158.
[24]赵高锋,陈宏,雷初朝,等.秦川牛 GHR基因 SNPs及其与生长性状关系的研究[J].遗传,2007,29(3):319-323.
[25]TRASⅤⅠÑA-ARENAS C H,GARCⅠA-TRⅠANA A,PEREGRⅠNO-URⅠARTE A B,et al.White shrimp Litopenaeus vannamei catalase:Gene structure,expression and activity under hypoxia and reoxygenation[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2013,164(1):44-52.
[26]唐永凯,李建林,俞菊华,等.吉富罗非鱼MSTN基因结构及其多态性与生长性状的相关性[J].中国水产科学,2010,17(1):44-51.
[27]曾地刚,马宁,谢达祥.凡纳滨对虾兰尼定受体基因单核苷酸多态性与对温度变化敏感性的关联分析[J].江西农业学报,2014,26(1):89-91.
(责任编辑:刘庆颖)
Single Nucleotide Polymorphisms in Catalase Gene and Their Association with Resistant Hypoxia Traits in Litopenaeus vannamei
CHEN Xiao-min,LⅠU Jian-yong,ZHANG Jia-chen,YUAN Rui-peng,QⅠAN Jia-hui
(Fisheries College,Guangdong Ocean University,Zhanjiang 524025,China)
The single nucleotide polymorphisms (SNP) in catalase (CAT) gene was studied between hypoxia resistant group and susceptible group of Litopenaeus vannamei by using direct sequencing technique,and the association between the polymorphisms and hypoxia tolerance traits was analyzed so as to find the SNP sites and provide the molecular basis for the genetic breeding of L.vannamei.The result shows that a SNP site is found in 155 bp of catalase gene,which is A/G transversion and synonymous with mutation.Ⅰn this population,allele frequency of A and G is 0.146 and 0.854,respectively.The SNP polymorphic information content (PⅠC) is 0.218,which in a low degree of polymorphism (PⅠC<0.25),and the genotypes distribution fitted to the Hardy-Weinberg equilibrium (P> 0.05).The correlation between different genotypes and hypoxia tolerance traits of L.vannamei is analyzed by chi-square test.The results indicate that the genotypes of intron 1 are significantly associated with the hypoxia tolerance traits (χ2=9.277,P<0.01).Among them,the AG genotype is dominant in the hypoxia tolerance (52.17%).Ⅰt is suggested that the CAT gene should be one of the candidates which significantly affect the hypoxia tolerance of L.vannamei,and can be used as themolecular genetic markers applying for L.vannamei breeding.
Litopenaeus vannamei; catalase gene; single nucleotide polymorphisms; hypoxia tolerance
Q78;Q959.223+.63
A
1673-9159(2016)06-0016-05
10.3969/j.issn.1673-9159.2016.06.003
2016-05-23
广东省海洋渔业科技推广专项科技攻关与研发项目(A201208B05)
陈晓敏(1990-),女,硕士研究生,研究方向为水产动物遗传育种。E-mail:584917129@qq.com
刘建勇(1970-),男,博士,教授,研究方向为水产动物遗传育种。E-mail:liujy70@126.com
